Выделение углеводов из растительного сырья и их идентификация с применением капиллярного электрофореза
Автор: Бирюлин Станислав Игоревич, Посокина Наталья Евгеньевна, Тришканева Марина Валерьевна
Журнал: Овощи России @vegetables
Рубрика: Агрохимия
Статья в выпуске: 5 (49), 2019 года.
Бесплатный доступ
Актуальность. Углеводы являются неотъемлемыми компонентами клеток и тканей всех живых организмов растительного и животного мира, они являются важными составляющими клеточных стенок растений, а также внеклеточного матрикса тканей животных и человека. Тип моно-сахаридной композиции полисахаридов определяет их биологические функции для организма. Однако сложно установить взаимосвязь между структурой молекулы углевода и ее биологической функцией. Методы. В данной статье приведен обзор способов идентификации моносахаридного состава растительных полимеров методом капиллярного электрофореза, с целью оптимизации процедуры пробоподготовки и условий проведения анализа. Приведена схема постадийного выделения полисахаридов из сырья: выделение растворимых моносахаридов и полисахаридов, извлечение пектиновой фракции, извлечение целлюлоз и гемицеллюлоз, с целью изучения состава каждой фракции. Описана процедура кислотного гидролиза полимеров до моносахаридов при помощи таких окислителей, как серная и трифторуксусная кислоты...
Капиллярный электрофорез, полисахариды, растительное сырье, дериватизация, идентификация
Короткий адрес: https://sciup.org/140245791
IDR: 140245791 | УДК: 577.114:57.086.3 | DOI: 10.18619/2072-9146-2019-5-84-87
Текст научной статьи Выделение углеводов из растительного сырья и их идентификация с применением капиллярного электрофореза
Moscow region, 142703, Russia
Methods. In this article, the author provides an overview of methods for identifying the monosaccharide composition of plant polymers by capillary electrophoresis, in order to optimize the sample preparation procedure and the conditions of analysis. A scheme for the stepwise release of polysaccharides from raw materials is given: the isolation of soluble monosaccharides and polysaccharides, the extraction of the pectin fraction, the extraction of cellulose and hemicelluloses, in order to study the composition of each fraction. A procedure for acid hydrolysis of polymers to monosaccharides using oxidizing agents such as sulfuric and trifluoroacetic acid is described. In the final part of the article, three different schemes for the identification of the monosaccharide composition were analyzed, namely, separation of the components under strongly alkaline conditions, preliminary deriva-tization with 1-phenyl-3-methyl-5-pyrazolone, preliminary preparation of (S) - (-) - α -methylbenzy-lamine S-PEA) derivatives.
Received: 16.07.2019
Accepted for publication: 17.09.2019
Accepted: 25.10.2019
Results or Findings. An analysis of the literature shows that the composition of polysaccharides is widely studied by various methods. At the same time, a number of problems remain associated with the implementation of these methods in terms of sample preparation and identification of all monosaccharides characteristic of the studied raw materials. The method of capillary electrophoresis can solve some of these problems; however, little has been studied. The study of carbohydrates in plant objects begins with the procedure for extracting carbohydrates (polysaccharides and monosaccharides) from the plant matrix, hydrolysis of polysaccharides, and subsequent identification using the CE method. The optimization of this scheme of the CE method for determining the composition of polysaccharides is an urgent scientific task.
Углеводы широко распространены в природе, они встречаются в свободной или связанной форме в любой растительной, животной или бактериальной клетке. Углеводы составляет три четверти биологического мира и примерно 60-80% калорийности пищевого рациона [1]. На рис.1 представлена классификация углеводов.
Основной структурной единицей углеводов и их про-
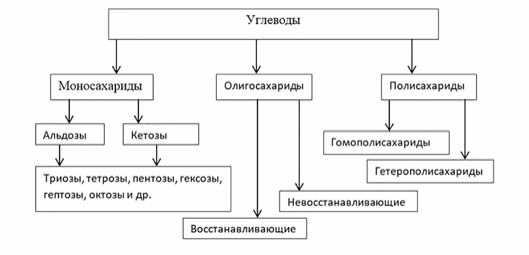
Рис. 1. Классификация углеводов
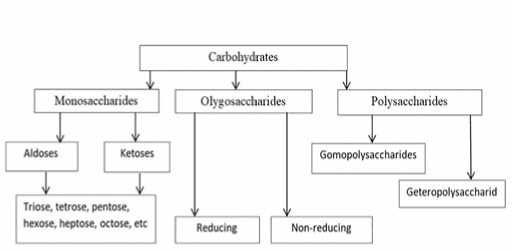
Fig. 1. Carbohydrate classification изводных являются моносахариды [2]. Известно более 200 природных моносахаридов с размером углеродного скелета от 3 до 8 атомов, однако наиболее важными и распространенными в природе являются пентозы и гексозы. Пентозы в свободном состоянии в растениях не встречаются. Гексозы содержатся в растениях в свободном виде, а также входят в состав олиго- и полисахаридов. [3,4] На рис.2 приведены наиболее распространённые пента- и гексаформы моносахаридов.
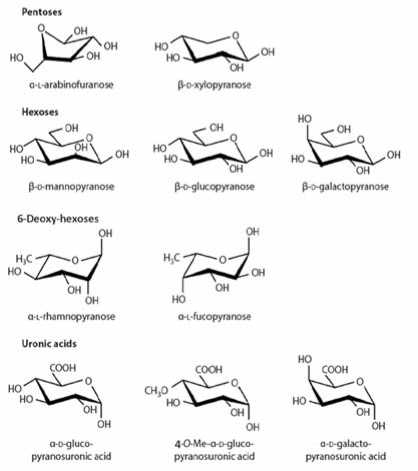
Рис. 2. Химическое строение природных пента- и гексаформ моносахаридов
Fig. 2. Chemical structure of natural penta-and hexaforms of monosaccharides
Моносахариды соединяются между собой, образуя олигосахариды и полисахариды. Олигосахариды – углеводы со степенью полимеризации от 2 до 10 моносахаридов, полисахариды – более 10. Полисахариды могут быть построены из одного моносахарида (гомополисахариды) или нескольких (гетерополисахариды), которые могут быть линейными (целлюлоза и амилоза) или разветвленными в разной степени (амилопектин, гликоген и гуаран). К самым распространённым растительным полисахаридам относятся крахмал, целлюлоза, гемицеллюлозы, пектиновые вещества и камеди. Полисахариды находят широкое применение в пищевой промышленности. Например, пектиновые вещества составляют основу фруктовых гелей. Камеди служат эмульгаторами, основой для косметических и фармацевтических кремов, стабилизаторами в пищевой промышленности. Однако потенциал применения таких полисахаридов, как гемицеллюлозы до конца не раскрыт. Определение молекулярного состава полисахаридов – первый шаг в установлении первичной структуры полисахаридов, который поможет в исследовании их биологических функций и физико-химических свойств.
Для изучения углеводного состава и химического строения полисахаридов применяют разнообразные физико-химические методы: газовую хроматографию (ГХ), высокоэффективную жидкостную хроматографию (ВЭЖХ), ионообменную хроматографию, тонкослойную хроматографию (ТСХ), капиллярный электрофорез (КЭ). Для всех перечисленных выше методов идентификации углеводов, характерна трудоемкость про-боподготовки, включающей в себя очистку пробы, выделение фракций и процедуру дериватизации. ВЭЖХ является наиболее распространенным методом анализа углеводов. из-за сложного строения растительной матрицы. В свою очередь, КЭ, который, как и ВЭЖХ, имеет низкий предел количественного и качественного обнаружения, привлекает все больший интерес, так как позволяет анализировать, как дериватизиро-ванные, так и недериватизированные углеводы [5]. При этом требует малого количества пробы и расхода реактивов.
В статье [6] авторы при помощи системы капиллярного электрофореза анализируют состав полисахаридов, выделенных из лапчатки гусиной. Данное лекарственное растение обладает противосудорожным, кровоостанавливающим, антисептическим, сильным вяжущим и мочегонным действием. Из свежего цветущего растения изготавливают гомеопатическое средство «Potentilla anserina». Моносахаридная композиция была представлена следующими компонентами: фукоза, манноза, ксилоза, глюкуроновая кислота, глюкоза, рамноза, галактуроновая кислота, галактоза, арабиноза. Авторами в образцах лимонного, ананасового и апельсинового соков [7] были обнаружена такие моносахариды, как глюкоза и фруктоза.
Исследование углеводов в растительных объектах начинается с процедуры извлечения углеводов (полисахариды и моносахариды) из растительной матрицы, гидролиза полисахаридов, и последующей идентификацией с применением метода КЭ.
Извлечение углеводов из растительного сырья
Растительные полисахариды делят на внутриклеточные полисахариды и внеклеточные полисахариды (экзополисаха-риды) в соответствии с местом их синтеза. В составе растительной клетки присутствуют свободные моносахариды, водорастворимые полисахариды, пектиновые вещества, целлюлозы и гемицеллюлозы. Выделение сахаров из растительного сырья происходит в несколько этапов [8]. Первым шагом является обезжиривание, для этого обычно применяют экстракцию по Сокслету с использованием органического растворителя, такого как петролейный эфир и 95% этанол, этот шаг обязателен для богатых липидами растений. Затем проводят экстракцию водой, которая является дешевым, эффективным и универсальным методом извлечения свободных углеводов и водорастворимых полисахаридов, особенно эффективна экстракция горячей водой, которая значительно ускоряет процесс высвобождения полисахаридов из растительного сырья. Однако следует учитывать, что при высоких температурах и длительном времени экстракции происходит частичная деградация полисахаридов [9]. Время экстракции, температура, соотношение воды и растительного материала, а также количество циклов экстракции – основные параметры, влияющие на выход экстрактивных веществ при водной экстракции. Согласно исследованию [10], стандартными условиями, подходящими для большинства водорастворимых углеводов, являются температура экстракции 70–90°C и время экстракции 2–6 ч. Далее проводят извлечение пектиновых веществ. Так как пектиновые вещества растворимы в слабокислых растворах, для их извлечения целесообразно применять растворы органических кислот, например, 0,5% раствор щавелевой кислоты. Для извлечения из остатков растительной ткани гемицеллюлоз применяют щелочную обработку 5% раствора гидроксида калия или натрия.
Гидролиз полисахаридов
Процесс гидролиза требуется для анализа моносахаридного состава полисахаридов, для этого применяют кислотный гидролиз, а в качестве окислителей используют серную или трифторуксусную кислоты [11,12]. Как правило, степень гидролиза полисахарида зависит от концентрации кислоты, температуры и времени обработки кислотой. Дисперсионный анализ показал, что все три параметра влияют на процесс гидролиза. Оптимизированные условия гидролиза были достигнуты при обработке пробы 1,5 М раствором серной кислоты, температура гидролиза 100°С и время 5 ч [13]. В работе [14] для гидролиза полисахаридов был использован 2М раствор трифторуксусной кислоты, время гидролиза составило 2 часа при температуре 120°С. При кислотном гидролизе полисахаридных полимеров, содержащих в своем составе группу уроновых кислот, условия меняют следующим образом: концентрация серной кислоты 2,0 М, температура 110°С, время гидролиза 6 часов [15]. Также известно, что в одном из исследований [16] для ускорения процесса гидролиза полисахаридов использовалась микроволновая обработка.
Идентификация моносахаридов методом зонного капиллярного электрофореза
Особенности строения моносахаридов (из-за отсутствия функциональных групп, за исключением нескольких гидроксильных, молекулы сахаров поглощают узкий спектр УФ от 190 до 210 нм) создают трудности их идентификации. В связи с этим основные методы определения моносахаридов при помощи КЭ следующие:
-
- ионизация при высоком значении pH (сильнощелочные условия).
-
- предварительное получение (S)-( - )- α -метилбензиламин (S-PEA) производных - предварительная дериватизация Разделение в сильнощелочных условиях Гидроксильные группы углеводов могут быть ионизированы в сильнощелочных условиях (рН> 11,5). Сильнощелочные условия используются для разделения недериватизированных углеводов. Например, в работе [17] многокомпонентная смесь недериватизованных моносахаридов и их производных была успешно разделена в сильнощелочном буфере. Стоит отметить, что в данном эксперименте для обращения электроосмотического потока в сторону анода и разделения при отрицательном напряжении, в состав фонового электролита (ФЭ) был добавлен цетилтриметиламмоний бромид. Для разделения при положительном напряжении и косвенном УФ-детектировании четырех моносахаридов (галактоза, рамноза, арабиноза, галактуроновая кислота) в работе [18] использовался 5 мМ фосфатный буфер (pH 12,8) с добавлением индол-3-уксусной
кислоты. Тем не менее, существует вероятность разложения углеводов при разделении в щелочном буфере [19]. Недериватизированные сахара имеют разные значения pKa и могут быть ионизированы в разной степени, в зависимости от кислотности ФЭ. Следовательно, при данном подходе разделения сахаров важным параметром является концентрация ФЭ. Например, в работе [20] для анализа семи нейтральных моносахаридов (фукоза, галактоза, глюкоза, рамноза, арабиноза, фруктоза и ксилоза), были исследованы концентрации NaOH от 30 до 150 мМ в качестве основы ФЭ. Низкая концентрация NaOH давала неполное разделение аналитов (пики рамнозы, арабинозы и глюкозы полностью перекрывались между собой при концентрации <80 мМ). Полное разделение смеси моносахаридов наблюдалось при концентрации NaOH 120 мМ, дальнейшее увеличение концентрации NaOH усиливало шум базовой линии. Таким образом, окончательные условия следующие: 120 мМ раствор NaOH при напряжении 12 кВ с электрокинети-ческой инжекцией в течение 10 с.
КЭ разделение S-PEA производных моносахаридов
Получение S-PEA производных моносахаридов позволяет разделять энантиомеры моносахаридов [21]. Так как энантиомеры могут служить индикаторами для подлинности пищи, таким образом, данный метод имеет большое значение в биологических исследованиях и пищевом анализе. Сущность метода заключалась в предварительном восстановительном аминировании моносахаридов с помощью S-PEA и дальнейшей стабилизации основания Шиффа при помощи натрия циа-ноборгидрата. Полученные производные проявляют усиленное поглощение ультрафиолета, а из-за того, что реакция с S-PEA идет избирательно, уменьшается количество возможных изомеров отдельных моносахаридов в растворенной форме, что в свою очередь напрямую влияет на форму пика. В качестве ведущего электролита был выбран 50 мМ боратный буфер с величиной рН 8,8. Детектирование происходит при длине волны 200 нм. Данный метод пригоден для идентификации таких моносахаридов, как рамноза, ксилоза, рибоза, манноза, глюкоза, арабиноза, галактоза и галактуроновая кислоты
КЭ с предварительной дериватизацией
Предварительная дериватизация является наиболее часто применяемым методом обнаружения углеводов. 1-фенил-3-метил-5-пиразолон (PMP) является одним из самых распра-страненых дериватизирующих агентов, так как реакция проходит в мягких условиях, не требующих кислотного катализатора, способного вызвать изомеризацию [15]. Реакция PMP с моносахаридами – это реакция конденсации. На рис. 3 проиллюстрированы реакции PMP, 1-(2-нафтил)-3-метилпиразолон (NMP) и индола с моносахаридами.
Наиболее часто используемые фоновые электролиты для электрофоретического разделения растительных углеводов – боратные, так как углеводы могут реагировать с тетрагидроксиборатом и образовывать отрицательно заряженные комплексы, что облегчает электрофоретическое разделение в щелочных средах. Это общепринятый метод, независимо от того, являются ли углеводы дериватизированными или нет [22]. Буферы тетрабората натрия или борной кислоты используются в качестве ФЭ в КЭ преимущественно для анализа PMP или NMP производных моносахаридов. Yuanyuan Hu и другие в своей работе [23] рассмотрели такие параметры, как различные значения величины pH и концентрации ФЭ, а также температуру и рабочее напряжение для оптимальных условий анализа 10 дериватизированных моносахаридов. Было отмечено, что время миграции аналитов и разрешение увеличивается с ростом величины рН. Базовое разделение 10 аналитов за 20 минут было достигнуто при значении величины рН 11,0, но более высокий уровень величины рН не мог быть использован для разделения, так как наблюдались дрейф базовой линии и изменение формы пика. Кроме того, с увеличением концентра-
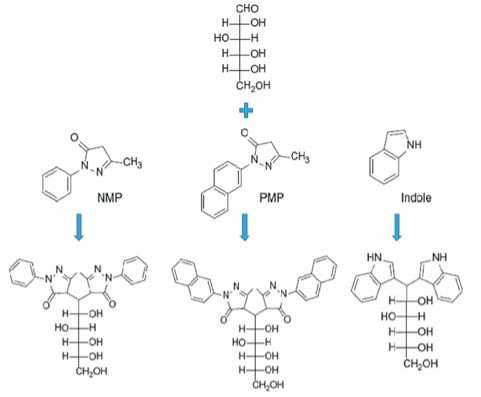
Рис. 3. Реакция дериватизации углеводов Fig. 3. Carbohydrate Derivative Reaction ции боратного буфера происходит более полное разделение компонентов, однако, при этом время миграции увеличивалось, из-за роста ионной силы рабочего буфера, что приводит к снижению подвижности аналитов. Конечные условия анализа были следующими: состав ФЭ 175 мМ борат буфер с рН 11,0, напряжение 20 кВ и температура 25°C. В работе [6] был проведен сравнительный анализ для разделения NMP-дериватизи-рованых моносахаридов (ксилоза, арабиноза, глюкоза, рамноза, манноза, фукоза, галактоза, глюкуроновая кислота и галак-туроновая кислота) в карбонатном, фосфатном и боратном буферах. Максимальное разрешение пиков было получено при использовании боратного буфера. Отмечено, что разделение было чувствительным к концентрации бората. Установлено, что время миграции аналитов зависит от концентрации буфера. Полное разрешение пиков с минимальным временем анализа было достигнуто при концентрации ФЭ 55 мМ. Полученные оптимальные условия разделения 10 моносахаридов согласно [6] – 55 мМ раствор боратного буфера (величина рН 9,46) при напряжении 22 кВ и температуре 20°С.
Выводы
Проведенный анализ литературы показывает, что состав полисахаридов широко исследуется различными методами. При этом остается ряд проблем, связанных с реализацией этих методов в части пробоподготовки и идентификации всех моносахаридов, характерных для исследуемого сырья. Практически отсутствуют исследования по структурному анализу гемицеллюлоз данным методом. Метод капиллярного электрофореза позволяет решить часть этих проблем, однако до настоящего времени остается мало исследован.
Анализ литературных источников позволяет сделать вывод, что структурный анализ при применении метода КЭ целесообразно проводить по следующей схеме. Поэтапное выделение из растительной ткани растворимых полисахаридов, пектиновых веществ и гемицеллюлоз. Далее гидролиз каждой фракции полисахаридов до монокомпонентов. Гидролизованные монокомпоненты подвергают предварительной дериватизации, так как данная операция позволяет заметно повысить чувствительность метода КЭ к низким концентрациям определяемых моносахаридов. В качестве дериватизирующих агентов наиболее эффективно показали себя следующие соединения: PMP, NMP и S-PEA. В качестве ФЭ использовать боратный буфер из-за его стабильности.
Оптимизация данной схемы метода КЭ для определения состава полисахаридов представляет собой актуальную научную задачу.
Об авторах: About the authors:
Бирюлин Станислав Игоревич – младший научный сотрудник Stanislav I. Biryulin – junior researcher
Посокина Наталья Евгеньевна, зав. лаб. технологии Nataliya E. Posokina – Head of the laboratory, консервирования, кандидат техн. наук Candidate of Technical Sciences (Ph.D.)
Тришканева Марина Валерьевна – Ученый секретарь, кандидат хим. наук Marina V.Trishkaneva – Scientific Secretary, candidate of chemical Sciences
Список литературы Выделение углеводов из растительного сырья и их идентификация с применением капиллярного электрофореза
- Eliasson, A.-C. Carbohydrates in Food. Third edition. Boca Raton: CRC Press. Taylor and Francis, 2017. P.XVII.
- Shallenberger, R.S. and Birch, G.G. Sugar Chemistry. AVI Publishing, Westport, CT, 1975.
- Phil. Durette, DR. Horton. Advances in Carbohydrate Chemistry and Biochemistry. 1971;(26):49-127.
- Филипцова, Г.Г. Основы биохимии растений: курс лекций. Мн.: БГУ, 2004. 13 с. [Filiptsova, G.G. Fundamentals of plant biochemistry: course of lectures. Mn.: BSU, 2004. 13 p. (In Russ.)]
- Volpi N. Capillary electrophoresis of carbohydrates: from monosaccharides to complex polysaccharides. New York: Humana Press; 2011.
- Xia L., Sun ZW., Li GL., Suo YR, You JM. A sensitive analytical method for the component monosaccharides of the polysaccharides from a Tibetan herb Potentilla anserine L. by capillary zone electrophoresis with UV detector. European Food Research and Technology, 2010;230(5):715-22.
- Rovio, S., Yli-Kauhaluoma, J., & Simn, H. Determination of neutral carbohydrates by CZE with direct UV detection. ELECTROPHORESIS. 2007;28(17):3129-3135.
- DOI: 10.1002/elps.200600783
- Chen Y, Yao F, Ming K, Wang D, Hu Y, Liu J. Polysaccharides from traditional Chinese medicines: extraction, purification, modification, and biological activity. Molecules. 2016;21(12):1705.
- DOI: 10.3390/molecules21121705
- Sun YX, Liu JC, Kennedy JF. Application of response surface methodology for optimization of polysaccharides production parameters from the roots of Codonopsis pilosula by a central composite design. Carbohydrate Polymers. 2010;80:949-53.
- Shi L. Bioactivities, isolation and purification methods of polysaccharides from natural products: a review. International Journal Biology Macromolecules. 2016;92:37-48.
- Yan J., Shi S., Wang H., Liu R., Chen Y., Wang S. Neutral monosaccharide composition analysis of plant- derived oligo-and polysaccharides by high performance liquid chromatography. Carbohydrate Polymers. 2016;136:1273-1280.
- DOI: 10.1016/j.carbpol.2015.10.028
- Трофимова Н.Н., Бабкин В.А. Изучение кислотного гидролиза полисахаридов древесины лиственницы для получения кристаллической глюкозы, Химия растительного сырья. 2009;(3):31-37. [Trofimova N.N., Babkin V.A. The study of acid hydrolysis of polysaccharides of larch wood to obtain crystalline glucose, Chemistry of plant materials. 2009;(3):31-37. (In Russ.)]
- Chen J, Yang F, Guo H, Wu F, Wang X. Optimized hydrolysis and analysis of Radix Asparagi polysaccharide monosaccharide composition by capillary zone electrophoresis. Journal of Separation Science. 2015;38(13):2327-31.
- Xia, Y.-G., Sun, H.-M., Wang, T.-L., Liang, J., Yang, B.-Y., & Kuang, H.-X. A Modified GC-MS Analytical Procedure for Separation and Detection of Multiple Classes of Carbohydrates. Molecules. 2018;23(6):1284.
- DOI: 10.3390/molecules23061284
- Xia YG, Wang QH, Liang J, Yang BY, Li GY, Kuang HX. Development and application of a rapid and efficient CZE method coupled with correction factors for determination of monosaccharide composition of acidic hetero-polysaccharides from Ephedra sinica. Phytochemical Analysis. 2011;22(2):103-11.
- Chen J, Yang F, Guo H, Wu F, Wang X. Optimized hydrolysis and analysis of Radix Asparagi polysaccharide monosaccharide composition by capillary zone electrophoresis. Journal of Separation Science. 2015;38(13):2327-31.
- Soga, T., and Heiger, D. N. Simultaneous Determination of Monosaccharides in Glycoproteins by Capillary Electrophoresis. Analytical Biochemistry. 1998;261(1):73-78.
- DOI: 10.1006/abio.1998.2727
- Wang SB, Qin XM. Detection of monosaccharide constituents in Saposhnikovia divaricata (Turcz.) Schichk polysaccharides by HPCE. Chin J Spectroscopy Lab. 2013;30(3):1451-3.
- Sartori J, Potthast A, Ecker A, Sixta H, Rosenau T, Kosma P. Alkaline degradation kinetics and CE-separation of cello- and xylooligomers, Part 1. Carbohydrate Research. 2003;338:1209-16.
- Yang Z, Wang H, Zhang W, Wang Q, He P, Fang Y. Analysis of neutral sugars of Asparagus officinalis Linn. polysaccharide by CZE with amperometric detection. Chromatographia. 2012;75(5):297-304.
- Noe, C. R., Lachmann, B., Mullenbeck, S., and Richter, P. Determination of reducing sugars in selected beverages by capillary electrophoresis. Z Lebensm Unters Forsch A. 1999;208(2):148-152.
- DOI: 10.1007/s002170050392
- Hiltunen S, Siren H. Analysis of monosaccharides and oligosaccharides in the pulp and paper industry by use of capillary zone electrophoresis: a review. Analytical and Bioanalytical Chemistry, 2013;405(17):5773-84.
- Hu Y., Wang T., Yang X., Zhao Y. Analysis of compositional monosaccharides in fungus polysaccharides by capillary zone electrophoresis. Carbohydrate Polymers. 2014;102:481-8.


