Выявление вирусалейкоза птиц подгруппы К в России и его молекулярно-генетический анализ
Автор: Бородин А.М., Алексеев Я.И., Коновалова Н.В., Терентьева Е.В., Ефимов Д.Н., Емануйлова Ж.В., Смолов С.В., Огнева О.А., Фисинин В.И.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Ветеринарная вирусология, иммунология
Статья в выпуске: 4 т.53, 2018 года.
Бесплатный доступ
Вирус лейкоза птиц (ВЛП) принадлежит к роду Alpharetrovirus семейства Retroviridae. Геном вируса представлен одноцепочечной РНК длиной более 7 тыс. нуклеотидов. У кур описаны подгруппы ВЛП A, B, C, D, J, K и E. Их классифицируют по антигенам белка оболочки GP85. ВЛП широко распространен по всем миру, вызывает различные патологии, снижает продуктивность и наносит огромный ущерб промышленному птицеводству. ВЛП подгруппы К был впервые обнаружен в странах Азии. Исследования превалентности ВЛП подгруппы К немногочисленны и на территории России ранее не проводились. Нашей целью было изучение распространения ВЛП этой подгруппы у кур из российских птицеводческих хозяйств с использованием тест-системы, разработанной для идентификации генома ВЛП подгруппы К методом ПЦР в реальном времени (ПЦР-РВ), и анализ свойств ВЛП подгруппы К. Испытание тест-системы проводили на 5292 образцах ДНК кур отечественного мясного кросса бройлерного типа из хозяйства Московской области и у кур мясных и яичных пород из хозяйств в разных регионах России...
Вирус лейкоза птиц, тест-система для выявления вируса лейкоза птиц подгруппы к, полимеразная цепная реакция в реальном времени
Короткий адрес: https://sciup.org/142216583
IDR: 142216583 | УДК: 636.52/.58:619:578:575 | DOI: 10.15389/agrobiology.2018.4.842rus
Текст научной статьи Выявление вирусалейкоза птиц подгруппы К в России и его молекулярно-генетический анализ
Вирус лейкоза птиц (ВЛП) принадлежит к роду Alpharetrovirus семейства Retroviridae . Геном вируса представлен одноцепочечной РНК длиной более 7 тыс. нуклеотидов. Для кур специфичны ВЛП подгрупп A, B, C, D, J, K и E, которые различаются антигенными участками белка оболочки GP85 (1-3). ВЛП может вызывать не только лимфоидный и миелоидный лейкоз, но и новообразования других тканей (4 - 6) включая глиомы
∗ При проведении исследования использовано научное оборудование центра коллективного пользования «Биотехнология» Всероссийского НИИ сельскохозяйственной биотехнологии. Работа выполнена при финансовой поддержке ФАНО России, государственное задание ФГБУ СГЦ «Смена» ¹ 007-01359-17-00, в рамках выполнения Федеральной научно-технической программы развития сельского хозяйства на 20172025 годы. Подпрограмма «Создание отечественных конкурентоспособных мясных кроссов бройлерного типа». Часть работы, связанная с выделением ДНК с помощью роботизированного комплекса для молекулярно-генетических исследований Савраска-02 (ООО «Синтол», Россия), была выполнена при финансовой поддержке Министерства образования и науки Российской Федерации (проект ¹ 14.579.21.0012 от 05.06.2014 г. ID RFMEFI57914X0012).
и нейрофибросаркомы (7, 8). Определить подгруппу вируса можно на основании анализа нуклеотидной последовательности гена белка оболочки GP85 (3, 9, 10). По способу инфицирования клеток хозяина ВЛП делятся на экзогенные (1, 4) и эндогенные. Вирусы подгрупп A, B, C, D, J и K относятся к экзогенным и более патогенны, чем эндогенный вирус подгруппы Е, у которого патогенность слабая или отсутствует. Геном эндогенных вирусов встроен в геном хозяина и передается, как и остальные гены хозяина, вертикально. Экзогенные вирусы способны распространяться посредством одной из форм вертикальной передачи — конгенитально, то есть через инфицирование кур и далее через эмбрион. Эндогенные ВЛП иногда могут вести себя как экзогенные, заражая кур горизонтально. Обычно смертность кур от инфекции ВЛП не превышает нескольких процентов, но при активной форме инфекции смертность может составлять более 20 % (9). ВЛП широко распространен, вызывает различные патологии, снижает продуктивность и наносит огромный ущерб промышленному птицеводству.
ВЛП подгруппы К обнаружен недавно в странах Азии — Китае (3, 10, 11), Японии (8) и на Тайване (12). Патогенность этих изолятов не ясна. Существует опасность рекомбинации ВЛП подгруппы К с вирусами других подгрупп, в частности с ВЛП-J, что может привести к появлению новой подгруппы ВЛП с более высокой патогенностью (10, 11). Исследования распространенности ВЛП подгруппы К немногочисленны и на территории России ранее не проводились (13).
В этой статье сообщается о первой идентификации ВЛП подтипа К в российских промышленных популяциях кур и представлены результаты его молекулярно-генетического изучения.
Нашей целью было выявление ВЛП подгруппы К в птицеводческих хозяйствах России с использованием разработанной тест-системы на основе ПЦР в реальном времени (ПЦР-РВ) и последующий анализ свойств ВЛП подгруппы К.
Методика . Праймеры и зонд для ПЦР-РВ и секвенирования по Сэнгеру были синтезированы в ООО «Синтол». Они подбирались так, чтобы амплифицировать ДНК ВЛП подгруппы К без амплификации известных эндовирусов. Использовали в качестве флуоресцентной метки карбоксифлуоресцеин (6FAM), в качестве гасителя флуоресценции — краситель BHQ-1, для 3´-концевой модификации зонда — фосфат (р).
Для выявления ВЛП подтипа К методом ПЦР-РВ использовали следующие праймеры и зонд:
ALVKF (5´→3´) — CGGAGCATTGACACGCTTTCAGA, ALVKR (5´→3´) — GTGGTTGCGGCGGAGGAGGA, KPL (5´→3´) — (6FAM)CCACCTCGTGAG(dT-BHQ-1)TGCGGCC-р.
Длина синтезируемого ампликона — 72 п.н., фрагмент представляет собой часть гена gp85, кодирующего белок оболочки GP85.
Праймеры, которые были использованы для ПЦР и секвенирования ДНК ВЛП подтипа К:
ALVKF (5´→3´) — CGGAGCATTGACAAGCTTTCAGA, SEQA-KR (5´→3´) — CGCGATCCCCACAAATGAGGAAA.
Длина продукта амплификации (часть гена gp85, кодирующего белок оболочки GP85) — 466 п.н.
Типирование 3´-концевых фрагментов генов gp85 и вариантов длинных концевых повторов (LTR) осуществляли с помощью трех обратных праймеров и универсального праймера SEQKF:
SEQKF (5´→3´) — GGCCGTTCATTTGCTGAAAGGA,
SEQKRKm (5'^3') — CAGGCTAGGCACTTAAGTACAACA, SEQKRJ (5'^3') — GGGCACTTAAATACAGTATCTCTG, SEQKROKI (5'^3') — CAATCAGCATGCGCCACGATGAA.
Для амплификации 3´-концевых фрагментов гена gp85 и длинных концевых повторов, сходных с эндовирусными, применяли специальную пару праймеров, которые исключали амплификацию последовательностей ДНК ВЛП подгруппы Е:
SEQKF12 (5'^3') — GTGGCTCCTCCTCCGCCGCAA, SEQKREV (5'^3') — GCAGCTTATATAATCGTGCATAGC.
Испытание тест системы проводили на 5292 образцах ДНК кур мясного кросса бройлерного типа из хозяйства в Московской области.
ДНК выделяли из перьев с использованием набора М-Сорб (ООО «Синтол», Россия) с помощью роботизированного комплекса для молекулярно-генетических исследований Савраска-02 (ООО «Синтол», Россия). Фрагмент пера длинной 0,3-0,5 см помещали в пробирку объемом 1,5 мл, добавляли 400 мкл лизирующего раствора и инкубировали при 60 °С в течение 20 мин с перемешиванием, лизат осаждали в высокоскоростной микроцентрифуге Циклотемп-902 (ЗАО «Циклотемп», Россия) в течение 3 мин при 13 тыс. об/мин. Супернатант переносили в пробирку объемом 1,5 мл и продолжали выделение в соответствии со стандартным протоколом к набору М-Сорб.
Режим для проведения ПЦР был универсальным, в реакцию брали 1,5 мкл выделенной ДНК. Концентрация праймеров в реакционной смеси составляла 450 нМ, концентрация зонда — 150 нМ. ПЦР-РВ (канал детекции — FAM) проводили на приборе АНК-48 (Институт аналитического приборостроения РАН, Россия) по следующей программе (45 циклов): денатурация при 93 °С — 10 с, отжиг при 60 °С — 30 с. Для амплификации ДНК использовали реакционную смесь (10 мкл) для ПЦР-РВ (Кат. ¹ М428, ООО «Синтол», Россия).
Специфичность ПЦР-РВ подтверждали секвенированием продуктов амплификации, полученных при помощи праймеров ALVKF и SEQA-KR, на генетическом анализаторе Нанофор 05 (Институт аналитического приборостроения РАН, Россия).
Для филогенетического анализа и подбора специфических участков ДНК при типировании ВЛП подгруппы К и секвенировании использовали геномные последовательности штаммов ВЛП разных подгрупп: подгруппа А — MQNCSU-A (DQ365814); подгруппа В — Schmidt-Ruppin B (AF052428); подгруппа С — Prague C (J02342.1); подгруппа D — Schmidt-Ruppin D (D10652); подгруппа Е — ev-1 (AY013303); подгруппа J — HPRS103 J (Z46390); подгруппа К — Km_6222 (AB764103), Km_5943 (AB669897), Km_5845 (AB670314), Km_5844 (AB670312), Km_6202 (AB764101), Km_5892 (AB682778), Km_6181 (AB764100), Km_6349 (AB764106), Km_6249 (AB764104), Km_6343 (AB764105), Sp-53 (AB617820), SD110503R (KF738251), Sp-40 (AB617819), JS14CZ02 (KY490696), GDFX0601 (KP686142), GDFX0602 (KP686143), TW-3593 (HM582658), GD14LZ (KU605774), JS11C1 (KF746200), GDFX0603 (KP686144), JS14CZ01 (KY490695), Oki 009 (AB669433) (в скобках указаны номера последовательностей, депонированных в GenBank). Консервативные участки генома ВЛП, специфичные для подгруппы К, подбирали с помощью программ ClustallW и BLAST . Построение филогенетических деревьев для ВЛП разных подгрупп проводили при помощи программы ClustallW с использованием алгоритма Rooted phylogenetic tree (UPGMA).
Результаты . Подобранные участки генома ВЛП, специфичные для подгруппы К, использовали для амплификации и секвенирования ДНК. Положительным контролем при разработке системы служил синтетический фрагмент ДНК, соответствующий расчетному ампликону для ВЛП подгруппы К. Аналитическую чувствительность системы оценивали в тесте с разведениями положительного контроля. Она составила 100 копий генома ВЛП подгруппы К, или приблизительно 70 геном-эквивалентов/мкл в исходной пробе. В качестве отрицательного контроля использовали раствор, не содержащий разведений синтетического ампликона.
С помощью разработанной тест-системы изучили 5292 образца ДНК от бройлеров одного из хозяйств Московской области. Специфичные последовательности гена gp85 ВЛП подгруппы К обнаружили у 177 птиц, что составляет 3,3 % от общего числа. Были проанализированы пробы от кур из других регионов России. В результате геномные последовательности ВЛП подгруппы К также выявили у птицы из ряда областей — Калининградской (3 образца), Ленинградской (2 образца), Свердловской (5 образцов) и Новгородской (3 образца). Учитывая, что комплектование одной из птицефабрик в Калининградской области, где детектировали ВЛП подгруппы К, происходит из Германии, география распространения ВЛП этого типа в Европе, вероятно не ограничивается Россией.
Для подтверждения специфичности тест-системы секвенировали фрагменты гена gp85 , используя праймеры ALVKF и SEQA- KR и ДНК 12 кур из хозяйства Московской области. Анализ выявил два варианта геномных последовательностей ВЛП подгруппы К. Вирус в одной группе имел сходство 96 % со штаммами ВЛП Oki 009, GDFX0601, GDFX0602, GDFX0603, Km_5845 и др., во второй — сходство до 100 % со штаммом TW-3593. Секвенирование показало, что оба варианта исследованных ВЛП имели LTR, сходные с таковыми у ВЛП подгруппы E.
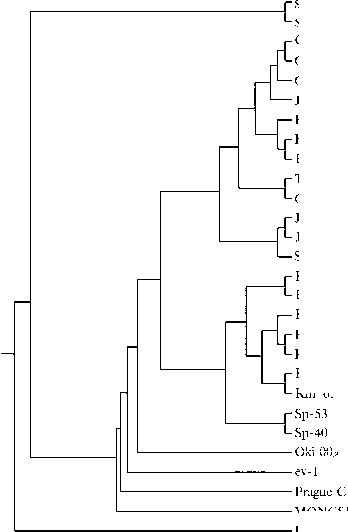
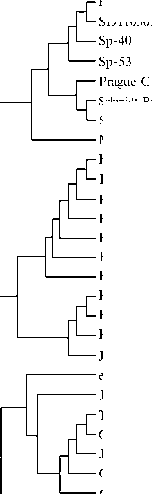
При анализе географической распространенности и связи ВЛП подгруппы К с заболеваниями кур на основании данных GenBank в качестве референсной использовали последовательность генома изолята GD14LZ ВЛП подруппы К (KU605774) (3). Наличие сходных с геномом GD14LZ последовательностей выявило страны, в которых распространен ВЛП подгруппы К. В базе данных GenBank был обнаружен ряд полноразмерных геномных последовательностей ВПЛ со сходством нуклеотидных последовательностей гена gp85 с последовательностью гена gp85 у изолята GD14LZ от 95 до 100 %. Вариабельность вирусного генома у ВЛП подгруппы J очень высока и может достигать внутри одного организма 94,9 % (14). Был сформирован пул, состоящий из 22 полноразмерных геномных последовательностей ВЛП, предположительно относящихся к подгруппе К, и проведен их анализ (табл., рис.).
Построение филогенетических деревьев на основе нуклеотидных последовательностей фрагментов гена gp85 показало, что ВЛП подгруппы К образуют отдельную, отличную от остальных вирусов группу (см. рис., А). Анализ 3´-UTR последовательностей ВЛП подгруппы К демонстрирует их гетерогенность и то, что ВЛП подгруппы К могут быть разделены на четыре кластера (см. рис., Б). У ВЛП подгруппы К имеются четыре различных 3´-UTR области (см. табл.), сходные с 3´-UTR как патогенных штаммов ВЛП подгруппы J, так и менее патогенных вирусов подгруппы Е. Также имеются 3´-UTR, специфичные для подгруппы К, — ВЛП К и Oki.
Разные 3´-UTR могли быть получены в результате рекомбинации с другими вирусами, например известен вирус, несущий ген gp85 от ВЛП подгруппы А и LTR от ВЛП подгруппы J (15). ВЛП подгруппы J предположительно представляет собой продукт рекомбинации между эндогенными и экзогенными формами вируса (16).
Патогенные свойства и распространение изолятов вируса лейкоза птиц подгруппы К, описанные в литературе и представленные в GenBank (NCBI)
|
Изолят (район) |
¹ депонирования в GenBank |
Автор (ссылка) |
Тип 3 ´ -UTR |
Патология |
|
SD110503R (Китай) |
KF738251 |
Chen J. н.о. |
ВЛП J |
Не известна |
|
Sp-40 (Япония) |
AB617819 |
Nakamura S. et al. (8) |
ВЛП J |
Глиома |
|
Sp-53 (Япония) |
AB617820 |
Nakamura S. et al. (8) |
ВЛП J |
Глиома |
|
Km_6222 (Япония) |
AB764103 |
Nakamura S. н.о. |
ВЛП К |
Не известна |
|
Km_6343 (Япония) |
AB764105 |
Nakamura S. н.о. |
ВЛП К |
Не известна |
|
Km_6181 (Япония) |
AB764100 |
Nakamura S. н.о. |
ВЛП К |
Не известна |
|
Km_5892 (Япония) |
AB682778 |
Nakamura S. et al. (17) |
ВЛП К |
Миокардит |
|
Km_6249 (Япония) |
AB764104 |
Nakamura S. н.о. |
ВЛП К |
Не известна |
|
Km_6349 (Япония) |
AB764106 |
Nakamura S. н.о. |
ВЛП К |
Не известна |
|
Km_6222 (Япония) |
AB764103 |
Nakamura S. н.о. |
ВЛП К |
Не известна |
|
Km_5844 (Япония) |
AB670312 |
Ochi A. et al. (18) |
ВЛП К |
Глиома |
|
Km_5845 (Япония) |
AB670314 |
Ochi A. et al. (18) |
ВЛП К |
Пролиферация астроцитов |
|
Km_5943 (Япония) |
AB669897 |
Ochi A. et al. (18) |
ВЛП К |
Не известна |
|
JS11C1 (Китай) |
KF746200 |
Cui N. et al. (10) |
ВЛП К |
Не известна |
|
JS14CZ01 (Китай) |
KY490695 |
Shao H. et al. (11) |
ВЛП Е |
Не известна |
|
TW-3593 (Тайвань) |
HM582658 |
Chang S.W. et al. (12) |
ВЛП Е |
Не известна |
|
GDFX0601 (Китай) |
KP686142 |
Jianyong H. н.о. |
ВЛП Е |
Не известна |
|
GDFX0602 (Китай) |
KP686143 |
Jianyong H. н.о. |
ВЛП Е |
Не известна |
|
GDFX0603 (Китай) |
KP686144 |
Jianyong H. н.о. |
ВЛП Е |
Не известна |
|
JS14CZ02 (Китай) |
KY490696 |
Shao H. et al. (11) |
ВЛП Е |
Не известна |
|
GD14LZ (Китай) |
KU605774 |
Li X. et al. (3) |
ВЛП Е |
Не известна |
|
Oki 009 (Япония) |
AB669433 |
Ochi A. et al. (18) |
Oki |
Не известна |
|
Прим еч ани е. н.о |
. — не опубликовано |
(депонировано в GenBank). |
||
Анализ литературы показывает, что ВЛП подгруппы К может вызывать глиомы и миокардиты (8, 17, 18) — нетипичные для ВЛП патологии. В случае вируса лейкоза птиц механизм патогенеза изучен неполно. Предполагается, что высокая изменчивость ретровирусов может вносить вклад в их вирулентность и патогенез (19). В LTR областях у некоторых штаммов ВЛП присутствует Е элемент, который не является онкогеном, но увеличивает патогенность вирусов (20). Некоторые из изученных последовательностей ВЛП подгруппы К имеют последовательности, сходные с Е элементом. Примером может служить штамм SD110503R (KF738251) из Китая (о патогенности этого штамма ничего не известно, поскольку опубликована только геномная последовательность в GenBank). Два штамма ВЛП, вызывающие глиому, описаны в Японии: это Sp-40 (AB617819) и Sp-53 (AB617820). Их геномы содержат небольшой фрагмент длиной 27 нуклеотидов, сходный с Е элементом (8) (см. табл.). Один из механизмов патогенеза при заражении вирусом лейкоза птиц — инсерционный мутагенез (21, 22), также может происходить изменение экспрессии генов клетки-хозяина за счет дополнительной транскрипции с LTR ВЛП (23, 24). Многое в механизмах проявления инфекции остается неясным, поскольку спектр заболеваний, вызываемый ВЛП, достаточно широк. Например, в развитии гемангиом предполагается ведущая роль инсерционного мутагенеза с изменением экспрессии гена met (21), другие авторы подчеркивают важность участия белка оболочки GP85 в развитии этого заболевания (24). Есть данные, что белок оболочки служит основной детерминантой при лимфоидном и миелоидном лейкозе (25). Можно ожидать, что наличие ВЛП подгруппы К снижает продуктивность птицы. Так, считается что ВЛП с LTR, сходными с LTR ВЛП подгруппы Е, не обладают заметной патогенностью. Однако проведенный метагеномный анализ возможного инфекционного агента, ставшего причиной до 20 % потерь куриного стада 846
(26), показал, что у этого вируса нуклеотидные последовательности проявляют 100 % сходства с геном gp85 и LTR ВЛП штамма TW-3593, имеющего LTR ВЛП подгруппы Е.
Б
А
GDFX0602
GDFX0603
Km_5844
TW-3593
Km 6343
JS14CZ02
Km_5943
Km_5845
Km_6349
Km_5892
Km_6181
Km_6222
Km_6249
Km_6202
GD14LZ
JS11C1 JS14CZ01
SD110503R
Oki 009
Schmidt-Ruppin В
Schmidt-Ruppin D GDFX0601
MQNCSU-A
HPRS103 J
HPRS103 J
SD11O5O3R
Schmidt-Ruppin D Schmidt-Ruppin В MQNCSU-A Km_6202
Km_6343
Km_5844
Km_5845
Km_5943
JS14CZ01
GDFX0603
Km_6181
Km_5892
Km_6249
Km_6349
Km_6222
GD14LZ
Oki 009
TW-3593
GDFX0602
JS14CZ02
GDFX0601
JS11C1
Филогенетические деревья, построенные на основе сравнения последовательностей гена gp85 белка оболочки (А) и 3´-UTR (Б) у штаммов разных подтипов вируса лейкоза птиц из GenBank . Описание штаммов см. в разделе «Методика».
Экзогенные и эндогенные вирусы лейкоза птиц могут вызывать большие экономические потери даже при субклинической инфекции (6, 27). Для изучения патогенных свойств вариантов ВЛП подгруппы K, обнаруженных нами у мясного кросса бройлерного типа, 123 инфицированные птицы в возрасте 58 сут были изолированы от основного стада. В возрасте 156 сут у 6 павших птиц не выявили неопластических процессов.
Итак, разработана тест-система ПЦР в реальном времени для детекции вируса лейкоза птиц подгруппы К, при помощи которой вирус этой подгруппы обнаружен в России. Таким образом, распространение ВЛП подгруппы К не ограничивается странами Азии. Анализ данных литературы позволяет говорить о возможной патогенности ВЛП подгруппы К, поэтому нужна программа его мониторинга и контроля.
Список литературы Выявление вирусалейкоза птиц подгруппы К в России и его молекулярно-генетический анализ
- Lloyd Spencer J. Progress towards eradication of lymphoid leukosis viruses -а review. Avian Pathol., 1984, 13(4): 599-619 ( ) DOI: 10.1080/03079458408418560
- Payne L.N., Brown S.R., Bumstead N., Howes K., Frazier J.A., Thouless M.E. A novel subgroup of exogenous avian leukosis virus in chickens. J. Gen. Virol., 1991, 72: 801-807 ( ) DOI: 10.1099/0022-1317-72-4-801
- Li X., Lin W., Chang S., Zhao P., Zhang X., Liu Y., Chen W., Li B., Shu D., Zhang H., Chen F., Xie Q. Isolation, identification and evolution analysis of a novel subgroup of avian leukosis virus isolated from a local Chinese yellow broiler in South China. Arch. Virol., 2016, 161(10): 2717-2725 ( ) DOI: 10.1007/s00705-016-2965-x
- Crittenden L.B. Exogenous and endogenous leukosis virus genes -A review. Avian Pathol., 1981, 10(2): 101-112 ( ) DOI: 10.1080/03079458108418464
- Payne L.N., Fadly A.M. Leukosis/sarcoma group. In: Diseases of poultry/B.W. Calnek, H.J. Bar-nes, C.W. Beard, L.R. Mc Dougald, Y.M. Saif (eds.). Iowa, 1997, V. 10: 414-466.
- Payne L.N. Retrovirus-induced disease in poultry. Poultry Sci., 1998, 77(8): 1204-1212 ( ) DOI: 10.1093/ps/77.8.1204
- Ochi A., Ochiai K., Nakamura S., Kobara A., Sunden Y., Umemura T. Molecular characteristics and pathogenicity of an avian leukosis virus isolated from avian neurofibrosarcoma. Avian Dis., 2012, 56(1): 35-43 ( ) DOI: 10.1637/9830-060711-Reg.1
- Nakamura S., Ochiai K., Hatai H., Ochi A., Sunden U., Umemura T. Pathogenicity of avian leukosis viruses related to fowl glioma-inducing virus. Avian Pathol., 2011, 40(5): 499-505 ( ) DOI: 10.1080/03079457.2011.605783
- Gao L., Qin L.T., Pan W., Wang Y.Q., Lee Qi.X., Gao H.L., Wang X.M. Avian leukosis virus subgroup J in layer chickens, China. Emerg. Infect. Dis., 2010, 16(10): 1637-1638 ( ) DOI: 10.3201/eid1610.100780
- Cui N., Su S., Chen Z., Zhao X., Cui Z. Genomic sequence analysis and biological characteristics of a rescued clone of avian leukosis virus strain JS11C1, isolated from indigenous chickens. J. Gen. Virol., 2014, 95(Pt 11): 2512-2522 ( ) DOI: 10.1099/vir.0.067264-0
- Shao H., Wang L., Sang J., Li T., Liu Y., Wan Z., Qian K., Qin A., Ye A. Novel avian leukosis viruses from domestic chicken breeds in mainland China. Arch. Virol., 2017, 162(7): 2073-2076 ( ) DOI: 10.1007/s00705-017-3344-y
- Chang S.W., Hsu M.F., Wang C.H. Gene detection, virus isolation, and sequence analysis of avian leukosis viruses in Taiwan country chickens. Avian Dis., 2013, 57(2): 172-177 ( ) DOI: 10.1637/10387-092612-Reg.1
- Плотников В.А., Гребенникова Т.В. Дудникова Е.К., Шульпин М.И., Лазарева С.П., Никонова З.Б., Меньщикова А.Э., Норкина С.Н., Алипер Т.И. О распространении вируса лейкоза птиц в птицеводческих хозяйствах на территории России. Сельскохозяйственная биология, 2013, 6: 36-42 ( ) DOI: 10.15389/agrobiology.2013.6.36rus
- Meng F., Li X., Fang J., Gao Y., Zhu L., Xing G., Tian F., Gao Y., Dong X., Chang S., Zhao P., Cui Z., Liu Z. Genomic diversity of the Avian leukosis virus subgroup J gp85 gene in different organs of an infected chicken. J. Vet. Sci., 2016, 17(4): 497-503 ( ) DOI: 10.4142/jvs.2016.17.4.497
- Lupiani B., Hunt H., Silva R., Fadly A. Identification and characterization of recombinant subgroup J avian leukosis viruses (ALV) expressing subgroup A ALV envelope. Virology, 2000, 276(1): 37-43 ( ) DOI: 10.1006/viro.2000.0539
- Bai J., Payne L.N., Skinner M.A. HPRS-103 (exogenous avian leukosis virus, subgroup J) has an env gene related to those of endogenous elements EAV-0 and E51 and an E element found previously only in sarcoma viruses. J. Virol., 1995, 69(2): 779-84 ( ) DOI: 10.1128/JVI.75.2.726-737.2001
- Nakamura S., Ochiai K., Ochi A., Yabushita H., Abe A., Kishi S., Sunden Y., Umemura T. Cardiac pathology and molecular epidemiology by avian leukosis viruses in Japan. PLoS ONE, 2014, 9(1): e86546 ( ) DOI: 10.1371/journal.pone.0086546
- Ochi A., Ochiai K., Kobara A., Nakamura S., Hatai H., Handharyani E., Tiemann I., Tanaka I.B. 3rd, Toyoda T., Abe A., Seok S.H., Sunden Y., Torralba N.C., Park J.H., Hafez H.M., Umemura T. Epidemiological study of fowl glioma-inducing virus in chickens in Asia and Germany. Avian. Pathol., 2012, 41(3): 299-309 ( ) DOI: 10.1080/03079457.2012.684373
- Mansky L.M. Retrovirus mutation rates and their role in genetic variation. J. Gen. Virol., 1998, 79: 1337-1345 ( ) DOI: 10.1099/0022-1317-79-6-1337
- Chesters P.M., Smith L.P., Nair V. E (XSR) element contributes to the oncogenicity of Avian leukosis virus (subgroup J). J. Gen. Virol., 2006, 87(9): 2685-2692 (doi 10.1099/vir.0.81884-0).
- Justice J. 4th, Malhotra S., Ruano M., Li Y., Zavala G., Lee N., Morgan R., Beemon K. The MET gene is a common integration target in avian leukosis virus subgroup J-induced chicken hemangiomas. J. Virol., 2015, 89(9): 4712-4719 ( ) DOI: 10.1128/JVI.03225-14
- Hayward W.S., Neel B.G., Astrin S.M. Activation of a cellular onc gene by promoter insertion in ALV-induced lymphoid leukosis. Nature, 1981, 290(5806): 475-480 ( ) DOI: 10.1038/290475a0
- Laimins L.A., Tsichlis P., Khoury G. Multiple enhancer domains in the 3ґ terminus of the Prague strain of Rous sarcoma virus. Nucleic Acids Res., 1984, 12(16): 6427-6442.
- Maeda N., Fan H., Yoshikai Y. Oncogenesis by retroviruses: old and new paradigms. Rev. Med. Virol., 2008, 18(6): 387-405 ( ) DOI: 10.1002/rmv.592
- Chesters P.M., Howes K., Petherbridge L., Evans S., Payne L.N., Venugopal K. The viral envelope is a major determinant for the induction of lymphoid and myeloid tumours by avian leukosis virus subgroups A and J, respectively. J. Gen. Virol., 2002, 83: 2553-2561 ( ) DOI: 10.1099/0022-1317-83-10-2553
- Bande F., Arshad S.S., Omar A.R. Isolation and metagenomic identification of avian leukosis virus associated with mortality in broiler chicken. Adv. Virol., 2016, 2016: Article ID 9058403 ( ) DOI: 10.1155/2016/9058403
- Bacon L.D., Fulton J.E., Kulkarni G.B. Methods for evaluating and developing commercial chicken strains free of endogenous subgroup E avian leukosis virus. Avian Pathol., 2004, 33(2): 233-243 ( ) DOI: 10.1080/0307943042000195731


