Выраженный клинико-морфологический ответ у больного местнораспространенным раком желудка после проведения неоадъювантной химиотерапии с последующей химиолучевой терапией (клиническое наблюдение)
Автор: Скоропад В.Ю., Миронова Д.Ю., Колобаев И.В., Агабабян Т.А., Жаворонкова Е.С., Гриневич В.Н., Иванов С.А., Каприн А.Д.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Случай из клинической практики
Статья в выпуске: 3 т.22, 2023 года.
Бесплатный доступ
Актуальность. В нашей стране и в мире рак желудка входит в число онкологических заболеваний с наиболее высокими показателями заболеваемости и смертности. Стандартом лечения местнораспространенного рака желудка признаны хирургическое вмешательство в объеме гастрэктомии/субтотальной резекции желудка с лимфодиссекцией D2 и периоперационной химиотерапией по схеме FLOT. До настоящего времени не определена роль химиолучевой терапии в лечении данного заболевания. За рубежом проводятся 3 крупных многоцентровых рандомизированных клинических исследования, посвященных данной теме. В 2019-21 гг. в МРНЦ им. А.Ф. Цыба проведено проспективное клиническое исследование в рамках 2-й фазы по изучению безопасности и эффективности неоадъювантной терапии в составе: индукционная химиотерапия FLOT (2 цикла) и химиолучевая терапия (СОД 46 Гр, на фоне химиотерапии препаратами капецитабин и оксалиплатин) с последующей операцией. Цель исследования - демонстрация успешного проведения курса неоадъювантной терапии по поводу местнораспространенного рака желудка, с достижением выраженного патоморфоза опухоли, существенным эффектом снижения стадии (“downstaging”) и более чем 2,5-летней безрецидивной выживаемости. Описание клинического случая. Пациент Т., 48 лет, обратился с жалобами на тянущие боли в эпигастрии, беспокоящие в течение 2 мес. При гастроскопии с биопсией выявлен рак желудка. При комплексном обследовании в МРНЦ установлен диагноз: рак проксимального отдела желудка с распространением на абдоминальный сегмент пищевода cT3N3aM0, III стадия. Пациенту предложено участие в клиническом исследовании, получено информированное добровольное согласие. Было проведено комплексное лечение - 2 цикла химиотерапии по схеме FLOT с последующей химиолучевой терапией и хирургическим вмешательством в объеме гастрэктомии с резекцией абдоминального сегмента пищевода и лимфодиссекцией D2. При морфологическом исследовании операционного материала зарегистрирована 1b степень лечебного параморфоза по К. Becker. При исследовании лимфатических узлов определялся полный лечебный патоморфоз. На момент анализа в течение более 33 мес после начала лечения пациент жив, без признаков прогрессирования опухоли. Заключение. В данном клиническом случае применение неоадъювантной индукционной химиотерапии с последующей химиолучевой терапией позволило достичь выраженного лечебного патоморфоза и снижения стадии заболевания, а также безрецидивной выживаемости в течение 2,5 лет.
Местнораспространенный рак желудка, неоадъювантная химиолучевая терапия, лечебный патоморфоз, гастрэктомия, безрецидивная выживаемость
Короткий адрес: https://sciup.org/140300175
IDR: 140300175 | УДК: 616.33-006.6-08:615.28:615.849.1 | DOI: 10.21294/1814-4861-2023-22-3-153-161
Текст научной статьи Выраженный клинико-морфологический ответ у больного местнораспространенным раком желудка после проведения неоадъювантной химиотерапии с последующей химиолучевой терапией (клиническое наблюдение)
Клинический случай
На междисциплинарном онкологическом консилиуме с учетом гистотипа опухоли и распространенности процесса был выработан план комплексного лечения. Пациенту предложено участие в клиническом исследовании, получено информированное добровольное согласие.
На первом этапе лечения, с 14.04. по 01.05.2020, проведено 2 цикла химиотерапии по схеме FLOT (Доцетаксел 50 мг/м2, внутривенно капельно в 1-й день + Оксалиплатин 85 мг/м2 в 1-й день + Кальция фолинат 200 мг/м2 (2-часовая внутривенная инфузия) в 1-й день + 5-фторурацил 2600 мг/м2, 24-часовая внутривенная инфузия в 1-й день), повтор курса каждые 2 нед. Лечение проводилось на фоне премедикации и сопроводительной терапии, в том числе с профилактикой гематологической токсичности препаратом лейкостим в дозе 300 мг подкожно. В процессе химиотерапии отмечались явления гастроинтестинальной токсичности I степени по шкале СТСАЕ.
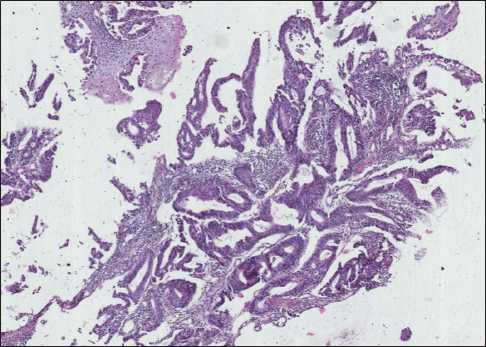
Рис. 1. Морфологическое исследование биопсийного материала. Окраска гематоксилином и эозином, ×200 Fig. 1. Morphological study of the biopsy specimen. Hematoxylin-eosin staining, ×200
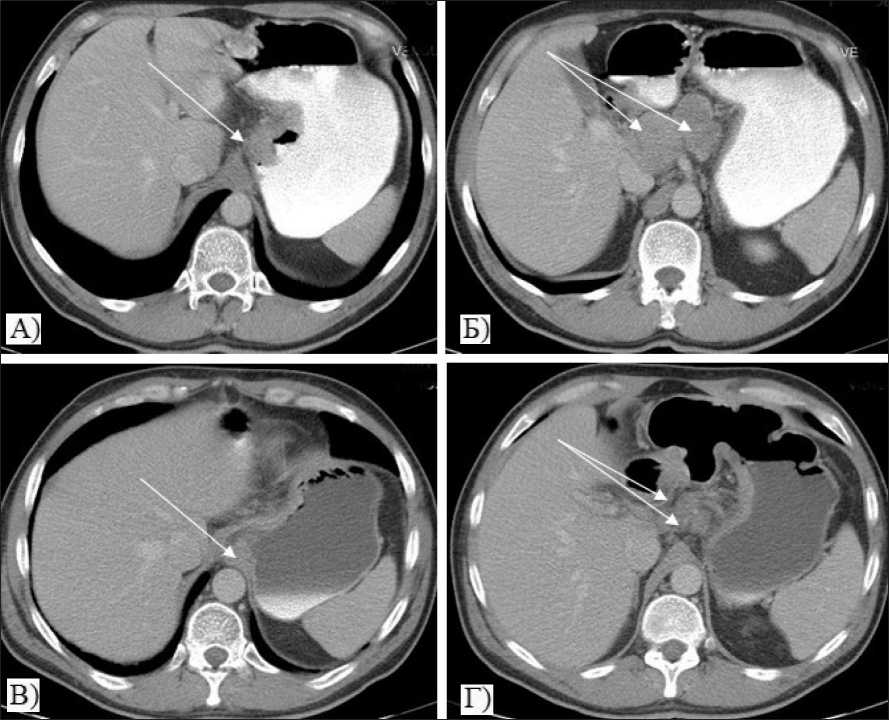
Fig. 2. CT of abdomen before (A,B) and after (C,D) neoadjuvant chemoradiation therapy:
A) Axial CT image shows mural thickening in proximal stomach with tumor extending along gastrohepatic ligament (arrow);
B) Numerous enlarged 45x32mm perigastric lymph nodes are present (arrows). C) After chemoradiation therapy, the size of the tumor is markedly decreased on CT; D) Reduction of the number and size of metastatic lymph nodes after chemoradiation therapy up to 24x22mm (arrows)
ежедневно; оксалиплатин – 85 мг/м2, внутривенно капельно, 1-й и 21-й дни). Лучевую терапию проводили на линейном ускорителе электронов Elekta Synergy S в режиме традиционного фракционирования (РОД 2 Гр, СОД 46 Гр) с использованием технологии объемной визуализации мишени (IGRT) и индивидуальных фиксирующих устройств. В процессе лечения наблюдалась печеночная и гематологическая токсичность I степени, а также гастроинтестинальная токсичность II степени.
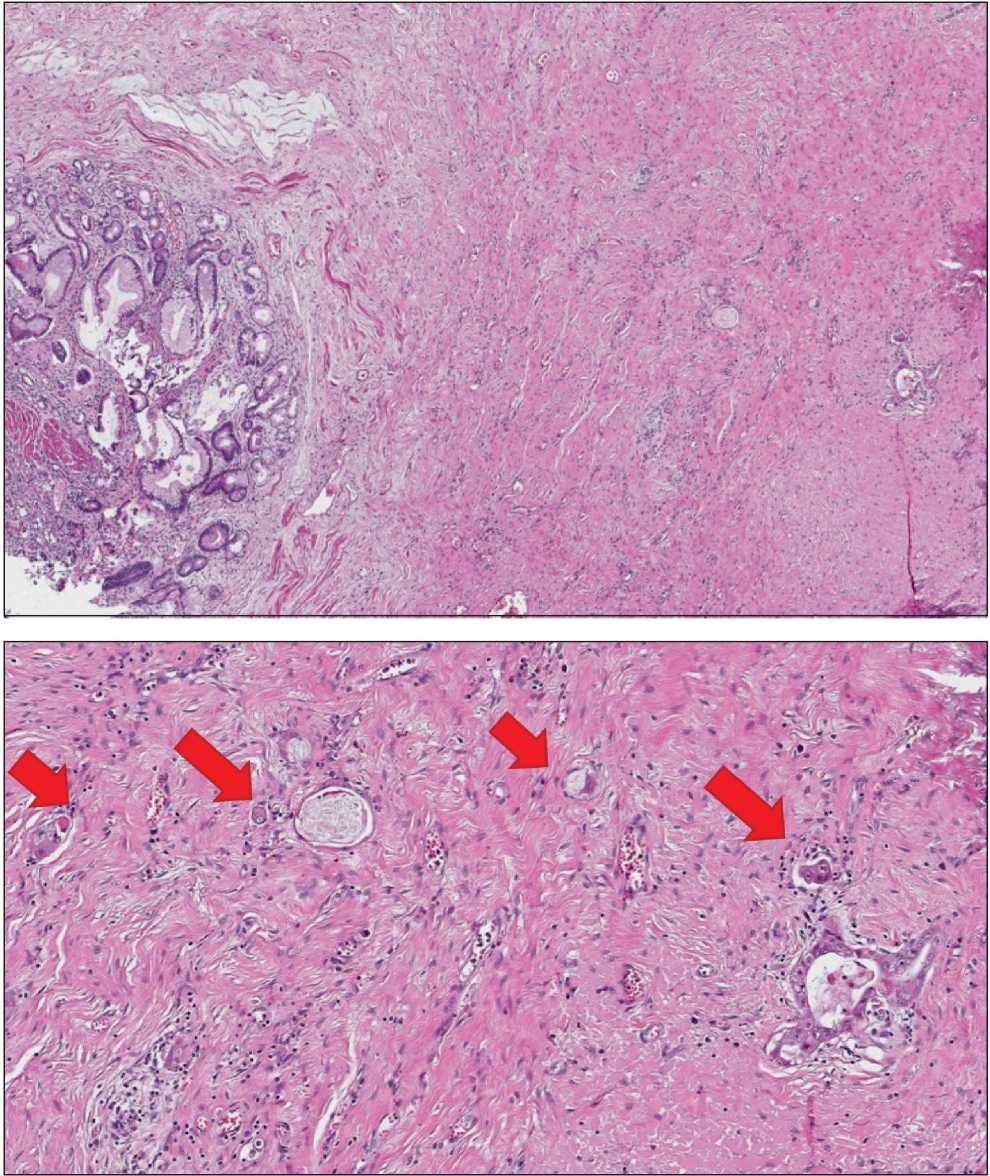
Окраска гематоксилином и эозином, ×50
Fig. 3. Morphological study of the surgical specimen.
Hematoxylin-eosin staining, ×50
Рис. 4. Морфологическое исследование операционного материала (тот же фрагмент, большее увеличение). Стрелками указаны дискретно расположенные опухолевые клетки и комплексы аденокарциномы. Окраска гематоксилином и эозином, ×200 Fig. 4. Morphological study of the surgical specimen (the same fragment but larger magnification). The arrows indicate discretely located tumor cells and adenocarcinoma complexes. Hematoxylin-eosin staining, ×200
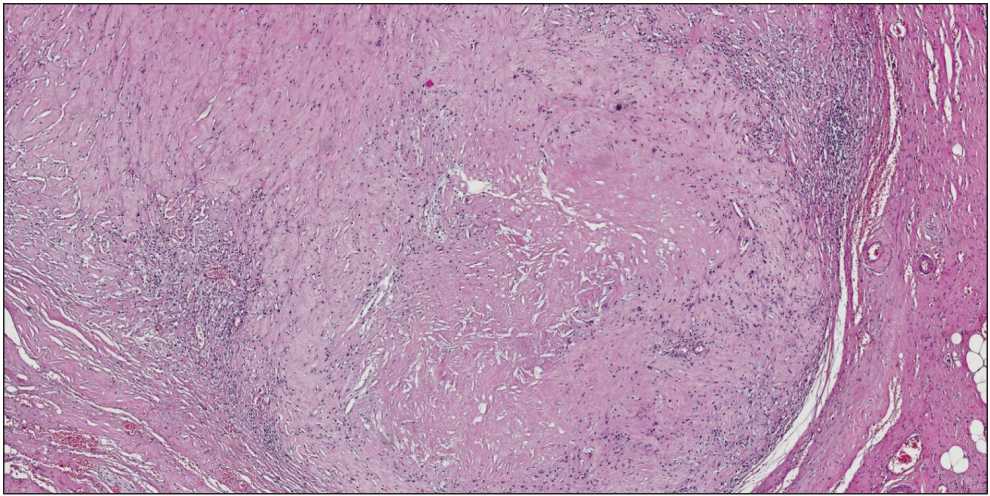
Рис. 5. Морфологическое исследование операционного материала (лимфатический узел). Окраска гематоксилином и эозином, ×100
Fig. 5. Morphological study of the surgical specimen (lymph node). Hematoxylin-eosin staining, ×100
Пациент находился под динамическим наблюдением без признаков прогрессирования опухоли в течение более 33 мес после начала лечения. При телефонном контакте (январь 2023 г.) – само- чувствие удовлетворительное, социально активен, работает по основной профессии, жалоб не предъявляет.
Обсуждение
В последние годы в зарубежной литературе все более активно обсуждается феномен «снижения стадии» (“downstaging”), включая его потенциальную прогностическую значимость. Наибольшее внимание уделяется посттерапевтическому статусу регионарных лимфатических узлов (ypN), поскольку сохранение их метастатического поражения (ypN+) после проведения неоадъювантной терапии является наиболее значимым фактором неблагоприятного прогноза [12]. Принципиально важным является доказательство того факта, что показатель выживаемости пациентов, у которых после проведения неоадъювантной терапии зафиксирована категория ypN0, в том числе ранее имевших категорию сN+ (конверсия сN+ → ypN0), не отличается от аналогичных показателей пациентов с исходной категорией сN0 → ypN0 и pN0.
Показатели 3-летней (83 vs 44 %) и 5-летней (75 vs 35 %) общей выживаемости оказались значимо (р<0,05) выше в группе пациентов ypN0. По данным многофакторного анализа посттерапевтический статус лимфатических узлов являлся значимым независимым фактором прогноза в отношении общей выживаемости (р=0,027). Авторы заключили, что снижение стадии пораженных лимфатических узлов (сN+ → ypN0) является важным фактором, отражающим эффективность неоадъювантной терапии и положительно влияющим на показатели выживаемости.
Список литературы Выраженный клинико-морфологический ответ у больного местнораспространенным раком желудка после проведения неоадъювантной химиотерапии с последующей химиолучевой терапией (клиническое наблюдение)
- Sung H., Ferlay J., Siegel R.L., Laversanne M., Soerjomataram I., Jemal A., Bray F. Global Cancer Statistics 2020: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2021; 71(3): 209-49. https://doi.org/10.3322/caac.21660.
- Zlokachestvennye novoobrazovaniya v Rossii v 2021 godu (zabolevaemost' i smertnost'). Pod red. A.D. Kaprina, V.V. Starinskogo, A.O. Shakhzadovoi. M., 2022. 252 s.
- Al-Batran S.E., Homann N., Pauligk C., Goetze T.O., Meiler J., Kasper S., Kopp H.G., Mayer F., Haag G.M., Luley K., Lindig U., Schmiegel W., Pohl M., Stoehlmacher J., Folprecht G., Probst S., Prasnikar N., Fischbach W., Mahlberg R., Trojan J., Koenigsmann M., Martens U.M., Thuss-Patience P., Egger M., Block A., Heinemann V., Illerhaus G., Moehler M., Schenk M., Kullmann F., Behringer D.M., Heike M., Pink D., Teschendorf C., Lohr C., BernhardH., Schuch G., Rethwisch V, von Weiker-sthal L.F., Hartmann J.T., Kneba M., Daum S., Schulmann K., Weniger J., Belle S., Gaiser T., Oduncu F.S., Guntner M., Hozaeel W., Reichart A., JagerE., Kraus T., MonigS., Bechstein W.O., SchulerM., SchmalenbergH., Hofheinz R.D.; FLOT4-AIO Investigators. Perioperative chemotherapy with fluorouracil plus leucovorin, oxaliplatin, and docetaxel versus fluorouracil or capecitabine plus cisplatin and epirubicin for locally advanced, resectable gastric or gastro-oesophageal junction adenocarcinoma (FLOT4): a randomised, phase 2/3 trial. Lancet. 2019; 393(10184): 1948-57. https://doi.org/10.1016/S0140-6736(18)32557-1.
- Leong T., Smithers B.M., Haustermans K., Michael M., Gebski V., Miller D., Zalcberg J., Boussioutas A., Findlay M., O'Connell R.L., Verghis J., Willis D., Kron T., Crain M., Murray W.K., Lordick F., Swallow C., Darling G., Simes J., Wong R. TOPGEAR: A Randomized, Phase III Trial of Perioperative ECF Chemotherapy with or Without Preoperative Chemoradiation for Resectable Gastric Cancer: Interim Results from an International, Intergroup Trial of the AGITG, TROG, EORTC and CCTG. Ann Surg Oncol. 2017; 24(8): 2252-8. https://doi.org/10.1245/s10434-017-5830-6.
- Liu X., Jin J., Cai H., Huang H., Zhao G., Zhou Y., Wu J., Du C., Long Z., Fang Y., Ma M., Li G., Zhou M., Yin J., Zhu X., Zhu J., Sheng W., Huang D., Zhu H., Zhang Z., Lu Q., Xie L., Zhang Z., Wang Y. Study protocol of a randomized phase III trial of comparing preoperative chemoradiation with preoperative chemotherapy in patients with locally advanced gastric cancer or esophagogastric junction adenocarcinoma: PREACT. BMC Cancer. 2019; 19(1): 606. https://doi.org/10.1186/s12885-019-5728-8.
- Slagter A.E., JansenE.PM., van LaarhovenH.W.M., van Sandick J.W., van Grieken N.C.T., Sikorska K., Cats A., Muller-Timmermans P., Hul-shofM.C.CM., BootH., LosM., BeerepootL.V, PetersF.P.J., HospersGA.P., van Etten B., HartgrinkH.H., van Berge HenegouwenM.I., Nieuwenhui-jzen G.A.P., van Hillegersberg R., van der Peet D.L., Grabsch H.I., Verheij M. CRITICS-II: a multicentre randomised phase II trial of neo-adjuvant chemotherapy followed by surgery versus neo-adjuvant chemotherapy and subsequent chemoradiotherapy followed by surgery versus neo-adjuvant chemoradiotherapy followed by surgery in resectable gastric cancer. BMC Cancer. 2018; 18(1): 877. https://doi.org/10.1186/s12885-018-4770-2.
- Su P., Zhang Y., Yu T., Jiang L., Kang W., Liu Y., Yu J. Does postoperative chemotherapy improve overall survival of patients with ypT1-2N0 cancer? World J Surg Oncol. 2022; 20(1): 408. https://doi.org/10.1186/s12957-022-02881-y.
- Petrelli F., Tomasello G., Barni S. Surrogate end-points for overall survival in 22 neoadjuvant trials of gastro-oesophageal cancers. Eur J Cancer. 2017; 76: 8-16. https://doi.org/10.1016/j.ejca.2017.01.032.
- Tomasello G., Petrelli F., Ghidini M., Pezzica E., Passalacqua R., Steccanella F., Turati L., Sgroi G., Barni S. Tumor regression grade and survival after neoadjuvant treatment in gastro-esophageal cancer: A metaanalysis of 17 published studies. Eur J Surg Oncol. 2017; 43(9): 1607-16. https://doi.org/10.1016/j.ejso.2017.03.001.
- Stark A.P., IkomaN., Chiang Y.J., Estrella J.S., Das P, MinskyB.D., Blum M.M., Ajani J.A., Mansfield P., Badgwell B.D. Characteristics and Survival of Gastric Cancer Patients with Pathologic Complete Response to Preoperative Therapy. Ann Surg Oncol. 2019; 26(11): 3602-10. https://doi.org/10.1245/s10434-019-07638-8.
- Skoropad V.Yu., Kudryavtsev D.D., Titova L.N., Mozerov S.A., Agababyan T.A., Ivanov S.A., Kaprin A.D. Lechebnyi patomorfoz posle neoad"yuvantnoi khimioluchevoi terapii u bol'nykh mestnorasprostranennym rakom zheludka. Sibirskii onkologicheskii zhurnal. 2020; 19(3): 38-46. https://doi.org/10.21294/1814-4861-2020-19-3-38-46.
- Pelc Z., Skorzewska M., Rawicz-Pruszynski K., Polkowski W.P. Lymph Node Involvement in Advanced Gastric Cancer in the Era of Multimodal Treatment-Oncological and Surgical Perspective. Cancers (Basel). 2021; 13(10): 2509. https://doi.org/10.3390/cancers13102509.
- Wu L., Xing Z., Huang M., Yu H., Qin Y., Jin Q., Zhou Z., Chen J. Nodal downstaging to ypN0 after neoadjuvant chemotherapy positively impacts on survival of cT4N+ GC/GEJ patients. J Surg Oncol. 2022; 126(8): 1403-12. https://doi.org/10.1002/jso.27065.
- Ikoma N., Estrella J.S., Hofstetter W., Das P., Minsky B.D., Ajani J.A., Fournier K.F., Mansfield P., Badgwell B.D. Nodal Downstaging in Gastric Cancer Patients: Promising Survival if ypN0 is Achieved. Ann Surg Oncol. 2018; 25(7): 2012-17. https://doi.org/10.1245/s10434-018-6471-0.
- Ikoma N., Hofstetter W.L., Estrella J.S., Das P., Minsky B.D., Fournier K.F., Mansfield P.F., Ajani J.A., Badgwell B.D. The ypT category does not impact overall survival in node negative gastric cancer. J Surg Oncol. 2018; 117(8): 1721-8. https://doi.org/10.1002/jso.25081.
- Sandø A.D., Fougner R., Grønbech J.E., Bringeland E.A. The value of restaging CT following neoadjuvant chemotherapy for resectable gastric cancer. A population-based study. World J Surg Oncol. 2021; 19(1): 212. https://doi.org/10.1186/s12957-021-02313-3.


