Высокоинтенсивная фокусированная ультразвуковая абляция (HIFU) рака предстательной железы у 976 пациентов: 7-летние результаты
Автор: Соловов Вячеслав Александрович, Орлов Андрей Евгеньевич, Воздвиженский Михаил Олегович, Фесенко Денис Владимирович, Матяш Яна Сергеевна, Копылов Андрей Валерьевич, Хаметов Равиль Зийнурович, Печенина Ирина Анатольевна
Статья в выпуске: 2-3 т.17, 2015 года.
Бесплатный доступ
Высокоинтенсивная фокусированная ультразвуковая абляция - минимально инвазивная технология, которая применяется для лечения различных видов новообразований. В ретроспективный анализ включены результаты лечения 976 больных с раком предстательной железы, получивших лечение в Самарском онкологическом центре в 2007-2014 гг. Приведенные данные свидетельствуют о высокой клинической эффективности лечения рака простаты.
Высокоинтенсивная фокусированная ультразвуковая абляция, рак, предстательная железа
Короткий адрес: https://sciup.org/148102337
IDR: 148102337 | УДК: 616.65-006:615.837.3
Текст научной статьи Высокоинтенсивная фокусированная ультразвуковая абляция (HIFU) рака предстательной железы у 976 пациентов: 7-летние результаты
В развитых странах рак предстательной железы (РПЖ) является наиболее распространенным злокачественным заболеванием у мужчин и второй причиной смерти от рака после рака легких [8] . В 2013 г РПЖ занял третье месс-то в структуре онкологических заболеваний среди мужского населения России, зафиксировано 29158 новых случаев заболевания [1] . 9535
пациентов умерли от рака простаты в 2013 г. [1] . Радикальная простатэктомия (РПЭ) и лучевая терапия (ДЛТ) являются стандартами лечения пациентов с локализованным раком простаты с ожидаемой продолжительностью жизни не менее 10 лет [11] . У 30% пролеченных больных с помощью РПЭ и ДЛТ возникает рецидив. Далее лечение включает в себя гормонотерапию, что приводит в конечном итоге к развитию кастратрезистентного рака предстательной
Соловов Вячеслав Александрович, доктор медицинских наук, заведующий отделением интервенционных методов диагностики и лечения. E-mail
Орлов Андрей Евгеньевич, кандидат медицинских наук, главный врач
Воздвиженский Михаил Олегович, доктор медицинских наук, заместитель главного врача по лечебной работе Фесенко Денис Владимирович, врач отделения интервенционных методов диагностики и лечения.
Матяш Яна Сергеевна, врач отделения интервенционных методов диагностики и лечения.
Копылов Андрей Валерьевич, заведующий консультативным отделением
Хаметов Равиль Зийнурович, врач консультативного отделения.
Печенина Ирина Анатольевна, врач консультативного отделения железы (КРРПЖ). Ранее для лечения КРРПЖ применяли вторую линию гормональной терапии, химиотерапию, достигая паллиативного результата без увеличения выживаемости [5]. Новые схемы лечения с доцетакселом и преднизолоном показали как паллиативные результаты, так увеличение выживаемости [6, 7]. В течение последнего десятилетия разработаны новые малоинвазивные методы лечения РПЖ, например, брахитерапия, высокоинтенсивная фокусированная ультразвуковая абляция (HIFU), криотерапия. HIFU является альтернативным выбором лечения РПЖ с низким и промежуточным риском развития прогрессии. Ультразвуковая абляция применяется для терапии пациентов с ГРРПЖ, используется как спасительное местное лечение после рецидива РПЭ, ДЛТ [9].
HIFU терапия является неинвазивным методом лечения, представляющий собой один сеанс терапии продолжительностью 1-2 часа под спинальной анестезией. В прямую кишку вводится трансректальный аппликатор, который состоит из УЗИ-датчика и изогнутого пьезоэлектрического кристалла, который фокусирует ультразвуковые лучи в фокальной точке. Положение аппликатора меняется в трех плоскостях, регулируется с помощью компьютерной программы; объем абляции, интенсивность и продолжительность HIFU терапии определяются индивидуально для каждого сеанса. Лечение проводится под ультразвуковой навигацией в режиме реального времени, обеспечивая высокую интраоперационную точность высокоинтенсивного фокусированного ультразвука. Физически HIFU ткани происходит с помощью двух способов воздействия: теплового и механического. Тепловой эффект достигается за счет поглощения фокусированных ультразвуковых волн в фокальной точке. Итоговая температура достигает более 80°C, что приводит к необратимым повреждениям тканей и к коагуляционному некрозу. При механическом воздействии отрицательное давление, передаваемое на ткани ультразвуковой волной, вызывает микропузырьки, формирующиеся внутри клеток, которые увеличиваются в размерах до точки, при которой достигается резонанс. Внезапное схлопывание этих пузырьков происходит при высоком давлении (20,000-30,000 бар) и повреждает клетки. Основные одиночные поражения малы и имеют размер 1,7 х 19-26 мм, но шаг за шагом они производят запланированный объем абляции. Во время лечения из-за резкого градиента температуры между тканями в фокусе и окружающими тканями экстрапростатические ткани чувствительных смежных структур, а именно охлажденная прямая кишка, наружный сфинктер и сосудисто-нервные пучки не подвергаются тепловому воздействию. При применении HIFU в тканях возникает коагуляционный некроз в результате превращения механической энергии в тепловую и механизма кавитации [4].
Первая работа, посвященная потенциальным возможностям HIFU, появилась в 1942 г. [3] . Позже братья Фрай применили ультразвуковую абляцию у пациентов с болезнью Паркинсона и другими неврологическими расстройствами. Исследования по применению HIFU в нейрохирургии продолжались в 50-60-е годы прошлого столетия [12] . В 1956 г. российский ученый А.К. Буров впервые предположил, что HIFU может быть использована при лечении злокачественных опухолей. УЗИ и магнитнорезонансная томография (МРТ) сделали доступным контроль над лечением в режиме реального времени, в связи с чем в настоящее время HIFU интенсивно развивается во многих направлениях хирургии и онкологии.
При HIFU терапии в организме пациента возникает стимуляция иммунологического ответа, вызванная эффектом кавитации. Значительно повышается проницаемость кровеносных сосудов, изменяется микросреда ткани опухоли, значительно увеличивается количество натуральных киллеров CD8, CD4, CD4+, NK [13]. Для коагуляции больших площадей ультразвуковая абляция должна осуществляться в определенном алгоритме. Это может быть достигнуто путем механического перемещения источника энергии или в электронном виде при фазированной антенной решетке [2, 10]. Наиболее важными параметрами HIFU являются: 1 – частота ультразвука (МГц), 2 – интенсивность звука (Вт), 3 – длительность применения, 4 – интервалы импульсов (задержка времени), 5 – боковое расстояние между элементарными поражениями, 6 – продольное смещение источника энергии, 7 – глубина проникновения аппликатора. Эти многочисленные технические параметры играют важную роль в конструкции системы HIFU для определенного органа и специального приложения. Сегодня стандартные урологические приложения используют для HIFU преобразователи с фиксированным, но регулируемым аппликатором, который перемещается механически.
Во время 15-летнего клинического опыта применения HIFU для лечения РПЖ было доказано, что трансректальный доступ под ультразвуковым контролем является безопасным методом даже без измерения температуры в «реальном времени». В течение последнего десятилетия с помощью трансректального HIFU было пролечено более 30 000 пациентов с раком простаты. Эффективность и побочные эффекты при лечении рака простаты были изучены и подробно описаны в европейском многоцентровом исследовании [ Ошибка! Источник ссылки не найден. ]. Авторы сообщают о своем опыте лечения определенных групп пациентов и сформулированных на основе этих результатов стандартизированных процедурах и протоколов ведения пациентов. В начале единственным показанием для HIFU были пациентов с локализованным раком простаты, которые не были кандидатами на операцию из-за их возраста, общего состояния здоровья, сопутствующих заболеваний или пациенты, которые отказались от радикальной простатэктомии. Однако на основе клинического опыта есть основания расширить показания применения HIFU: фокальная опухоль, случайно выявленный рак простаты после ТУР, спасительная терапия при местном рецидиве после радикальной простатэктомии, лучевой терапии или гормональной абляции, местно-распространенный РПЖ в качестве адъювантной локальной терапии, гормонально резистентный РПЖ. Противопоказаниями к трансректальному HIFU являются отсутствие прямой кишки, поврежденная стенка прямой кишки. Использование ТУР до HIFU позволяет удалить кальцификаты, абсцессы, уменьшить размер предстательной железы. Большой размер простаты (> 40 мл) больше не рассматривается как противопоказание для HIFU.
Цель исследования: оценить результаты лечения РПЖ фокусированной HIFU у пациентов с низким и высоким риском развития прогрессии, с местным рецидивом после ДЛТ и
РПЭ, ГРРПЖ.
Объекты и методы исследования.
Проведен ретроспективный анализ результатов лечения 976 пациентов, которым была проведена ультразвуковая абляция рака простаты в Самарском областном клиническом онкологическом диспансере с 2007 по 2014 гг. Из них пациентов с низким риском прогрессии – 251, среднем – 375, высоким – 308, с местным рецидивом после ДЛТ и РПЭ – 42, соответственно. Средний возраст составил 69,2 (52-89) лет. Ультразвуковая абляция выполнялась под спинальной анестезией, с использованием устройства Ablatherm® (EDAP, Лион, Франция).873 (89,4%) пациентам перед HIFU-терапией была проведена трансуретральная резекция простаты (ТУР).
Показания к ТУР: объем предстательной железы больше 40 куб.см, выраженные симптомы инфравезикальной обструкции (средняя скорость при урофлоуметрии меньше 10 мл/с). Среднее время наблюдения после лечения – 52 (3-84) месяца.
Результаты. Уровень ПСА через 72 месяца у пациентов с низким риском прогрессии РПЖ составил 0,6 (0-3,9) нг/мл, со средним риском прогрессии – 1,1 (0,2-6,8) нг/мл, с высоким – 3,4 (1,2-24,5) нг/мл и пациентов с рецидивом после ДЛТ и РПЭ – 1,7 (0,4-9,9) нг/мл, соответственно. Результаты лечения представлены в табл. 1.
Таблица 1. Результаты лечения по группам пациентов
|
Группы пациентов в соответствии с риском прогрессии (D’Amico) |
Местный рецидив и /или прогрессия через 7 лет наблюдения, % |
|
низкий риск : Глисон <7, стадия T1- 2N0M0, ПСА < 20 нг/мл. n=251 |
6,1 |
|
средний риск : Глисон <7, стадия T1- 2N0M0, ПСА < 20 нг/мл. n=375 |
8,2 |
|
высокий риск: Глисон ≤7, стадия T2-3N0M0, ПСА 20-50 нг/мл. n=308 |
30,5 |
|
местный рецидив после ДЛТ и РПЭ. n=42 |
24,6 |
Безрецидивная выживаемость по Каплану-Мейеру у всей группы больных составила 79,2% при 7-летнем наблюдении (рис. 1). Через 7 лет безрецидивная выживаемость составила 93,9% у пациентов с низким риском, 91,8% – со средним риском, 69,5% – с высоким риском и 75,4% с местным рецидивом после ДЛТ и РПЭ (рис. 2).
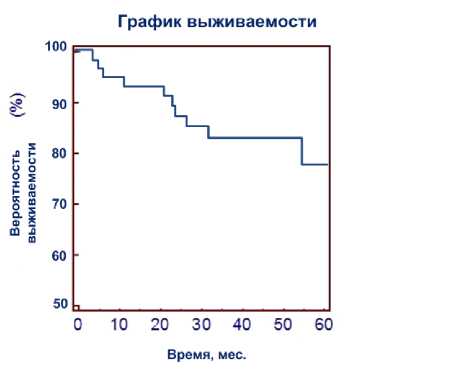
Рис. 1 . Выживаемость после HIFU терапии
Осложнения. Учащенное мочеиспускание в первый месяц после вмешательства отмечалось у 185 (19%) пациентов. Стрессовое недержание мочи I-II степени у 317 (32,5%) пациентов
(купировалось в течение 3-6 месяцев). Стриктуры простатического отдела уретры определялись у 156 (16%) пациентов (проведена ТУР стриктуры). Уретрально-прямокишечный свищ был у 3 (0,3%) пациентов (закрылся самостоятельно в течение 6 месяцев). Количество осложнений в группах первичного и спасительного HIFU отличались незначимо (p=0,035).
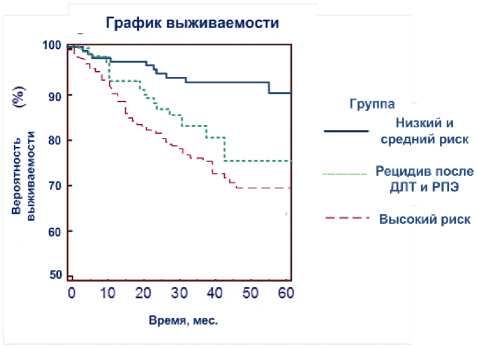
Рис. 2. Выживаемость после HIFU по группам пациентов
Выводы: ультразвуковая абляция являя-ется эффективным методом лечения первичного рака предстательной железы, спасительной терапией после рецидива ДЛТ и РПЭ, адъювантной паллиативной терапией при местно-распространенном РПЖ. Ультразвуковую абляцию применяют в качестве «радикальной HIFU терапии», включая ТУР, или как «фокальную терапию» без ТУР. Универсальность HIFU, по-видимому, уникальна для лечения всего спектра РПЖ, который является длительным заболеванием. Показания к HIFU терапии перекрываются в определенном диапазоне со всеми другими методами лечения. Ультразвуковая абляция представляет собой один сеанс неинвазивной терапии с небольшим числом послеоперационных осложнений с возможностью проведения у пациентов в любом возрасте и состоянии здоровья. HIFU помогает отодвинуть использование хирургического, лучевого или гормонального лечения до момента, когда они действительно неизбежны и наиболее эффективны. Исследуется вспомогательный терапевтический эффект от HIFU терапии – стимулирование иммунного ответа.
Список литературы Высокоинтенсивная фокусированная ультразвуковая абляция (HIFU) рака предстательной железы у 976 пациентов: 7-летние результаты
- Состояние онкологической помощи населению России в 2013 году/Под редакцией А.Д. Каприна, В.В. Старинского, Г.В. Петровой -М., 2014. 250 с.
- Curiel, L. 1.5-D high intensity focused ultrasound array for non-invasive prostate cancer surgery/L. Curiel et al.//IEEE Trans Ultrason Ferroelectr Freq Control. 2002. Vol. 49. P. 231-242.
- Lynn, J.G. A new method for the generation and use of focused ultrasound in experimental biology/J.G. Lynn, R.L. Zwemer, A.J. Chick, A.E. Miller//J. Gen. Physiol. 1942. Vol. 26. P. 179-193.
- Chaussy, Ch. Transrectal high-intensity focused ultrasound for local treatment of prostate cancer: current role/Ch. Chaussy, S. Thuroff//Arch. Esp. Urol. 2011. Vol. 64 (6). P. 493-506.
- Tannock, I.F. Chemotherapy with mitoxantrone plus prednisone or prednisone alone for symptomatic hormone-resistant prostate cancer: a Canadian randomized trial with palliative end points/I.F. Tannock et al.//J. Clin. Oncol. 1996. Vol. 14. P. 1756-1764.
- Petrylak. D.P. Docetaxel and estramustine compared with mitoxantrone and prednisone for advanced refractory prostate cancer/D.P. Petrylak et al.//N. Engl. J. Med. 2004. Vol. 351. P. 1513-1520.
- Tannock, I.F. Docetaxel plus prednisone or mitoxantrone plus prednisone for advanced prostate cancer/I.F. Tannock et al.//N. Engl. J. Med. 2004. Vol. 351. P. 1502-1512.
- Jemal, A. Gender Statistics/A. Jemal et al.//CA Cancer J. Clin. 2010. V. 7. P. 547-561.
- Thuroff, S. High-intensity focused ultrasound and localized prostate cancer: efficacy results from the European multricentric study/S. Thuroff et al.//J. Endourol. 2003. Vol. 17(8). P. 673-677.
- Chapelon, J.Y. New piezoelectric transducers for therapeutic ultrasound/J.Y. Chapelon et al.//Ultrasound Med Biol. -2002. -Vol. 26. -P.153-159.
- Prostate Cancer Treatment Guidelines, NCCN, v.1.2012.
- Fry, W.J. Ultrasonic lesions in the mammalian central nervous system/W.J. Fry et al.//Science. 1955. Vol. 122. P. 517-518.
- Unga, J. Ultrasound induced cancer immunotherapy/J. Unga, M. Hashida, J. Unga, M. Hashida//Adv. Drug Deliv. Rev. 2014. Mar 25. P. 13-31.


