Высвобождение антибиотиков из материалов для замещения постостеомиелитических дефектов кости
Автор: Стогов М.В., Шастов А.Л., Киреева Е.А., Тушина Н.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.30, 2024 года.
Бесплатный доступ
Введение. Поиск материалов для замещения костных дефектов, который обеспечивал бы пролонгированное высвобождение антибиотиков в терапевтических объемах в течение продолжительного периода, - актуальная задача при лечении пациентов с остеомиелитом.Цель работы - сравнить кинетику высвобождения антибиотиков из материала на основе полимеров полиуретанового ряда для замещения постостеомиелитических дефектов кости.Материалы и методы. Проведен in vitro сравнительный анализ кинетики высвобождения цефотаксима, ванкомицина и меропенема из двух материалов: на основе полимеров полиуретанового ряда (серия РК) и на основе полиметилметакрилата (серия ПММА). В каждой серии антибиотики вносили в исходные материалы в трех пропорциях полимер : антибиотик - 10:1 (группа 1); 10:0,5 (группа 2) и 10:0,25 (группа 3). Образцы инкубировали в 10 мл физиологического раствора при 37 °С. Инкубационный раствор в течение первой недели меняли ежедневно, в последующем - раз в неделю. В каждой группе инкубировали по 6 образцов.Результаты. Показано, что объем элюируемого цефотаксима из материала серии ПММА был выше, чем из материала серии РК при всех концентрациях антибиотика. В свою очередь для ванкомицина и меропенема эта особенность наблюдалась только для образцов группы 1. Для групп 0,5 и 0,25 в серии РК отмечался больший объем высвобождающихся антибиотиков, чем из ПММА. Обнаружено, что в серии РК высвобождение ванкомицина и цефатоксима в эффективной (терапевтической) концентрации было более пролонгировано. В серии РК пролонгированное сохранение эффективных концентраций происходило на фоне меньшего объема высвободившегося антибиотика, чем в серии ПММА.Обсуждение. Каждый материал показал свой профиль элюции антибиотика, и каждый из них может иметь свои показания. Материал на основе РК в части длительности элюции антибиотиков в терапевтических дозах имеет преимущества.Заключение. Длительность высвобождения изученных антибиотиков в эффективных концентрациях из материала на основе полимеров полиуретанового ряда выше, чем из материала на основе ПММА.
Остеомиелит, костные дефекты, костный цемент, антибиотики, кинетика элюции
Короткий адрес: https://sciup.org/142243870
IDR: 142243870 | УДК: 616.71-018.46-002-004.8-089.844-74:615.33 | DOI: 10.18019/1028-4427-2024-30-6-873-880
Текст научной статьи Высвобождение антибиотиков из материалов для замещения постостеомиелитических дефектов кости
В настоящее время для замещения костных дефектов, образующихся при удалении остеомиелитических очагов, широко применяют различные материалы, насыщенные антибиотиками [1, 2]. Это позволяет наиболее эффективно купировать локальный инфекционный процесс, тем самым снижая зависимость от системных антибиотиков [3–5]. Основным материалом, используемым для этих целей, является полиметилметакрилат (ПММА) (т.н. костный цемент) [6]. Накопленный опыт применения ПММА как носителя антибиотиков указывает на ряд недостатков при решении задач купирования остеомиелитического очага. В частности, к ключевым недостаткам относят особенности кинетики высвобождения антибиотика из материала, когда большая его часть высвобождается в течение первых суток после имплантации, что вызывает риски реинфицирования пациентов в отдаленный период, а также повышает токсическую нагрузку на организм, при этом присутствует дополнительный фактор — сложность удаления данного материала [7, 8]. Эти обстоятельства позволяют сохранять актуальность проблемы поиска основного материала (носителя) для замещения костных дефектов, который обеспечивал бы пролонгированное высвобождение антибиотиков в терапевтических объемах в течение продолжительного периода [9–11]. В этом плане для решения таких задач перспективным материалом является отечественный материал Рекост (РЗН 2014/1646, дата гос. регистрации 03.07.2014, бессрочно) [12] на основе полимеров полиуретанового ряда [13].
Цель работы — сравнить кинетику высвобождения антибиотиков из материала на основе полимеров полиуретанового ряда для замещения постостеомиелитических дефектов кости.
МАТЕРИАЛЫ И МЕТОДЫ
В исследовании проведен in vitro сравнительный анализ кинетики высвобождения трех антибиотиков (цефотаксим, ванкомицин, меропенем) из двух материалов: Рекост на основе полимеров полиуретанового ряда (Нижний Новгород, РЗН 2014/1646 от 03.07.2014, бессрочно) (серия РК) и костный цемент (РУ № ФСЗ 2012/11622 от 19.03.2012, бессрочно) на основе полиметилметакрилата (серия ПММА).
Из тестируемых материалов (согласно инструкции к их применению) формировали цилиндры высотой 7 мм и диаметром 4 мм. Антибиотики вносили в исходные материалы в трех пропорциях:
-
1) полимер : антибиотик — 10:1 (группа 1 в каждой серии);
-
2) полимер : антибиотик — 10:0,5 (группа 0,5 в каждой серии);
-
3) полимер : антибиотик — 10:0,25 (группа 0,25 в каждой серии).
Цилиндры инкубировали в физиологическом растворе объемом 10 мл при 37 °С. Инкубационный раствор в течение первой недели меняли ежедневно, в последующем — раз в неделю. В каждой группе инкубировали по 6 образцов. Параллельно инкубировали образцы без антибиотика (контроль).
В каждой пробе инкубационного раствора спектрофотометрически, относительно стандартной калибровочной кривой, по интенсивности поглощения определяли концентрацию тестируемых антибиотиков: цефотаксим — при 243 нм, ванкомицин — при 280 нм, меропенем — при 298 нм. При расчетах концентрации опытных проб вычитали значения экстинкции в пробах контрольного материала (без антибиотиков). Инкубацию прекращали, когда в пробах в течение двух недель отмечали следовые количества.
В параллелях рассчитывали медиану и интерквартильный размах. Достоверность различий между группами оценивали с помощью W-критерия Вилкоксона для независимых выборок.
Исследования выполнены с учетом рекомендаций, обозначенных в ГОСТе ISO 10993-13-2016 «Изделия медицинские. Оценка биологического действия медицинских изделий. Часть 13. Идентификация и количественное определение продуктов деструкции полимерных медицинских изделий».
Работа выполнена в формате исследования in vitro без применения биоматериалов, поэтому этическое заключение не требовалось.
РЕЗУЛЬТАТЫ
Результаты кинетики высвобождения цефотаксима показали, что выход антибиотика из образцов серии ПММА для всех концентраций был максимален в течение первых суток опыта — 25–40 % (рис. 1). Высвобождение цефотаксима из образцов серии РК в этот период составило около 10 %. В последующие сроки наблюдения выход антибиотика из образцов сери РК в среднем был выше, чем в серии ПММА.
Высвобождение ванкомицина в первые сутки опыта в серии ПММА для всех концентраций также было максимальным за весь период наблюдения и существенно превышало значения серии РК (рис. 2). Однако в последующие сроки опыта выход антибиотика из образцов серии РК был более значителен относительно серии ПММА, особенно в группе 0,25.
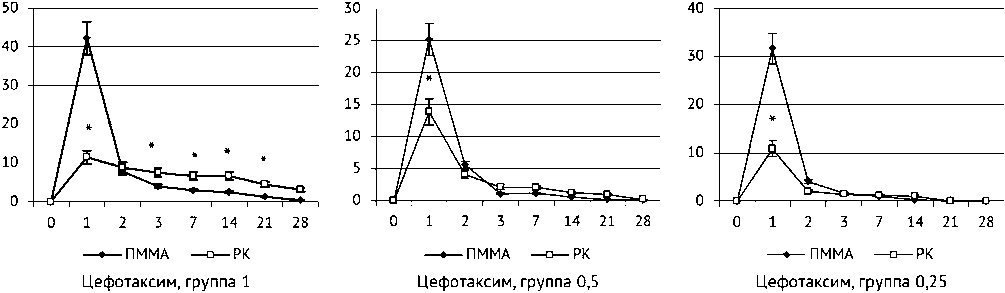
Рис. 1. Динамика высвобождения цефотаксима (% от общей массы введенного антибиотика) из тестируемых материалов (Ме, интерквартильный размах). * — достоверность различий между сериями при p < 0,05. По оси абсцисс — сутки инкубации
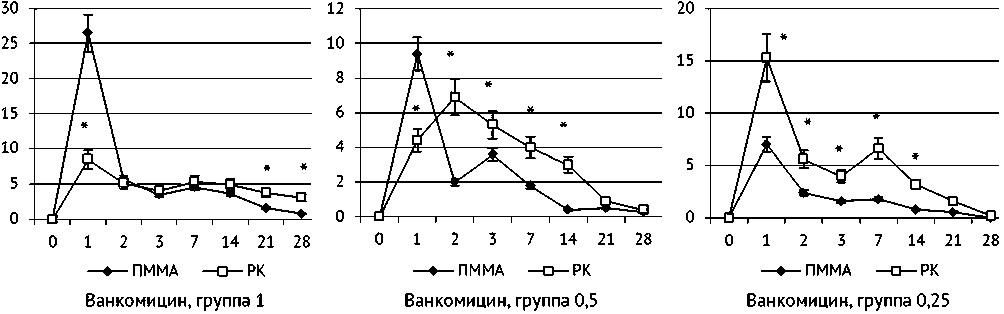
Рис. 2. Динамика высвобождения ванкомицина (% от общей массы введенного антибиотика) из тестируемых материалов (Ме, интерквартильный размах). * — достоверность различий между сериями при p < 0,05. По оси абсцисс — сутки инкубации
Высвобождение меропенема в первые сутки опыта в серии ПММА группы 1 было существенно выше значений аналогичной серии РК (рис. 3). В группе 0,5 кинетика высвобождения в серии РК в течение первой недели опыта была идентична аналогичной группе серии ПММА, а в последующие сроки даже превышала уровень выхода в серии ПММА. В группе 0,25 выход антибиотика из образцов сери РК был выше относительно серии ПММА на всех сроках наблюдения.
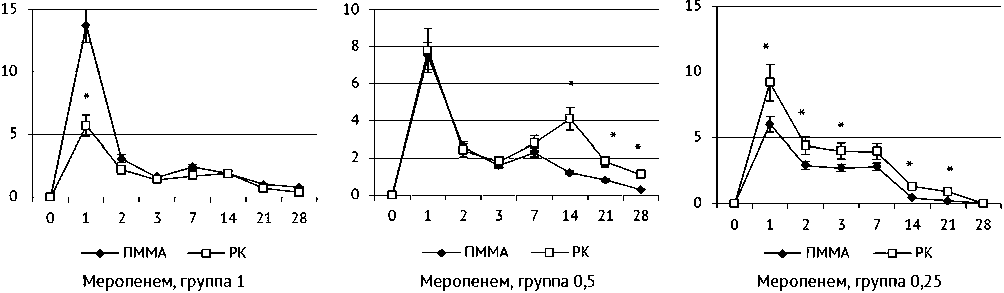
Рис. 3. Динамика высвобождения меропенема (% от общей массы введенного антибиотика) из тестируемых материалов (Ме, интерквартильный размах). * — достоверность различий между сериями при p < 0,05. По оси абсцисс — сутки инкубации
Обобщенные результаты кинетики высвобождения изученных антибиотиков в разных концентрациях из материалов ППМА и РК показаны в таблице 1. Обнаружено, что общая длительность высвобождения антибиотиков (L) снижалась при уменьшении в образцах их содержания. При этом общая длительность высвобождения ванкомицина и меропенема была одинакова для групп ПММА и РК. Для цефотаксима в группах 1 и 0,5 более длительно антибиотик выходил из материала серии РК. Однако общий объем (Vо) высвобожденного цефотаксима из ПММА был выше, чем из РК при всех концентрациях.
Для ванкомицина и меропенема суммарный выход из ПММА был в группе 1, тогда как в группах 0,5 и 0,25 больший объем высвобождался из материала серии РК. Для всех серий максимум высвобождающегося объема антибиотиков (Мах) отмечен после первых суток инкубации.
Таблица 1
Общие результаты кинетики высвобождения антибиотиков в разных концентрациях из материалов ППМА и РК (Медиана)
|
Антибиотик |
Группа |
L, сутки ПММА/РК |
Vо, % ПММА/РК |
Мах, сутки (%) ПММА/РК |
|
Цефотаксим |
1 |
56/70 |
69,2/48,2 |
1(52,2)/1(11,5) |
|
0,5 |
21/28 |
30,6/25,5 |
1(25,2)/1(13,8) |
|
|
0,25 |
14/14 |
39,7/15,8 |
1(31,6)/1(10,8) |
|
|
Ванкомицин |
1 |
42/42 |
52,1/49,5 |
1(26,5)/1(8,5) |
|
0,5 |
35/35 |
20,8/30,1 |
1(9,4)/1(4,4) |
|
|
0,25 |
21/21 |
13,8/33,6 |
1(7,0)/1(14,7) |
|
|
Меропенем |
1 |
42/42 |
25,8/14,3 |
1(13,7)/1(5,7) |
|
0,5 |
28/28 |
16,5/21,5 |
1(7,5)/1(7,7) |
|
|
0,25 |
14/14 |
15,3/23,4 |
1(5,9)/1(9,1) |
Примечание : L — длительность высвобождения антибиотика; Vо — суммарный объем высвободившегося антибиотика в % относительно всего импрегнированного антибиотика; Мах — срок наблюдения (в сутках), когда отмечался максимальный объем высвободившегося антибиотика, и в скобках процент этого высвободившегося антибиотика относительно всего импрегниро-ванного антибиотика
Таким образом, нами показано, что объемы высвобождающихся антибиотиков зависят как от их концентрации в материале, так и от природы самого материала. Для оценки вероятных клинических приложений полученных данных далее нами проведено сопоставление количеств элюированного антибиотика со значениями минимальной подавляющей концентрации (МПК) для основных классов микроорганизмов. Значения МПК взяты из данных «Европейского комитета по определению чувствительности к антимикробным препаратам. Таблицы пограничных значений для интерпретации значений МПК и диаметров зон подавления роста. Версия 13.0, 2023» . Согласно справочнику для цефотаксима и меропонема по отношению к Staphylococcus spp. МПК составляет 4 мг/л, для ванкомицина по отношению к Staphylococcus spp. — 2 мг/л, по отношению к Enterococcus spp. — 4 мг/л, для меропонема по отношению к Pseudomonas spp. — 2 мг/л.
Таблица 2
Сроки сохранения уровня антибиотиков выше значений МПК для разных микроорганизмов в элюатах из изученных материалов
|
Антибиотик |
Группа |
Staphylococcus spp ., ПММА/РК |
Enterococcus spp ., ПММА/РК |
Pseudomonas spp ., ПММА/РК |
|
Цефотаксим |
1 |
7/56 |
– |
– |
|
0,5 |
3/7 |
– |
– |
|
|
0,25 |
2/1 |
– |
– |
|
|
Ванкомицин |
1 |
35/42 |
14/42 |
– |
|
0,5 |
3/21 |
1/7 |
– |
|
|
0,25 |
3/14 |
1/7 |
– |
|
|
Меропенем |
1 |
14/14 |
– |
35/21 |
|
0,5 |
2/2 |
– |
14/21 |
|
|
0,25 |
1/1 |
– |
7/7 |
Обнаружено, что концентрация цефотаксима, превышающая МПК в отношении Staphylococcus spp ., в элюате из образцов серии РК поддерживалась дольше, чем для образцов серии ПММК в группах 1 и 0,5, удерживаясь соответственно 56 и 7 суток (табл. 2). В образцах группы 0,25 концентрация цефотаксима, превышающая МПК, отмечалась в элюате только в течение первых двух суток инкубации в серии ПММА и первых суток в серии с РК. Концентрация в элюате ванкомицина выше МПК в отношении Staphylococcus spp . и Enterococcus spp . из образцов серии РК поддерживалась дольше, чем в серии с ПММА во всех изученных группах. Концентрация меропенема выше МПК в отношении Staphylococcus spp . в элюате из образцов серии РК и ПММК сохранялась в течение одинакового периода. По отношению к Pseudomonas spp . МПК была превышена в образцах серии РК в группах 1 и 0,5 и поддерживалась дольше относительно серии ПММА.
ОБСУЖДЕНИЕ
Полученные нами данные позволяют заключить, что объемы высвобождающихся антибиотиков и, соответственно, длительность сохранения МПК в элюатах определяются их содержанием в исходном материале и типом носителя. Показано, что объем элюируемого цефотаксима из материала серии ПММА был выше, чем из материала серии РК при всех концентрациях антибиотика. В свою очередь для ванкомицина и меропенема эта особенность наблюдалась только для образцов группе 1. Для групп 0,5 и 0,25 в серии РК отмечался больший объем высвобождающихся антибиотиков, чем из ПММА. Оценивая такой важный показатель как длительность удержания уровня антибиотиков в элюатах выше значений МПК очевидно, что в серии с РК высвобождение ванкомицина и цефатоксима в эффективной (терапевтической) концентрации было более пролонгировано. На этом фоне к дополнительным критериям в пользу РК можно отнести и то, что пролонгированное сохранение эффективных концентраций происходило на фоне меньшего объема высвободившегося антибиотика, что снижает токсическую нагрузку.
Наши данные для серии с ПММА вполне согласуются с данными других авторов [14]. Однако показатели элюции носителей, которые предлагаются в качестве аналога ПММА, существенно отличаются. Так достаточно вариабельные характеристики в части длительности элюции имеют разрабатываемые системы доставки антибиотиков, где носителем выступают кальций-фосфатные материалы. В частности, варьируя составом данного материала, исследователи добиваются длительности высвобождения антибиотиков в терапевтических объемах (выше значений МПК) от одних [15] до 18–34 суток [16, 17].
Применение искусственных полимеров, в частности сополимера полимолочной и полигликолевой кислоты (PLGA), в качестве носителя выглядит достаточно перспективным за счет того, что материал деградируем, имеет достаточную механическую прочность и может быть использован для создания 3D-моделей замещаемого дефекта [18]. Однако имеющиеся исследования демонстрируют, что высвобождение антибиотиков из данного материала в основном происходит в течение первых двух дней [19, 20].
В плане биодеградируемости стоит отметить материалы натурального происхождения. Так, практически полное высвобождение клиндамицина или гентамицина из гидрогеля коллагена человеческого происхождения происходило в течение 18 часов [21]. Использование хитозана в качестве носителя повышает длительность элюции, но её скорость зависела от природы антибиотика: цефатоксим высвобождался в течение 3 суток, гентамицин и линкомицин — 15 [22].
Попытки повышения длительности элюции антибиотиков в терапевтических дозах привело исследователей к разработке материалов комбинированного состава. Так, материал на основе коллагена и гидроксиапатита показал элюцию ванкомицина в течение 28 дней [23], элюция ципрофлоксацина из гидрогеля на основе карбоксиметилрезистентного крахмала и полиакриловой кислоты — 3 суток [24], элюция ампициллина из нанокомпозитов хитозан/крахмал — в течение суток [25].
Разрабатываются и новые потенциальные носители: нанокомпозитные гидрогели, содержащие полиакриламид/декстран, содержащие углеродные квантовые точки [26], гидрогели на основе аспарагиновой кислоты/акриламида [27], ион-содержащие носители [28], молекулярно-импринтированные полимеры, представляющие собой синтетические рецепторы [29].
В целом большинство из текущих исследований представлено работами, в которых попытка получения материалов с характеристиками пролонгированного высвобождения антибиотиков сводилась к поиску оптимальных химических составов. Поэтому достаточно интересным выглядит группа новых материалов, позволяющих регулировать кинетику высвобождения за счет изменения физико-химических параметров носителя. Так, группа авторов показала возможность регулировать скорость элюции антибиотика из оксидных нанотрубок путем модификации размеров этих нанотрубок [30]. Предложены носители, в которых высвобождение антибиотиков регулируется переменным магнитным полем [31]. Разработан гидрогель, скорость высвобождения антибиотиков из которого зависит от рН окружения и наличия в нём свободных радикалов [32].
Представленные данные показывают, что каждый материал имеет свой профиль элюции антибиотика и каждый из них может иметь свои показания, связанные с необходимостью либо пролонгированной элюции действующего вещества (хронический процесс), либо, наоборот, с необходимостью создания «ударной» концентрации в локальном объеме (острый процесс). При этом большая часть используемых и разрабатываемых материалов имеет ограничения по длительности элюции антибиотиков в эффективных концентрациях. В этом плане можно говорить о том, что материал на основе РК в части длительности элюции антибиотиков в терапевтических дозах имеет преимущества. По этому критерию РК соответствует аналогичным разрабатываемым материалам на основе кальций-фосфата.
В целом на основе выполненного исследования применение материала РК выглядит достаточно перспективным для использования в качестве носителя антибиотиков при замещении костных дефектов. При этом возможность достижения дозы высвобождающегося антибиотика выше значений МПК при меньших концентрациях лекарственных средств в материале позволит импрегнировать в состав материала несколько действующих веществдля повышения эффективности антибиотикотерапии. Такие исследования встречаются в литературе [33].
Несомненно, дизайн выполненного исследования имеет ограничения. В частности, проведённые модельные опыты должны быть подтверждены исследованиями на живых объектах, что требует последующих наблюдений.
ЗАКЛЮЧЕНИЕ
Таким образом, длительность высвобождения ряда антибиотиков в эффективных концентрациях из материала на основе полимеров полиуретанового ряда выше, чем из материала на основе ПММА. Эти характеристики делают перспективным применение исследуемого изделия для профилактики инфицирования при замещении постостеомиелитических дефектов кости.
Список литературы Высвобождение антибиотиков из материалов для замещения постостеомиелитических дефектов кости
- Афанасьев А.В., Божкова С.А., Артюх В.А. и др. Применение синтетических заменителей костной ткани при одноэтапном лечении пациентов с хроническим остеомиелитом. Гений ортопедии. 2021;27(2):232-236. doi: 10.18019/1028-4427-2021-27-2-232-236
- Liu Y, He L, Cheng L, et al. Enhancing Bone Grafting Outcomes: A Comprehensive Review of Antibacterial Artificial Composite Bone Scaffolds. MedSciMonit. 2023;29:e939972. doi: 10.12659/MSM.939972
- Cara A, Ferry T, Laurent F, Josse J. Prophylactic Antibiofilm Activity of Antibiotic-Loaded Bone Cements against Gram-Negative Bacteria. Antibiotics (Basel). 2022;11(2):137. doi: 10.3390/antibiotics11020137
- Liu Y, Li X, Liang A. Current research progress of local drug delivery systems based on biodegradable polymers in treating chronic osteomyelitis. FrontBioengBiotechnol. 2022;10:1042128. doi: 10.3389/fbioe.2022.1042128
- Wassif RK, Elkayal M, Shamma RN, Elkheshen SA. Recent advances in the local antibiotics delivery systems for management of osteomyelitis. DrugDeliv. 2021;28(1):2392-2414. doi: 10.1080/10717544.2021.1998246
- Chen P, Chen B, Liu N, et al. Global research trends of antibiotic-loaded bone cement: A bibliometric and visualized study. Heliyon. 2024;10(17):e36720. doi: 10.1016/j.heliyon.2024.e36720
- Тапальский Д.В., Волотовский П.А., Козлова А.И., Ситник А.А. Антибактериальная активность покрытий на основе импрегнированного антибиотиками костного цемента в отношении микроорганизмов с различными уровнями антибиотикорезистентности. Травматология и ортопедия России. 2018;24(4):105-110. doi: 10.21823/23112905-2018-24-4-105-110
- Wall V, Nguyen TH, Nguyen N, Tran PA. Controlling Antibiotic Release from Polymethylmethacrylate Bone Cement. Biomedicines. 2021;9(1):26. doi: 10.3390/biomedicines9010026
- Chen L, Lin X, Wei M, et al. Hierarchical antibiotic delivery system based on calcium phosphate cement/montmorillonite-gentamicin sulfate with drug release pathways. Colloids Surf B Biointerfaces. 2024;238:113925. doi: 10.1016/j. colsurfb.2024.113925
- Jin Y, Liu H, Chu L, et al. Initial therapeutic evidence of a borosilicate bioactive glass (BSG) and Fe3O4 magnetic nanoparticle scaffold on implant-associated Staphylococcal aureus bone infection. Bioact Mater. 2024;40:148-167. doi: 10.1016/j.bioactmat.2024.05.040
- Wathoni N, Herdiana Y, Suhandi C, et al. Chitosan/Alginate-Based Nanoparticles for Antibacterial Agents Delivery. Int JNanomedicine. 2024;19:5021-5044. doi: 10.2147/IJN.S469572
- Балязин-Парфенов И.В., Балязин В.А., Зайцев В.Д. и др. Отдаленные результаты аллокраниопластики с применением индивидуальных биополимерных остеоинтегрируемых имплантов из материала «Рекост-М». Российский нейрохирургический журнал имени профессора А. Л. Поленова. 2024;16(2):6-15. doi: 10.56618/2071-2693_2024_16_2_6. EDN: OCDTXS
- Колмогоров Ю.Н., Успенский И.В., Маслов А.Н. и др. Костнозамещающие имплантаты из материала «Рекост-М» на основе 3D-моделирования для закрытия посттрепанационных дефектов черепа: доклинические и клинические исследования. Современные технологии в медицине. 2018;10(3):95-103. doi: 10.17691/stm2018.10.3.11
- Madadi AK, Sohn MJ. Pharmacokinetic Interpretation of Applying Local Drug Delivery System for the Treatment of Deep Surgical Site Infection in the Spine. Pharmaceutics. 2024;16(1):94. doi: 10.3390/pharmaceutics16010094
- Kai KC, Borges R, Pedroni ACF, et al. Tricalcium phosphate-loaded injectable hydrogel as a promising osteogenic and bactericidal teicoplanin-delivery system for osteomyelitis treatment: An in vitro and in vivo investigation. Biomater Adv. 2024;164:213966. doi: 10.1016/j.bioadv.2024.213966
- Mabroum H, Elbaza H, Ben Youcef H, et al. Design of antibacterial apatitic composite cement loaded with Ciprofloxacin: Investigations on the physicochemical Properties, release Kinetics, and antibacterial activity. Int J Pharm. 2023;637:122861. doi: 10.1016/j.ijpharm.2023.122861
- Noukrati H, Hamdan Y, Marsan O, et al. Sodium fusidate loaded apatitic calcium phosphates: Adsorption behavior, release kinetics, antibacterial efficacy, and cytotoxicityassessment. Int JPharm. 2024;660:124331. doi: 10.1016/j.ijpharm.2024.124331
- Visan AI, Negut I. Development and Applications of PLGA Hydrogels for Sustained Delivery of Therapeutic Agents. Gels. 2024;10(8):497. doi: 10.3390/gels10080497
- Попков А.В., Кононович Н.А., Попков Д.А. и др. Индукция бактерицидной активности разлагаемыми имплан-татами. Гений ортопедии. 2023;29(6):596-601. doi: 10.18019/1028-4427-2023-29-6-596-601. EDN: GFHUED
- Lan Z, Guo L, Fletcher A, et al. Antimicrobial hydrogel foam dressing with controlled release of gallium maltolate for infection control in chronic wounds. BioactMater. 2024;42:433-448. doi: 10.1016/j.bioactmat.2024.08.044
- Jarman E, Burgess J, Sharma A, et al. Human-Derived collagen hydrogel as an antibiotic vehicle for topical treatment of bacterial biofilms. PLoS One. 2024;19(5):e0303039. doi: 10.1371/journal.pone.0303039
- Севостьянов М.А., Федотов А.Ю., Насакина Е.О. и др. Кинетика высвобождения антибиотиков из биодеградиру-емых биополимерных мембран на основе хитозана. Доклады Академии наук. 2015:465(2);194-197. doi: 10.7868/ S086956521532016X
- Sheehy EJ, von Diemling C, Ryan E, et al. Antibiotic-eluting scaffolds with responsive dual-release kinetics facilitate bone healing and eliminate S. aureus infection. Biomaterials. 2025;313:122774. doi: 10.1016/j.biomaterials.2024.122774
- Li X, Wei A, Zhao H, et al A carboxymethyl-resistant starch/polyacrylic acid semi-IPN hydrogel with excellent adhesive and antibacterial properties for peri-implantitis prevention. Colloids Surf B Biointerfaces. 2024;242:114082. doi: 10.1016/j.colsurfb.2024.114082
- Nguyen VN, Wang SL, Nguyen TH, et al. Preparation and Characterization of Chitosan/Starch Nanocomposites Loaded with Ampicillin to Enhance Antibacterial Activity against Escherichia coli. Polymers (Basel). 2024;16(18):2647. doi: 10.3390/polym16182647
- Sahu KM, Biswal A, Manisha U, Swain SK. Synthesis and drug release kinetics of ciprofloxacin from polyacrylamide/ dextran/carbon quantum dots (PAM/Dex/COD) hydrogels. Int J Biol Macromol. 2024;269(Pt 2):132132. doi: 10.1016/j. ijbiomac.2024.132132
- Wang G, An S, Huang S, et al. Fabrication, optimization, and in vitro validation of penicillin-loaded hydrogels for controlled drug delivery. JBiomater Sci Polym Ed. 2024:1-21. doi: 10.1080/09205063.2024.2387953
- Shi Y, Wang L, Song S, et al. Controllable Silver Release for Efficient Treatment of Drug-Resistant Bacterial-Infected Wounds. Chembiochem. 2024;25(16):e202400406. doi: 10.1002/cbic.202400406
- Galvan-Romero V, Gonzalez-Salazar F, Vargas-Berrones K, et al. Development and evaluation of ciprofloxacin local controlled release materials based on molecularly imprinted polymers. Eur J Pharm Biopharm. 2024;195:114178. doi: 10.1016/j.ejpb.2024.114178
- Osak P, Skwarek S, Lukowiec D, et al. Preparation and Characterization of Oxide Nanotubes on Titanium Surface for Use in Controlled Drug Release Systems. Materials (Basel). 2024;17(15):3753. doi: 10.3390/ma17153753
- Huang Z, Li Y, Yin W, et al. A magnetic-guided nano-antibacterial platform for alternating magnetic field controlled vancomycin release in staphylococcus aureus biofilm eradication. Drug Deliv Transl Res. 2024. doi: 10.1007/s13346-024-01667-x
- Oi H, Wang B, Wang M, et al. A pH/ROS-responsive antioxidative and antimicrobial GelMA hydrogel for on-demand drug delivery and enhanced osteogenic differentiation in vitro. Int J Pharm. 2024 Ma;657:124134. doi: 10.1016/j. ijpharm.2024.124134
- Seidenstuecker M, Hess J, Baghnavi A, et al. Biodegradable composites with antibiotics and growth factors for dual release kinetics. J Mater Sci Mater Med. 2024;35(1):40. doi: 10.1007/s10856-024-06809-8


