ВЫЖИВАЕМОСТЬ И ТРАНСФЕКЦИЯ КЛЕТОК HeLa ПРИ КУЛЬТИВАЦИИ НА ПОВЕРХНОСТИ ПОЛУПРОВОДНИКОВЫХ НИТЕВИДНЫХ НАНОКРИСТАЛЛОВ
Автор: С. В. Шмаков, З. Ф. Сосновицкая, В. М. Кондратьев, А. С. Букатин, А. Д. Большаков
Журнал: Научное приборостроение @nauchnoe-priborostroenie
Рубрика: Приборостроение физико-химической биологии
Статья в выпуске: 1, 2025 года.
Бесплатный доступ
В статье представлены результаты исследования выживаемости клеток культуры HeLa при их культивации на поверхности вертикального массива полупроводниковых нитевидных нанокристаллов (ННК). Показана выживаемость клеток при росте на поверхности ННК, сформированных из фосфида галлия со средней длиной 4 и 8 мкм, а также арсенида галлия со средней длиной 2 мкм. Демонстрируется возможность трансфекции клеток при культивации на массиве ННК путем прямого введения плазмиды в культуральную среду. Показана зависимость эффективности трансфекции от средней длины ННК.
Итевидные нанокристаллы, трансфекция, культура клеток, цитотоксичность
Короткий адрес: https://sciup.org/142244739
IDR: 142244739 | УДК: 576.08,53.086
Текст научной статьи ВЫЖИВАЕМОСТЬ И ТРАНСФЕКЦИЯ КЛЕТОК HeLa ПРИ КУЛЬТИВАЦИИ НА ПОВЕРХНОСТИ ПОЛУПРОВОДНИКОВЫХ НИТЕВИДНЫХ НАНОКРИСТАЛЛОВ
Трансфекция — доставка генетического материала в клетки эукарит — является одной из важнейших задач современных наук о жизни [1, 2]. В настоящее время существует множество решений, позволяющих осуществлять доставку молекул ДНК и РНК в клетки, однако все типы трансфекции можно разделить на два больших класса: физические и химические [3]. Сущность химических методов заключается в образовании способных к преодолению клеточной мембраны комплексов различных молекул, как правило, полимеров, обладающих липофильными свойствами, с молекулами нуклеиновых кислот [4]. Физические методы, такие как электропорация [5] или микроинъекция [6], доставляют целевые молекулы в клетки путем частичного и обратимого разрушения клеточной мембраны различными физическими воздействиями. Одним из существенных недостатков физических методов трансфекции является сложность масштабирования процедуры на большое количество образцов. Альтернативным способом созданий физической системы трансфекции, позволяющим без затруднений работать с большим количеством образцов, является применение вертикальных массивов нанопроводов.
Нанопровода, или нитевидные нанокристаллы (ННК) представляют собой квазиодномерные наноструктуры с вертикальной геометрией, синтезированные на подложках различного состава [7]. В зависимости от желаемых свойств ННК могут быть сформированы из полупроводниковых, ди- электрических либо металлических материалов [8, 9]. Современные методы синтеза, такие как молекулярно-пучковая эпитаксия [10] и химическое осаждение из газовой фазы [11], позволяют получать ННК с контролируемой геометрией, оптическими и электронными свойствами, находящие широкое применение в нанофотонике [12] или изготовлении различных газовых сенсоров [13]. Помимо этого, такие наноструктуры обладают потенциалом применения в области наук о жизни, включая создание биоинтерфейсов [14] биохимических сенсоров [15] визуализации клеток [16].
Целью данной работы является исследование биосовместимости и способности к трансфициро-ванию клеток массива нитевидных нанокристаллов из полупроводников типа A3B5 на примере GaP и GaAs. Выбор таких материалов обусловлен оптическими и электрическими свойствами таких ННК, позволяющими потенциально создавать на их основе не только новые инструменты для трансфекции, но и оптические и электрические датчики для изучения состава внутриклеточной среды.
МАТЕРИАЛЫ И МЕТОДЫ
Рост нитевидных нанокристаллов и их характеризация
Рост ННК проводился на установке Veeco GEN III MBE system (Veeco, США). Рост ННК проводился по автокаталитическому механизму (пар–жидкость–кристалл) на кремниевой подлож- ке, содержащей слой поверхностного оксида SiOx. Подробные условия роста описаны в работе [17]. Для дальнейшего исследования выживаемости и трансфекции клеток применялось три типа подложки: GaAs нитевидные нанокристаллы с характерной длиной 2 мкм, GaP ННК со средней длиной 4 мкм и GaP ННК со средней длиной
8 мкм. Средний диаметр ННК составляет от ~160 нм у подложки и ~150 нм около концевой части. Изображения соответствующих подложек, полученные методом сканирующей электронной микроскопии, представлены на рис. 1. Морфология была охарактеризована на сканирующем электронном микроскопе Supra 2 (Carl Zeiss, Германия).

Рис. 1. Изображения применяемых в работе нитевидных нанокристаллов, полученные с помощью сканирующего электронного микроскопа.
а, б — ННК из арсенида галлия со средней длиной 2 мкм; в, г — ННК из фосфида галлия, средняя длина
4 мкм; д, е — образец ННК фосфида галлия, средняя длина 8 мкм
Культура клеток
В ходе работы использовались клетки культуры HeLa (карцинома шейки матки человека). Культура была получена в Российской коллекции клеточных культур позвоночных Института цитологии РАН, Санкт-Петербург. Клетки культивировались в среде DMEM (БиоЛот, Россия), с добавлением 10% фетальной бычьей сыворотки (Hyclone, США), в присутствии антибиотика гентамицина (40 мкг/мл). Клетки культивировались в инкубаторе, в увлажненной атмосфере, содержащей 5% СО 2 , при температуре 37°С.
Исследование жизнеспособности клеток
Для исследования влияния ННК на жизнеспособность клеток в лунки 24-луночного культурального планшета помещались образцы кремниевых подложек со сформированными на их поверхности массивами ННК различной геометрии и состава. В качестве контрольного образца использовались чистые кремниевые подложки. В нормальном состоянии при контакте с воздухом поверхность подложки покрыта слоем диоксида кремния и, таким образом, по своим свойствам является близкой к стеклянным поверхностям для роста клеток. Площадь каждого образца составляла ~ 20 мм2. Каждая лунка, содержащая подложку, с целью стерилизации обрабатывалась 70% раствором этанола в течение 20 мин. После этого для удаления спирта образцы трижды отмывались свежей культуральной средой. Затем в каждую лунку вносилось 500 мкл суспензии, содержащей клетки с концентрацией 1 × 106 клеток/мл, и планшет помещался в инкубатор. Через 24 ч в первую лунку, содержащую образец, добавлялся краситель Hoechst 33342, предназначенный для контрастирования ядра всех клеток, а также йодистый пропидий для контрастирования ядра мертвых клеток. Концентрация обоих красителей составляла 2 мкг/мл. Образцы инкубировались в течение 15 мин, затем промывались свежей средой, переносились на покровное стекло и анализировались на инвертированном микроскопе Axio Observer.Z1 (Carl Zeiss, Германия) с конфокальным модулем YokogawaCSU-X1 (Yokogawa, Япония). Процедура повторялась через 3, 5 и 7 дней после начала эксперимента. Для количественной характеризации жизнеспособности клеток подсчитывалось количество живых клеток, окрасившихся только красителем Hoechst 33342, а также количество мертвые клеток, окрасившихся как Hoechst 33342, так и йодидом пропидия. Выживаемость клеток подсчитывалась согласно формуле:
% выживаемости = образец х 100, n контроль где nобразец — количество живых клеток в образце, nконтроль — количество живых клеток в контроле соответствующего дня эксперимента.
Трансфекция
Первоначальная подготовка клеток и образцов совпадала с протоколом, описанным в предыдущем разделе. Через 24 ч после рассева клеток на подложки ростовая среда удалялась из лунок и после трехкратной промывки фосфатно-солевым буфером заменялась на бессывороточную среду DMEM. После этого в среду добавлялась плазмида, кодирующая зеленый флуоресцентный белок GFP, в концентрации 1 нг/мл. Через сутки инкубации ядра клеток окрашивались красителем Hoechst 33342 и исследовались на конфокальном микроскопе.
Статистичекая обработка результатов
Для статистической обработки данных использовалась программа GraphPadPrism 8.0.1. Для расчета средних значений, среднеквадратичных отклонений и достоверности различий все эксперименты по исследованию выживаемости и трансфекции были выполнены трижды, для расчета значений P value применялся t-тест Стьюдента.
РЕЗУЛЬТАТЫ
Выживаемость и жизнеспособность клеток
В работе были получены данные, свидетельствующие о высокой биосовместимости ННК на основе фосфида галлия и существенно более низкой выживаемости клеток при культивации на поверхности арсенида галлия. В случае культивации клеток на контрольной подложке (рис. 2, а–г) удвоение количества живых клеток наблюдается приблизительно через каждые 48 ч (рис. 2, к). Наблюдается рост от единичных клеток, равномерно распределенных по подложке, через 24 ч инкубации вплоть до образования монослоя на 7-й день роста. На 5-й день наблюдаются одиночные мертвые клетки, однако на 7-й день эксперимента мертвые клетки, т.е. клетки с ядром, окрашенным йодистым про-пидием, не наблюдаются. Исчезновение мертвых клеток на 7-й день можно объяснить достижением конфлюентности, т.е. заполнением всего свободного пространства живыми клетками, что приводит к откреплению мертвых клеток от поверхности.
В случае культивации клеток на поверхности ННК их выживаемость и способность к пролиферации зависит как от морфологии подложки, так и от ее химического состава. Через 24 ч после рассева клеток во всех случаях наблюдается снижение количества живых клеток до 40% от кон- трольного образца. Однако наблюдаемое количество мертвых клеток мало и составляет ~ 10% от общего количества клеток (рис. 2, д). Таким образом, возможным объяснением двукратного уменьшения количества клеток является не их гибель, а невозможность закрепления на поверхности
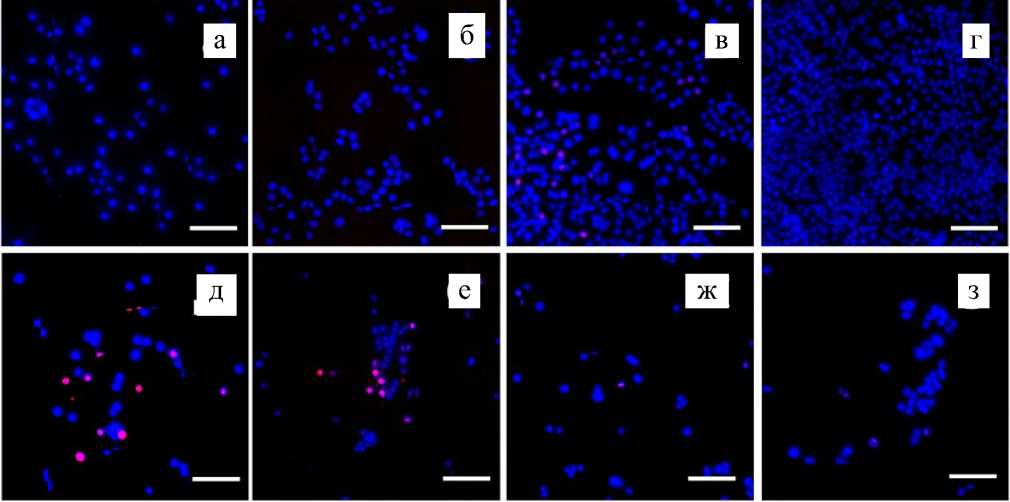
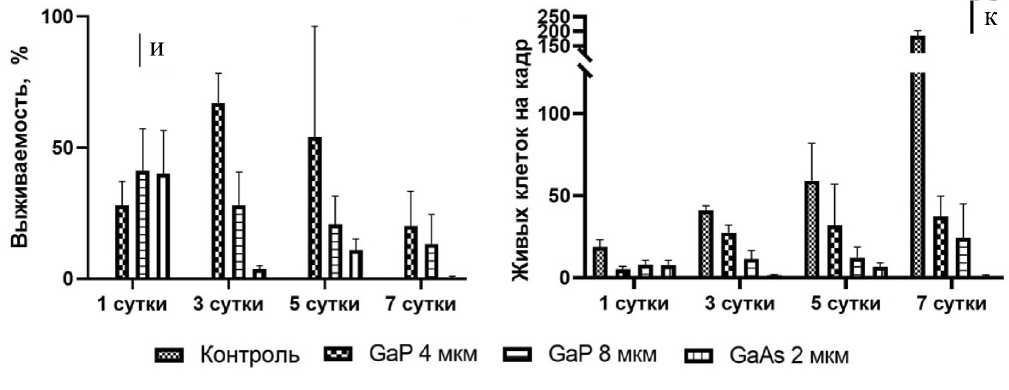
Рис. 2. Выживаемость клеток культуры HeLa при культивации на поверхности ННК различной морфологии и состава в течение 7 суток.
а–г: визуализации количества клеток на поверхности контрольного образца через 1, 3, 5, 7 суток культивации; д–з: визуализации количества клеток на поверхности 8 мкм GaP нанокристаллов через 1, 3, 5, 7 суток культивации. Светлые пятна — ядра клеток (окрашивание Hoechst 33342), более интенсивный белый цвет на д, е — комбинация красителей Hoechst 33342 и йодида пропидия, окрашивающего мертвые клетки.
и, к — гистограммы, демонстрирующие выживаемость и количество клеток на кадр при культивации клеток на различных подложках; шкала — 100 мкм
массива ННК. На третий день эксперимента наблюдается падение выживаемости клеток на поверхности образца GaAs до 4%, в то время как клетки, растущие на поверхности образцов GaP 4 и 8 мкм, демонстрируют выживаемости 67 ± 11% и 28 ± 13% от контроля. Таким образом, можно сделать вывод о критическом влиянии материала ННК на выживаемость клеток. На пятый день эксперимента наблюдается плавное снижение выживаемости клеток на образцах GaP 4 и 8 мкм до 54 ± ± 42 и 20 ± 11%. Несмотря на снижение выживаемости относительно контрольного образца, общее количество живых клеток увеличивается: на 3-й день культивации плотность клеток составила 27.5 ± 4.7 и 11.5 ± 5.2 на кадр для образцов GaP со средней длиной 4 и 8 мкм соответственно. На 5-е сутки плотность клеток на этих образцах составила 32 ± 25.3 и 12.3 ± 6.4 клеток на кадр. На 7-е сутки эксперимента продолжается постепенное сни- жение выживаемости клеток при культивации на поверхности GaP ННК, однако количество клеток продолжает увеличиваться. Представленные данные позволяют сделать вывод, что нитевидные нанокристаллы с длиной до 8 мкм, хотя и снижают выживаемость при культивации клеток на их поверхности, но не вызывают гибели существенной части популяции.
Трансфекция
Возможность трансфекции клеток при их культивации на поверхности ННК исследовалась на примере культуры HeLa. Клетки культивировались на поверхности образцов GaP 4 и 8 мкм и GaAs 2 мкм, а также кремниевой планарной подложки, используемой в качестве контрольного образца. Полученные результаты представлены на рис. 3.
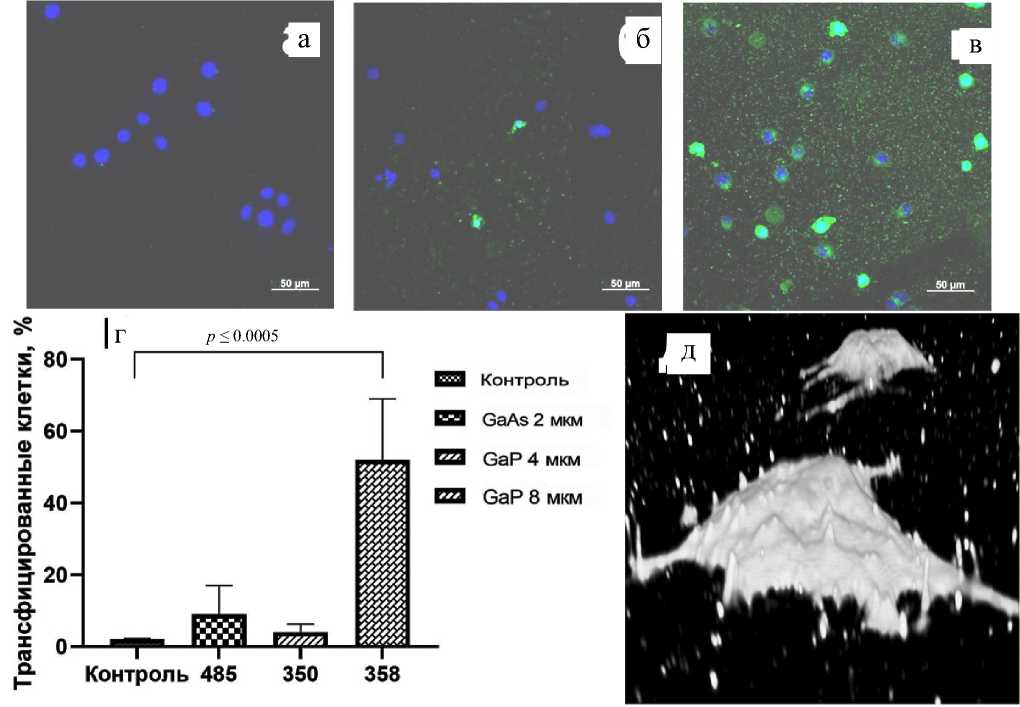
Рис. 3. Трансфекция клеток HeLa при культивации на поверхности ННК различной морфологии и состава.
а — контрольный образец; б — GaAs ННК с характерной длиной 2 мкм; в — GaP ННК с характерной длиной 8 мкм. Светлые пятна — ядра клеток, прокрашенные Hoechst 33342, ярко-белые пятна — зеленый флуоресцентный белок GFP транскрибирующийся в клетке после попадания плазмиды; г — гистограмма, демонстрирующая процент трансфицированных клеток через 24 ч после введения плазмиды в культуральную среду; д — трехмерная реконструкция клетки HeLa, культивируемой на поверхности 8 мкм GaP ННК; наблюдаются проколы мембраны, формирующие обратимые поры, через которые плазмида попадает в клетку
На панелях а–в представлены микрофотографии клеток через 24 ч после введения в культуральную среду плазмиды, кодирующей ген зеленого флуоресцентного белка GFP. В случае контрольного образца плазмида не способна преодолеть плазматическую мембрану, и зеленая флуоресценция в клетках отсутствует. При культивации клеток на поверхности GaAs ННК с характерной длиной 2 мкм наблюдается трансфекция единичных клеток. Наилучший результат был достигнут при использовании в качестве подложки для роста образца GaP 8 мкм. В этом случае эффективность трансфекции составила 52 ± 17%. В случае культивации на поверхности GaP ННК с характерной длиной 4 мкм трансфекция практически не наблюдалась. Таким образом, как и в случае с анализом выживаемости клеток, можно заключить, что наряду с морфологическими характеристиками, в частности средней длиной нитевидных нанокристаллов, эффективность трансфекции зависит от химического состава ННК. На рис. 3, д, представлена трехмерная реконструкция клетки HeLa, культивирующейся на поверхности образца GaP 8 мкм, полученная методом конфокальной микроскопии. На изображении видны микроиглы, прокалывающие клетку. Это позволяет предположить, что механизм увеличения проницаемости плазматической мембраны, позволяющий молекулам ДНК проникнуть в клетку, заключается в формировании обратимых пор на месте проколов. Сравнивая полученные результаты с данными, продемонстрированными в предыдущих работах [20, 21], посвященных изучению трансфекции клеток на ННК, следует подчеркнуть, что трансфекция достигается путем прямого добавления плазмиды в культуральную среду в сравнении с предварительным нанесением плазмиды на поверхность ННК либо при электропорации, в случае которой нанокристаллы выступали в роли микроэлектродов.
ВЫВОДЫ
В работе исследована выживаемость клеток культуры HeLa на поверхности нитевидных нанокристаллов фосфида галлия с характерными длинами 4 и 8 мкм, а также арсенида галлия с характерной длиной 2 мкм. Показана зависимость выживаемости клеток как от морфологических характеристик ННК, так и от состава: нанокристаллы, сформированные из арсенида галлия обладают существенно большей токсичностью. Более короткие GaP ННК обладают большей биосовместимостью, однако при культивации клеток на 8 мкм GaP выживаемость составляет от 41% через 24 ч культивации до 16% на 7-е сутки.
Продемонстрирована трансфекция клеток, растущих на поверхности ННК, путем прямого введения плазмиды в культуральную среду. В случае 8 мкм GaP ННК эффективность трансфекции составила 52%. Сделан вывод о формировании обратимых пор в плазматической мембране, приведена трехмерная реконструкция серии конфокальных оптических срезов, демонстрирующая порирова-ние мембраны нанокристаллами.
Исследование выполнено при финансовой поддержке Российского научного фонда в рамках проекта № 23-24-00288
Список литературы ВЫЖИВАЕМОСТЬ И ТРАНСФЕКЦИЯ КЛЕТОК HeLa ПРИ КУЛЬТИВАЦИИ НА ПОВЕРХНОСТИ ПОЛУПРОВОДНИКОВЫХ НИТЕВИДНЫХ НАНОКРИСТАЛЛОВ
- 1. Kim T.K., Eberwine J.H. Mammalian cell transfection: the present and the future // Analytical and bioanalytical chemistry. 2010. Vol. 397. P. 3173–3178. DOI: 10.1007/s00216-010-3821-6
- 2. Liu X., Rong N., Tian Z., Rich J., Niu L., Li P., Zheng H. Acoustothermal transfection for cell therapy // Science
- Advances. 2024. Vol. 10, iss. 16. DOI: 10.1126/sciadv.adk1855
- 3. Wells-Holland C., Elfick A. Transfection reflections: fitfor-purpose delivery of nucleic acids // Nature Reviews Molecular Cell Biology. 2023. Vol. 24, iss. 11. P. 771–772. DOI: 10.1038/s41580-023-00627-6
- 4. Ben-Akiva E., Karlsson J., Hemmati S., Yu H., Tzeng S.Y., Pardoll D.M., Green J.J. Biodegradable lipophilic polymeric mRNA nanoparticles for ligand-free targeting of splenic dendritic cells for cancer vaccination // Proceedings of the National Academy of Sciences. 2023. Vol.
- 120, iss. 26. Id. e2301606120. DOI: 10.1073/pnas.2301606120
- 5. Kotnik T., Frey W., Sack M., Meglič S.H., Peterka M., Miklavčič D. Electroporation-based applications in biotechnology // Trends in biotechnology. 2015. Vol. 33, iss. 8. P. 480–488. DOI: 10.1016/j.tibtech.2015.06.002
- 6. Chow Y.T., Chen S., Wang R., Liu C., Kong C.W., Li R.A., Sun D. Single cell transfection through precise microinjection with quantitatively controlled injection volumes // Scientific reports. 2016. Vol. 6, iss. 1. Id. 24127. DOI: 10.1038/srep24127
- 7. Barrigón E., Heurlin M., Bi Z., Monemar B., Samuelson L. Synthesis and applications of III–V nanowires // Chem. Rev. 2019. Vol. 119, iss. 15. P. 9170–9220. DOI: 10.1021/acs.chemrev.9b00075
- 8. Sofiah A.G.N., Samykano M., Kadirgama K., Mohan R.V., Lah N.A.C. Metallic nanowires: mechanical properties – theory and experiment // Applied Materials Today. 2018. Vol. 11. P. 320–337. DOI: 10.1016/j.apmt.2018.03.004
- 9. Quan L.N., Kang J., Ning C.Z., Yang P. Nanowires for photonics // Chemical reviews. 2019. Vol. 119, iss. 15. P. 9153–9169. DOI: 10.1021/acs.chemrev.9b00240
- 10. Werner P., Zakharov N.D., Gerth G., Schubert L., Gösele U. On the formation of Si nanowires by molecular beam epitaxy // International journal of materials research. 2006. Vol. 97, iss. 7. P. 1008–1015. DOI: 10.1515/ijmr-2006-0159
- 11. Li B., Li H., Yao X., Zhu X., Liu N. Preparation and ablation resistance of ZrC nanowires-reinforced CVD-ZrC coating on sharp leading edge C/C composites // Applied Surface Science. 2022. Vol. 584. Id. 152617. DOI: 10.1016/j.apsusc.2022.152617
- 12. Kim M., Park N., Lee H.J., Rho J. The latest trends in nanophotonics // Nanophotonics. 2022. Vol. 11, iss. 11.
- P. 2389–2392. DOI: 10.1515/nanoph-2022-0191
- 13. Lu S., Zhang Y., Liu J., Li H.Y., Hu Z., Luo X., Liu H. Sensitive H2 gas sensors based on SnO2 nanowires // Sensors and Actuators B: Chemical. 2021. Vol. 345. Id. 130334. DOI: 10.1016/j.snb.2021.130334
- 14. Shi J., Sun C., Liang E., Tian B. Semiconductor nanowire‐based cellular and subcellular interfaces // Advanced Functional Materials. 2022. Vol. 32, iss. 11. Id. 2107997. DOI: 10.1002/adfm.202107997
- 15. Rajan N.K., Routenberg D.A., Reed M.A. Optimal signalto-noise ratio for silicon nanowire biochemical sensors // Applied physics letters. 2011. Vol. 98, iss. 26. Id. 264107. DOI: 10.1063/1.3608155
- 16. Rahong S., Yasui T., Kaji N., Baba Y. Recent developments in nanowires for bio-applications from molecular to cellular levels // Lab on a Chip. 2016. Vol. 16, iss. 7. P. 1126–1138. DOI: 10.1039/C5LC01306B
- 17. Harberts J., Bours K., Siegmund M., Hedrich C., Glatza M., Schöler H.R., Blick R.H. Culturing human iPSCderived neural progenitor cells on nanowire arrays: mapping the impact of nanowire length and array pitch on proliferation, viability, and membrane deformation // Nanoscale. 2021. Vol. 13, iss. 47. P. 20052–20066. DOI: 10.1039/D1NR04352H
- 18. Kim Y.J., Yoo C.J., Lee U., Yoo Y.M. Cytotoxicity of gold nanorods and nanowires on cultivated neural precursor cells // Journal of nanoscience and nanotechnology. 2015. Vol. 15, iss. 8. P. 5617–5623. DOI: 10.1166/jnn.2015.10612
- 19. Fedorov V.V., Bolshakov A.D., Dvoretckaia L.N., Sapunov G.A., Kirilenko D.A., Mozharov A.M., Shugurov K.Yu., Shkoldin V.A., Cirlin G.E., Mukhin I.S. Selfcatalyzed mbe-grown gap nanowires on Si (111): V/III ratio effects on the morphology and crystal phase switching // Semiconductors. 2018. Vol. 52, iss. 16. P. 2092–2095. DOI: 10.1134/S106378261816008X
- 20. Shalek A.K., Robinson J.T., Karp E.S., Lee J.S., Ahn D.R., Yoon M.H., Park H. Vertical silicon nanowires as a universal platform for delivering biomolecules into living cells // Proceedings of the National Academy of Sciences. 2010. Vol. 107, iss. 5. P. 1870–1875. URL:
- https://www.pnas.org/cms/asset/a0914056-abd0-4e0dae5d-e8e4260cb9e2/pnas.2010.107.issue-5.toc.pdf
- 21. Choi S.O., Kim Y.C., Lee J.W., Park J.H., Prausnitz M.R., Allen M.G. Intracellular protein delivery and gene transfection by electroporation using a microneedle electrode array // Small. 2012. Vol. 8, iss. 7. P. 1081–1091. DOI: 10.1002/smll.201101747


