Взаимодействие 2,2’-бипиридина с аллилгалогенидами
Автор: Калита Елена Владимировна, Ким Дмитрий Гымнанович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 1 т.10, 2018 года.
Бесплатный доступ
При взаимодействии 2,2’-бипиридина с бромистым аллилом и хлористым металлилом в ацетонитриле образуются бис-четвертичные соли: дибромид 1,1’-диаллил-2,2’-бипиридиния и дихлорид 1,1’-бис(2-металлил)-2,2‘-бипиридиния. Дигалогениды при термическом разложении распадаются на 5-(пиридин-2-ил)-1,8а-дигидроиндолизин и 1,1’,8а,8’а-тетрагидро-5,5’-бииндолизин. При действии на дибромид 1,1’-диаллил-2,2’-бипиридиния водным раствором щелочи образуется 1,1’-диаллил-6’-гидрокси-1’,6’-дигидро-[2,2’-бипиридин]-6(1Н)-он.
2'-бипиридин, аллилбромид, металлилхлорид, алкилирование, бис-четвертичные соли, дибромид 1, 1'-диаллил-2, 2'-бипиридиния, дихлорид 1, 1'-бис(2- металлил)-2, 1'-диаллил-6'-гидрокси-1', 6'-дигидро-[2, 2'-бипиридин]-6(1н)-он, кватернизация, масс-спектрометрия, фрагментация
Короткий адрес: https://sciup.org/147160414
IDR: 147160414 | УДК: 547.828.1 | DOI: 10.14529/chem180102
Текст научной статьи Взаимодействие 2,2’-бипиридина с аллилгалогенидами
Производные пиридина присутствуют в живых системах, и в качестве лекарственных средств используются для лечения самых разнообразных болезней [1–4]. Они применяются как препараты, значительно улучшающие работоспособность организма [1, 2] , способных бороться с ВИЧ [3] и онкологией [4]. Различные бипиридины проявляют противовоспалительную активность [5].
В литературе описаны алкилирование 2,2’-бипиридина ( 1 ) галогеналканами [6–18]. Как правило, в результате реакции образуются продукты монокватернизации [7–16] и только в случае иодметана при проведении реакции при нагревании образуется бисчетвертичная соль [17, 18]. В то же время в литературе практически отсутствуют данные о кватернизации 2,2’-бипиридина аллилгалогенидами. Целью данной работы является синтез бисчетвертичных солей 2,2’-бипиридина и исследование их методами масс-спектрометрии [19, 20] и ЯМР 1 Н.
Обсуждение результатов
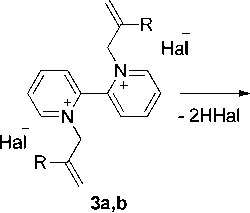
В настоящей работе нами впервые изучено взаимодействие 2,2’-бипиридина с 3-бром-пропеном ( 2а ) и 3-хлор-2-метилпропеном ( 2b ) в ацетонитриле. Найдено, что происходит кватер-низация по двум атомам азота с образованием дибромида 1,1’-диаллил-2,2’-бипиридиния ( 3а ) и дихлорида 1,1’-бис(2-металлил)-[2,2‘-бипиридиния] соответственно ( 3b ) (Схема 1).
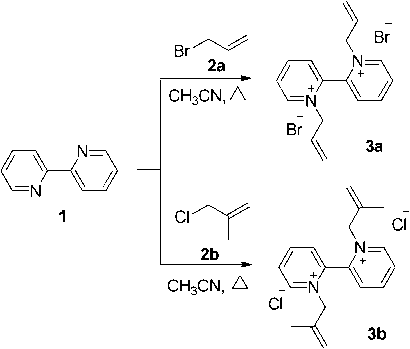
Схема 1. Алкилирование 2,2’-дипиридина
Строение соединения 3а доказано методом ЯМР 1 Н. Протоны двух пиридиновых колец и двух аллильных групп являются эквивалентными и в спектре ЯМР 1 Н дают только один набор сигналов. Так, в спектре ЯМР 1 Н бромида 3а протоны пиридиновых колец образуют три группы сигналов в области 8,51–9,41 м.д., а протоны аллильных групп – сигналы в области 5,06–6,03 м.д.
Бромид 3а и хлорид 3b были исследованы методом масс-спектрометрии путем прямого ввода образца в масс-спектрометр. В условиях регистрации масс-спектров температура ионного источника достигает 350 °С , в результате чего происходит термическое разложение солей 3а,b .
Нами обнаружено, что бромид 3а разлагается на два соединения с M = 196 (рис. 1) и M = 236 (рис. 2).
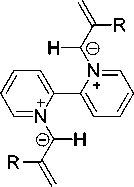
На наш взгляд, соединение с М = 196 является 5-(пиридин-2-ил)-1,8а-дигидроиндолизином ( 5а ), который образуется по следующей схеме (схема 2). Вначале происходит монодекватерни-зация бромида 3а с образованием монобромида 1-аллил-[2,2’-дипиридиния] 4а , затем элиминирование бромоводорода с образованием цвиттер-иона и его циклизация с образованием индолизина 5а .
I, %
0 35
25.0
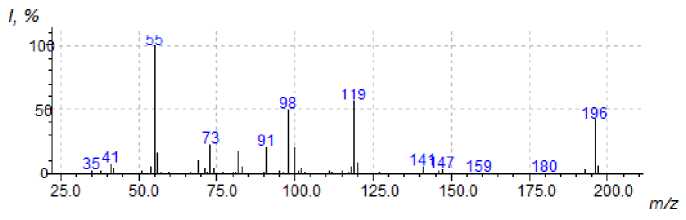
Рис. 1. Масс-спектр 5-(пиридин-2-ил)-1,8а-дигидроиндолизина
64 77
100.0
50.0
75.0
125.0
165 178 189 205
150.0 175.0 200.0
2250 m/z
Рис. 2. Масс-спектр 1,1’,8а,8’а-тетрагидро-5,5’-бииндолизина
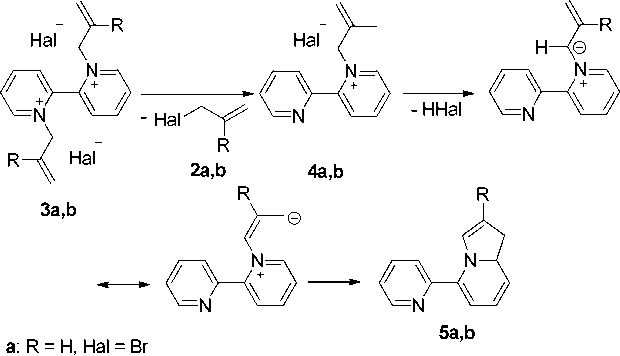
Ь - P — CN ЫЫ — Cl . lx — I/I13, rial — L/l
Схема 2. Монодекватернизация дибромида 1,1’-диаллил-2,2’-бипиридиния и дихлорида 1,1’-бис(2-металлил)-2,2‘-бипиридиния
В масс-спектре индолизина 5а (см. рис. 1) имеется пик с m/z 119 с интенсивностью 63%, который соответствует образованию катион-радикала 1,8а-дигидроиндолизина. Максимальным является пик с m/z 55, соответствующий образованию катион-радикала 1-имино-2-пропена (схема 3).
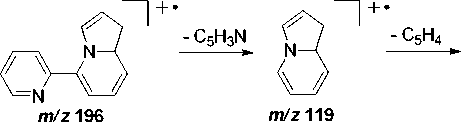
m/z55
Схема 3. Фрагментация 5-(пиридин-2-ил)-1,8а-дигидроиндолизина

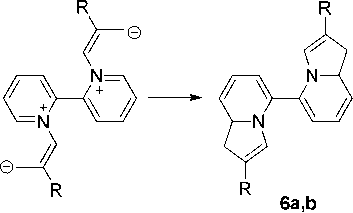
Соединение с М = 236 является, на наш взгляд, 1,1’,8а,8’а-тетрагидро-5,5’- бииндолизином (6а), который образуется по схеме 4.
о ■ P — I—I Ual — Dr a. rx — n, ndi — di
Ь . P — ГИ Ual — Cl . гл — L/M^, Mal — L/l
Схема 4. Образование 1,1’,8а,8’а-тетрагидро-5,5’-бииндолизина и 2,2’-диметил-1,1’,8а,8’а-тетрагидро-5,5’-бииндолизина
По-видимому, от бромида 3а происходит элиминирование двух молекул бромоводорода и образование 1,1’,8а,8’а-тетрагидро-5,5’-бииндолизина 6а (схема 4) с М = 236.
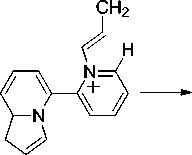
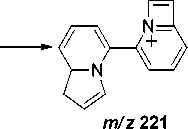
В масс-спектре бииндолизина 6а максимальным является пик с m/z 221, соответствующий элиминированию метильного радикала и образованию катиона 2-(1,8a-дигидроиндолизин-5-ил)-азето[1,2- a ]пиридиния (схема 5).
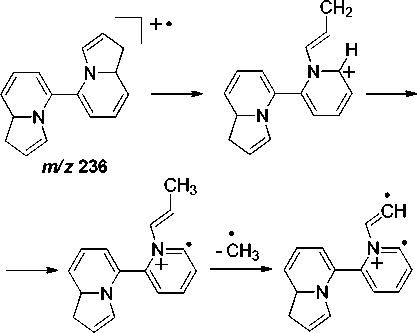
Схема 5. Фрагментация 1,1’,8а,8’а-тетрагидро-5,5’-бииндолизина
По аналогичной схеме происходит разложение хлорида 3b (схемы 2 и 4). Методом МС установлено, что образуются два соединения с М = 210 (рис. 3) и M = 264 (рис. 4).
I, %
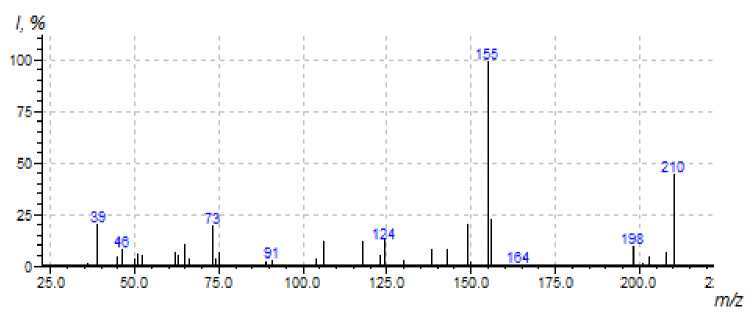
Рис. 3. Масс-спектр 2-метил-5-(пиридин-2-ил)-1,8а-дигидроиндолизина
0 37
25.0
50.0
—I—
75.0
100.0
125.0
150.0
171 195 219 235 264
175.0 200.0 225.0 250.0 275 m/Z
Рис. 4. Масс-спектр 2,2’-диметил-1,1’,8а,8’а-тетрагидро-5,5’-бииндолизина
На примере бромида 3а нами изучено его взаимодействие с водным раствором NaOH. Продукты реакции были исследованы методом МС.
В реакционной смеси нами обнаружен продукт с М = 270 (рис. 5), который соответствует соединению 1,1’-диаллил-6’-гидрокси-1’,6’-дигидро-[2,2‘-бипиридин]-6(1 Н )-ону ( 7 ).
I, %
25.0 50.0
90 145 171
77 118 131
75.0 100.0 125.0 150.0 175.0 200.0
225.0 250.0
275.0
m/z
Рис. 5. Масс-спектр 1,1’-диаллил-6’-гидрокси-1’,6’-дигидро-[2,2‘-бипиридин]-6(1 Н )-она
По-видимому, он образуется по следующей схеме: изначально образуется псевдооснование – 1,1’-диаллил-1,1’,6,6’-тетрагидро-[2,2‘-бипиридин]-6,6’-диол, который частично окисляется до кетона 7 (схема 6).
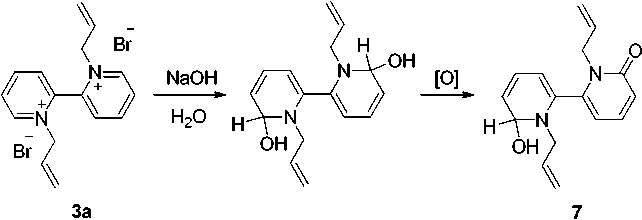
Схема 6. Щелочной гидролиз дибромида 1,1’-диаллил-2,2’-бипиридиния
В масс-спектре соединения 7 имеется интенсивный пик (85 %) молекулярного иона с m/z 270. Максимальным является пик с m/z 215, соответствующий элиминированию проп-2-ен-1-имину и образованию катион-радикала 1-аллил-6-(5-гидроксициклопента-1,3-диен-1-ил)-2-пиридона. Пик с m/z 253 соответствует катиону 1,1’-диаллил-6-гидрокси-6’-оксо-1’,6’-дигидро-2,2‘-бипиридиния (схема 7).
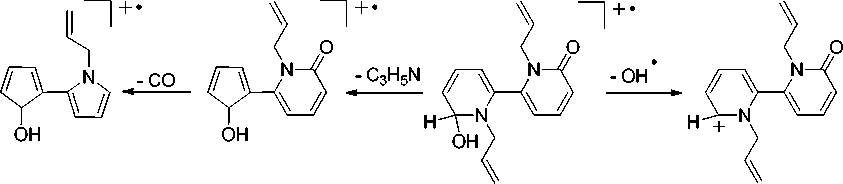
m/z^ m/z 215
m/z 270
m/z 253
Схема 7. Фрагментация 1,1’-диаллил-6’-гидрокси-1’,6’-дигидро-[2,2‘-бипиридин]-6(1 Н )-она
Экспериментальная часть
Масс-спектры сняты на газовом хроматомасс-спектрометре GCMS-QP2010 Ultra фирмы Shimadzu (ЭУ, 70 эВ). Спектр ЯМР 1 Н записан на приборе Bruker DRX-400 (400 МГц), внутренний стандарт ТМС, растворитель ДМСО- d6 . Температуры плавления определены на приборе для определения температуры плавления ПТП (М).
Общая методика синтеза соединений 3а,b
К 1,56 г (10 ммоль) 2,2‘-бипиридина в 4 мл ацетонитрила добавили 15 ммоль бромистого ал-лила/хлористого металлила и нагревали смесь с обратным холодильником в течение 16 часов. При охлаждении смеси до комнатной температуры выпадают кристаллы, которые отфильтровывают промывают ацетонитрилом трижды по 3 мл.
Дибромид 1,1’-диаллил-2,2’-бипиридиния ( 3a ). Бесцветные кристаллы. Выход 83%. Т. пл. 199–200 °С. Спектр ЯМР 1 H (400 МГц, ДМСО- d 6 , м.д., J /Гц): 5,08 (2H, дд, J = 15,39 Гц; J = 5,71 Гц, =CH 2 ); 5,25–5,16 (4H, м, NCH 2 ); 5,38 (2H, дд, J = 10,32 Гц; J = 0,77 Гц, =CH 2 ); 6,02 (2H, тдд, J = 16,76 Гц; J = 10,39 Гц; J = 6,15 Гц, СН=); 8,53 (4H, дд, J = 12,17 Гц; J = 4,49 Гц, Н-5, Н-3); 8,92 (2H, дт, J = 7,86 Гц; J = 1,18 Гц, Н-4); 9,40 (2H, д, J = 5,74 Гц, Н-6).
Дихлорид 1,1’-бис(2-металлил)-2,2’-бипиридиния ( 3b ). Желтые кристаллы. Выход 40 %. Т. пл. 176 °С.
1,1’-Диаллил-6’-гидрокси-1’,6’-дигидро-[2,2‘-бипиридин]-6(1 Н )-он (7). К раствору 0,398 г (1 ммоль) дибромида 1,1’-диаллил-2,2’-бипиридиния в 2 мл H 2 O добавили раствор 0,04 г (2 моль) NaOH в 2 мл H 2 O. Оставили реакционную смесь на сутки при комнатной температуре. Смесь экстрагировали CH 2 Cl 2 трижды по 2 мл, раствор упарили. Остаток – светло-желтое масло, которое исследовали методом МС.
Выводы
Показано, что взаимодействие 2,2’-бипиридина с бромистым аллилом или хлористым металлилом в ацетонитриле при нагревании протекает с образованием бис-четвертичных солей дибромида 1,1’-диаллил-2,2’-бипиридиния и дихлорида 1,1’-бис(2-металлил)-2,2‘-бипиридиния. Дибромид 3а при термическом разложении распадается на два соединения: 5-(пиридин-2-ил)-1,8а-дигидроиндолизин и 1,1’,8а,8’а-тетрагидро-5,5’-бииндолизин. При действии на дибромид 1,1’-диаллил-2,2’-бипиридиния щелочью образуется кетон - 1,1’-диаллил-6’-гидрокси-1’,6’-дигидро-[2,2‘-бипиридин]-6(1 Н )-он, что подтверждено методом ХМС.
Статья выполнена при финансовой поддержке Правительства РФ (Постановление № 211 от 16.03.2013 г.), соглашение № 02.A03.21.0011 и в рамках выполнения государственного задания Минобрнауки России (номер государственной регистрации 4.9665.2017/8.9).
Список литературы Взаимодействие 2,2’-бипиридина с аллилгалогенидами
- Bodor, N. Drugs of the future/N. Bodor//Pharmazie. -1981. -V. 6. -P. 165-183.
- Способ получения 3-гидрокси-2,4,6-триметилпиридина -активного вещества для получения нитросукцината 3-гидрокси-2,4,6-триметилпиридина -перспективного противоишемического средства/Р.З. Гильманов, И.Ф. Фаляхов, Е.С. Петров, Ю.В.Филиппов, Б.С. Федоров//Вестник КТУ. -2012. -№ 1 (15). -С.82-84.
- Лукевиц, Э. Производные пиридина в арсенале лекарственных средств/Э. Лукевиц//Х.Г.С. -1995. -№ 6. -С. 723-734.
- Заявка 2005119520 Российская Федерация, С07Д213/65. Ингибиторы метастазов и средства повышающие химиотерапевтическую активность противоопухолевых препаратов (Россия)/Б.С. Федоров, М.А. Фадеев, Н.П. Коновалова, С.М. Алдошин, А.Е. Сашенкова; опубл. 24.06.2005.
- Оценка биологической активности функционализированных пиридинов и дипиридинов как потенциальных компонентов кариеспротекторных агентов/О.В. Продан, В.Ю. Анисимов, В.Е. Кузьмин, В.О. Гельмбольдт//Одесский медицинский журнал. -2015. -№ 3 (149). -С. 25-29.
- Пожарский, А.Ф. Теоретические основы химии гетероциклов/А.Ф. Пожарский. -М.: Химия, 1985. -279 с.
- Synthesis of new pyrrole-pyridine-based ligands using an in situ Suzuki coupling method/M. Boettger, B. Wiegmann, S. Schaumburg, P.G. Jones, W. Kowalsky, H.-H. Johannes//Beilstein Journal of Organic Chemistry. -2012. -V. 8. -P. 1037-1047 DOI: 10.3762/bjoc.8.116
- HPLC Analysis of Aliphatic Sulfonate Surfactants using Ion-Pair Detection/M. Zahrobsky, D. Camporese, О. Rist, H.J. Carlsen//Molecules. -2005. -V. 10, № 9. -P. 1179-1189 DOI: 10.3390/10091179
- Tabushi, I. N-alkyl-4,4'-Bipyridyl. A new efficient electron carrier in the photochemical hydrogen producing system/I. Tabushi, A. Yazaki//Tetrahedron. -1981. -V. 37, № 24. -P. 4185-4188 DOI: 10.1016/0040-4020(81)85009-0
- Plaquevent, J.C. Alkylation reduction of ketones with aromatic properties/J.C. Plaquevent, I. Chichaoui//Bulletin de la Societe Chimique de France. -1996. -V. 133, № 4. -P. 369-379.
- Westheimer, F.H. The Quantitative Evaluation of the Effect of Hydrogen Bonding on the Strength of Dibasic Acids/F.H. Westheimer, O.T. Benfey//J. Am. Chem. Soc. -1956. -V. 78, № 20. -P. 5309-5311 DOI: 10.1021/ja01601a042
- Koizumi, T.A. Synthesis and electrochemical properties of bis(bipyridine)ruthenium(II) complexes bearing pyridinyl-and pyridinylidene ligands induced by cyclometalation of N′-methylated bipyridinium analogs/T.A. Koizumi, T. Tomon, K. Tanaka//Journal of Organometallic Chemistry. -2005. -V. 690, № 5. -P. 1258-1264 DOI: 10.1016/j.jorganchem.2004.11.032
- Zamocka, J. Synthesis, physicochemical and antimicrobial properties of 1-alkyl-2-(2-pyridyl)pyridinium bromides/J. Zamocka, I. Lacko, F. Devinsky//Pharmazie. -1994. -V. 49, № 1. -P. 66-67.
- Physico-chemical properties and spectrophotometric determination of biologically active 1-alkyl-2-(2-pyridyl)pyridinium bromides/L. Novotny, A. Vachalkova, M. Blesova, B.J. Denny, D. Sharma, Z. Ovesna, J. Zamocka//Pharmazie. -2003. -V. 58. -P. 320-324.
- Antimicrobial Activity of a Series of 1-Alkyl-2-(4-Pyridyl)Pyridinium Bromides against Gram-Positive and Gram-Negative Bacteria/B.J. Denny, L. Novotny, P.W.J. West, M. Blesova, J. Zamocka//Med. Princ. Pract. -2005. -V. 14. -P. 377-381 DOI: 10.1159/000088108
- Xiao, J.-C. Bipyridinium Ionic Liquid-Promoted Cross-Coupling Reactions between Perfluoroalkyl or Pentafluorophenyl Halides and Aryl Iodides/J.-C. Xiao, C. Ye, J.M. Shreeve//Organic Letters. -2005. -V. 7, № 10. -P. 1963-1965 DOI: 10.1021/ol050426o
- Regioselective Functionalization of 2,2'-Bipyridine and Transformations into Unsymmetric Ligands for Coordination Chemistry/T. Norrby, A. Boerje, L. Zhang, B. Akermark//Acta Chemica Scandinavica. -1998. -V. 52, № 1. -P. 77-85 DOI: 10.3891/acta.chem.scand.52-0077
- Cyclometalated Ir(III) complexes of deprotonated N-methylbipyridinium ligands: effects of quaternised N centre position on luminescence/B.J. Coe, M. Helliwell, J. Raftery, S. Sánchez, M.K. Peers, N.S. Scrutton//Dalton Transactions. -2015. -V. 44, № 47. -P. 20392-20405 DOI: 10.1039/C5DT03753K
- Вульфсон, Н.С. Масс-спектрометрия органических соединений/Н.С. Вульфсон, В.Т. Залкин, А.И. Микая. -М.: Химия, 1986. -312 c.
- Лебедев, А.Т. Масс-спектрометрия в органической химии/А.Т. Лебедев. -М.: БИНОМ. Лаборатория знаний, 2003. -493 c.


