Взаимодействие 5-замещенных 2-(аллилсульфанил)-1,3,4-тиадиазолов с галогенами
Автор: Тарасова Наталья Михайловна, Ким Дмитрий Гымнанович, Шарутин Владимир Викторович
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 4 т.8, 2016 года.
Бесплатный доступ
Изучено взаимодействие 2-(аллилсульфанил)-5-амино(бензоиламино)-1,3,4-тиадиазолов с иодом и бромом. Состав и строение, полученных в результате соединений, изучены методами ЯМР 1Н, хромато-масс-спектрометрии и РСА.
6-дигидротиазоло[2, 4]тиадиазолий, 7-дигидро-5н-[1, 4]тиадиазоло[2, 3]тиазиний, хромато-масс-спектрометрия, ямр 1н, рентгеноструктурный анализ, 7-dihydro-5н-[1, 1н nmr
Короткий адрес: https://sciup.org/147160372
IDR: 147160372 | УДК: 547.794.3 | DOI: 10.14529/chem160401
Текст научной статьи Взаимодействие 5-замещенных 2-(аллилсульфанил)-1,3,4-тиадиазолов с галогенами
Научно-практический интерес к конденсированным производным 1,3,4-тиадиазола с узловым атомом азота в целом и, в частности, к тиазоло[2,3- b ][1,3,4]тиадиазолиевым и [1,3,4]тиадиазоло[2,3- b ]тиазиниевым системам обусловлен большим потенциалом использования их в качестве лекарственных препаратов [1–3]. В то же время, известны примеры, когда введение атома иода в состав органической молекулы приводило к повышению биологической активности препарата [4]. С целью расширения спектра потенциально биологически активных средств среди конденсированных галогенсодержащих систем 1,3,4-тиадиазола нами было исследовано взаимодействие 2-(аллилсульфанил)-5-амино(бензоиламино)-1,3,4-тиадиазолов с иодом и бромом.
Экспериментальная часть5-амино-1,3,4-тиадиазол-2-тион (2).
Получен по методу [5] из тиосемикарбазида и сероуглерода приобретенных у компании Alfa Aesar.
5-Амино-2-(аллилсульфанил)-1,3,4-тиадиазол (3).
Растворяют 0,35 г Na в 20 мл этанола, добавляют 2,00 г (15 ммоль) 5-амино-1,3,4-тиадиазол-2-тиона ( 2 ) и 1,44 мл (15 ммоль) аллилбромида и кипятят в течение 6 ч. Фильтруют, отгоняют этанол, остаток обрабатывают тремя порциями горячего гексана по 10 мл, после испарения растворителя, получают вязкую жидкость желтого цвета. Выход 2,28 г (88 %). Масс-спектр, 70 Эв, m/z 173 [M]+• (< 5%), 172 [M–Н] + (< 5%), 171 (8), 156 [M–NН 2 ]+ (28), 140 [M–SH]+ (< 5%), 129 (10), 124 (9), 116 (6), 115 [M–SC 2 Н 2 ]+• (66), 106 (< 5%), 100 (5), 98 (16), 84 (12), 78 (< 5%), 73 [SC 3 Н 5 ]+ (23), 72 [SC 3 Н 5 ]+• (21), 71 (25), 60 (49), 59 [С 2 Н 3 S]+(5), 58 (42), 57 (30), 56 [SC 2 ]+• (100), 55 (5), 45 (15), 43 (33), 42 (44), 41 (37), 39 (25).
Иодиды 2-амино-5-(иодметил)-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия (4а) и
2-амино-6-иод-6,7-дигидро-5 Н -[1,3,4]тиадиазоло[2,3- b ][1,3]тиазиния (5а).
К раствору 0,1 г (0,5 ммоль) 2-(аллилсульфанил)-5-амино-1,3,4-тиадиазола 3 в 5 мл i -PrOH прибавляют 0,23 г иода в 6 мл i -PrOH. Через 48 ч раствор декантируют, оставшееся черное аморфное вещество растворяют в 10 мл ацетона и добавляют двойной избыток NaI, образовавшийся желтый осадок смеси иодидов 4а и 5а отфильтровывают (0,045 г). Испаряют растворитель из фильтрата, остаток растворяют в смеси 5 мл ацетона с 2 мл воды. Добавляют 0,25 г тиосульфата натрия порциями до полного обесцвечивания раствора, через 24 ч отфильтровывают выпавший желтый осадок смеси иодидов 4а и 5а (0,05 г). Выход – 0,095 г (38 %).
Трииодиды 2-амино-5-(иодметил)-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия (4b) и 2-амино-6-иод-6,7-дигидро-5 Н -[1,3,4]тиадиазоло[2,3- b ][1,3]тиазиния (5b).
К раствору 0,2 г (1 ммоль) 2-(аллилсульфанил)-5-амино-1,3,4-тиадиазола 3 в 3 мл EtOH прибавляют 0,6 г иода в 5 мл EtOH. Через 72 ч отфильтровывают выпавшие игольчатые кристаллы черного цвета. Выход – 0,21 г (30 %).
2-(Аллилсульфанил)-5-бензоиламино-1,3,4-тиадиазол (6) .
К раствору 1 г (4 ммоль) 2-(аллилсульфанил)-5-амино-1,3,4-тиадиазола 3 в 10 мл диоксана прибавляют 1,21 мл (4 ммоль) триэтиламина и 0,67 мл (4 ммоль) бензоилхлорида. Раствор перемешивают 10–12 ч. Растворитель отгоняют. Остаток перекристаллизовывают из этанола. Вещество выделяют в виде желтых кристаллов. Выход 1,30 г (81 %).
Иодиды 2-бензоиламино-5-(иодметил)-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия (7а) и 2-бензоиламино-6-иод-6,7-дигидро-5 Н -[1,3,4]тиадиазоло[2,3- b ][1,3]тиазиния (8а) Растворяют в 10 мл i -PrOH 0,15 г (0,5 ммоль) 2-(аллилсульфанил)-5-бензоиламино-1,3,4-тиадиазола 3 , прибавляют 0,23 г иода в 6 мл i -PrOH. Через 48 ч растворитель испаряют, оставшееся черное аморфное вещество растворяют в 10 мл ацетона и добавляют двойной избыток NaI, образовавшийся желтый порошкообразный осадок отфильтровывают. Выход 0,13 г (66 %)
Бромиды 2-бензоиламино-5-(бромметил)-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия
(7b) и 2-бензоиламино-6-бром-6,7-дигидро-5 Н -[1,3,4]тиадиазоло[2,3- b ][1,3]тиазиния (8b) .
Растворяют 0,11 г (0,4 ммоль) 2-(аллилсульфанил)-5-бензоиламино-1,3,4-тиадиазола 3 в 5 мл CHCl 3 при перемешивании прибавляют 0,03 мл (0,6 ммоль) Br2 в 5 мл CHCl 3 при охлаждении льдом в течение 20 мин. Смесь выдерживают 48 ч при комнатной температуре. Растворитель отгоняют, остаток обрабатывают ацетоном. Выпавший белый осадок отфильтровывают и перекристаллизовывают из этанола. Выход 0,13 г (74 %).
Спектры ЯМР1 Н полученных соединений записаны на спектрометре Bruker DRX-400 (400 МГц) в ДМСО-d6, внутренний стандарт ТМС.
Масс-спектры (ЭУ, 70 эВ) зарегистрированы на хромато-масс-спектрометре фирмы SHIMADZU GCMS QP-2010 Ultra.
Taблица 1
Спектральные данные соединений 2 – 8b
|
Соединение |
Спектр ЯМР 1 Н, б, м.д. ( J , Гц) |
|
3 |
3,69 (2Н, д, 3 J= 7,02, SCH 2 ); 5,18 (1Н, дд, 3 J= 0,81, 2 J= 10,60, =СН 2т ); 5,2 (1Н, ДД, 3 J= 1,31, 2 J= 16,90, =СН 2ц ); 5,875.89 (1Н, м, =СН-); 7,33 (2Н, с, -NH 2 ) |
|
4a |
3,703.71 (2H, м, 6-СН 2 ); 8,32 (2Н, с, NH 2 ); 5,18–5,09 (1H, м, 5-CH), 4,12–4,22 (1H, м, CH 2 I); 3,99–4,11 (1H, м, CH 2 I) |
|
5a |
3,63 (1H, дд, 4 J= 6,7 , 2 J =12,1, 7-CH 2 ); 3,86 (1H, дд, 4 J= 1.9 , 2 J =12,9, 7-СН 2 ); 4,55 (1Н, дд, 4 J= 7,2 , 2 J =14,6, 5-СН2); 4,79 (1H, дд, 4 J= 3,5 , 2 J =14,2, 5-СН2); 4,97-5,04 (1H, м, 6-CH); 8,32 (2Н, с, NH 2 ); |
|
6 |
3,92 (2Н, д, 3 J =6,9, SCH 2 ); 5,16-5,20 (1Н, м, =ОД; 5,31 (1Н, дк, 3 J =16,9, 4 J =1,3, =СН); 13,13 (1Н, с, NH); 5,96 (1Н, ддт, 3 J =16,9, 3 J =10,0, 3 J =6,9, -СН=); 7,55-7,59 (2H, м, СН аром. ); 7,65-7,70 (1H, м, СН аром. ); 8,11 (2H, дд,3 J =8,3, 4 J =1,2, СН аром. ) |
|
7a |
3,79-3,83 (2Н, м, 6-СН 2 ); 3,86 (1Н, дд,3 J =2,7,2 J =11,4, СЩ); 4,31 (1Н, дд,3 J =9,9,2 J =11,9, CH 2 I); 5,34–5,41 (1Н, м, 5-СН); 7,58–7,63 (2Н, м, CH аром. ); 7,69–7,75 (1Н, м, CH аром. ); 8,08– 8,19 (2H, м, CH аром. ); 13,07 (1Н, уш.с, NH) |
|
7b |
3,78-3,83 (1Н, м, 7-СН 2 ); 3,96 (1Н, дд, 3 J= 2,1 , 2 J =12,7, 7-СН 2 ); 4,80 (1Н, дд, 3 J= 8,5 , 2 J =14,7, 5-СН2); 5,04 (1Н, дд,3 J= 2,6 , 2 J =14,5, 5-СН2); 5,03-5,08 (1Н, м, 6-СН); 7,58- 7,63 (2Н, м, CH аром. ); 7,69–7,75 (1Н, м, CH аром. ); 8,08–8,19 (2H, м, CH аром. ); 13,07 (1Н, уш.с, NH) |
|
8a |
3,78–4,23 (2H, м, 6-CH 2 ); 3,90–4,0 (1H, м, CH 2 Br); 4,33 (1H, т, 11,0, CH 2 Br); 5,66–5,83 (1H, м, 5-СН); 7,69-7,60 (2Н, м, СН аром. ); 7,79-7,69 (1Н, м, СН аром. ); 8,13 (2Н, д, J =6,5, СН аром. ); 13,20 (1H, уш.с, NH) |
|
8b |
4,19-4,23 (1Н, м, 7-СН 2 ); 4,38-4,47 (1Н, м, 7-СН 2 ); 4,84 (1Н, дд, 2 J= 14,7 , 3J =4,3, 5-СН 2 ); 5,12 (1Н, дд, 2 J= 14,1 , 3J =2,7, 5-СН 2 ); 5,37-5,43 (1Н, м, 6-СН); 7,60-7,69 (2Н, м, СНаром . ); 7,69-7,79 (1Н, м, СНа ро М . ); 8,13 (2Н, д, J =6.5, СН аром. ); 13,20 (1Н, уш.с, NH) |
Рентгеноструктурный анализ (РСА) кристаллов соединений 4b , 5b проведен на автоматическом четырехкружном дифрактометре D8 QUEST фирмы Bruker (Mo K α -излучение, λ = 0,71073 Å, графитовый монохроматор).
Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [6]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [7]. Структуры соединений 4b , 5b определены прямым методом и уточнены методом наименьших квадратов в анизотропном приближении для неводородных атомов. Основные кристаллографические данные и результаты уточнения структур приведены в табл. 2.
Taблица 2
Кристаллографические данные, параметры эксперимента и уточнения структуры соединений 4b и 5b
|
Параметры |
Значение |
|
Cингония |
моноклинная |
|
Пространственная группа |
P2 1 /c |
|
a , Å |
8,7541(7) |
|
b , Å |
8,1069(7) |
|
c, Å |
20,6293(16) |
|
α , град |
90,00 |
|
β, град |
92,783(4) |
|
γ , град |
90,00 |
|
V , Å3 |
1462,3(2) |
|
Z |
4 |
|
ρ (выч.) , г/см3 |
3,093 |
|
- 1 µ , мм |
8,782 |
|
F (000) |
1208,0 |
|
Размер кристалла (размер, мм) |
0,48 × 0,28 × 0,18 |
|
Область сбора данных по 2 θ , град |
6,4 - 54,8 |
|
Интервалы индексов отражений |
–11 ≤ h ≤ 10, –10 ≤ k ≤ 10, –26 ≤ l ≤ 26 |
|
Измерено отражений |
13196 |
|
Независимых отражений |
2941 |
|
R int |
0,0403 |
|
Переменных уточнения |
127 |
|
GOOF |
1,135 |
|
R -факторыпо F 2> 2 σ (F 2 ) |
R 1 = 0,0529, wR 2 = 0,0959 |
|
R -факторы по всем отражениям |
R 1 = 0,0882, wR 2 = 0,1087 |
|
Остаточная электронная плотность (min/max), e /Å3 |
1,54/–1,08 |
Результаты и обсуждение
Ранее нами показано галогенциклизация 2-(аллилсульфанил)-5-метил-1,3,4-тиадиазола под действием иода и брома, приводит к образованию смеси изомерных продуктов [8]. В настоящей работе изучена иодциклизация 2-(аллил-сульфанил)-5-амино-1,3,4-тиадиазола (3) в спирте при комнатной температуре. Установлено, что закономерности, наблюдаемые нами для 5-метилзамещенного1,3,4-тиадиазола, прослеживаются и в данном случае. В результате реакции образуется смесь иодидов 2-амино-5-(иодметил)-5,6-дигидротиазоло[2,3-b][1,3,4]тиадиазолия (4а) и 2-амино-6-иод-6,7-дигидро-5Н-[1,3,4]тиадиа-золо[2,3-b][1,3]тиазиния (5а) в соотношении 2:1, c выходом 38 %. В реакционном растворе по данным ХМС остается исходный аллилсульфид 3. Бромциклизация соединения 3 при охлаждении льдом в дихлорметане не протекает. Наши
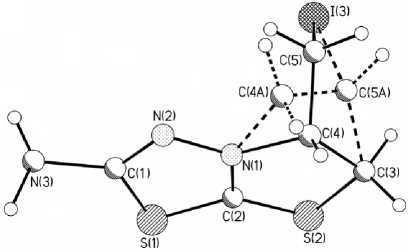
Рис. 1. Общий вид молекул соединений 4b и 5b в кристалле по данным метода РСА
попытки повысить выход продуктов иодциклизации 4а и 5а путем увеличения продолжительности реакции и варьированием растворителя ( i -PrOH, EtOH, и ледяная CH3COOH) оказались безуспешными. Вероятно, причина данного явления заключается в образовании комплекса иода с аминогруппой 1,3,4-тиадиазола, за счет чего снижается выход целевого продукта. При проведении реакции в абсолютном этаноле была выделена смесь трииодиов 4b и 5b . Согласно предварительным данным РСА соединения 4b и 5b кристаллизуются совместно (рис. 1). Для систем 4b и 5b координаты 1,3,4-тиадиазолового цикла и атома иода совпадают. 1,3,4-Тиадиазоловый и тиазоловый циклы лежат практически в одной плоскости, геометрия тиазинового кольца имеет отклонения от плоскости.
Нами осуществлено ацилирование аминогруппы соединения 3 бензоилхлоридом с целью снижения ее дезактивирующего влияния на процесс галогенциклизации. Взаимодействие с иодом, полученного таким образом 2-(аллилсульфанил)-5-бензоиламино-1,3,4-тиадиазола ( 6 ), позволило синтезировать смесь иодидов 2-бензоиламино-5-(иодметил)-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия 7а и 2-бензоиламино-6-иод-6,7-дигидро-5 Н -[1,3,4]тиадиазоло[2,3- b ][1,3]тиазиния 8а с общим выходом 66 % в соотношении 10:7. Кроме того, осуществлена бромциклизация соединения 6 . Установлено, что в данном случае происходит образование смеси бромидов 2-бензоиламино-5-(бромметил)-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия 7b и 2-бензоиламино-6-бром-6,7-дигидро-5 Н -[1,3,4]тиадиазоло[2,3- b ][1,3]тиазиния 8b в соотношении 10:7, выделенных с выходом 74 %.
диоксан,
20 oC - 12 ч
Et 3 N O Cl
ON
«•» N
Hal +
I или II O N -N
Hal
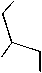
Ph
NS
Ph H
6 81 %
I. 1) I 2 , i -PrOH,
20 oC - 48 ч
2) NaI, Me 2 CO
Ph NH
II. 1) Br2, диоксан, 0 oC - 20 мин, 20 oC - 48 ч 2) Me 2 CO
7a 7b
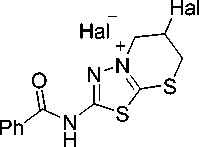
10:7 66 % 8a
10:7 74 % 8b
Выводы
Показано, что иодциклизация 2-(алиллсульфанил)-5-амино-1,3,4-тиадиазола и гало-генциклизация 2-(алиллсульфанил)-5-бензоиламино-1,3,4-тиадиазола протекает с образованием смеси изомерных продуктов – галогенидов 2-амино-, 2-бензоиламино-5-(галогенметил)-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия и 2-амино-, 2-бензоиламино-6-галоген-6,7-дигидро-5 Н -[1,3,4]тиадиазоло[2,3- b ][1,3]тиазиния. Методом рентгеноструктурного анализа установлено, что иодиды 2-амино-5-(иодметил)-5,6-дигидротиазоло[2,3- b ][1,3,4]тиадиазолия и 2-бензоиламино-6-иод-6,7-дигидро-5 Н -[1,3,4]тиадиазоло[2,3- b ][1,3]тиазиния кристаллизуются совместно в моноклинной кристаллической решетке.
Список литературы Взаимодействие 5-замещенных 2-(аллилсульфанил)-1,3,4-тиадиазолов с галогенами
- Claremon, D.A. Assignee: Merck & Co Inc. Methods and compositions for thrombolytic therapy/D.A. Claremon, P.A. Friedman, D.C. Remy, A.M. Stern//Patent US 4968494. -1990. -Nov. 6.
- Ibrahim, D.A. Synthesis and biological evaluation of 3,6-disubstituted triazolothiadiazole derivatives as a novel class of potential anti-tumor agents/D.A. Ibrahim//Eur. J. of Med. Chem. -2009. -V. 44. -P. 2776-2781.
- Amir, M. Condensed bridgehead nitrogen heterocyclic system: Synthesis and pharmacological activities of 1,2,4-triazolo--1,3,4-thiadiazole derivatives of ibuprofen and biphenyl-4-yloxy acetic acid/M. Amir, H. Kumar, S.A. Javed//Eur. J. of Med. Chem. -2008. -V. 43. -P. 2056-2066.
- Iodination increases the activity of verapamil derivatives in reversing PGP multidrug resistance/R. Barattin, B. Gerby, K. Bourges et al.//Anticancer Res. -2010. -V. 30, № 7. -P. 2553-2559.
- Preparation and hydrolysis of some derivatives of 1,3,4-thiadiazole/V. Petrow, O. Stephenson, A. J. Thomas et al.//J. Chem. Soc. -1958. -P. 1508-1513.
- Bruker (2000) SMART. Bruker Molecular Analysis Research Tool, Versions 5.625, Bruker AXS, Madison, Wisconsin, USA.
- Bruker (2000) SAINTPlus Data Reduction and Correction Program Versions 6.02a, Bruker AXS, Madison, Wisconsin, USA.
- Тарасова, Н.М. Галогенциклизация S-и N-алкенильных производных 5-метил-1,3,4-тиадиазол-2-тиона/Н.М. Тарасова, Д.Г. Ким, П.А. Слепухин//Химия гетероцикл. соед. -2015. -№ 10. -С. 923-928.


