Взаимодействие экстракта чистотела большого с плазмидной ДНК, выделенной из клинического штамма Esherichia coli
Автор: Бабушкина Ирина Владимировна, Свистунов А.А., Чомаев Х.-М.П., Чеботарева Е.Г., Бельская Н.А.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Биохимия
Статья в выпуске: 3 т.5, 2009 года.
Бесплатный доступ
Поиск соединений, обладающих антибактериальной активностью и влияющих на плазмидную ДНК, - одна из важных задач практической медицины. Природные вещества являются наиболее желательными кандидата- ми на эту роль. Выделение плазмидной ДНК проводили из штамма Esherichia coli, полученного от больного Н., страдающе- го хроническим пиелонефритом, в бактериологической лаборатории Областной клинической больницы г. Сара- това по модифицированному методу Birnboim и Doli. Производили подсчет концентрации алкалоидов (сангви- нарина и хелеретрина), содержащихся в экстракте чистотела. Разработанная методика была апробирована на пяти образцах настойки чистотела, заложенных на хра- нение для изучения стабильности содержания алкалоидов и других показателей качества данного препарата, при этом содержание суммы алкалоидов в настойке составляло 1%. Обнаружено уменьшение концентрации плазмидной ДНК после обработки клеток экстрактом чистотела.
Экстракт чистотела, плазмидная днк
Короткий адрес: https://sciup.org/14916910
IDR: 14916910
Текст научной статьи Взаимодействие экстракта чистотела большого с плазмидной ДНК, выделенной из клинического штамма Esherichia coli
используются штаммы Escherichia coli: HB101, K-12, С-600 и другие. Спектр грамотрицательных микроорганизмов, которые обнаруживаются при посеве на среды от больных, находящихся на лечении в стационаре, достаточно обширен и включает в себя такие бактериальные штаммы, как: Pseudomonas aeruginosa, Serratia plymuthica, Klebsiella, Proteus vulgaris, E.coli, Citrobacter [3] .
Естественно предположить, что строение клеточной стенки у таких штаммов, а также их метаболизм будут существенно различаться. Подбор условий для оптимального роста и последующего лизиса клеток представляет собой отдельную задачу, решение которой можно ожидать на пути последовательного эмпирического перебора наиболее доступных методов выращивания и лизирования клеточной биомассы.
Поиск соединений, обладающих антибактериальной активностью, — еще одна важная задача практической медицины. Природные вещества являются наиболее желательными кандидатами на эту роль.
Материалы и методы. Для исследований использовали сбор чистотела большого, произрастающего в районе Кумысной поляны города Саратова. Сбор проводили в начале цветения (май), так как именно в этот период количественный и качественный состав алкалоидов является оптимальным [4]. Собранные растения подвергали естественной сушке в тени. Отделяли листья и измельчали в фарфоровой ступке. Для получения водного экстракта навеску растительного материала массой 1г заливали 10мл дистиллированной воды. Экстракцию осуществляли в течение 15 минут при температуре 80єС. Методика количественного определения суммы алкалоидов в настойке чистотела следующая. 20 мл настойки чистотела помещают в круглодонную колбу вместимостью 100 мл и упаривают под вакуумом на ротационном испарителе до 1/4 исходного объема. Полученный остаток количественно переносят в делительную воронку вместимостью 50-100 мл, прибавляют 8 мл 25%-ного раствора аммиака и алкалоиды трижды извлекают хлороформом (порциями по 20, 20 и 10 мл соответственно). Объединенные хлороформные извлечения дважды обрабатывают 5%-ным раствором серной кислоты в делительной воронке вместимостью 50– 100 мл порциями по 20 мл. К объединенным сернокислым извлечениям прибавляют 8 мл 25%-ного раствора аммиака и основания алкалоидов вновь трижды экстрагируют хлороформом в делительной воронке вместимостью 50-100 мл порциями по 20, 20 и 10 мл соответственно. Объединенные хлороформные извлечения переносят в круглодонную колбу вместимостью 100 и 250 мл и отгоняют хлороформ досуха под вакуумом.
Сухой остаток количественно переносят в стакан для титрирования последовательно с помощью 5 мл ледяной уксусной кислоты, 10 мл ацетонитрила и титруют потенциометрически раствором хлорной кислоты (0.05 моль/л). Параллельно проводят контрольный опыт.
Массовую долю Х (в %) суммы алкалоидов в пересчете на сангвинарин и хелеретрин в препарате вычисляют по формуле
( V - V 1)*0,01765* 100
X = ,
где 0,01765 – количество суммы алкалоидов в пересчете на сангвинарин и хелеретрин, соответствующее 1 мл раствора хлорной кислоты (0.05 моль/л), г, V – объем хлорной кислоты (0.05 моль/л), пошедшей на титрирование суммы алкалоидов, мл; V1 – объем хлорной кислоты (0.05 моль/л), пошедшей на титрирование в контрольном опыте, мл.
Разработанная методика была апробирована на пяти образцах настойки чистотела, заложенных на хранение для изучения стабильности содержания алкалоидов и других показателей качества данного препаратах [5, 6]. При этом содержание суммы алкалоидов в настойке колеблется в пределах 1%.
Подсчет концентрации алкалоидов (по всей вероятности, сангвинарина и хелеретрина), содержащихся в экстракте чистотела, производили следующим образом. Поскольку навеска составляла один грамм, а количество алкалоидов 1%, то рассчитывали количество алкалоидов в 1 г сырья чистотела большого:
1 г – 100 %
-
х г – 1 %
х = 1Ч1/100 = 10–2 г
Известно, что молекулярная масса сангвина-рина составляет 353 г/М, а молекулярная масса хелеретрина равна 367 г/М. Таким образом можно рассчитать концентрацию алкалоидов в 10 мл растворителя (исходный объем растворителя для экстракта чистотела большого). Усредним молекулярные массы сангвинарина и хелеретрина: (353 + 367)/2 = 360 г/М.
с = m х 1
М M V0’ где СМ – концентрация алкалоидов в М/л, m – масса алкалоида в г, М – молекулярная масса алкалоидов в г/М, V0 – объем используемого растворителя в л.
С М
10 - 2 г 1
х
360 г / М 10 - 2 л
« 2,8 х 10 - 3 М / л ,
Такая концентрация алкалоидов обнаруживается в 10 мл раствора, приготовленного описным выше методом.
Выделение плазмидных ДНК
Определение антибактериального действия соединений чистотела на бактериальные клетки штамма E. coli, выделенного от больного Н., страдающего хроническим пиелонефритом, проводили в бактериологической лаборатории Областной клинической больницы г. Саратова.
В большинстве методов выделения плазмидных ДНК используют биомассу, полученную в результате выращивания бактерий в течение 18 часов в 1-1,5 мл среды при температуре 37оС.
Больший объем культуральной среды нежелателен, так как препарат геномной ДНК будет слишком концентрированным и с таким препаратом трудно производить последующие действия.
Для быстрого выделения плазмид используют клетки, которые берут непосредственно с чашки с агаром. Трудность состоит в том, что при соскобе надо избегать захвата агара (он будет мешать при последующий работе), поскольку ингибирует активность большинства рестриктирующих эндонуклеаз и других ферментов, работающих на ДНК; этим ингибитором, возможно, являются содержащиеся в агаре сульфонированные углеводороды. Размер соскоба не должен превышать 2-х рисовых зерен, чтобы после ресуспендирования клеток их концентрация в растворе не превышала нужную.
Важным фактором является время выращивания культур. Оно не должно превышать 16–18 часов. При таком времени рост культур еще находится в логарифмической фазе, что дает большой выход плаз-мидной ДНК.
Лизис биомассы, как правило, является первым этапом многих методов выделения плазмид. Для разрушения клеточной стенки биомассу обрабатывают ЭДТА и лизоцимом. Под действием ЭДТА разрушается наружная мембрана, а лизоцим расщепляет мукопептидный слой.
Культуры микроорганизмов выращивали в 5 мл 10% питательной среды на основе бульона Хоттингера в течение 18 часов в термостате при температуре 37 оС.
Затем 1 мл бульонной культуры отбирали в микропробирки и концентрировали микробные клетки центрифугированием при 14000 об/мин в течение 1 минуты. Осадок ресуспендировали в 100 мкл раствора № 1, содержащего лизоцим “Serva” (2 мг/мл)
оставляли в ледяной бане на 10 минут. Лизоцим растворяли в растворе № 1 непосредственно перед использованием.
По истечении 10 минут к смеси добавляли 200 мкл раствора № 2. Микропробирки один раз резко встряхивали и снова помещали в ледяную баню на 5 минут. Затем в пробирки добавляли по 150 мкл раствора № 3, встряхивали 1–2 раза, хорошо перемешивали и оставляли в ледяной бане на 30 минут.
После этого микропробирки центрифугировали в течение 15 минут при 14 000 об/мин. Супернатант отбирали в чистые микропробирки, приливали к нему 400 мкл фенола и центрифугировали в течение 5 минут при 14 000 об/мин. После этого отбирали верхнюю фазу, не содержащую фенол, и добавляли к ней 400 мкл хлороформа, после чего центрифугировали в течение 10 минут при 14 000 об/мин.
Затем снова переливали верхнюю фазу, не содержащую хлороформа, в чистые микропробирки и добавляли 40 мкл 3М ацетата натрия и 1000 мкл 96%-ного перегнанного этанола, перемешивали и оставляли содержимое на 15–30 минут при температуре –20 оС.
На следующем этапе содержимое пробирок центрифугировали в течение 15 минут при 14 000 б/мин. Затем удаляли супернатант, а к осадку добавляли 250 мкл 70%-ного охлажденного при температуре –20оС этанола, несколько раз осторожно переворачивали пробирки для того, чтобы лучше промыть осадок, и снова центрифугировали в течение 2 мин при 14 000 об/мин.
После этого вновь удаляли супернатант, а остатки жидкости удаляли с помощью полосок фильтровальной бумаги. Осадок просушивали на воздухе при открытой крышке микропробирки. Осадок старались не пересушивать. После завершения процедуры высушивания осадок растворяли в 30 мкл ТЕ-буфера.
Выделенную таким образом плазмидную ДНК в дальнейшем использовали для электрофоретического исследования.
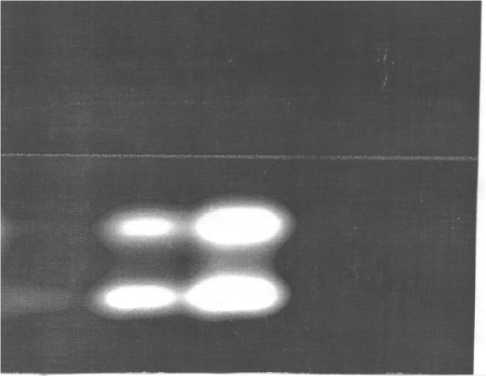
3 2 1
Электрофоретический профиль плазмидных ДНК, выделенных из клеток E.coli после их обработки экстрактом чистотела:
1 - клетки без обработки экстрактом чистотела; 2 - клетки после обработки экстрактом чистотела, разведенным в 10 раз;
3 - клетки после обработки экстрактом чистотела без разведения.
Модификация метода состоит в том, что, во-первых, по сравнению со стандартным выделением плазмидной ДНК по методу Birnboim и Doli, уменьшено время выдержки в ледяной бане; во-вторых, не применялась баня, содержащая смесь сухого льда и этанола; в-третьих, использование отечественных центрифуг на 8 000-10 000 об/мин (3.577.6 g) нисколько не снизило процент выхода плазмид-ной ДНК.
Результаты. Электрофоретические профили плазмидных ДНК, выделенных после обработки исходных бактериальных клеток экстрактом чистотела, представлены на рисунке. Обращает на себя внимание уменьшение концентрации плаз-мидной ДНК после обработки клеток экстрактом чистотела.
Обсуждение. Алкалоиды имеют в своей структуре положительно заряженный атом азота. Возможно возникновение электростатических сил притяжения между отрицательно заряженным сахарофосфатным остовом ДНК и положительным атомом азота. Кроме положительного атома азота, алкалоиды имеют структуру плоских ароматических колец, которые, по всей видимости, могут интеркалировать в двойную спираль ДНК, изменяя структуру последней, в отличие от односпиральных РНК, поскольку не обнаружено прямого взаимодействия между РНК и компонентами экстракта чистотела [7]. Отсутствие подобного взаимодействия иллюстрирует спектр поглощения экстракта чистотела в присутствии РНК в кюветах сравнения и определения. На спектрах поглощения экстракта чистотела большого не обнаружено смещения спектральных полос, что указывало бы на взаимодействие с РНК.
Заключение . Можно предположить, что препараты чистотела большого подавляют синтез плазмидных ДНК, и их использование может быть перспективным для подавления антибиотикорези-стентности клинических штаммов микроорганизмов.
Список литературы Взаимодействие экстракта чистотела большого с плазмидной ДНК, выделенной из клинического штамма Esherichia coli
- Шагинян, И.А. Роль и место молекулярно-генетических методов в эпидемиологическом анализе внутрибольничных инфекций/И.А.Шагинян//Клиническая микробиология и антимикробная терапия.-2002.-Т. 2.-№3.-С.-82-95.
- Birnboim, H.C. A rapid alkaline extraction procedure for screening recombinant DNA/H.C.Birnboim, S.Doli//Nucleic Acids Res.-1999.-V. 7.-P. 1513-1523.
- Козлов, Р.С. Нозокомиальные инфекции: эпидемиология, патогенез, профилактика, контроль/Р.С. Козлов//Клиническая антимикробная терапия. -2000. -№1. -С.16-32.
- Бузук, Г.Н. Изменчивость качественного и количественного состава алкалоидов чистотела большого в течение вегетации/Г.Н.Бузук, М.Я.Ловкова, А.А.Булатов//Химико-фармацевтический журнал.-1990.-Т.4.-№ 5.-С.50-53.
- Новые подходы к стандартизации травы чистоте-ла большого/С.В.Первушкин, А.А.Сохина, В.А.Куркин, Г.Г.Запесочная//Фармация.-1999.-Т.48.-№2. -С.26-27.
- 6. Фомичева, Е.А. Изучение компонентного состава фла- воноидов и фенолкарбоновых кислот в гомеопатических настойках чистотела хроматографическими методами // Е.А.Фомичева, З.П.Костенникова // Фармация.- 2001. - Т.49.- №3. - С.17-19.
- Рожнова, С.Ш. Значение плазмид в эволюции возбудителей и эпидемического процесса/С.Ш.Рожнова, Л.А.Кафтырева//Эпидемиология и инфекционные болезни.-2000. -№ 5. -С. 25-27.


