Взаимодействие низкометилированных пектинов с концентратом белков молочной сыворотки
Автор: Тешаев Хуршед Икромович, Усманова Сура Рахматджоновна, Шамсара Омид, Мухидинов Зайниддин Камарович
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Биотехнология, бионанотехнология и технология сахаристых продуктов
Статья в выпуске: 1 (51), 2012 года.
Бесплатный доступ
Методом потенциометрического титрования растворимых комплексов, продемонстрирован процесс образования комплекса между концентратом белков молочной сыворотки и НМ-пектином: показано, что образованию комплекса соответствует изгиб на кривых титрования, рНс; рНс не завесит от соотношения биополимеров; ионная сила уменьшает рНс и способствует образованию стабильных комплексов; при рН>рI лактоглобулина взаимодействие происходит за счет отрицательного заряда сегментов цепи НМ-пектина и положительных зарядов локальных очажков молекул протеина
Комплексообразования, нм-пектин, концентрат белков молочной сыворотки, потенциометрическое титрование
Короткий адрес: https://sciup.org/14039780
IDR: 14039780 | УДК: 543.554.2:547.962.4
Текст научной статьи Взаимодействие низкометилированных пектинов с концентратом белков молочной сыворотки
Белки и полисахариды играют ключевую роль в формировании структуры и стабилизации пищевой системы. В пищевых продуктах белки используются в качестве эмульгаторов, а полисахариды – в качестве стабилизаторов. Смеси обоих полимеров могут быть обнаружены в ингредиентах пищевых коллоидов широкого спектра, начиная с майонеза и заканчивая мороженным. По данным Диккен-сона [1], устойчивость и текстура пищевых коллоидов, содержащих смеси биополимеров, зависят не только от функциональных свойств индивидуальных ингредиентов, но и от природы и силы взаимодействия протеин - полисахарид.
Вопросам комплексообразования в системе протеин-полисахарид посвящены многочисленные исследования [1-9]. Комплексы протеин - полисахарид могут быть растворимыми или коацерватами (явление, приводящее
Мухидинов З.К., 2012
к агрегированному разделению фаз из-за термодинамической несовместимости биополимеров, когда они несут одинаковый заряд). На природу этих комплексов влияют как энтропийные (структура и молекулярный вес), так и энтальпийные (соотношение биополимеров, природа и плотность заряда на них) факторы. Количественная оценка параметров связывания в данной системе чрезвычайно сложна, так как оба полимера имеют гетерогенную структуру. Поэтому данные по количественной оценке связывания протеин - полисахарид в литературе незначительны [9]. Указанные комплексы, или коацерваты, широко применяются в пищевой промышленности и биотехнологии, в частности как заменители жира [3], при выделении и концентрировании белков [5,8] и инкапсулировании лекарств [6]. Пектин представляет собой полимерную цепь, состоящую из звеньев галактуроновой кислоты, pK о которой колеблется от 2,9 до 3,3 [10].
В данной работе исследуется процесс образования комплексов низкометилированно-го пектина и концентрата белков молочной сыворотки (КБМС) c помощью метода потенциометрического титрования. КБМС был получен из творожной сыворотки методом ультрафильтрации [12]. Состав и степень чистоты КБМС анализировали на капиллярном электрофорезе (Agilent HPCE G1600AX), с использованием компьютерн ой программы Agilent ChemStation Software B.02.01 SR2. Для разделения лактоглобулинов молочной сыворотки (МС) применяли кварцевый капилляр (uSIL-WAX) размером 95см х 50 мкм с эффективной длиной 70,0 cм. В качестве контроля использовали стандартные белки фирмы Sigma ( β -лактоглобулин B 18,0 kDa, альбумин 66,0 kDa и α -лактоальбумин 14,0 kDa). Растворы белков готовили в 5 мМ фосфатном буфере при рН = 2,9 с добавлением 1 М мочевины. Все растворы перед введением в капилляр фильтровались через мембранный фильтр с размерами пор 0,45 мкм. В качестве ведущего электролита использовали 10 mM фосфатный буфер с pH = 2,9. Количественный состав КБМС, полученный данным методом, представлял: 37,35 % β-Lg A; 52,9 % β-Lg B; и 9,7 % α-Lg.
Найденные значения рК o основных и концевых карбоксильных и имидазольных групп гистидинового остатка стандартного образца β -лактоглобулина (β-Lg) представлены в предыдущей работе [13] и хорошо согласуются с известными данными [14].
С помощью потенциометрического титрования можно наблюдать за процессом комплексообразования путем титрования кис- лотных и основных групп протеина. Предполагается, что отрицательно заряженный НМ-пектин взаимодействует с β-Lg посредством карбоксильных, амино-, имидазольных- и гуаниновых групп в пептидной цепи белка. Для понимания механизма процесса комплексообразования двух полиэлектролитов в растворе необходимо создать модель полиионов в растворе [15]. Если достаточное количество нейтрального электролита, как хлорид натрия, добавить в раствор полиэлектролита, структура полииона будет окружена цилиндрической ионной сферой, и полимерная цепь приобретет более или менее спиральную конформацию.
С целью изучения взаимодействия сывороточного белка молока с пектином мы использовали КБМС и НМ-пектин из подсолнечника (НМПП 2М 85-2, ГК 68,8; СЭ 45,2; Mw 142,4) при двух значениях pH 3,75 и 5,6 в растворе ацетатного буф ера. Соответствующее количество раствора НМ-пектина (0,607 мг/мл) было добавлено к 5 мл раствора КБМС, содержащего 0,35 мг/мл белка, при температуре 24 оС для получения весового соотношения протеин/пектин 1:1, 2:1, 4:1 и 6:1. Титрование проводили на рН-метре 827 pH lab. Metrohom, электроды калибровались с помощью стандартных буферных растворов (Metrahom pH 4,00; 7,00; и 9,00). В кислом растворе pH (3,75), в системе протеин/пектин наблюдалось разделение фаз. Растворимая и нерастворимая фазы были разделены центрифугированием при 4500 g в течение 30 мин. Обе фазы были исследованы на содержание свободных фракций протеина и пектина, а также степень набухания нерастворимого комплекса . Полученные результаты приведены в таблице
Таблица
Содержание фракций протеина и пектина в растворимых и нерастворимых комплексах , степень набухания нерастворимого комплекса
|
Соотношение КБМС: пектин, моль/моль |
Нерастворимая фаза |
Растворимая фаза |
||||
|
Выход, % |
Фракция протеина, % |
Фракция пектина, % |
Степень набухания, S 0 |
Фракция протеина, % |
Фракция пектина, % |
|
|
0.43 |
18,9 |
3,30 |
97,33 |
7.0 |
86,70 |
2,67 |
|
0.86 |
36,9 |
9,92 |
95,04 |
3.0 |
90,08 |
4,96 |
|
1.73 |
23,1 |
18,05 |
83,26 |
3.0 |
81,95 |
16,74 |
|
2.60 |
21,4 |
24,84 |
78,53 |
4.0 |
75,16 |
21,47 |
Из таблицы следует, что с ув еличением мольной доли протеина выход н ерастворимого комплекса проходит через максимум. Максимальный выход комплекса обнаружен при соотношении КБМС/пектин 0,86. При низком соотношении КБМС/пектин комплексы имеют высокую степень набухания, в то время как с увеличением содержания протеина в комплексе степень их набухания уменьшается, при дальнейшем увеличении содержания белка состав комплекса не изменяется. Если в нерастворимой части комплекса преобладают пек- тиновые макромолекулы (78-97 %), то растворимая фракция содержит от 75 до 90 % протеина. Поскольку рК0 ПП находится ниже этой точки, то диссоциация карбоксильных групп подавляется положительно заряженными группами белков, что приводит к агрегативному разделению пектина.
Процесс формирования нерастворимого комплекса КБМС с различными пектинами нами изучался методом турбидиметрического титрования как описано в работе [16]. Поэтому в данной работе мы приводим только результаты исследования растворимой части комплексов путем титрования кислых и основных групп протеина растворами щёлочи или кисло- ты. Полученные супернатанты после осаждения нерастворимой части титровались 0,1 ʜ NaOH (рис. 1).
Как видно из рис. 1, при равном соотношении КБМС/НМПП количество титруемых групп уменьшается, и с увеличением доли белков кривые вновь смещаются в сторону увеличения и приближаются к кривым КБМС. Авторами [11] было показано, что pH растворимого комплекса соответствует начальной точке перегиба кривых титрования и обозначен как рНс. Дальнейшее увеличение количества титранта (т.е. рН смеси) приводит к фазовому разделению в системе.
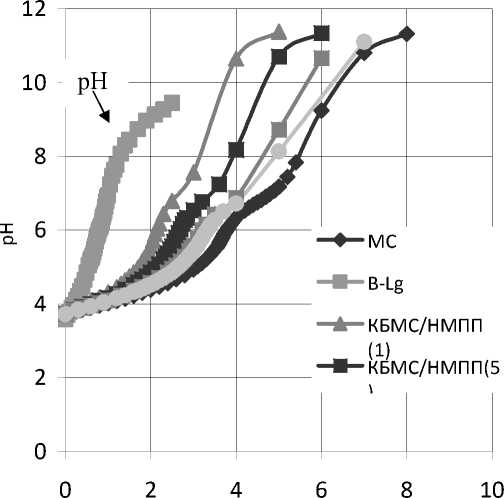
V(NaOH), мл
Рис. 1. Кривые потенциометрического титрования карбоксильных групп протеинов МС, β-Lg и комплекса КБМС с пектином
При увеличении соотношения КБМС/HMПП pHc соответствовал значению 5,3±0,1, а количество титранта, требующегося для нейтрализации свободных карбоксильных групп полученных комплексов, при этом возросло от 1,85 до 2,9 мл.
При pH 5,6 pH >PI (изоэлектрической точки) лактоглобулинов было изучено ком -плексообразование КБМС с НМПП в водном растворе и в растворе, содержащем NaCl. В дальнейшем проводили потенциометрическое и кондуктометрическое титрование рас- творимой фракции, используя раствор NaOH для кислотных и HCl – для основных групп.
В результате в пределах исследованных экспериментальных условий не обнаружено фазового разделения как при pH 3,75. При смешивании двух полимеров образовывалась либо опаловая однофазовая система, либо чистая жидкая фаза с небольшим количеством осадка, зависящего от общей концентрации биополимера и их соотношения (рис. 2).
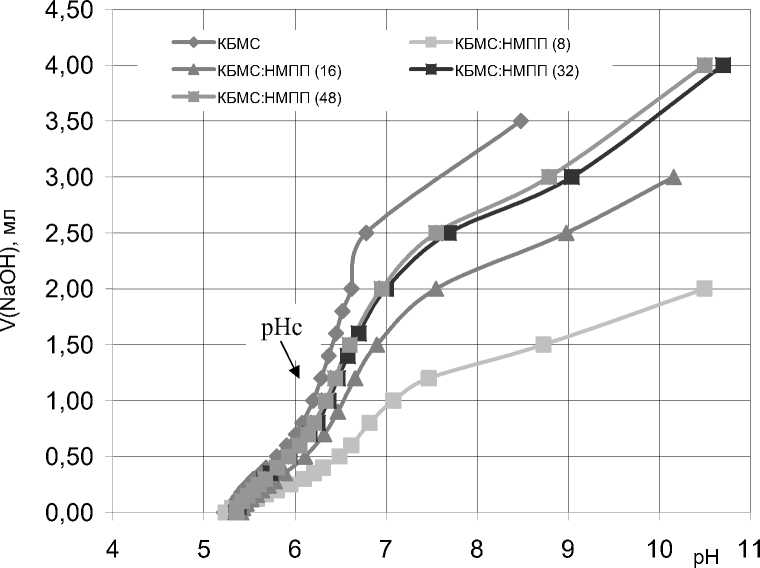
Рис. 2. Кривые титрования КБМС и КБМС/НМПП комплекса с 0,1N NaOH без добавления электролита при I = 0,01 M, pHc = 6,28
Из рис. 2 видно, что рНс, независимо от соотношения биополимеров, находится в области рН 6,28. Такая закономерность в образовании была обнаружена в работе [17] при изучении процесса компексообразования в системе чистого β-Lg с HM- и ВМ-пектинами. При pH 6,5 некоторые свободные карбоксильные группы пектина и протеина могут быть ионизированы или образовывать комплекс, на нейтрализацию которого требуется больше титранта, чем при pH 3,5. Данный факт свидетельствует о том, что пектин и протеин в первом случае существуют в свободной форме (раствор супернатанта), а во втором случае они формируют комплекс. На нейтрализацию комплекса с низким соотношением биополимеров расходуется меньше титранта, чем с большим. Известно [18,19], что комплексообразование между протеином и пектином происходит в 2 стадии: вначале образуется внутримолекулярный комплекс, где на молекулу пектина приходится до 8 молекул протеина, и его размер сопоставим с размером молекулы пектина. На второй стадии образуется межмолекулярный комплекс (интерполиэлектролит-ный), через агрегацию первого.
При титровании основных (имидазольных) групп КБМС/НМПП раствором 0,1 M HCl компл екс не образовывался, так как точка перегиба на кривых титрования (рис. 3) отсутствовала. Поэтому для обнаружения рНс предварительно рН раств оров в смеси биополимеров установливали до значения 7,5 рaс-твором NaOH, затем смесь титровали раствором HCl до значения 4,5, близкого к значению рКа пектина.
В качестве примера приведены кривые титрования аминогрупп (рис. 4) для образцов β-Lg, КБМС и их комплексов с НМПП. Как видно, рНс на кривых потенциометрического титрования комплекса чистого β-Lg с НМПП отличается от рНс кривых титрования КБМС с пектином.
3,00
2,50
2,00 с;
1,50 О
1,00
0,50
0,00
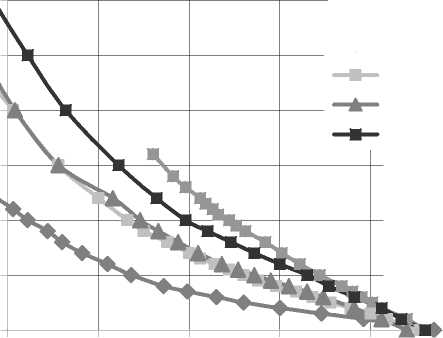
КБМС
КБМС:НМПП
КБМС:НМПП КБМС:НМПП КБМС:НМПП
4 4,5 5 5,5 6 6,5 pH 7
Рис. 3. Кривые титрования
основных (имидазольных) групп КБМС/НМПП комплексов с 0,1M HCl.
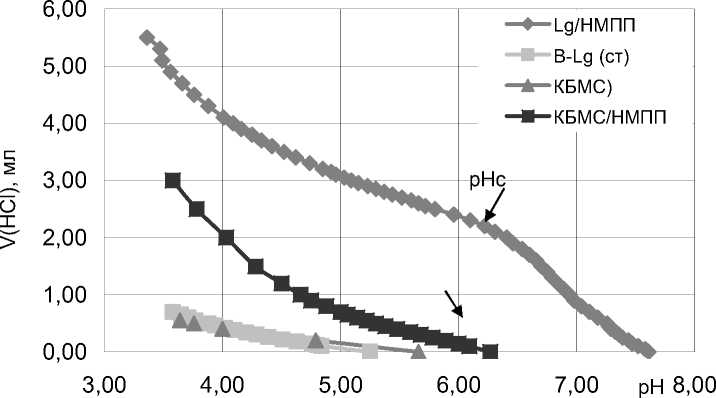
Рис. 4. Кривые титрования основных групп β-Lg, КБМС и комплекса КБМС/НМПП (32) с 0,1M HCl
Данные рис. 4 указывают на то, что комплексообразование ΗΜΠΠ c β-Lg и КБМС отличается и происходит при различных pHc, хотя кривые титрования исходных образцов одинаковые. Такое отличие в профилях кривых может быть из-за вовлечения альбумина и лактоальбумина (α-La) в комплекс при использовании КБМС.
Для того чтобы оценить роль электростатического взаимодействия и водородных связей на pHc, было изучено влияние низкомолекулярного электролита на процесс ком- плексообразования путем добавления 100 mM хлорида натрия к водн ому раствору биополимера. Кривые титрования основных групп комплекса КБМС/НМПП (32) с 0,1M HCl, без добавления хлорида натрия (I = 0,07) и с добавлением (I = 0,17) представлены на рис. 5.
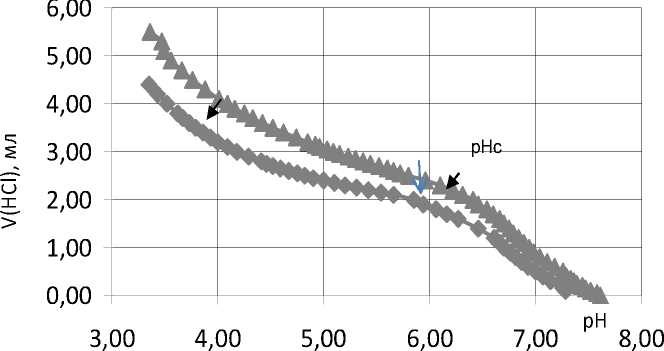
Рис. 5. Кривые титрования основных групп комплекса КБМС/НМПП (32) с 0,1M HCl при I = 0,07 (тре угольники); I = 0,17 (квадраты)
Ионная природа хлорида натрия экранирует электростатическое взаимодействие между биополимерами. Добавление электролита ослабляет удержание H+ ионов комплексом, рНс уменьшается, и это означает, что ио- протеином и пектином. Это также подтверждается изменением кажущейся pKa аминокислотных остатков протеина (рис.6) в присутствии хлорида натрия (рК0 8,72) и в отсутствие (рК0 8,44) с высвобождением молекул
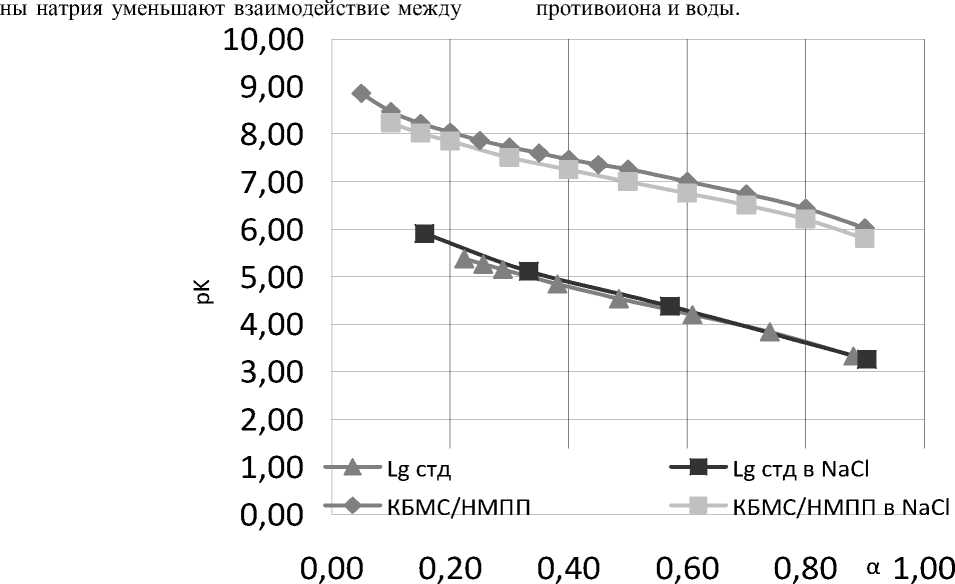
Рис. 6. Зависимость рКа от степени ионизации основных групп в комплексе КБМС/НМПП (32) с 0,1 M HCl при I = 0,07 (треугольники); I = 0,17 (квадраты)
Поэтому комплексообразование β-Lg c LMP при pH = 6,5 может быть обнаружено методом потенциометрии, но не турбидимет-рически. Поскольку суммарный заряд β-Lg отрицательный при рН > р I, связывание β-Lg с НМПП при pH > 5,6 соответствует комплек- сообразованию “на неправильной стороне” pI. Такое явление, т.е. когда оба биополимера отрицательно заряжены, было обнаружено между полисахаридами и белками в ряде других исследований [4, 8, 9, 11, 17].
Электростатистическое взаимодействие приводит к потере гибкости и подвижности полимерной цепы, но при этом реакция протекает за счет выигрыша энтальпии и энтропии, вызванной суммарным отрицательным зарядом биополимеров, при которой создаются стабильные комплексы. В то же время с уменьшением рНс до рΗφ при рΗ 3,5 также образуются растворимые комплексы.
Таким образом, с использованием метода потенциометрического титрования растворимых комплексов продемонстрирован процесс образования комплекса между концентратом белков молочной сыворотки и ΗΜ-пектином: показано, что при рΗ > рI лактоглобулина взаимодействие происходит за счет отрицательного заряда сегментов цепи ΗΜ-пектина и положительных зарядов локальных очажков молекул протеина. Образованию компл екса соответствует изгиб на кривых титрования (рΗс), который не зависит от соотношения биополимеров, а при увеличении ионной силы происходит сдвиг рΗс, что способствует образованию стабильных комплексов


