Взаимодействие пентафенилсурьмы с n-(4-метоксифенил)фталамовой кислотой
Автор: Шарутин В.В., Шарутина О.К., Зубарева В.В., Чернышова А.В., Доценко В.В.
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Химия элементоорганических соединений
Статья в выпуске: 3 т.16, 2024 года.
Бесплатный доступ
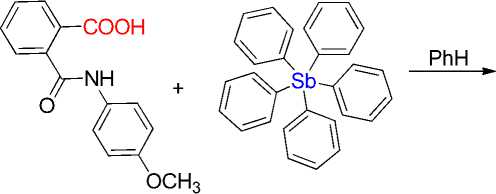
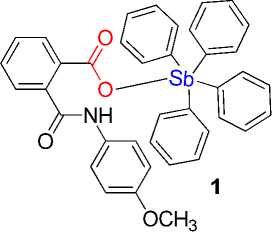
Пентафенилсурьма взаимодействует с N-(4-метоксифенил)фталамовой кислотой в бензоле при комнатной температуре с образованием бесцветных кристаллов сольвата Ph4SbOC(O)C6H4[2-C(O)NHC6H4(OMe-4)]∙1½ PhH (1а, б), строение которого установлено методом рентгеноструктурного анализа (РСА). По данным РСА, атомы сурьмы в двух кристаллографически независимых молекулах 1а, б имеют координацию искаженной тригональной бипирамиды с тремя фенильными заместителями в экваториальной плоскости, аксиальные углы CSbO составляют 173,7(2)° и 179,0(2)°, суммы углов между экваториальными связями равны 357,6(3)° и 357,1(2)°. Экваториальные связи Sb-C (2,103(7)-2,123(7) Å 1а, 2,106(6)-2,114(6) Å 1б) короче аксиальной (2,184(7) Å 1а и 2,155(6) Å 1б). Длины связей Sb-O (2,235(4) Å 1а и 2,257(4) Å 1б) превосходят сумму ковалентных радиусов атомов сурьмы и кислорода. Молекулы сольватного бензола разупорядочены. Данные РСА: (1) (дифрактометр D8 Quest фирмы Bruker (MoKα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 293(2)К [C78H64N2O8Sb2, M = 1400,81; моноклинная сингония, пр. гр. C2/c; размер кристалла 0,34 ´ 0,13 ´ 0,13 мм; параметры ячейки: a = 40,68(2) Å, b = 10,492(5) Å, c = 36,395(17) Å; β = 100,30(2)°, V = 15283(13) Å3, Z = 8; r(выч.) = 1,218 г/см3; m = 0,758 мм-1; F(000) = 5696,0; обл. сбора по 2q: 5,68-54,3°; -48 ≤ h ≤ 52, -13 ≤ k ≤ 13, -46 ≤ l ≤ 46; всего отражений 203363; независимых отражений 16863 (Rint = 0,1223); GOOF = 1,0; R-фактор 0,0524]. Для соединения 1 и исходной N-(4-метоксифенил)фталамовой кислоты проведен предикторный анализ на соответствие критериям биодоступности. Найдено, что исходная фталамовая кислота может рассматриваться как молекула-кандидат для дальнейшего скрининга, тогда как комплексное соединение 1 не обладает приемлемыми физико-химическими параметрами для рассмотрения в качестве потенциально биоактивной молекулы.
Пентафенилсурьма, n-(4-метоксифенил)фталамовая кислота, карбоксилат тетрафенилсурьмы, молекулярная структура, рентгеноструктурный анализ, предикторный анализ
Короткий адрес: https://sciup.org/147244655
IDR: 147244655 | УДК: 546.865 | DOI: 10.14529/chem240303
Текст научной статьи Взаимодействие пентафенилсурьмы с n-(4-метоксифенил)фталамовой кислотой
Известно, что эффективным способом получения соединений сурьмы Ar4SbX является метод, основанный на реакции деарилирования пентаарилсурьмы кислотами HX [1 - 18]. Например, при взаимодействии пентаарилсурьмы с карбоновой кислотой единственным продуктом является карбоксилат тетраарилсурьмы, выделяемый из реакционной смеси с выходом до 98 % [1]. Карбоксилаты тетраарилсурьмы привлекают внимание из-за своей биологической активности [19 - 21]. С теоретической точки зрения, интерес вызывает строение, поскольку известны три типа координации карбоксилатного лиганда на атом сурьмы: монодентатный, когда лиганд образует только одну связь Sb - O, анизобидентатный - в случае внутримолекулярной координации карбонильного атома кислорода при условии, что расстояние Sb···O существенно меньше суммы ван-дер-ваальсовых радиусов атомов, и бидентатный - с практически двумя равными расстояниями Sb - O [22]. Установлено, что способ координации зависит от заместителей, как в органическом радикале кислоты, так и в арильном лиганде при атоме сурьмы. Сообщалось о реакциях полифункциональных карбоновых кислот, таких как 2-[(6-аминопиримидин-4(3 Н )-он-2-ил)сульфанил]уксусная, 2-[(6-гидрокси-5-нитрозопиримидин-4(3 Н )-он-2-ил)сульфанил]уксусная кислоты, в результате которых имело место образование карбоксилатов тетраарилсурьмы с высококоординированным атомом металла [23, 24].
В продолжение исследований взаимодействия пентафенилсурьмы с карбоновыми кислотами, содержащими несколько координационных центров, нами в качестве исходного реагента в реакции деарилирования пентафенилсурьмы была выбрана N -(4-метоксифенил)фталамовая кислота. В литературе описаны некоторые комплексные соединениия на основе фталамовых кислот [25], однако среди производных сурьмы продукты комплексообразования известны только с солями Sb(III) [26].
Экспериментальная часть
Исходная N -(4-метоксифенил)фталамовая кислота (4-MeOPhtCO 2 H) получена реакцией фталевого ангидрида с 4-метоксианилином в инертном растворителе по известной методике [27].
Синтез сольвата N -(4-метоксифенил)фталамата тетрафенилсурьмы с бензолом (1).
Смесь 0,17 г (0,34 ммоль) пентафенилсурьмы и 0,090 г (0,34 ммоль) N-(4-метоксифенил)фталамовой кислоты в 5 мл бензола нагревали в запаянной ампуле 1 ч, охлаждали до комнатной температуры. Ампулу вскрывали, раствор концентрировали. Образовались бесцветные кристаллы 1, выход 86 %, т. пл. 102 °С. Для Ph4SbOC(O)C6H4[2-C(O)NHC6H4(OMe-4)]·1½PhH (1) найдено (%): C 68,65; Н 4,90. Для C87H73N2O8Sb2 рассчитано (%): С 68,77; Н 4,81.
ИК-спектр (ν, см–1): 3250, 3061, 2833, 1662, 1618, 1592, 1511, 1434, 1359, 1346, 1239, 1175, 1149, 1065, 1037, 997, 824, 730, 690, 519, 469, 447.
ИК-спектры соединения 1 записывали на ИК-спектрометре Shimadzu IRAffinity-1S в таблетках KBr в области 4000–400 см–1.
РСА кристалла 1 проведен на дифрактометре D8 Quest фирмы Bruker (MoKα-излучение, λ = 0,71073 Å, графитовый монохроматор) при 296(2) К. Сбор, редактирование данных и уточнение параметров элементарной ячейки, а также учет поглощения проведены по программам SMART и SAINT-Plus [28]. Все расчеты по определению и уточнению структуры выполнены по программам SHELXL/PC [29] и OLEX2 [30]. Структура определена прямым методом и уточнена методом наименьших квадратов в анизотропном приближении для неводородных атомов. Положение атомов водорода уточняли по модели наездника (Uизо(H) = 1,2Uэкв(C)). Полные таблицы координат атомов, длин связей и валентных углов депонированы в Кембриджском банке структурных данных (№ 2331049; ; . Основные кристаллографические данные и результаты уточнения структуры 1 приведены в табл. 1, длины связей и валентные углы – в табл. 2.
Таблица 1
Кристаллографические данные, параметры эксперимента и уточнения структуры 1
|
Параметр |
1 |
|
Стехиометрическая формула |
C 87 H 73 N 2 O 8 Sb 2 |
|
М |
1517,99 |
|
Сингония |
Моноклинная |
|
Пространственная группа |
С 2/ с |
|
a , Å |
40,68(2), |
|
b , Å |
10,492(5), |
|
c, Å |
36,395(17) |
|
β, град. |
100,30(2) |
|
V , Å3 |
15283(13) |
|
Z |
8 |
|
ρ выч , г/см3 |
1,218 |
|
µ , мм–1 |
0,758 |
|
F (000) |
5696,0 |
|
Размер кристалла, мм |
0,34 × 0,13 × 0,13 |
|
Диапазон сбора данных по 2 θ , град. |
5,68–54,3 |
|
Диапазон индексов |
–48 ≤ h ≤ 52, –13 ≤ k ≤ 13, –46 ≤ l ≤ 46 |
|
Число измеренных рефлексов |
203363 |
|
Чисто независимых рефлексов |
16863 |
|
R int |
0,1223 |
|
GOOF |
1,075 |
|
Число параметров |
813 |
|
R -факторы по I > 2 σ ( I ) |
R 1 = 0,0688, wR 2 = 0,1793 |
|
R -факторы по всем рефлексам |
R 1 = 0,1397, wR 2 = 0,2136 |
|
Остаточная электронная плотность (max/min), e /A3 |
1,31/–0,57 |
Таблица 2
Длины связей и валентные углы в структуре 1
|
Связь |
d , Å |
Угол |
ω, град. |
|
Sb1–O1 |
2,235(4) |
C11‒Sb1‒C31 |
114,3(3) |
|
Sb1–C11 |
2,103(7) |
C11‒Sb1‒C21 |
126,0(3) |
|
Sb1–C31 |
2,123(7) |
C1‒Sb1‒O1 |
173,7(2) |
|
Sb1–C1 |
2,184(7) |
C21‒Sb1‒C31 |
117,3(3) |
|
Sb1–C21 |
2,113(7) |
C31‒Sb1‒O1 |
81,4(2) |
|
Sb2–O5 |
2,257(4) |
C21‒Sb1‒C1 |
96,3(3) |
Окончание табл. 2
|
Связь |
d , Å |
Угол |
ω, град. |
|
Sb2–C71 |
2,106(6) |
C71‒Sb2‒C51 |
112,7(2) |
|
Sb2–C51 |
2,114(6) |
C71‒Sb2‒C61 |
125,8(2) |
|
Sb2–C61 |
2,111(6) |
C61‒Sb2‒C51 |
118,6(3) |
|
Sb2–C41 |
2,155(6) |
C41‒Sb2‒O5 |
179,0(2) |
|
O1‒C117 |
1,286(7) |
C117‒O1‒Sb1 |
123,9(4) |
|
N1‒C118 |
1,341(7) |
C118‒N1‒C121 |
126,4(5) |
|
N1‒C121 |
1,427(8) |
C97‒O5‒Sb2 |
120,1(4) |
|
O3–C118 |
1,224(7) |
C98‒N2‒C101 |
127,9(5) |
|
O2–C117 |
1,229(7) |
O2‒C117‒C111 |
121,5(5) |
|
O5–C97 |
1,288(7) |
N1‒C118‒C112 |
115,7(5) |
|
O6–C98 |
2,227(7) |
O3‒C118‒N1 |
124,4(6) |
|
O7–C98 |
1,215(8) |
O3‒C118‒C112 |
119,4(6) |
|
N2–C98 |
1,345(8) |
C122‒C121‒N1 |
117,4(6) |
|
N2–C98 |
1,345(8) |
O4‒C124‒C125 |
115,1(7) |
Обсуждение результатов
Известно, что N -(4-метоксифенил)фталамовая кислота имеет в своем составе несколько потенциальных координирующих центров, которыми являются атомы с неподеленными элктрон-ными парами (атомы кислорода и азота), способными вступать в дополнительные взаимодействия с атомом металла. Нами установлено, что реакция указанной кислоты с пентафенилсурьмой приводит к образованию с выходом 86 % N -(4-метоксифенил)фталамата тетрафенилсурьмы, кристаллизующегося из смеси бензол – октан (1:2 объемн.) в виде сольвата Ph 4 SbOC(O)C 6 H 4 [2-C(O)NHC 6 H 4 (OMe-4)]·1½PhH ( 1 ). Кристаллы 1 хорошо растворимы в аренах, хлороформе, четыреххлористом углероде и нерастворимы в алканах.
В ИК-спектре комплекса 1 присутствует характерная полоса поглощения средней интенсивности при 3061 см-1, отвечающая валентным колебаниям связей CAr–H, и полоса валентных колебаний углеродного скелета ароматических фрагментов в области 1590 см–1 [31]. Интенсивная полоса поглощения при 1662 см–1, соответствующая валентным колебаниям связи С=O, смещена в низковолновую область, по сравнению с аналогичной полосой в ИК-спектре N -(4-метоксифенил)фталамовой кислоты (1706 см-1). Колебания связей Sb - C характеризуются полосой при 447 см - 1.
Из данных РСА следует, что в ячейке присутствуют две кристаллогрфически независимых молекулы а и б, геометрические параметры которых различаются. Атомы Sb(1) и Sb(2) имеют координацию искаженной тригональной бипирамиды с фенильными заместителями в экваториальной плоскости и атомом кислорода карбоксильного лиганда в аксиальном положении (см. рисунок). Об искажении координации свидетельствуют значения валентных углов при атоме сурьмы, которые отклоняются от теоретических. Так, аксиальные углы C(1)Sb(1)O(1) и C(41)Sb(2)O(5) равны 173,7(2) и 179,0(2)°. Суммы углов CSb(1)C и CSb(2)С в экваториальных плоскостях составляют 357,6(3) и 357,1(2)°. Атомы Sb(1) и Sb(2) выходят из соответствующих экваториальных плоскостей в сторону аксиального атома углерода на 0,189 и 0,205 Å, что сопровождается увеличением углов Сакс.SbCэкв. по сравнению с 90° (93,0(3)°, 96,1(2)°, 96,3(3)° при ато- ме Sb(1); 93,7(3)°, 95,8(2)°, 97,5(3)° при атоме Sb(2)) и уменьшением углов ОSbCэкв по сравнению с этим значением (81,4(2)°, 83,9(2)°, 88,7(2)°; 81,5(2)°, 84,5(2)°, 86,9(2)° в молекулах а, б соответственно).
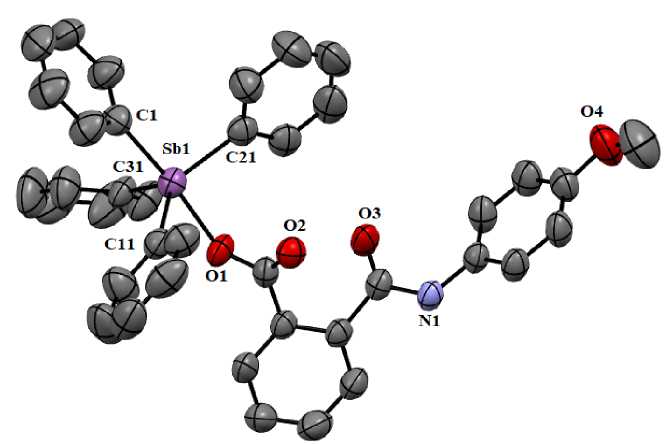
Общий вид одной из двух молекул комплекса 1
(атомы водорода и молекулы сольватного бензола не показаны)
В молекулах 1 а , б имеет место удлинение аксиальных связей Sb - C (2,184(7); 2,155(6) А) по сравнению с экваториальными (2,103(7) - 2,123(7) А; 2,106(6) - 2,114(6) А), что характерно для соединений типа Ar4SbX с пентакоординированным атомом металла. Связи Sb(1) - O(1) и Sb(2) - O(5) равны 2,235(4) и 2,257(4) А. Карбоксилатный лиганд проявляет анизобидентатный характер связывания, поскольку расстояния между центральным атомом и карбонильным атомом кислорода (Sb(1)∙∙∙O(2) 3,337(3) Å, Sb(2)∙∙∙O(6) 3,259(3) Å) значительно короче суммы ван-дер-ваальсовых радиусов указанных атомов (3,58 Å [32]).
Расстояния С - О в карбоксильных группах (1,287(7) и 1,229(7) А в 1 а и 1,288(7) и 1,227(7) А в 1 б ) свидетельствуют об отсутствии перераспределения электронной плотности, при этом значение длины связи С=О практически совпадает с таковой в карбонильной группе (1,224(7) Å в 1 а и 1, 215(8) А в 1 б ). Валентные углы в карбоксильных группах ОСО равны 124,0(6) ° и 125,0(5) ° в 1 а и 1 б соответственно.
В остатке кислоты (молекула а ) угол между плоскостями бензольных колец [С(111) - С(116)] и [С(121) - С(166)] составляет 78,09 ° , плоскость карбоксильной группы [О(1)С(117)О(2)] образует с плоскостью [С(111) - С(116)] угол 49,73 ° , торсионный угол H(1)N(1)C(118)O(3) равен - 178,4 ° (аналогичные параметры для молекулы б : 72,97 ° , 47,87 ° , 173,3 ° ).
Молекулы а и б образуют димеры посредством водородных связей N(1) - H(1)-^O(6) (расстояния H(1)-O(6) 2,15 А, N(1)-O(6) 2,928(4) А) и N(2) - H(2)-O(2) (расстояния H(2)-O(2) 2,05 А, N(2)^-O(2) 2,905(4) А), которые за счет слабых взаимодействий С - Н-^ п -типа формируют трехмерную структуру.
Отметим, что атомы кислорода метокси- и амидо-групп не участвуют в образовании внутри-и межмолекулярных связей.
Координационные соединения и, в частности, координационные соединения сурьмы(V) представляют определенный интерес с позиции исследования биологического действия [33]. В связи с этим нами был проведен расчет in silico ряда параметров ADMET и соответствия критериям пероральной биодоступности для соединения 1 и исходной N -(4-метоксифенил)фталамовой кислоты 4-MeOPhtCO2H. Анализ комплекса 1 и исходной N -(4-метоксифенил)фталамовой кислоты 4-MeOPhtCO2H на соответствие «правилу пяти» Липински (молекулярная масса (MW) ≤ 500, сlogP ≤ 5,0 ; TPSA ≤ 140 Å2, число Н-акцепторов ≤ 10,
Н-доноров ≤ 5) [34 - 36] произведен с использованием программного пакета OSIRIS Property Explorer [37]. Были рассчитаны следующие параметры: сlogP (логарифм коэффициента распределения между н -октанолом и водой log(С octanol /С water ), растворимость (logS), площадь топологической полярной поверхности (Topological Polar Surface Area, TPSA), ряд токсикологических характеристик – рисков побочных эффектов (мутагенные, онкогенные, репродуктивные эффекты), параметр сходства с известными лекарственными препаратами (drug-likeness), а также общая оценка фармакологического потенциала (drug score). Полученные расчетные данные представлены в табл. 3. Как следует из приведенных в табл. 3 данных, комплексное соединение 1 не обладает привлекательными с позиций биоскрининга физико-химическими параметрами, и соответствует критериям Липински только по параметру TPSA. Для соединения прогнозируется чрезмерная липофильность (сlogP >> 5,0), высокие риски токсических эффектов в сочетании с низкой растворимостью в воде (менее 1·10 - 6 моль/л), что по итогу реализуется в низких оценках drug-likeness и drug score. Напротив, исходный лиганд, N -(4-метоксифенил)фталамовая кислота, прогнозируемо обнаруживает более привлекательный профиль потенциальной биологической активности, и в целом соответствует критериям Липински, что указывает на перспективность дальнейшего скрининга в ряду фталамовых кислот. За счет формального соответствия критериям биодоступности и прогнозируемой низкой токсичности оценка drug score достаточна высока и составляет 0,45.
Таблица 3
Риски токсичности и физико-химические параметры соединения 1 и 4-MeOPhtCO 2 H, спрогнозированные с помощью программного сервиса OSIRIS Property Explorer
|
Соединение |
Риск токсичности* |
Физико-химические параметры |
||||||||
|
А |
В |
С |
D |
с log P |
log S |
MW |
TPSA |
Drug likeness |
Drug Score |
|
|
1 |
+ |
± |
± |
± |
7,83 |
- 6,44 |
699 |
64,6 |
- 7,57 |
0,03 |
|
4-MeOPhtCO 2 H |
– |
– |
– |
– |
2,22 |
- 3,16 |
271 |
75,6 |
- 3,42 |
0,45 |
*Знаком (–) обозначено прогнозируемое отсутствие токсичности, (±) – умеренный риск эффекта, (+) высокий риск токсического эффекта. A – мутагенность, B – канцерогенность, С – раздражающее действие, D – репродуктивные эффекты.
Выводы
Установлено, что N -(4-метоксифенил)фталамовая кислота дефенилирует пентафенилсурьму в бензоле с образованием N -(4-метоксифенил)фталамата тетрафенилсурьмы (86 %), кристаллизующегося из смеси бензол – октан в виде сольвата Ph 4 SbOC(O)C 6 H 4 [2-C(O)NHC 6 H 4 (OMe-4)]·1½PhH ( 1 ). В молекулах 1 атом сурьмы имеет координацию искаженной тригональной бипирамиды, карбоксильная группа проявляет анизобидентатные свойства, координируясь на центральный атом крайне асимметрично (отношения длин связей Sb - О и Sb ⋅⋅⋅ О равны 1,5 и 1,44 в двух типах кристаллографически независимых молекул). В кристалле имеют место межмолекулярные водородные связи N - H∙∙∙O, формируемые имино-группой и карбонильным кислородом карбоксильной группы. Атомы кислорода метокси- и амидо-групп не участвует в образовании внутри- и межмолекулярных связей. Расчет in silico соответствия критериям пероральной биодоступности для соединения 1 указывает на отсутствие перспектив для исследования данного комплексного соединения как потенциально биоактивной молекулы с приемлемыми параметрами биодоступности, тогда как исходная N -(4-метоксифенил)фталамовая кислота представляет интерес как потенциальный кандидат для скрининга.
Список литературы Взаимодействие пентафенилсурьмы с n-(4-метоксифенил)фталамовой кислотой
- Кочешков К.А., Сколдинов А.П., Землянский Н.Н. Методы элементоорганической химии. Сурьма, висмут. М.: Наука, 1976. 483 с.
- Шарутин В.В., Поддельский А.И., Шарутина О.К. // Коорд. химия. 2020. Т. 46, № 10. С. 579. DOI: 10.31857/S0132344X20100011
- Шарутин В.В., Шарутина О.К., Пакусина А.П., Бельский В.К. // Журн. общ. химии. 1997. Т. 67, № 9. С. 1536. EDN: PFLFSA
- Шарутин В.В., Шарутина О.К., Тарасова Т.А. и др. // Журн. общ. химии. 1999. Т. 69, № 12. С. 1979.
- Шарутин В.В., Шарутина О.К., Платонова Т.П. и др. // Журн. общ. химии. 2000. Т. 70, № 11. С. 1932. EDN: BAWNYU
- Шарутин В.В., Шарутина О.К., Молокова О.В. и др. // Коорд. химия. 2002. Т. 28, № 8. С. 581. EDN: QEXAWC
- Шарутин В.В., Шарутина О.К., Молокова О.В. и др. // Журн. общ. химии. 2001. Т. 71, № 8. С. 1317.
- Шарутин В.В., Шарутина О.К., Осипов П.Е. и др. // Журн. общ. химии. 2000. Т. 70, № 6. С. 931.
- Сопшина Д.М. // Вестник ЮУрГУ. Сер. «Химия». 2022. Т. 14, № 1. С. 50. DOI: 10.14529/chem220106.
- Ефремов А.Н., Шарутин В.В. // Вестник ЮУрГУ. Сер. «Химия». 2021. Т. 13, № 1. С. 47. DOI: 10.14529/chem210105
- Шарутина О.К. // Вестник ЮУрГУ. Сер. «Химия». 2021. Т. 13, № 4. С. 63. DOI: 10.14529/chem210404
- Сенчурин В.С., Орленко Е.Д. // Вестник ЮУрГУ. Сер. «Химия». 2019. Т. 11, № 2. С. 66. DOI: 10.14529/chem190207
- Шарутин В.В., Шарутина О.К., Бондарь Е.А. и др. // Коорд. химия. 2002. Т. 28, № 5. С. 356. EDN: EOICYB
- Шарутин В.В., Шарутина О.К., Ефремов А.Н., Андреев П.В. // Журн. неорг. химии. 2017. Т. 62, № 10. С. 1330. DOI: 10.7868/S0044457X17100075
- Шарутин В.В., Шарутина О.К. // Журн. неорган. химии. 2017. Т. 62, № 7. С. 925. DOI: 10.7868/S0044457X17070224
- Шарутин В.В., Шарутина О.К., Сенчурин В.С., Сомов Н.В. // Журн. неорган. химии. 2016. Т. 61, № 8. С. 1017. DOI: 10.7868/S0044457X16080146
- Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Журн. структ. химии. 2020. Т. 61, № 9. С. 1490. DOI: 10.26902/JSC_id60682
- Шарутин В.В., Шарутина О.К., Ефремов А.Н. // Журн. неорган. химии. 2020. Т. 65, № 1. С. 49. DOI: 10.31857/S0044457X20010158
- Шарутин В.В., Шарутина О.К., Ефремов А.Н., Артемьева Е.В. // Журн. неорган. химии. 2020. Т. 65, № 4. С. 482. DOI: 10.31857/S0044457X20040170
- Artem’eva E.V., Duffin R.N., Munuganti S. et al. // J. Inorg. Biochem. 2022. V. 234. P. 111864. DOI: 10.1016/j.jinorgbio.2022.111864
- Artem'eva E.V., Efremov A.N., Sharutina O.K. et al. // Polyhedron. 2022. V. 213. P. 115627. DOI: 10.1016/j.poly.2021.115627
- Cambridge Crystallografic Datebase. Release 2023. Cambridge.
- Губанова Ю.О., Шарутин В.В., Шарутина О.К. и др. // Журн. общ. химии. 2020. Т. 90, № 9. С. 1407. DOI: 10.31857/S0044460X20090127
- Губанова Ю.О., Шарутина О.К., Ким Д.Г. и др. // Вестник ЮУрГУ. Серия «Химия». 2019. Т. 11. № 4. С. 49. DOI: 10.14529/chem190406
- Чернышова А.В., Николаев А.А., Колоколов Ф.А., Доценко В.В., Аксенов Н.А., Аксенова И.В. // Журн. общ. химии. 2021. Т. 91, № 6. С. 950. DOI: 10.31857/S0044460X21060123
- Chourasiа S., Chauhan H.P.S. // Ind. J. Chem. 1996. V. 35A. Р. 903. Avail. URL: https://nopr.niscpr.res.in/bitstream/123456789/41458/1/IJCA%2035A%2810%29%20903-905.pdf
- Perry C.J., Parveen Z. // J. Chem. Soc. Perkin Trans. 2. 2001. P. 512. DOI: 10.1039/B008399M
- Bruker. SMART and SAINT-Plus. Versions 5.0. Data Collection and processing software for the SMART system. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Bruker. SHELXTL/PC. Versions 5.10. An integrated system for solving, refining and displaying crystal structures from diffraction data. Bruker AXS Inc., Madison, Wisconsin, USA, 1998.
- Dolomanov O.V., Bourhis L.J., Gildea R.J. et al. // J. Appl. Cryst. 2009. V. 42. P. 339. DOI: 10.1107/S0021889808042726
- Тарасевич Б.Н. ИК-спектры основных классов органических соединений. М.: МГУ, 2012. 54 с.
- Mantina M., Chamberlin A.C., Valero R. et al. // J. Phys. Chem. A. 2009. V. 113, Nо. 19. P. 5806. DOI: 10.1021/jp8111556
- Frezard F., Demicheli C., Kato K.C., Reis P.G., Lizarazo-Jaimes E.H. // Rev. Inorg. Chem. 2013. V. 33, Nо. 1. Р. 1. DOI: 10.1515/revic-2012-0006
- Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. // Adv. Drug. Delivery Rev. 1997. V. 23, Nо. 1–3. P. 4. DOI: 10.1016/S0169-409X(96)00423-1
- Lipinski C.A. // Drug Discov. Today: Technologies. 2004. V. 1, Nо. 4. P. 337. DOI: 10.1016/j.ddtec.2004.11.007
- Lipinski C.A., Lombardo F., Dominy B.W., Feeney P.J. // Adv. Drug. Delivery Rev. 2012. V. 64. Suppl. P. 4. DOI: 10.1016/j.addr.2012.09.019
- Sander T. OSIRIS Property Explorer. Available URL: http://www.organicchemistry.org/prog/peo/. Idorsia Pharmaceuticals Ltd, Switzerland.


