Взаимосвязь гиперэкспрессии соматостатиновых рецепторов 2-го типа в инфарцированном миокарде и сывороточных биомаркеров воспаления в раннем постинфарктном периоде
Автор: Ильюшенкова Ю.Н., Трусов А.А., Кравченко Е.С., Рябов В.В., Сазонова С.И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.40, 2025 года.
Бесплатный доступ
Введение. На сегодняшний день радионуклидная визуализация соматостатиновых рецепторов 2-го типа (SSTR-2) имеет большие перспективы в качестве нового маркера сердечно-сосудистого воспаления. Однако до сих пор остается неизвестным, является ли локальное воспаление, а также высокое содержание макрофагов в зоне инфаркта, экспрессирующих на своей мембране SSTR-2, положительным или отрицательным фактором для заживления миокарда. Цель: оценка взаимосвязи биомаркеров воспаления как показателей системного ответа на ишемическое повреждение и локального воспалительного ответа в миокарде, измеренного с помощью SSTR-2-направленной визуализации в раннем постинфарктном периоде. Материал и методы. В исследование вошли 23 пациента с острым первичным инфарктом миокарда передней стенки и подъемом сегмента ST (STEMI). В 1-е сут (до проведения чрескожного вмешательства (ЧКВ)) и на 5-е сут после острого инфаркта миокарда (ОИМ) у всех пациентов проводился забор венозной крови для определения уровня высокочувствительного С-реактивного белка (вч-СРБ) и интерлейкина-6 (ИЛ-6). На 5–6-е сут после развития острого коронарного события всем пациентам была выполнена однофотонная эмиссионная компьютерная томография (ОФЭКТ) / компьютерная томография (КТ) с 99mTc-Тектротидом, а на 7-е сут после развития острого коронарного синдрома (ОКС) – перфузионная сцинтграфия миокарда с 99mTc-Технетрилом в покое. Результаты. Согласно результатам исследования, вч-СРБ и ИЛ-6, измеренные в 1-е и 5-е сут, имели отрицательную корреляционную взаимосвязь с фракцией выброса (ФВ) левого желудочка (ЛЖ) и положительную корреляционную взаимосвязь с суммарным баллом дефекта перфузии (SRS). При этом показатель SUVmax не был статистически значимо взаимосвязан с уровнями вч-СРБ и ИЛ-6. В то же время SUVmax умеренно коррелировал с SRS (r = 0,517; р = 0,011). В моделях однофакторной линейной регрессии SUVmax не влиял на уровни вч-СРБ и ИЛ-6. В то же время SRS в покое оказывал статистически значимое воздействие на изменение уровней биомаркеров воспаления. Также стоит отметить, что корреляционная взаимосвязь между SUVmax и SRS отсутствовала. Заключение. Было показано, что интенсивность аккумуляции аналога соматостатина 99mTc-Тектротид в миокарде ЛЖ в раннем постинфарктном периоде не ассоциирована с уровнями биомаркеров воспаления. Полученные нами данные, с одной стороны, указывают на активацию клеточных и биохимических путей воспалительной каскада, с другой стороны, свидетельствуют о возможной противовоспалительной роли гиперэкспрессии соматостатиновых рецепторов 2-го типа.
ОФЭКТ / КТ, SUVmax, соматостатиновые рецепторы 2-го типа, постинфарктное воспаление, 99mTc-Тектротид, интерлейкин-6, высокочувствительный С-реактивный белок
Короткий адрес: https://sciup.org/149150139
IDR: 149150139 | УДК: 616.127-005.8-00 | DOI: 10.29001/2073-8552-2025-2707
Текст научной статьи Взаимосвязь гиперэкспрессии соматостатиновых рецепторов 2-го типа в инфарцированном миокарде и сывороточных биомаркеров воспаления в раннем постинфарктном периоде
Инфаркт миокарда (ИМ) является одной из главных причин смертности и заболеваемости в мире, что обусловливает необходимость глубокого изучения механизмов, способствующих его патогенезу и разработке новых методов терапии [1]. В последние десятилетия внимание исследователей привлекает не только механизмы, непосредственно приводящие к некрозу сердечной мышцы, но и комплексные системные реакции на ишемию и реперфузию [2]. Ключевым компонентом этих реакций яв- ляется воспалительный процесс, который включает как локальные, так и системные воспалительные ответы. Локальное воспаление, развивающееся в области повреждения миокарда, играет важную роль в процессе репарации, однако его взаимодействие с системным иммунным ответом может существенно влиять на прогноз и исход заболевания [3].
Накопленные данные свидетельствуют о том, что рецепторы соматостатина второго типа (SSTR-2) играют важную роль в патофизиологии постинфарктного состояния миокарда, в частности, в модуляции воспалительных
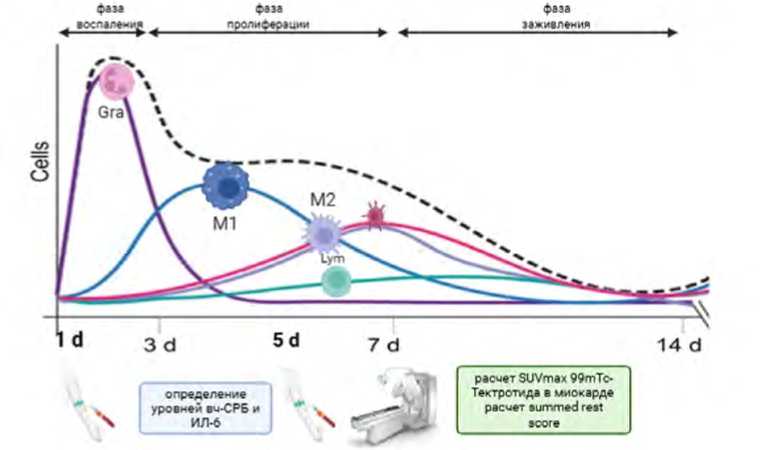
Рис. 1. Клинический дизайн исследования, совмещенный с таймлайном течения воспалительной, пролиферативной и репарационной фаз в постинфарктном периоде (адаптировано Thackeray J., 2018) 1
Примечание: Gra - гранулоциты, M1 – макрофаги с провоспалительной поляризацией, M2 – макрофаги с противовоспалительной поляризацией, Lym – лимфоциты, STEMI – инфаркт миокарда с подъемом сегмента ST, вч-СРБ – высокочувствительный С-реактивный белок , ИЛ-6 – интерлейкин-6.
Fig. 1. The clinical study design with the timeline of the inflammatory, proliferative and repair phases in the post-infarction period (adapted from Thackeray J., 2018)
Note: Granulocytes (Gr), macrophages with proinflammatory polarization (M1), macrophages with anti-inflammatory polarization (M2), lymphocytes (Lym), ST-segment elevation myocardial infarction (STEMI), high-sensitivity C-reactive protein (hsCRP), interleukin-6 (IL-6).
процессов и апоптозе кардиомиоцитов [4]. В экспериментальных исследованиях было показано, что в условиях ИМ происходит изменение экспрессии SSTR-2, что может быть связано с процессами репарации и ремоделирования миокарда. В то же время предполагается, что SSTR-2 избыточно экспрессируется CD68-позитивными макрофагами, активное привлечение которых наблюдается в первые 3 сут от начала острого повреждения миокарда [5].
На сегодняшний день SSTR-2-направленная визуализация имеет большие перспективы в качестве нового маркера сердечно-сосудистого воспаления. Данный подход потенциально позволяет не только локализовать очаги повреждения, но и оценить активность воспалительных реакций, что критически важно для прогнозирования неблагоприятных событий и выбора тактики лечения. В нескольких исследованиях была показана возможность использования радионуклидных индикаторов, тропных к SSTR-2 для визуализации зоны инфаркта [5, 6].
Однако до сих пор остается неизвестным, является ли локальное воспаление, а также высокое содержание макрофагов в зоне инфаркта, экспрессирующих на своей мембране SSTR-2, положительным или отрицательным фактором для заживления миокарда. Кроме того, сами механизмы взаимодействия соматостатина и SSTR-2 при ИМ до сих пор недостаточно изучены.
Цель исследования: оценка взаимосвязи биомаркеров воспаления как показателей системного ответа на ишемическое повреждение и локального воспалительного ответа в миокарде, измеренного с помощью SSTR-2-направленной визуализации в раннем постинфарктном периоде.
Материал и методы
В исследование вошли 23 пациента (медиана возраста 57 лет [50–61]) с острым первичным ИМ передней стенки и подъемом сегмента ST (STEMI).
Критерии включения в исследование:
-
1. Возраст пациентов старше 18 лет с первичным передним острым инфарктом миокарда (ОИМ) и подъемом сегмента ST.
-
2. Наличие добровольного информированного согласия пациента на исследование.
Критерии исключения из исследования:
-
1. Повторный ИМ.
-
2. Отсутствие подъема сегмента ST.
-
3. Миокардит, инфекционный эндокардит, воспалительная кардиомиопатия.
-
4. Предшествующая терапия аналогами соматостатина.
-
5. Выраженная почечная недостаточность.
-
6. Отказ пациента от участия в исследовании.
Всем пациентам при поступлении в стационар было выполнено лабораторно-инструментальное обследование, предусмотренное клиническими рекомендациями МЗ РФ «Острый инфаркт миокарда с подъемом сегмента ST электрокардиограммы» (2022), чрескожное вмешательство (ЧКВ) со стентированием передней нисходящей коронарной артерии (с предшествующим тромболизисом или без него), а также консервативное лечение в соответствии с рекомендациями.
-
Ди зайн исследования представлен на рисунке 1.
1 Адаптировано из: Thackeray J.T., Bengel F.M. Molecular imaging of myocardial inflammation with positron emission tomography postischemia: a determinant of subsequent remodeling or recovery. JACC Cardiovasc. Imaging. 2018;11(9):1340–1355. jcmg.2018.05.026
Оценка системного воспалительного ответа
В 1-е сут (до проведения ЧКВ) и на 5-е сут после ОИМ у всех пациентов проводился забор венозной крови для определения уровня высокочувствительного С-реактив-ного белка (вч-СРБ) и интерлейкина-6 (ИЛ-6) методом твердофазного иммуноферментного анализа с использованием наборов реактивов ЗАО «Вектор-Бест» (Россия) в соответствии с инструкцией фирмы-производителя.
Оценка локального воспалительного ответа
ОФЭКТ / КТ с 99mTc-Тектротидом
На 5–6-е сут после развития острого коронарного события всем пациентам была выполнена однофотонная эмиссионная компьютерная томография (ОФЭКТ) / КТ с 99mTc-Тектротидом (99mTc-HYNIC-[D-Phe1, Tyr3-oktreotide]; IAE POLATOM).
Гибридное исследование сердца, а также расчет максимального значения стандартизированного показателя накопления (Maximum Standardized Uptake Value – SUVmax) 99mTc-Тектротида осуществлялись на ОФЭКТ / КТ томографе GE Discovery NM/CT 850 (США), оснащенном низкоэнергетическими коллиматорами высокого разрешения и высокой чувствительности. Запись сцинтиграфических изображений в томографическом режиме проводилась через 3 ч после внутривенной инъекции 550 МБк 99mTc-Тектротида в 64 проекции в матрицу 128 × 128 пикселя, размер пикселя 1,72 мм, зум 1, время записи 1 проекции – 15 с. По окончании записи ОФЭКТ, не меняя положения тела пациента и высоты томографического стола, выполнялась КТ грудной клетки в режиме коррекции аттенюации со следующими характеристиками сканирования: режим спиральный, напряжение трубки – 140 кВ, сила тока – 30 мА, толщина среза 1,25 мм. Непосредственно перед инъекцией 99mTc-Тектротида и после нее проводилось измерение активности шприца в радиометре с фиксированием времени измерения.
Оценка и интерпретация изображений гибридного исследования, определение локализации аккумуляции радиофармпрепарата (РФП) выполнялись с использованием программного приложения Volumetrix MI рабочей станции Advantage Workstation 4.6 (GE Healthcare). Сегментация аккумулированного РФП в миокарде и количественная оценка осуществлялись на заключительном этапе обработки изображений перед просмотром. Для расчета SUVmax использовались следующие параметры: рост и вес пациента, активность РФП в шприце до введения и после введения, время измерения шприцев, время инъекции, период полураспада 99mTc, чувствительность камеры (160 cnt/min/µCi), единица измерения радиоактивности (mCi). Все необходимые данные вводились в таблицу. Затем с помощью инструмента «кисть» осуществлялась сегментация аккумулированного РФП, контролируя точность в аксиальной, сагиттальной и фронтальной проекциях, а также на КТ-изображениях сердца. По окончании сегментации приложение Volumetrix MI автоматически рассчитывало значение SUVmax.
Перфузионная сцинтиграфия миокарда
Для оценки локализации, размера и глубины дефекта перфузии на 7-е сут после развития острого коронарного синдрома (ОКС) всем пациентам была выполнена перфузионная сцинтиграфия миокарда с 99mTc-Технетрилом в покое. Полуколичественная оценка дефекта перфузии выражалась как суммарный балл дефекта перфузии (summed rest score – SRS).
Статистическая обработка данных
Статистическую обработку полученных данных проводили с помощью пакета Jamovi 2.6.44. Количественные показатели представлены медианой (Me) и межквартильным диапазоном [Q1–Q3]; категориальные признаки абсолютными (n) и относительными (в %) частотами. Статистическую значимость различий между двумя зависимыми выборками оценивали по критерию Уилкоксона. Для определения силы и направления связи между количественными показателями использовали коэффициент корреляции Спирмена (r). Были построены прогностические модели однофакторной линейной регрессии, характеризующие влияние изучаемых показателей на изменение SUVmax. Критический уровень значимости при проверке статистических гипотез составлял 0,05.
Результаты
Клиническая характеристика пациентов, включенных в исследование, представлена в таблице 1.
Данные эхокардиографии, выполненной в В-режиме в течение 1-х сут от начала ОИМ, подтверждали переднюю локализацию ИМ и снижение глобальной сократимости левого желудочка (ЛЖ). У 6 пациентов фракция выброса (ФВ) ЛЖ сохранялась в пределах нормальных значений. Увеличение объемных показателей ЛЖ (конечно-систолического объема (КСО) и конечно-диастолического объема (КДО)) наблюдалось только у 11 обследованных. У всех пациентов отмечались зоны нарушения локальной сократимости ЛЖ различной степени выраженности в области зоны инфаркта. Острая аневризма ЛЖ была зафиксирована у 3 пациентов.
Оценка воспалительного статуса
Медианные значения уровней маркеров воспаления ИЛ-6, вч-СРБ в 1-е и 5-е сут после развития ОИМ представлены в таблице 2. Высокий уровень вч-СРБ наблюдался у всех пациентов, включенных в исследование. Однако на 5-е сут снижение вч-СРБ отмечалось только у 5 пациентов. Уровень ИЛ-6 более 7 пг/мл наблюдался только у 10 пациентов с последующим снижением к 5-м сут более чем в 2 раза.
Результаты перфузионной сцинтиграфии миокарда в покое
По результатам перфузионной сцинтиграфии миокарда 99mTc-Технетрилом в покое нормальное распределение РФП в миокарде ЛЖ отмечалось у 4 пациентов из 23. У 19 пациентов визуализировались дефекты перфузии в области верхушки, передней стенки, передне-перегородочной области различной степени выраженности. Медиана суммарного балла дефекта перфузии в покое (summed rest score – SRS) составила 12 баллов [5–18,5].
Результаты количественной оценки аккумуляции 99mTc-Тектротида в миокарде
По данным ОФЭКТ / КТ 99mTc-Тектротида, выполненной на 5–6-е сут после развития ОКС, аккумуляция РФП была выявлена у 15 пациентов из 23 обследованных. Во всех случаях включение 99mTc-Тектротида в миокард носило диффузный характер, а локализация соответствовала зоне инфаркта (рис. 2). Медиана SUVmax составила 2,74 [1,46–3,02] г/мл.
Таблица 1 . Клиническая характеристика пациентов
Table 1 . Clinical characteristics of patients
|
Характеристика |
Значение |
|
Пол |
|
|
Мужчины ( n , %) |
18 (78) |
|
Женщины ( n , %) |
5 (22) |
|
Возраст, лет |
57 [50–61] |
|
Гипертония ( n , %) |
19 (82,6) |
|
НТГ ( n , %) |
8 (34,7) |
|
Диабет 2-го типа ( n , %) |
0 |
|
Дислипидемия ( n , %) |
15 (65,2) |
|
ИМТ, кг/м2 |
27,3 [25,2–29,3] |
|
Курение ( n , %) |
15 (65,2) |
|
пачка/лет |
25,5 [15,9–33,2] |
|
Общее время ишемии, мин |
220 [180–426] |
|
ФВ ЛЖ, % |
51,5 [42,7–57,7] |
|
КДО, мл |
103 [96–117] |
|
КСО, мл |
50 [42–57] |
|
КФК-МВ |
45,8 [25,5–100] |
|
Пиковый TnI |
25000 [11312–36150] |
|
Оценка коронарного кровотока TIMI: |
|
|
TIMI 0 ( n , %) |
10 (43) |
|
TIMI 1 ( n , %) |
4 (17) |
|
TIMI 2 ( n , %) |
6 (26) |
|
TIMI 3 ( n , %) |
3 (14) |
Примечание: НТГ – нарушение толерантности к глюкозе, ИМТ – индекс массы тела, TIMI (Thrombolysis In Myocardial Infarction) – шкала для оценки перфузии коронарной артерии после точки окклюзии при коронарной ангиографии.
Таблица 2 . Уровни биомаркеров воспаления у пациентов с острым инфарктом миокарда в 1-е и 5-е сутки
Table 2 . Levels of inflammatory biomarkers in patients with AMI on days 1 and 5
|
Показатель |
1-е сутки |
5-е сутки |
р |
|
вч-СРБ, мг/мл |
20,85 [9,78–35,8] |
20,17 [7,53–35,56] |
0,502 |
|
ИЛ-6, пг/мл |
9,8 [5,38–41,9] |
9,17 [2,55–15,94] |
0,003 |
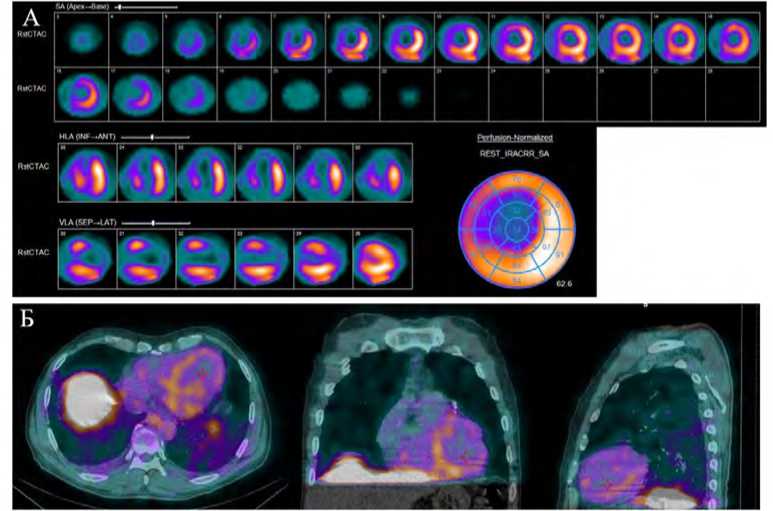
Рис. 2. А – перфузионная сцинтиграфия миокарда в покое с 99mTc-Технетрилом, выполненная на 8-е сутки после острого инфаркта миокарда (срезы по короткой оси, срезы по вертикальной оси, срезы по горизонтальной оси, полярная карта). Визуализируется зона больших размеров гипоперфузии в области верхушки, передней стенки, передне-перегородочной области. Б – ОФЭКТ / КТ с 99mTc-Тектротидом, выполненная через 3 часа после введения радиофармпрепарата на 7-е сутки после острого инфаркта миокарда (аксиальный, фронтальный и сагиттальный срезы). На совмещенных изображениях визуализируется диффузная аккумуляция радиофармпрепарата в проекции верхушки, передней стенки, перегородки
Fig. 2. A – myocardial perfusion scintigraphy at rest with 99mTc-MIBI performed 8 days after AMI (short axis slices, vertical axis slices, horizontal axis slices, polar map). A large hypoperfusion area is visualized in the apex, anterior wall, anteroposterior wall, and anterior septal area. B – SPECT / CT with 99m Tc-Tectrotyd performed 3 hours after injection on the 7th day after AMI (axial, frontal and sagittal slices). The overlapped images show diffuse accumulation in the projection of the apex, anterior wall, and septum
Взаимосвязь уровня биомаркеров воспаления с данными эхокардиографии, перфузионной сцинтиграфии миокарда и SSTR-2-направленной визуализации
Показатели вч-СРБ и ИЛ-6, измеренные в 1-е и 5-е сут после развития ОКС, имели отрицательную корреляцию с ФВ ЛЖ и положительную корреляцию с суммарным баллом дефекта перфузии SRS. При этом взаимосвязь между биомаркерами воспаления и SUVmax отсутствовала (табл. 3). Показатель SUVmax умеренно коррелировал с SRS ( r = 0,517; р = 0,011).
Для анализа непосредственной взаимосвязи между размером дефекта перфузии миокарда ЛЖ и интенсивности аккумуляции 99mTc-Тектротида с интенсивностью синтеза биомаркеров воспаления был построен ряд однофакторных регрессионных моделей. Последовательное вычисление вклада каждого исследуемого показателя в модель продемонстрировало отсутствие влияния SUVmax на уровни вч-СРБ и ИЛ-6. В то же время размер дефекта перфузии в покое был взаимосвязан с уровнями биомаркеров воспаления (табл. 4). Также стоит отметить, что статистически значимая связь между SUVmax и SRS отсутствовала ( р = 0,102).
Для анализа непосредственной взаимосвязи между размером дефекта перфузии миокарда ЛЖ и интенсивности аккумуляции 99mTc-Тектротида с интенсивностью синтеза биомаркеров воспаления был построен ряд однофакторных регрессионных моделей. Последовательное вычисление вклада каждого исследуемого показателя в модель продемонстрировало отсутствие влияния SUVmax на уровни вч-СРБ и ИЛ-6. В то же время размер дефекта перфузии в покое был взаимосвязан с уровнями биомаркеров воспаления (табл. 4). Также стоит отметить, что статистически значимая связь между SUVmax и SRS отсутствовала ( р = 0,102).
Обсуждение
В данном исследовании нами было показано, что интенсивность аккумуляции аналога соматостатина 99mTc-Тектротид в миокарде ЛЖ в раннем постинфарктном периоде не ассоциирована с уровнями биомаркеров воспаления, но взаимосвязана с суммарным баллом дефекта перфузии в покое.
Воспаление играет ключевую роль в патогенезе атеросклеротического поражения коронарных артерий и постинфарктного заживления миокарда. Ишемическое повреждение приводит к запуску широкого спектра клеточных, молекулярных и биохимических паттернов, инициирующих воспалительный ответ как локально, так и системно [3, 7], направленного на защиту миокарда и формирование рубца.
В постинфарктном воспалительном каскаде выделяют 3 фазы: воспалительную, фазу пролиферации и фазу заживления. Принято считать, что критическим этапом реконструкции тканей после ИМ является фаза пролиферации, которая существенно влияет на степень последующего ремоделирования [8]. Чрезмерность и длительность воспалительных и фиброгенных реакций являются причинами неблагоприятного ремоделирования с исходом в сердечную недостаточность. Факторы, влияющие на данную дисрегуляцию, до сих пор являются предметом дискуссии. Однако в мировой литературе закрепилось мнение о том, что макрофаги играют решающую роль в регуляции иммунной системы и оказывают существенное влияние на процесс воспалительной репарации после ОИМ, тем самым определяя степень повреждения миокарда и последующее патологическое ремоделирование [13].
До недавнего времени считалось, что основным субстратом для экспрессии соматостатиновых рецепторов 2-го типа являются провоспалительные макрофаги [5]. На этом основан один из подходов визуализации сердечно-сосудистого воспаления – радионуклидная SSTR-направленная визуализация методами позитронно-эмиссионной томографии (ПЭТ) / КТ и ОФЭКТ / КТ [5, 6, 9]. По данным мировой литературы, аккумуляция РФП, тропных к рецепторам соматостатина 2-го типа, ассоциируется с активным воспалительным процессом в раннем постинфарктном периоде [5, 6], а также связана с неблагоприятным ремоделированием миокарда [6, 11]. На сегодняшний день немногочисленные данные свидетельствуют о том, что соматостатиновые рецепторы 2-го типа активно экспрессируются не только воспалительными макрофагами (CD68/СD80/CD206), но и моноцитами, нейтрофилами, лимфоцитами, перицитами, а также фибробластами и периваскулярными адипоцитами [4, 12, 13].
В нашем исследовании была показана взаимосвязь ФВ ЛЖ и SRS с ИЛ-6 и вч-СРБ, которая сохранялась как в фазу повреждения, так и в фазу репарации. Хорошо известно, что ИЛ-6 и вч-СРБ ассоциируются с бόльшим размером инфаркта и снижением насосной функции миокарда [14]. Однако примечательным остается факт отсутствия взаимосвязи между SUVmax и биомаркерами воспаления как в фазу повреждения, так и в фазу репарации. Одной из вероятных причин этого может быть высокая вариабельность уровней различных цитокинов с неизвестной кинетикой высвобождения. N. Cristell и соавт., исследуя уровень вч-СРБ в большой выборке пациентов со STEMI, пришли к выводу, что более 40% обследованных имели уровень вч-СРБ менее 2 мг/л, и в целом в общей выборке присутствовал большой разброс значений [15]. С другой стороны, нельзя исключать наличие реципрокной взаимосвязи между цитокинами. Так, E. Ammirati и соавт. показали, что у пациентов со STEMI и низким уровнем ИЛ-6 наблюдались высокие значения противовоспалительного цитокина ИЛ-10 [16].
Еще одной предполагаемой причиной отсутствия взаимосвязи SUVmax с биомаркерами воспаления является иное назначение гиперэкспрессии SSTR-2. В ряде экспериментальных исследований было показано прямое кардиопротекторное действие соматостатина при ишемическом повреждении [4, 17]. Предполагается, что соматостатин способен оказывать как прямое дозозависимое влияние на регуляцию апоптоза, стимуляцию фиброза и ангиогенеза, так и опосредованное через SSTR-1 и SSTR-2 [4]. Высокая плотность соматостатиновых рецепторов на клетках может быть обусловлена активной наработкой пептида, однако функциональная роль этих рецепторов у человека плохо изучена. В исследовании Ch. Armani и соавт. было показано, что моноциты и макрофаги, выделенные из периферической крови человека и культивированные с агонистами соматостатиновых рецепторов, утрачивают жизнеспособность и способность к активной наработке хемокинов [18]. Также имеются сведения о том, что октреотид способен оказывать противовоспалительный эффект за счет ингибирования воспалительного каскада путем снижения уровня TНФ-α, ИЛ-6 и ИЛ-1β в различных моделях ишемии [17, 19, 20].
Таблица 3 . Результаты корреляционного анализа биомаркеров воспаления, суммарного балла дефекта перфузии левого желудочка и стандартизованного значения аккумуляции 99mTc-Тектротида
Table 3 . Results of inflammatory biomarkers, summed rest score, and SUVmax 99mTc-Tectrotyd correlation analysis
|
Корреляты |
вч-СРБ (1-е сутки) |
вч-СРБ (5-е сутки) |
ИЛ-6 (1-е сутки) |
ИЛ-6 (5-е сутки) |
|
ФВ ЛЖ |
r = -0,724 p = 0,003 |
r = -0,532 p = 0,05 |
r = -0,464 p = 0,05 |
r = -0,620 p = 0,018 |
|
SRS |
r = 0,731 p = 0,003 |
r = 0,766 p = 0,001 |
r = 0,616 p = 0,019 |
r = 0,762 p = 0,002 |
|
SUV max |
NS* |
NS* |
NS* |
NS* |
Примечание: *NS – not significant (не достоверно).
Таблица 4 . Оценка влияния биомаркеров воспаления на суммарный балл дефекта перфузии левого желудочка в покое в моделях однофакторной линейной регрессии
Table 4 . Evaluation of the influence inflammatory biomarkers on a summed rest score in single-factor linear regression models
|
Ковариаты |
Коэффициент регрессии |
R2 |
F-тест |
p |
Критерий DW* |
|
ИЛ-6, 1-е сутки |
0,163 |
0,296 |
5,05 |
0,044 |
1,45 |
|
вч-СРБ, 1-е сутки |
0,352 |
0,522 |
13,1 |
0,004 |
2,35 |
|
ИЛ-6, 5-е сутки |
0,404 |
0,445 |
9,64 |
0,009 |
1,73 |
|
вч-СРБ, 5-е сутки |
0,352 |
0,579 |
16,5 |
0,002 |
2,32 |
Примечание: *DW – автокорреляционный тест Дурбина – Уотсона.
Ограничения
Наше исследование имеет несколько ограничений. В одноцентровом проспективном когортном исследовании не исключена систематическая ошибка отбора. Кроме того, из-за малого количества пациентов мы не смогли оценить взаимосвязи между исследуемыми показателями методом нелинейного регрессионного анализа.
Заключение
Представленные данные указывают на активацию клеточных и биохимических путей воспалительного каскада. Кроме того, получены сведения о возможной противовоспалительной роли гиперэкспрессии SSTR-2.
Результаты проведенного исследования открывают новые перспективы для потенциального использования соматостатина и его аналогов в клинической практике, направленной на улучшение стратегии лечения постинфарктного состояния, а также подчеркивают необходимость дальнейших изысканий в этой области для более глубокого понимания его роли в воспалении и кардиопротекции.


