Взаимосвязь гистоморфологических характеристик стенки аневризмы восходящего отдела аорты с ее биомеханическими свойствами
Автор: Саушкин В. В., Варламова Ю. В., Платонов А. С., Панфилов Д. С., Степанов И. В., Козлов Б. Н., Сазонова С. И.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.39, 2024 года.
Бесплатный доступ
Введение. Аневризма грудной аорты (АГА) занимает 17-е место среди всех причин смерти. За последнее десятилетие частота заболеваемости увеличилась в несколько раз и встречается примерно у 10 из 100 тыс. человек в год. Поиск причин, приводящих к развитию данной патологии, является актуальной задачей. Длительно существующее повышенное напряжение на стенку аорты приводит к значительным изменениям на тканевом и клеточном уровнях.
Аневризма грудной аорты, механическая прочность, деформация, гистология, коллаген, эластин, фиброз
Короткий адрес: https://sciup.org/149146305
IDR: 149146305 | УДК: 616.132.13-007.64-091.8:616-018.23 | DOI: 10.29001/2073-8552-2022-676
Текст научной статьи Взаимосвязь гистоморфологических характеристик стенки аневризмы восходящего отдела аорты с ее биомеханическими свойствами
УДК 616.132.13-007.64-091.8:616-018.23
Саушкин В.В., Варламова Ю.В., Платонов А.С., Панфилов Д.С., Степанов И.В., Козлов Б.Н., Сазонова С.И. Взаимосвязь гистоморфологических характеристик стенки аневризмы восходящего отдела аорты с ее биомеханическими свойствами. Сибирский журнал клинической и экспериментальной медицины. 2024;39(3):96–104. https://doi. org/10.29001/2073-8552-2022-676.
Аневризма грудной аорты (АГА) – это состояние, при котором один или несколько сегментов грудной аорты расширяются из-за дегенерации медиального слоя сосудистой стенки, делая последнюю менее прочной и наиболее уязвимой к повышенной нагрузке, что может приводить к возникновению ассоциированных с заболеванием жизнеугрожающих осложнений, таких как диссекция и разрыв [1]. По данным Национального центра по профилактике и контролю заболеваний, АГА занимает 17-е место среди всех причин смерти [2].
Частота встречаемости этой патологии за последние десятилетия достигла примерно 10 случаев на 100 тыс. населения в год [3]. Около 22% людей с острым аортальным синдромом умирают дома, не успев получить медицинскую помощь, а внутрибольничная летальность при своевременной госпитализации составляет 34% [4].
На сегодняшний день хирургическая коррекция АГА является единственным способом профилактики острого аортального синдрома. Вопрос о консервативной терапии, основанной на коррекции патогенетического процесса, лежащего в основе развития данного заболевания, по-прежнему остается актуальным и требует дальнейшего изучения. Это связано с тем, что патогенез развития АГА разнообразен и недостаточно ясен. Предполагают, что в образовании АГА участвуют несколько процессов, включая воспаление, кистозно-медиастинальный некроз, деградацию внеклеточного матрикса и ремоделирование аорты, которые до сих пор являются предметом многочисленных исследований [5]. Считается, что нарушение взаимодействия между клетками и матриксом делает сосуд более уязвимым к повышенной гемодинамической нагрузке, а разрыв АГА обусловлен сложными биологическими реакциями, которые запускаются в ответ на локальный механический стресс [6].
В то же время взаимосвязь между локальными механическими свойствами дилатированной сосудистой стенки и ее изменениями на тканевом, клеточном и молекулярном уровнях плохо изучена. Выявление таких корреляций может способствовать более полному пониманию патогенеза заболевания, улучшению стратификации риска пациентов с АГА, определению новых терапевтических мишеней для коррекции ремоделирования матрикса.
Цель исследования: было выявление ассоциаций между биомеханическими свойствами сосудистой стенки и гистопатологическими данными у больных с аневризмой восходящего отдела аорты.
Материал и методы
В исследование были включены 30 пациентов с аневризмой восходящего отдела аорты (16 мужчин и 14 женщин, медиана возраста – 59 лет [29; 74], максимальный диастолический диаметр восходящего отдела сосуда, по данным компьютерно-томографической ангиографии (КТ-ангиография), – 50,8 [34; 67,6] мм), находившихся на обследовании и лечении в НИИ кардиологии Томского НИМЦ с октября 2021 по ноябрь 2022 гг.
Критерии включения: возраст 45–70 лет; максимальный диаметр восходящей аорты, согласно данным КТ-ангиографии, ≥ 45 мм; несиндромные заболевания аорты (идиопатические, семейные); согласие пациента на участие в исследовании.
Критерии исключения: перенесенный инфаркт миокарда; перенесенный инсульт; нарушения ритма сердца; предшествующие операции на сердце и / или аорте; врожденные пороки сердца; синдромные заболевания аорты (синдромы Тернера, Марфана, Элерса – Данло, Лойеса – Дитца, другие генетические аномалии); аллергия на йодсодержащие лекарственные средства; отказ пациента от участия в исследовании.
Клиническая характеристика пациентов представлена в таблице 1.
Таблица 1. Клиническая характеристика пациентов ( n = 30)
Table 1. Clinical characteristics of the study group ( n = 30)
|
Характеристики |
Значение |
|
Возраст, лет, Ме [ Q 1; Q 3] |
59 [29; 74] |
|
Мужчины, n (%) |
16 (53,3) |
|
Сахарный диабет, n (%) |
2 (6,7) |
|
Гипертоническая болезнь, n (%) |
19 (63,3) |
|
Хроническая сердечная недостаточность, ФК по NYHA (I, II, III), n (%) |
10 (33,3) |
|
Дислипидемия, n (%) |
10 (33,3) |
|
Двустворчатый аортальный клапан, n (%) |
8 (26,7) |
|
Диаметр восходящей аорты, по данным КТ-ангиографии, мм, Me [ Q 1; Q 1] |
50,8 [34; 67,6] |
|
ФВ ЛЖ, %, Me [ Q 1; Q 1] |
65 [29; 76] |
|
КДО ЛЖ, мл, Me [ Q 1; Q 1] |
108 [12; 310] |
|
КСО ЛЖ, мл, Me [ Q 1; Q 1] |
36 [19; 149] |
Примечание: ФК – функциональный класс, ФВ – фракция выброса, ЛЖ – левый желудочек, КДО – конечный диастолический объем, КСО – конечный систолический объем, КТ – компьютерная томография.
Исследование было одобрено локальным этическим комитетом НИИ кардиологии Томского НИМЦ (протокол № 213 от 12.05.2021 г.) и проведено в соответствии с этическими нормами, изложенными в Хельсинкской декларации с пересмотром 2008 г. У всех пациентов было получено письменное информированное согласие на участие в исследовании.
Подготовка образцов стенки восходящей аорты
Всем пациентам выполняли плановое протезирование восходящего отдела аорты. В операционной сразу после резекции аневризмы иссеченный фрагмент аорты (рис. 1) погружали в раствор Кребса – Хензеляйта и передавали в патоморфологическую лабораторию, где производили вырезку с отбором фрагментов для: а – гистологического исследования (их сразу же фиксировали в 10% забуфе-ренном растворе формалина); б – для последующего эксперимента с оценкой механоэластических свойств аорты (в растворе Кребса – Хензеляйта); в – для криобанкиро-вания (в холодильник на –80 0С). Гистологический анализ проводили стандартным методом, используя автомат для гистологической проводки Thermo Scientific Excelsior AS (Thermo Fisher Scientific, Чарльстон, Южная Каролина, США). Фрагменты аорты заливали в парафин с помощью модульной станции заливки Tissue-Tek® TEC™6 (Sakura, Япония).
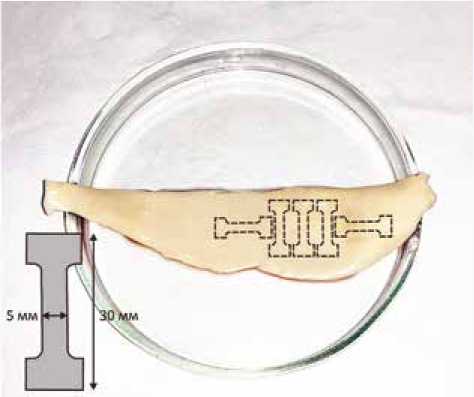
10 мм
Рис. 1. Подготовка образцов к одноостным механометрическим испытаниям на разрыв. На изображении представлен фрагмент восходящей аорты, иссеченный во время операции и разрезанный по малой кривизне. Пунктирными линиями схематически обозначены области, из которых вырезали продольные и циркулярные образцы. Размеры штампа приведены на схеме в нижнем левом углу изображения Fig. 1. Preparation of ascending aorta samples for uniaxial tensile test. The image shows a fragment of the ascending aorta cut along the inner curvature. The areas from which longitudinal and circular samples were cut off are shown by the dotted lines. The size of the stamp is shown in the diagram at the bottom left of the figure
Оценка механической прочности аорты
Биомеханическое испытание образцов восходящей аорты проводили следующим образом. Интраоперационный фрагмент восходящей аорты разрезали по малой кривизне. Затем с помощью штампа выделяли 3 продольных и 2 поперечных (циркулярных) образца восходящей аорты. При этом поперечные образцы располагали на середине рабочей области продольных образцов.
На испытательной машине (Instron 3343) каждый образец закрепляли атравматическими хирургическими сосудистыми зажимами за ушки образцов аорты (рис. 2) и растягивали до разрыва. Скорость движения траверсы для всех образцов была одинаковая и составила 1 мм/мин. Параметры тестирования представлены в таблице 2.
Таблица 2. Параметры механического тестирования образцов аорты
Table 2. Testing parameters
Параметры
Диапазон измерений
Точность определения, %
Напряжение, Н
0–50
± 0,5
Скорость перемещения траверсы, мм/мин
0,005–500
± 0,2
15–1000 0–1000
0,05
Линейное изменение размеров, мм:
растяжение сокращение
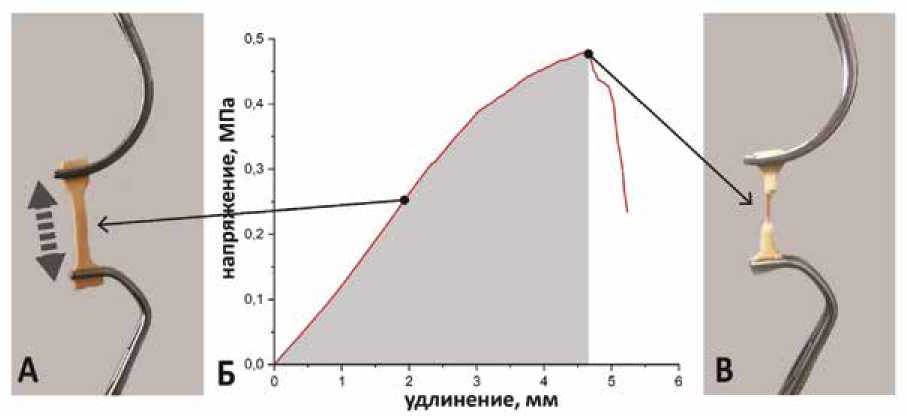
Рис. 2. Процесс растяжения образца аортальной стенки до разрыва. А – образец ткани восходящей аорты, зафиксированный атравматическими зажимами во время растяжения. Б – кривая «напряжение – удлинение». В – образец ткани восходящей аорты после разрыва
Fig. 2. The process of stretching a sample. А – ascending aorta sample of the fixed with atraumatic clamps during stretching. Б – loading diagram for aorta sample. В – ascending aorta sample after rupture
Результаты испытания были представлены в виде графиков «напряжение-удлинение». Графики отражают изменение длины (мм) образцов ткани восходящей аорты в зависимости от примененного к ним напряжения растяжения (МПа), создаваемого электромеханической разрывной машиной Instron 3343 (Instron, США). Для каждого образца определяли предел прочности при растяжении (σв, MPa) как максимальное значение кривой по оси
Y (рис. 3), относительное удлинение (ε, мм/мм%) – как процентное изменение длины образца по оси X от начала растяжения до разрыва. Площадь под кривой «напряжение – удлинение» (S) рассчитывали с помощью программы Origin (v 9.8, Origin Lab) (см. рис. 3).
Среднеарифметические значения показателей прочности аорты рассчитывали для продольных и циркулярных образцов.
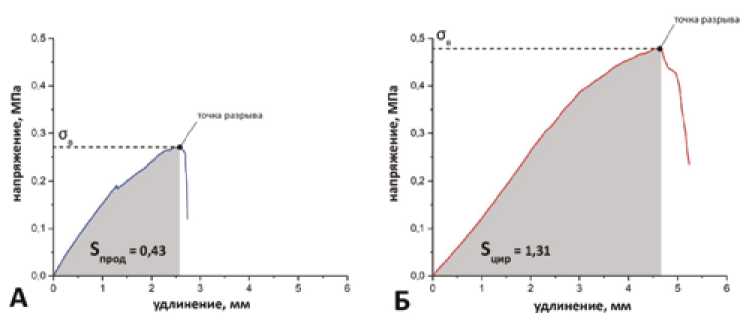
Рис. 3. Кривые «напряжение – удлинение», построенные по среднеарифметическим показателям для продольных (А) и циркулярных (Б) образцов. Стрелками указаны пики кривых, соответствующие пределу прочности образцов при растяжении (σв, МПа) и точкам разрыва Fig. 3. Mean loading diagrams for longitudinal (A) and circular (B) aortic wall samples. The arrows indicate the peaks of the curves corresponding to the tensile strength of the samples (σv, MPa) and the break points
Гистологическое исследование стенки аорты
Из парафиновых блоков изготавливали гистологические срезы толщиной 3–4 мкм с помощью ротационного микротома Thermo Scientific HM355S (США). Каждый срез окрашивали гематоксилином и эозином с помощью системы Leica ST5010 AXL (Германия). Рутинную микроскопию проводили на Zeiss AxioImager.М2 (Германия) в светлом поле. Цифровое сканирование гистологических образцов выполняли на приборе Leica Aperio АТ2 (Германия). Гистологическое оборудование расположено в центре коллективного пользования «Медицинская геномика» Томского НИМЦ.
В тканевых образцах из аневризмы аорты исследовали следующие гистологические характеристики:
Признаки воспаления – наличие или отсутствие воспалительной инфильтрации, клеточный состав воспалительного инфильтрата, выраженность воспалительной инфильтрации, которая оценивалась как слабая, умеренная и выраженная. При этом слабой считалась инфильтрация, представленная единичными воспалительными элементами (1–10 в поле зрения, при ув. × 200), умеренной – инфильтрация с формированием скоплений воспалительных клеток (11–30 в поле зрения, при ув. × 200), выраженной – инфильтрация с наличием большого числа клеточных элементов воспаления (более 30 в поле зрения, при ув. × 200).
Выраженность фиброза в стенке аорты – при этом использовался полуколичественный метод (шкала от 0 до 3 баллов), где 0 – отсутствие фиброза медии, 1 – слабый, 2 – умеренный, 3 – выраженный фиброз соответственно (рис. 4). Оценка данного параметра проводилась в зависимости от доли соединительнотканного матрикса в стенке аорты (0 – отсутствие, 1 – слабый – менее 1/6 толщины стенки, 2 – умеренный от 1/6–1/2, 3 – выраженный более 1/2).
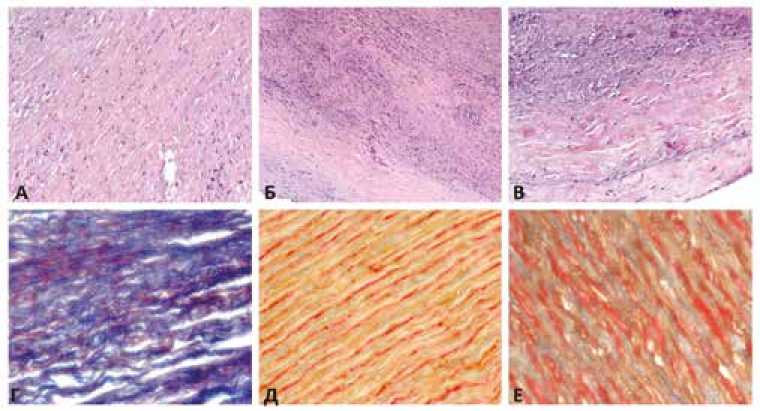
Рис. 4. Гистологические образцы аортальной стенки. Окраска гематоксилином и эозином (А, Б, В) выполнена для качественной оценки степени фиброза в стенке аорты (увеличение × 200). А – слабый фиброз; Б – умеренный фиброз; В – выраженный фиброз. Окраска по Пикро – Маллори (Г, Д, Е) выполнена для полуколичественной оценки соотношения коллаген/эластин (увеличение × 400). Г – преобладание коллагеновых волокон в стенке аорты (синий цвет), соотношение коллаген/эластин 3 : 1; Д – преобладание эластических волокон (желто-оранжевый цвет), 1 : 3; Е – эквивалентное соотношение коллагеновых и эластических волокон, 1 : 1
Fig. 4. Various degrees of fibrosis in the ascending aorta wall. Hematoxylin and eosin staining (magnification × 200). A – weak fibrosis; Б – moderate fibrosis; В – severe fibrosis. Different ratios of collagen and elastin in the thoracic aorta wall. Picro – Mallory staining (magnification × 400). Г – predominance of collagen fibers in the aortic wall (blue color), collagen/elastin 3 : 1; Д – predominance of elastic fibers (yellow-orange color), collagen/elastin 1 : 3; Е – the same ratio of collagen and elastin in the thoracic aorta wall, collagen/elastin 1 : 1
Морфометрическое измерение средней толщины коллагенового и гладкомышечного волокна (см. рис. 4). Кроме того, оценивалось соотношение между количеством коллагеновых и эластических в толще стенки аорты, при этом рассчитывался процент обоих типов волокон на всей толщине среза аорты, выполнялся подсчет соотношения между ними.
Гиперплазия интимы – оценивалась на основании светооптических признаков пролиферации интимальных гладкомышечных клеток и клеточных элементов эндотелия сосудистой стенки.
Атрофия медиального слоя – оценивалась на основании светооптических признаков уменьшения объема и количества гладкомышечных элементов средней стенки аорты (данный признак отражает убыль количества гладкомышечных клеток, в том числе обусловленную фиброзом медиального слоя).
Диаметр vasa vasorum – оценивался путем морфометрического измерения диаметра просвета vasa vasorum .
Фиброз vasa vasorum – оценивался на основании светооптических признаков утолщения vasa vasorum за счет пролиферации элементов соединительной ткани в их стенках.
Статистический анализ
Статистическую обработку данных осуществляли с использованием программного обеспечения STATISTICA 10 (StatSoft, Inc., США). Проверку на соответствие вы- борок нормальному закону распределения проводили согласно критерию Шапиро – Уилка. Поскольку нормальный закон распределения для всех анализируемых количественных данных не подтвердился, результаты были представлены в виде медианы [Me] и квартилей [Q1; Q3]. Проверку достоверности различий количественных данных осуществляли при помощи непараметрического критерия Манна – Уитни (U-тест). Оценку взаимосвязей между величинами выполняли при помощи расчета коэффициента корреляции Спирмена. Изменения считали достоверными при уровне значимости р < 0,05.
Результаты
По результатам гистологического исследования атеросклеротическое поражение аорты было выявлено в 13 (43,3%) из 30 случаев, аортит (наблюдалась густая диффузно-очаговая воспалительная инфильтрация в стенке аорты) – у 1 пациента (3,3%), дисплазия соединительной ткани – у 16 пациентов (53,3 %). Учитывая этиопатоге-нетическую неоднородность исследуемой группы и гистологическую картину густой диффузно-очаговой воспалительной инфильтрации в стенке аорты у пациента с аортитом, он был исключен из исследования. В зависимости от этиологии заболевания группу исследования разделили на две подгруппы. В подгруппу 1 вошли пациенты с атеросклерозом аорты, в подгруппу 2 – с дисплазией соединительной ткани. Биомеханические параметры образцов восходящей аорты представлены в таблице 3.
Таблица 3. Показатели механической прочности восходящей аорты в зоне аневризмы
Table 3. Tensile strength of the ascending aorta intraoperative samples
|
Параметры |
Вся группа, Me [ Q 1; Q 3], n = 29 |
Подгруппа 1, Me [ Q 1; Q 3], n = 13 |
Подгруппа 2, Me [ Q 1; Q 3] , n = 16 |
p |
|
σ в прод , Мпа |
0,64 [0,48; 0,77] |
0,60 [0,45; 0,70] |
0,69 [0,5; 0,82] |
0,52 |
|
σв цир, Мпа |
0,81 [0,55; 1,27] |
0,99 [0,8; 1,13] |
0,70 [0,50; 1,53] |
0,57 |
|
ε прод, мм/мм × % |
0,45 [0,34; 0,51] |
0,44 [0,33; 0,57] |
0,45 [0,40; 0,49] |
1,0 |
|
ε цир, мм/мм × % |
0,43 [0,37; 0,62] |
0,43 [0,37; 0,67] |
0,46 [0,38; 0,62] |
0,97 |
|
S прод, см2 |
15,53 [6,84; 20,89] |
15,60 [6,17; 20,89] |
15,53 [6,84; 21,82] |
0,93 |
|
S цир, см2 |
22,08 [14,83; 35,56] |
24,90 [16,87; 33,39] |
17,85 [10,48; 43,35] |
0,42 |
Примечание: σв прод – показатель предела прочности при разрыве продольных образцов аорты, σв цир – показатель предела прочности при разрыве циркулярных образцов аорты, ε про – удлинение при разрыве для продольных образцов аорты, ε цир – удлинение при разрыве для циркулярных образцов аорты; S прод – площадь под кривой «напряжение-удлинение» для продольных образцов аорты, Sв цир. – площадь под кривой «напряжение-удлинение» для циркулярных образцов аорты. .
Достоверных различий прочностных характеристик стенки аорты в зоне аневризмы между подгруппами выявлено не было.
Результаты гистоморфологического исследования образцов аорты представлены в таблице 4. В 86,2% случаев (25 образцов) при гистологическом исследовании были зарегистрированы признаки фиброза медии, умеренная и выраженная степень которого имела место только у 11 пациентов. Наблюдалось нарушение правильной слоистой архитектоники этого слоя за счет разрывов, лизиса эластических волокон с образованием кист. В 41,4% случаев АГА (12 образцов) была выявлена слабая очаговая воспалительная инфильтрация стенки аорты в виде скоплений единичных лимфоидных клеток, что, наиболее вероятно, может быть ассоциировано с иммунологическими реакциями на процессы пролонгированного во времени повреждения медии, которое нельзя исключить в зоне формирования аневризматического выпячивания. В 13,7% случаев АГА (4 образца) были определены признаки гиперплазии интимы, а атрофия медии (уменьшение количества гладкомышечных клеток) была замечена в 31% случаев (9 образцов). Изменения сосудистого компонента в стенке аорты (фиброз vasa vasorum) отмечались в 20,7% случаев (6 образцов АГА).
Таблица 4. Характеристика гистологических образцов
Table 4. Characteristics of histological samples
|
Показатели |
Значение |
|
Наименьшая толщина образца, n = 29 |
1,0 [0,9; 1,1] |
|
Признаки воспаления, n (%) |
12 (41,4) |
|
Признаки фиброза, n (%) |
25 (86,2) |
|
Окончание табл. 4 End of table 4 |
|
|
Показатели |
Значение |
|
Степень фиброза медии по шкале от 0 до 3, n (%): 0 |
5 (17,2) |
|
1 |
13 (44,8) |
|
2 |
8 (27,6) |
|
3 |
3 (10,3) |
|
Признаки гиперплазии интимы, n (%) |
4 (13,7) |
|
Толщина мышечного волокна, мкм |
6,7 [6,1; 7,3] |
|
Толщина коллагенового волокна, мкм |
2,9 [2,4; 3,6] |
|
Признаки атрофии медии, n (%) |
9 (31) |
|
Диаметр vasa vasorum , мкм |
36,5 [0; 55] |
|
Фиброз vasa vasorum , n (%) |
6 (20,7) |
|
Коллаген / эластин |
1,4 [0,5; 2] |
Была найдена корреляционная связь возраста c εцир ( r = –0,49), Sцир ( r = –0,54) и Sпрод ( r = –0,5). Из всех исследуемых гистоморфологических характеристик сосудистой стенки только степень фиброза медии ( r = –0,5) и соотношение коллаген / эластин ( r = –0,61) были отрицательно связаны с индексом предельной деформации при разрыве для циркулярных образцов аорты (εцир). При этом ни возраст, ни диаметр сосуда не коррелировали с изменением качественного состава внеклеточного матрикса медиального слоя АГА.
Ни одна из рассчитанных характеристик механической прочности аорты в зоне аневризмы не коррелировала с диаметром восходящей аорты. В то же время мы обнаружили умеренную отрицательную корреляционную связь между биомеханическими параметрами растяжимости ткани АГА и возрастом.
Обсуждение
Формирование аневризмы грудной аорты является патогенетически сложным процессом, в котором участвуют различные типы клеток и молекулярные регуляторные системы. За последнее десятилетие был достигнут значительный прогресс в понимании молекулярных механизмов формирования аневризмы восходящего отдела аорты и было установлено, что эта патология связана с воспалением и деградацией внеклеточного матрикса [7]. В отличие от патофизиологических механизмов, лежащих в основе развития аневризмы брюшной аорты, атеросклероз не рассматривается в качестве основной причины развития АГА. Однако в представленном исследовании атеросклеротические изменения в ткани восходящей аорты были обнаружены почти у половины (43,3%) пациентов. При этом мы не выявили каких-либо существенных различий показателей механической прочности аортальной стенки между подгруппами пациентов, разделенных по морфологическому признаку. Данные результаты могут указывать на то, что системный атеросклероз и развитие аневризмы восходящего отдела аорты, а также аорто-ассоциированных осложнений яв- ляются независимыми, параллельно протекающими процессами.
Вышеизложенное предположение согласуется с недавно опубликованным исследованием N. Grewal и соавт. [8], в котором было показано, что у большинства пациентов с расслоением аорты наблюдалось непрогрессирующее изменение интимы, в то время как у пациентов контрольной группы (посмертные образцы грудной аорты) наблюдалось прогрессирующее атеросклеротическое поражение интимы. Авторы пришли к выводу, что у пациентов с расслоением грудной аорты практически не наблюдается атеросклеротического изменения аортальной стенки [8].
Одним из результатов настоящего исследования стала отрицательная корреляционная взаимосвязь между параметрами, связанными с деформацией аорты (εцир, Sпрод, Sцир), и возрастом пациентов. Полученные данные хорошо согласуются с мировым опытом изучения влияния старения на механические свойства артерий. В частности, в одной из работ было показано, что эластичность и механическая прочность аорты снижаются с увеличением возраста [9].
В представленном исследовании не было выявлено корреляционной взаимосвязи между максимальным диаметром восходящей аорты и биомеханическими параметрами сосудистой стенки. В настоящее время основным критерием для принятия решения о необходимости хирургического вмешательства у пациентов с дилатацией грудной аорты является диаметр сосуда (более 50 мм) и скорость его увеличения1. Основанием для использования этих параметров при оценке индивидуального риска аорто-ассоциированных осложнений (расслоение, разрыв) является закон Лапласа, согласно которому напряжение на сосудистую стенку прямо пропорционально радиусу сосуда и давлению, оказываемому на его стенку, и обратно пропорционально ее толщине [10]. Данная формула не учитывает механобиологические свойства ткани аорты, и поэтому большое количество случаев острого аортального синдрома возникают у пациентов с диаметром сосуда менее 49 мм [11]. Это говорит о том, что диаметр аорты является лишь одним из многих компонентов, влияющих на предрасположенность к ее разрыву, и результаты нашего исследования косвенно подтверждают это предположение.
Заключение
Таким образом, в настоящей работе было показано, что наличие атеросклеротических изменений существенным образом не влияет на прочность стенки грудной аорты. Данные результаты свидетельствуют о том, что системный атеросклероз и аневризму восходящей аорты следует рассматривать как два независимых, параллельно протекающих процесса. Результаты нашего исследования продемонстрировали негативное влияние изменения качественного состава аортальной стенки на ее механическую прочность.
Список литературы Взаимосвязь гистоморфологических характеристик стенки аневризмы восходящего отдела аорты с ее биомеханическими свойствами
- Панфилов Д.С., Саушкин В.В., Сондуев Э.Л., Сазонова С.И., Козлов Б.Н. Хирургическое лечение аневризм восходящего отдела аорты у мужчин и женщин. Сибирский журнал клинической и экспериментальной медицины. 2022;37(3):108–113. Panfilov D.S., Saushkin V.V., Sonduev E.L., Sazonova S.I., Kozlov B.N. Gender-specific differences in ascending aortic surgery. Siberian Journal of Clinical and Experimental Medicine. 2022;37(3):108–113. (In Russ.). DOI: 10.29001/2073-8552-2022-37-3-108–113.
- Elefteriades J.A. Thoracic aortic aneurysm: reading the enemy’s playbook. Curr. Probl. Cardiol. 2008;33(5):203–277. DOI: 10.1016/j.cpcardiol.2008.01.004.
- Isselbacher E.M., Preventza O., Hamilton Black J. 3rd, Augoustides J.G., Beck A.W., Bolen M.A. et al. 2022 ACC/AHA Guideline for the diagnosis and management of aortic disease: A report of the American Heart Association/American College of Cardiology Joint Committee on Clinical Practice Guidelines. Circulation. 2022;146(24):e334–e482. DOI: 10.1161/CIR.0000000000001106.
- Olsson C., Thelin S., Stahle E., Ekbom A., Granath F. Thoracic aortic aneurysm and dissection: increasing prevalence and improved outcomes reported in a nationwide population-based study of more than 14,000 cases from 1987 to 2002. Circulation. 2006;114:2611–2618. DOI: 10.1161/CIRCULATIONAHA.106. 630400.
- El-Hamamsy I., Yacoub M.H. Cellular and molecular mechanisms of thoracic aortic aneurysms. Nat. Rev. Cardiol. 2009;6(12):771–786. DOI: 10.1038/nrcardio.2009.191.
- Choudhury N., Bouchot O., Rouleau L., Tremblay D., Cartier R., Butany J. et al. Local mechanical and structural properties of healthy and diseased human ascending aorta tissue. Cardiovasc Pathol. 2009;18(2):83–91. DOI: 10.1016/j.carpath.2008.01.001.
- Stary H.C., Chandler A.B., Dinsmore R.E., Fuster V., Glagov S., Insull W.Jr. et al. A definition of advanced types of atherosclerotic lesions and a histological classification of atherosclerosis: a report from the Committee on Vascular Lesions of the Council on Arteriosclerosis, American Heart Association. Arterioscler. Thromb. Vasc. Biol. 1995;15(9):1512–1531. DOI: 10.1161/01.cir.92.5.1355.
- Grewal N., Dolmaci O., Jansen E., Klautz R., Driessen A., Lindeman J. et al. Are acute type A aortic dissections atherosclerotic? Front. Cardiovasc. Med. 2023;9:1032755. DOI: 10.3389/fcvm.2022.1032755.
- Mammoto A., Matus K., Mammoto T. Extracellular matrix in aging aorta. Front. Cell. Dev. Biol. 2022;21(10):822561. DOI: 10.3389/fcell.2022.822561.
- Cikach F.S., Germano E., Roselli E.E., Svensson L.G.S. Ascending aorta mechanics and dimensions in aortopathy – from science to application. Indian J. Thorac. Cardiovasc. Surg. 2022;38(Suppl. 1):7–13. DOI: 10.1007/s12055-020-01092-y.
- Golledge J., Eagle K.A. Acute aortic dissection. Lancet. 2008;372(9632):55–66. DOI: 10.1016/S0140-6736(08)60994-0.


