Взаимосвязь инкрементов продолжительности жизни и массы тела Drosophila melanogaster с дифференциальной экспрессией генов циркадных ритмов в условиях культивирования с повышенным содержанием белка
Автор: Соловьев И.А., Щеголева Е.В., Шапошников М.В., Москалев А.А.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Статья в выпуске: 5 (51), 2021 года.
Бесплатный доступ
Ритмичное функционирование молекулярных циркадных часов в различных тканях и питание оказывают значительное влияние на продолжительность и качество жизни, а также скорость старения организмов. Известно, что масса тела коррелирует с экспрессией множества различных генов и риском летального исхода в различных возрастах. В настоящем исследовании предпринята попытка выявить закономерности в реализации генетической информации под давлением различных факторов, в частности способность эктопической экспрессии генов циркадных ритмов в жировом теле и мышцах влиять на массу тела в условиях, когда организм получает пищу с различными концентрациями белка. Использованы трансгенные линии Drosophila melano-gaster , несущие в промоторах генов циркадных ритмов ( cry , per , tim , clk , cyc ) UAS последовательности, усиливающие экспрессию, и линии, позволяющие индуцировать экспрессию тканеспецифичные GSG-311-2 (мышцы) и P{Switch1}106 (жировое тело). Измеряли на аналитических весах Mettler Toledo массу тела дрозофил и устанавливали корреляцию с инкрементами продолжительности жизни в ответ на сверхэкспрессию генов циркадных ритмов из ранее опубликованных данных. Установлена сильная корреляционная зависимость инкрементов массы тела и продолжительности жизни в случае сверхэкспрессии генов циркадных ритмов в жировом теле в условиях культивирования с повышенным содержанием белка, по Спирмену коэффициент корреляции составил 0.955. На основании полученных результатов и данных о высоком эволюционном консерватизме вовлеченных в процесс сигнальных путей (человеческие сигнальные пути эволюционно близки дрозофилиным каскадам) сделаны обобщения относительно негативных последствий использования высокобелковых диет в целях снижения массы тела на фоне нарушений циркадного ритма, которые широко распространены в мегаполисах.
Масса тела, drosophila, продолжительность жизни, сверхэкспрессия, циркадные ритмы, белковая диета
Короткий адрес: https://sciup.org/149139330
IDR: 149139330 | УДК: 577.24:577.214.5575.832 | DOI: 10.19110/1994-5655-2021-5-97-103
Текст научной статьи Взаимосвязь инкрементов продолжительности жизни и массы тела Drosophila melanogaster с дифференциальной экспрессией генов циркадных ритмов в условиях культивирования с повышенным содержанием белка
Генетический контроль циркадных ритмов осуществляется группой последовательностей в совокупности называемых циркадными часами клетки [1]. Циркадный осциллятор дрозофилы представлен ключевыми генами Clock, cycle, period, timeless и cryptochrome (сокращенно - Clk, eye, per, tim и cry); молекулярный механизм функционирует по принципу обратной связи: димер CLK/CYC прикрепляется к промоторам per и tim, а также множества других генов, инициируя их транскрипцию [2]. В предутренние часы белковые продукты генов per и tim накапливаются, затем на рассвете связываются с притерпевшим конформационные перестройки, индуцированные квантами света, белком CRY, формируя стабильный тример, который имеет сродство к комплексу CLK/CYC и останавливает транскрипцию всех последовательностей, в промоторах которых последний прикреплен в течение ночи [3]. Ранее было показано, что значительный вклад в продолжительность жизни дрозофилы вносят гены циркадных ритмов, эктопически экспрессируемые в центральной нервной системе и периферических тканях [4]. Механизмы генетического контроля метаболизма, реализуемые циркадными часами клетки, вовлечены также в формирование эффекта продления жизни при ограничении калорийности питания. Установлено, что эктопическая кондиционная экспрессия криптохрома в периферических тканях дрозофилы способна модифицировать пищевое поведение [5, 6].
Ограничение калорийности питания (англ. Diet restriction, caloric restriction, DR, CR) - это режим кормления, характеризующийся пониженным потреблением одного или нескольких макронутриентов (белков, липидов и углеводов) без недоедания [7,8]. DR известен как одно из самых эффективных вмешательств в процесс старения [8,9]. Доказано, что DR продлевает жизнь различным модельным организмам, включая дрожжи, червей, мух и грызунов [8,9]. Эффект увеличения продолжитель ности жизни от ограничения рациона поддерживается различными молекулярными механизмами, включая ингибирование инсулин/IGF-l и mTOR/S6K сигнальных путей активации сиртуинов и 4Е-ВР. Данные вмешательства вызывают усиление аутофагии, а также снижение уровней р53, активацию РОХО посредством подавления INR, повышая устойчивость организма к стрессу [8].
В настоящей работе мы попытались установить связь различных фенотипов (массы тела и продолжительности жизни) у дрозофил, сверхэкс-прессирующих гены циркадных ритмов в жировом теле и мышцах, проведя корреляционный анализ инкрементов этих показателей, используя данные ранее опубликованных работ [3,10] и результаты новых экспериментов.
Масса тела и индекс массы тела (для человека) являются одними из наиболее информативных количественных показателей, отражающих состояние различных функциональных систем организма в процессе старения [11]. Устойчивость циркадного ритма сна и бодрствования также является неотъемлемым атрибутом при оценке качества жизни и здоровья в старости [12]. Гены-детерминанты циркадных ритмов (в единстве с белковыми продуктами, образующими центральный осциллятор клетки) не только поддерживают цикл сна и бодрствования, но и осуществляют контроль метаболизма [13].
Цель данного исследования - выявить наличие корреляции эффектов кондиционной эктопической сверхэкспрессии генов циркадных ритмов в жировом теле (аналог печени) и мышечной ткани плодовых мух в условиях, когда особи получают пищу с различными концентрациями белка.
Материалы и методы
Трансгенные линии Drosophila melanogaster у, w;UAS-cry12/TM2 (трансген располагается на третьей хромосоме) [14]; у, w;UAS-cry24/CyO (трансген располагается на второй хромосоме) - обе конст- рукции являются несущими дополнительные копии гена cry (криптохром) в сопровождении промотор-ной последовательности UAS (upstream activating sequence) [14]; w; UAS-регЮ (несет единственную дополнительную копию per) [15]; w; UAS-per2.4 (несет две дополнительные копии гена per) - трансгены включают в себя одну и две дополнительные копии гена per под контролем активирующей последовательности UAS [16]. w; P{UAS-CYC.HA} - несет дополнительную копию гена cycle (ортолог гена Вта/1), находящийся под контролем промотора UAS [17]. Белок, кодируемый этим геном, образует димер CLK/CYC, который запускает транскрипцию tim и per [18]. у, w; P{tim-HA} - трансген снабжен геном tim, управляемым UAS последовательностью, расположенной в промоторе [18]. w; P{UAS-Clk.HA} - несет дополнительную копию гена С1к под промотором UAS [18].
w; Sp/CyO; P{MHC-GeneSwitch} (сокращенно GSG-311-2) - линия снабжена индуцируемой мифепристоном бинарной системой GAL4, функционирующей исключительно в миоцитах, поскольку снабжена тканеспецифичным промотором. w[1118]; P{w[+mW.hs]=Switch1}106) (сокращенно P{Switch1} 106) - линия с мифепристон-индуцибельным GAL4 в жировом теле [19]. Мухи были получены из Bloomington Stock Center (США).
Активация сверхэкспрессии. Для индукции генов циркадных ритмов использовали RU486-3kth- вируемый бинарный GeneSwitch [20]. Особей, экспрессирующих кондиционно гены-регуляторы циркадных ритмов в мускулатуре и жировом теле, получали от скрещиваний самцов линии GS-Gal4, снабженных тканеспецифичными энхансерами/про-моторами, и виргинных самок, несущих конструкцию с UAS последовательностью в промоторе. В питательную среду потомству добавляли мифепристон (RU486, Sigma, США), который связывается с химерной белковой молекулой, состоящей из активного центра прогестеронового рецептора, запускающего конформационные перестройки транскрипционного фактора GAL4, который связывает UAS-последовательность, тем самым активируя экспрессию генов интереса.
Раствор мифепристона готовили на 96 %-ном этаноле, использовалась концентрация в 25 мг/мл. Для приготовления рабочего раствора стоковый разбавляли в 100 раз, после чего вносили по 200 мкл в каждую пробирку на среду для особей, содержащих мифепристон-индуцибельную конструкцию. Для изучения влияния ограничительной диеты на массу тела дрозофил контрольную (без сверхэкспрессии) и опытную (со сверхэкспрессией) группы особей содержали на средах с высоким и сниженным содержанием белков.
Состав среды по [5, 21] на 1 л: вариант питательной среды с высоким содержанием белка: агар-агар -Юг, сахароза - 50 г, дрожжевой экстракт - 50 г. Вариант среды с низким содержанием белка в расчете на 1 л: агар-агар - Юг, сахароза - 50 г, дрожжевой экстракт - 0,5 г.
Измерение массы тела мух проводили на десятый день (чтобы в выборку не попали особи, которые гибнут от не связанных со старением причин)
после вылета имаго из куколок (использовались виргинные особи), осуществляя взвешивание особей в пяти технических повторностях по 10 мух в каждой, после чего высчитывали среднюю массу мухи и ошибку средней. Непараметрический корреляционный анализ проводили в программе Statistica 6.0, данные об инкрементах продолжительности жизни и экспрессии были взяты из результатов, представленных ранее (инкремент продолжительности жизни вычислялся как разность между медианами продолжительности жизни опытной и контрольной групп (по признаку индукции сверхэкспрессии)) [6], уровень значимости - 1 %.
Результаты и обсуждение
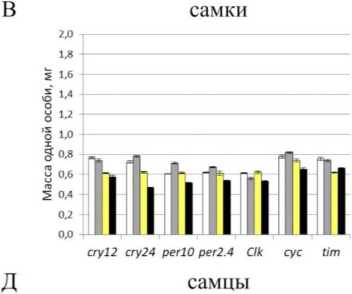
В настоящем исследовании нами установлена достоверная положительная корреляционная взаимосвязь между приростами медиан продолжительности жизни и массы тела у самок дрозофилы, культивируемых на среде с высокой концентрацией белка и сверхэкспрессирующих гены циркадных ритмов в жировом теле (рис. 1). В то же самое время не удалось обнаружить достоверных значений коэффициентов корреляции между экспрессией генов циркадных ритмов и приростом медианы продолжительности жизни, а также между приростом экспрессии гена и массой тела дрозофилы во всех остальных случаях. С точки зрения эволюционной биологии данный эффект закономерен. Не одомашненным животным не свойственна способность адаптироваться одновременно к нетипичному фоторежиму, который модулирует сверхэкспрессию того или иного гена и богатой белком диете, как следствие, наблюдается сниженная продолжительность жизни. Единственным исключением в настоящем эксперименте является ген сус [10], ортолог Вта11 млекопитающих, известный как циркадный регулятор киназы mTOR (Bmall ингибирует активность mTOR) [22]. Киназа mTOR участвует в распознавании нутриентов, а ее ингибирование ра-палогами и собственно рапамицином вызывает увеличение продолжительности жизни модельных животных. Таким образом, принимая во внимание наши результаты, следует заключить, что выявленная нами прямая корреляция между массой тела и приростами продолжительности жизни (р=0.955; р<0. 05) косвенно указывает на существование связи между CYC и ортологом mTOR дрозофилы (рис. 2).
В норме испытуемые животные должны снижать массу тела в ответ на богатую белком диету, однако при сверхэкспрессии гена сус в жировом теле на фоне стандартной диеты у самок повышается масса тела. Если сопоставить этот факт с данными, полученными на крысах, хронически употреблявших рапамицин и страдавших от инсулино-резистентности, развившейся вследствие этого вмешательства, можно заметить, что наблюдаемый эффект имеет похожую конъюнктуру [23]. Мухи, которые должны сбрасывать вес, набирают его, несмотря на общий тренд, характерный для других линий, содержащихся на стандартной диете. Данная тенденция к набору веса на фоне сверхэкспрессии сохраняется также и в вариантах со сверх-
А самцы
Б самцы
Г самки

Е самцы
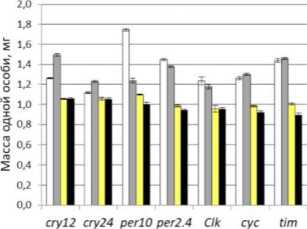
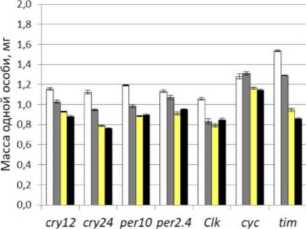
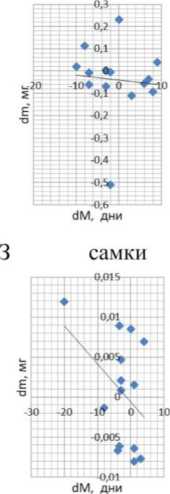
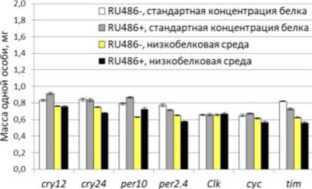
Рис. 1. Масса тела особей Drosophila melanogaster и корреляция массы тела плодовых мух, сверхэкспрессирующих гены циркадных ритмов в мышцах и жировом теле при культивировании на питательных средах со стандартным и низким содержанием белка.
Условные обозначения: ось у в первом столбце в ш, мг; А, Б, Д, Е - самцы, В, Г, Ж, 3 - самки; А, Б, В, Г - сверхэкспрессия в мышцах; Д, Е, Ж, 3 - сверхэкспрессия в жировом теле; белый - контрольная группа, содержащаяся на высокобелковой среде; серый - группа, содержащаяся на среде с мифепристоном; желтый - контрольная группа, содержащаяся на низкобелковой среде; черный - группа, содержащаяся на низкобелковой среде с мифепристоном; dM -прирост медианной продолжительности жизни; dm - инкремент массы тела.
Fig. 1. Body weight of Drosophila melanogaster individuals and correlation of body weight of fruit flies overexpressing circadian rhythm genes in muscles and fat body when cultured on nutrient media with standard and low protein content.
Symbols: у axis in the first column in m, mg; А, Б, Д, E - males, В, Г, Ж, 3 - females; А, Б, В, Г - overexpression in muscles; Д, E, Ж, 3 - overexpression in the fat body; white — the control group kept on a high-protein medium, gray - the group kept on a medium with mifepristone; yellow - the control group kept on a low-protein medium, black - the group kept on a low-protein medium with mifepristone; dM - increase in median life expectancy; dm - increment of body weight.
экспрессией eye в мышцах самок, а также самцов, на фоне именно богатой белком диеты [23].
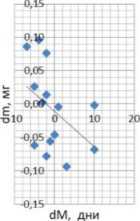
Обнаружена сильная положительная коррекция между инкрементами медианной продолжи тельности жизни и массы тела у самок дрозофил, содержащихся на среде со стандартным содержанием белка и сверхэкспрессирующих гены циркадных ритмов в жировом теле (коэффициент корреляции
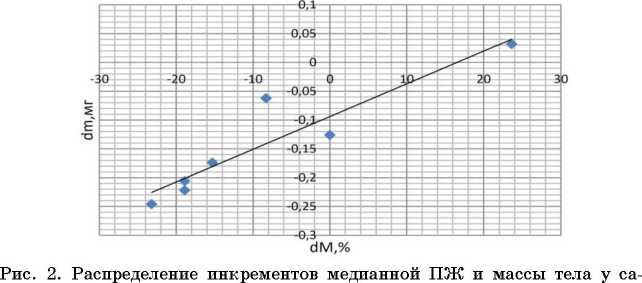
мок дрозофил, сверхэкспрессирующих гены циркадных ритмов в жировом теле на фоне диеты со стандартным содержанием белка.
Условные обозначения: dM - инкремент медианной ПЖ, %[6]; dm -инкремент массы тела.
Fig. 2. Distribution of increments of median pancreas and body weight in Drosophila females overexpressing genes of circadian rhythms in the fat body against the background of a diet with a standard protein content.
Symbols: dM - increment of the median pancreas [6], %; dm - increment of body weight.
Спирмена p=0.955, p<0.05) (данные представлены в табл. 1). В остальных вариантах индукции сверхэкспрессии (у самцов и в мышечной ткани обоих полов) корреляционная зависимость между инкрементами массы и медианной продолжительности жизни отсутствует на фоне тканеспецифичной эк топической кондиционной экспрессии генов циркадных ритмов и высокобелковой диеты (табл. 2).
Ранее были описаны механизмы регуляции метаболизма жиров циркадными часами клеток млекопитающих [13]. Любое нарушение функционирования молекулярного осциллятора, ассоциированное сдесинхронозом или джетлагом, способно привести к ожирению [13]. Каждый отдельный вариант индукции эктопической экспрессии следует считать нарушением в работе циркадных часов в рамках обсуждаемого эксперимента. На модели дрозофилы нам удалось убедительно показать, что снижение веса в условиях высокобелковой диеты возможно и при модельных десинхронозах. Например, мыши-мутанты по гену
Clock страдают от ожирения [24].
Усиление экспрессии генов-регуляторов циркадных ритмов в жировом теле (аналог печени, поджелудочной железы и жировой ткани млекопитающих) дрозофилы приводило в условиях вы-
Таблица 1
Данные об инкрементах медианной продолжительности жизни, экспрессии генов циркадных ритмов (в жировом теле) и массе тела самок, содержащихся на среде с повышенной концентрацией белка
Table 1
Data on increments of median life expectancy, expression of genes of circadian rhythms (in the fat body) and body weight of females kept on medium with increased concentration of protein
|
Ген |
dM,% |
dE |
dm,Mr |
Ген |
|
cry 12 |
0 |
950 |
-0.126 |
cry 12 |
|
cry24 |
-15.3 |
140 |
-0.174 |
cry24 |
|
per10 |
-18.9 |
1160 |
-0.206 |
per10 |
|
per2.4 |
-8.3 |
450 |
-0.062 |
per2.4 |
|
Clk |
-18.9 |
370 |
-0.222 |
Clk |
|
eye |
23.6 |
160 |
0.032 |
eye |
|
tim |
-23.2 |
190 |
-0.246 |
tim |
Примечание: dM - прирост медианной продолжительности жизни (данные взяты из Solovev et al. (2019) [6]); dE - прирост уровня экспрессии гена, данные взяты из [6]. dm - прирост массы тела плодовых мух.
Note: dM - increase in median life expectancy (data taken from Solovev et al. (2019) [6]; dE - increase in the level of gene expression, data are taken from [6)]; dm - weight gain of fruit flies.
Таблица 2 P- коэффициенты корреляции Спирмена для инкрементов медиан продолжительности жизни, экспрессии генов и массы тела самок, сверхэкспрессирующих гены циркадных ритмов в жировом теле
Table 2
Р- Spearman correlation coefficients for increments of median life expectancy, gene expression and body weight of females overexpressing genes of circadian rhythms in the fat body
|
P - коэффициент корреляции Спирмена |
dM |
dE |
dm |
|
dM |
1.000 |
-0.090 |
0.955* |
|
dE |
-0.090 |
1.000 |
-0.071 |
|
dm |
0.955* |
-0.071 |
1.000 |
Примечание: dM - прирост медианной продолжительности жизни; dE - прирост уровня экспрессии гена; dm -прирост массы тела плодовых мух. - значение коэффициента корреляции статистически достоверно.
Note: dM - increase in the median life expectancy; dE - increase in the level of gene expression; dm - weight gain of fruit flies.
сокобелковой диеты, главным образом, к потере массы тела и, в отдельных случаях, драматическому сокращению продолжительности жизни (см. табл. 1) [6]. Экстраполируя результаты с используемого в нашей работе модельного организма на человека (процедура допустима при учете высокого эволюционного консерватизма последовательностей генов циркадных ритмов и элементов mTOR сигнального пути, а также ассоциированного с метаболизмом жиров сигнального каскада PPARy), можно сделать вывод, что на фоне хронического нарушения ритмов сна и бодрствования (распространенного в мегаполисах) использование высокобелковой диеты с целью набора мышечной массы, даже при нормальной исходной массе тела, может быть губительно. На данный момент неизвестно, способны ли физические упражнения нивелировать аддитивные отрицательные эффекты высокобелковой диеты и нарушения циркадного ритма. Однако классические исследования способности физической активности выступать в качестве цайтгебера у человека дали положительный результат, так, упражнения приводят к сдвигу фазы ритма, но не обязательно нормализуют его [25].
Следует отметить, исходя из последних данных, представленных в работе [26], что высокий уровень белка в рационе далеко не всегда оказывает отрицательное влияние на организм человека при умеренном потреблении: у пожилых пациентов введение дополнительного белка в рацион значительно снижает частоту переломов костей, к сожалению, в обсуждаемом исследовании не проводилось оценки циркадных ритмов пациентов количественными методами [26].
Хотя диеты с высоким содержанием белка по-прежнему популярны в качестве средств для похудения и лечебного питания при диабете 2 типа; накопленные данные клинических наблюдений свидетельствуют о том, что ухудшение функции почек может происходить у людей как уже имеющих нарушения в этой системе, так и здоровых [27]. Высокое потребление белка с пищей способно вызвать внутриклубочковую гипертензию, что может привести к состоянию гиперфильтрации, также повреждению клубочков и протеинурии. Вполне возможно, что длительное потребление большого количества белка приводит к развитию хронической болезни почек de novo. Качество употребляемого белка также может иметь значение для здоровья почек. По сравнению с белком из растительных источников, животный белок был связан с повышенным риском развития терминальной стадии болезни почек в нескольких наблюдениях, включая Singapore Chinese Health Study [27]. Потенциальные медиаторы повреждения почек животным белком включают кислотную нагрузку, содержание фосфатов, дисбаланс кишечной микробиоты и возникающее в результате влияния всех вышеперечисленных факторов воспаление. В свете таких результатов следует с осторожностью подходить к принятию популярных диетических подходов, которые включают высокую долю белка в рационе для снижения веса или контроля гликемии у лиц с высоким риском заболевания почек [27].
Исследования выполнены в рамках госзада-ния по теме «Молекулярно-генетические механизмы старения, продолжительности жизни и стрес-соустойчивости Drosophila melanogaster» № AAAA-А18-118011120004-5, а также при финансовой поддержке РФФИ в рамках научного проекта № 19-3490058 «Аспиранты»: «Исследование геропротек-торных свойств стабилизатора и ингибитора криптохрома, KL001 и KS15, на модели Drosophila melanogaster».
Список литературы Взаимосвязь инкрементов продолжительности жизни и массы тела Drosophila melanogaster с дифференциальной экспрессией генов циркадных ритмов в условиях культивирования с повышенным содержанием белка
- Kim Y.H., Lazar MA. Transcriptional Control of Circadian Rhythms and Metabolism: A Matter of Time and Space // Endocrine Reviews. 2020. Vol. 41. № 5. P. 707-732.
- Dissection of central clock function in Drosophila through cell-specific CRISPR-mediated clock gene disruption / R. Delventhal, R.M. O'Connor, M.M. Pantalia, M. Ulgherait, И.Х. Kim, M.K. Basturk, J.C. Canman, M. Shira.su-Hiza // Elife. 2019 Vol. 15 № 8. P. e48308.
- Solovev IA., Shaposhnikov M.V., Moskalev AA. Genetic mechanisms of the influence of light and phototransduction on Drosophila melanogaster lifespan //Vavilovskii zhurnal genetiki i selektsii [Vavilov J. of Genetics and Selection], 2018. Vol. 22. № 7. P.878-886.
- Brown A.J., Pendergast J.S., Yamazaki S. Peripheral Circadian Oscillators // Yale J. Biol. Med. 2019. Vol. 92. № 2. P. 327-335.
- Peripheral Circadian Clocks Mediate Dietary Restriction-Dependent Changes in Lifespan and Fat Metabolism in Drosophila / S.D. Katewa, K. Akagi, N. Bose, K. Rait shit, T. Ca-marella, X. Zheng, D. Hall, S. Davis, C.S. Nelson, R.B. В re in, A. Ramanathan, A. Sehgal, J.M. Giebultowicz, P. Ka.pa.hi // Cell Metab. 2016 Vol. 23 № 1. P. 143-154.
- Circadian clock genes overexpression in Drosophila alters diet impact on lifespan / I. Solovev, E. Shchegoleva, A. Fedintsev, M. Shaposhnikov, A. Moskalev // Biogerontology. 2019 Vol. 20 № 2. P. 159-70.
- Caloric restriction blocks neuropathology and motor deficits in Machado-Joseph disease mouse models through SIRT1 pathway / J. Cunha-Santos, J. Duarte-Neves, V. Carmona, L. Gua-rente, L.P. De Almeida, C. Cavadas // Nature communications. 2016. Vol. 7, № 1. P. 1-4.
- Ka.pa.hi P., Kaeberlein M., Hansen M. Dietary restriction and lifespan: lessons from invertebrate models // Ageing research reviews. 2017 Vol. 39. P. 3-14.
- Fontana L., Partridge L., bongo V.D. Extending healthy life span-from yeast to humans // Science. 2010 Vol. 328. № 5976. P. 321-326.
- Neuron-specific overexpression of core clock genes improves stress-resistance and extends lifespan of Drosophila melanogaster / I. Solovev, E. Dobrovolskaya, M. Shaposhnikov, M. Sheptyakov, A. Moskalev // Exper. gerontology. 2019. Vol. 117. P. 61-71.
- Body mass index trajectories in relation to change in lean mass and physical function: the health, aging and body composition study / I. Reinders, RA. Murphy, K.R. Martin, LA Brouwer, M. Visser, D.K. White, A.B. Newman, D.K. Houston, A.M. Kanaya, D.S. Nagin, T.B. Harris // J. of American Geriatrics Society. 2015. Vol. 63. № 8. P. 1615-1621.
- Rest-activity rhythms and cognitive decline in older men: the osteoporotic fractures in men sleep study / T.S. Rogers -Soeder, T. Blacltwell, K. Yaffe, S. Ancoli -Israel, S. Red line, J A. Cau-ley, K.E. Ensrud, M. Paudel, E.Barrett -Connor, E.LeBlanc, K.Stone // J. of American Geriatrics Society. 2018. Vol. 66. № 11. P.2136-2143.
- Circadian rhythms and obesity: Timekeeping governs lipid metabolism / Y. Li, J. Ma, K. Ya.o, W. Su, B. Tan, X. Wu, X. Huang, T. Li, Y. Yin, G. Tosini, J. Yin // J. of Pineal Research. 2020 Vol. 69 № 3. P. el2682.
- Kumar S., Chen D., Sehgal A. Dopamine acts through Cryptochrome to promote acute arousal in Drosophila // Genes & development. 2012. Vol. 26. № 11. P. 1224-1234.
- Yang Z., Sehgal A. Role of molecular oscillations in generating behavioral rhythms in Drosophila. Neuron. 2001. Vol. 29 № 2. P. 453-467.
- The Drosophila circadian network is a seasonal timer / D. Stoleru, P. Nawathean, M. de la Paz Fernández, J.S. Menet, M.F. Certa ni, M. Rosbash 11 Cell. 2007. Vol. 129. № 1. P. 207-219.
- Circadian clocks in antennal neurons are necessary and sufficient for olfaction rhythms in Drosophila / S. Tanoue, P. Krishnan, B. Krish-nan, S.E. Dryer, P.E. Hardin // Current Biology. 2004. Vol. 14. № 8. P. 638-649.
- Hardin P.E. Molecular genetic analysis of circadian timekeeping in Drosophila // Advances in genetics. 2011. Vol. 74. P.141-173.
- P {Switch}, a system for spatial and temporal control of gene expression in Drosophila mela-nogaster / G. Roman, K. Endo, L. Zong, R.L. Davis 11 Proc. of the National Ac. Sci. 2001. Vol. 98. № 22. P. 12602-12607.
- A conditional tissue-specific trans-gene expression system using inducible GAL4 T. Ostenvalder, K.S. Yoon, B.H. White, H. Keshi-shian II Proc. of the National Ac. Sci. 2001. Vol. 98. M 22. P. 12596-12601.
- 4E-BP extends lifespan upon dietary restriction by enhancing mitochondrial activity in Drosophila / B.M. Zid, A.N. Rogers, S.D. Katewa, MA. Vargas, M.C. Kolipinski, T. A.Lu, S. Benzer, P.Kapahi // Cell. 2009. Vol. 139. № 1. P.149-160.
- BMAL1-dependent regulation of the mTOR signaling pathway delays aging / R.V. Khapre, AA. Kondratova, S. Patel, Y. Dubrovsky, M. Wrobel, M.P. Antoch, R.V. Kondratov // Aging (Albany NY). 2014 Vol. 6. № 1. P. 48.
- Chronic mTOR inhibition by rapamycin induces muscle insulin resistance despite weight loss in rats / N. Deblon, L. Bourgoin, C. Veyrat Durebex, M. Peyrou, M. Vinciguerra, A. Caillon, C. Maeder, M. Fournier, X. Montet, F. Rohner^Jeanrenaud, M.Foti // British J. of Pharmacology. 2012. Vol. 165. № 7. P. 2325-2340.
- Obesity and metabolic syndrome in circadian Clock mutant mice / F.W. Turek, C. Joshu, A. Kohsaka, E. Lin, G. Ivanovo., E. McDearmon, A. Laposky, S. Losee-Olson, A. Easton, D.R. Jensen, R.H. Eckel // Science. 2005, Vol. 308. № 5724. P.1043-1045.
- Effects of physical exercise on human circadian rhythms / Y. Yamanaka, K.I. Honma,, S. Hashimoto, N. Takasu, T. Miyazaki, S. Honma 11 Sleep and Biological Rhvthms. 2006. Vol. 4. № 3. P.199-206.
- Effect of dietary protein intake on bone mineral density and fracture incidence in older adults in the Health, Aging, and Body Composition study / AA. Weaver, J A. Tooze, J A. Cauley, D.C. Bauer, FA. Tylavsky, S.B. Kri-tchevsky, D.K. Houston // J. of Gerontology: Series A. 2021. P. glab068
- The effects of high-protein diets on kidney health and longevity / G.J. Ко, C.M. Rhee, K. Kalantar-Zadeh, S. Joshi // J. of American Society of Nephrology. 2020. Vol. 31. № 8. P.1667-1679.


