Взаимосвязь экспрессии генов адипоцитокинов и кальцификации коронарных артерий у пациентов с ишемической болезнью сердца
Автор: Груздева О.В., Белик Е.В., Дылева Ю.А., Брель Н.К., Коков А.Н., Синицкий М.Ю., Иванов С.В., Кашталап В.В., Авраменко О.Е., Барбараш О.Л.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.36, 2021 года.
Бесплатный доступ
Дисфункциональные изменения и ремоделирование жировой ткани (ЖТ) сопровождаются формированием микрокальцинатов в стенке сосудов. Биологически активные вещества, синтезируемые в ЖТ (адипоцитокины), могут выступать в качестве промоторов и ингибиторов развития кальцификации сосудов. Немногочисленные экспериментальные и клинические исследования не в полной мере объясняют возможные механизмы реализации этих эффектов.Цель исследования: изучение взаимосвязи адипоцитокинового профиля адипоцитов эпикардиальной (ЭЖТ) и периваскулярной ЖТ (ПВЖТ) со степенью выраженности кальциноза коронарных артерий (КА) у пациентов с ишемической болезнью сердца (ИБС).Материал и методы. Обследованы 125 пациентов с ИБС в возрасте 59 (53, 66) лет. Для определения экспрессии генов и секреции адипонектина, лептина, интерлейкина-6 (ИЛ-6) использованы изолированные адипоциты подкожной ЖТ (ПЖТ), ЭЖТ и ПВЖТ, полученные во время коронарного шунтирования. Экспрессию генов адипоцитокинов оценивали с помощью количественной полимеразной цепной реакции (ПЦР) с детекцией продуктов в режиме реального времени, концентрацию адипоцитокинов в культуральной среде определяли с использованием тест-систем «R&D Systems» (Canada) методом иммуноферментного анализа. Оценку степени кальциноза КА проводили методом мультиспиральной компьютерной томографии (МСКТ). Кальциевый индекс КА определяли по методу Агатстона с использованием программного пакета «Sygno Calcium Scoring» (Siemens AG Medical Solution, ФРГ).Результаты. Среди пациентов с ИБС наиболее высокую распространенность имел массивный коронарный кальциноз (КК) - 58,8% . Наибольший уровень экспрессии гена ADIPOQ во всех типах жировых депо наблюдался у пациентов с умеренным/средним КК по сравнению с лицами с массивным КК, максимальная экспрессия ADIPOQ отмечалась в культуре адипоцитов ПВЖТ. Экспрессия генов LEP и IL6 при массивном КК была выше с максимальными значениями в культуре адипоцитов ЭЖТ относительно ПЖТ и ПВЖТ. Снижение уровня мРНК ADIPOQ и его секреции, увеличение уровня мРНК LEР, IL6 и их секреции в адипоцитах ЭЖТ и ПВЖТ ассоциировано с развитием КК у пациентов с ИБС.Заключение. Провоспалительные адипокины, продуцируемые адипоцитами пациентов с ИБС при гипоксии, вызывают кальцификацию сосудов за счет стимуляции окислительного стресса, дифференцировки остеобластов, апоптоза и пролиферации гладкомышечных клеток (ГМК). Эндотелиальные клетки при стимуляции провоспалительными адипоцитокинами демонстрируют тенденцию к трансформации в остеобласты, что усугубляет степень сосудистого воспаления и кальцификации.
Экспрессия генов, адипоцитокины, коронарный кальциноз, ишемическая болезнь сердца
Короткий адрес: https://sciup.org/149139355
IDR: 149139355 | УДК: 616.12-005.4: | DOI: 10.29001/2073-8552-2021-36-3-68-77
Текст научной статьи Взаимосвязь экспрессии генов адипоцитокинов и кальцификации коронарных артерий у пациентов с ишемической болезнью сердца
Dysfunctional changes and remodeling of adipose tissue (АT) are associated with the formation of microcalcifications in the vascular wall. Biologically active substances synthesized by АT (adipocytokines) can act as promoters and inhibitors of vascular calcification development. The few available experimental and clinical studies do not fully explain the possible mechanisms of these effects.
Aim. To study the relationships between the adipocytokine profiles of adipocytes in epicardial and perivascular AT with the severity of coronary artery calcification in patients with coronary artery disease (CAD).
Material and Methods. A total of 125 patients with CAD aged 59 (53; 66) years were examined. The isolated adipocytes of subcutaneous adipose tissue (SAT), epicardial adipose tissue (EAT), and perivascular adipose tissue (PVAT), obtained during coronary artery bypass grafting, were used to determine gene expression and secretion of adipocytokines (adiponectin, leptin, and IL-6). Expression of adipocytokine genes was assessed using quantitative PCR with detection of products in real time (real-time qPCR); the concentration of adipocytokines in the culture medium was determined by enzyme-linked immunosorbent assay using R&D Systems kits (Canada). Coronary artery (CA) calcification degree was assessed by multislice spiral computed tomography (MSCT) method. The calcium index of CA was determined by the Agatston method using the Syngo Calcium Scoring software package (Siemens AG Medical Solution, Germany).
Results. Massive coronary calcification (CC) had the highest prevalence (58.8%) in patients with CAD. The highest level of expression of the ADIPOQ gene in all types of fat stores was observed in patients with moderate/medium CС compared to those with massive CС; the maximum expression of ADIPOQ was observed in the culture of PVAT adipocytes. Expression of the LEP and IL6 genes in massive CC was higher, with the maximum values in the culture of EAT adipocytes relative to SAT and PVAT adipocytes. Decreases in the levels of ADIPOQ mRNA and its secretion, increases in the levels of mRNA of LEP and IL6 and their secretion in adipocytes of the EAT and PVAT were associated with the development of СС in patients with CAD. Conclusion. Proinflammatory adipokines produced by adipocytes of patients with CAD during hypoxia induced vascular calcification by stimulating oxidative stress, osteoblast differentiation, apoptosis, and proliferation of smooth muscle cells. Endothelial cells, when stimulated with proinflammatory adipocytokines, tended to transform into osteoblasts, which further aggravated the degree of vascular inflammation and calcification.
Financial disclosure:
Adherence to ethical standards:
gene expression, adipocytokines, coronary calcification, ischemic heart disease. the authors do not declare a conflict of interest.
no author has a financial or property interest in any material or method mentioned.
informed consent was obtained from all patients. The study was approved by the Ethics Committee Research Institute for Complex Issues of Cardiovascular Diseases (protocol No. 10 from 07.11.2017).
Gruzdeva O.V., Belik E.V., Dyleva Y.A., Brel N.K., Kokov A.N., Sinitskiy M.Yu., Ivanov S.V., Kashtalap V.V., Avramenko O.E., Barbarash O.L. Relationships between the expression of adipocytokine genes and the calcification of coronary arteries in patients with coronary artery disease. The Siberian Journal of Clinical and Experimental Medicine. 2021;36(3):68–77.
Актуальность
Ишемическая болезнь сердца (ИБС) является самой распространенной причиной смерти в США и России, поэтому проблема прогнозирования течения и исхода ИБС остается одной из важнейших в современной кардиологии. Среди всех факторов риска ИБС ожирение остается самой быстрорастущей проблемой современного здравоохранения, благодаря тесной ассоциации с сердечно-сосудистыми заболеваниями (ССЗ).
До 40-х гг. прошлого века жировая ткань (ЖТ) рассматривалась как один из наименее сложных органов в организме человека. В течение многих лет в центре внимания исследователей были самые обычные функции ЖТ, такие как хранение нейтрального жира (триа-цилглицеролов), энергообеспечение (в ней организм нуждается в периоды голодания и длительного лишения пищи), механическая защита и терморегуляция [1]. Однако за последние 40 лет наши представления о ЖТ и ее биологических функциях радикально изменились, и кажущаяся простота сменилась постоянно растущей сложностью строения, функций и биологических эффектов ЖТ.
С конца 1980-х до середины 1990-х гг. было открыто множество факторов жирового происхождения (адипоцитокины), в том числе лептин, адипонектин, интерлейкин-6 (ИЛ-6). Известно, что адипоцитокины участвуют в регуляции различных физиологических процессов, включая поддержание гомеостаза структуры и функции сосудов, а также кардиомиоцитов [ 2 ] . В этой связи вполне закономерным является интерес исследователей к роли адипо-кинов в патогенезе ССЗ.
Кальцификация коронарных артерий (КА) рассматривается как патологический процесс эктопического отложения кальция и фосфора в стенке сосуда. При дисфункции ЖТ наблюдаются заметные изменения метаболизма кальция и фосфора в стенке сосудов с формированием микрокальцинатов. Более того, ремоделирование ЖТ, вызванное пролиферацией и гипертрофией адипоцитов, может приводить к окислительному стрессу и остеобластной дифференцировке гладкомышечных клеток (ГМК) сосудов. При этом адипоцитокины могут иметь противоположные эффекты на развитие кальцификации сосудов, выступая в качестве промоторов или ингибиторов данного патологического процесса.
Немногочисленные экспериментальные и клинические исследования свидетельствуют о взаимосвязи локальных жировых депо сердца и сосудов с коронарным кальцинозом (КК), но механизмы, посредством которых реализуется эта связь, неизвестны.
Цель исследования: изучение взаимосвязи адипо-цитокинового профиля адипоцитов эпикардиальной (ЭЖТ) и периваскулярной ЖТ (ПВЖТ) со степенью выраженности кальциноза КА у пациентов с ИБС.
Материал и методы
Обследованы 125 пациентов с ИБС в возрасте 59 (53; 66) лет, которые подписали информированное согласие на участие в исследовании. Пациенты, включенные в исследование, получали стандартную антиангинальную и антиагрегантную терапию. Клинико-анамнестическая характеристика обследованных лиц представлена в таблице 1.
Таблица 1. Клинико-анамнестическая характеристика пациентов с ишемической болезнью сердца
Table 1. Clinical and anamnestic characteristics of patients with coronary artery disease
|
Показатели Parameters |
Пациенты с ИБС ( n = 125) Patients with CAD ( n = 125) |
|
Мужчины, n (%) Men, n (%) |
92 (73,6) |
|
Возраст, Me [ Q 25; Q 75], лет Age, Me [ Q 25; Q 75], years |
59 (53; 66) |
|
Индекс массы тела, Me [ Q 25 ; Q 75], кг/м2 BMI, Me [Q 25 ; Q 75], kg/m2 |
28,5 (25,3; 31,1) |
|
Артериальная гипертензия, n (%) Arterial hypertension, n (%) |
93 (74,4) |
|
Дислипидемия, n (%) Dyslipidemia, n (%) |
30 (24) |
|
Курение, n (%) Smoking, n (%) |
48 (38,4) |
|
Отягощенный семейный анамнез ИБС, n (%) Family history of CAD, n (%) |
23 (18,4) |
|
Клиника стенокардии до развития ИМ, n (%) Clinic of angina before the development of MI, n (%) |
59 (47,2) |
|
ИМ в анамнезе, n (%) History of MI, n (%) |
16 (12,8) |
|
ОНМК, ТИА в анамнезе, n (%) History of ACVA, TIA, n (%) |
5 (4) |
|
ХСН в анамнезе, n (%) History of CHF, n (%) |
32 (25,6) |
|
ХСН I ФК, n (%) CHF I FC, n (%) |
7 (5,6) |
|
ХСН II ФК, n (%) CHF II FC, n (%) |
23 (18,4) |
|
ХСН III ФК, n (%) CHF III FC, n (%) |
2 (1,6) |
|
ХСН IV ФК, n (%) CHF VI FC, n (%) |
0 (0) |
|
Атеросклероз других бассейнов, n (%) Atherosclerosis of other pools, n (%) |
40 (32) |
|
Нет стенокардии, n (%) No angina, n (%) |
66 (52,8) |
|
Стенокардия I ФК, n (%) Аngina FC I, n (%) |
22 (17,6) |
|
Стенокардия II ФК, n (%) Аngina FC II, n (%) |
32 (25,6) |
|
Стенокардия III ФК, n (%) Аngina FC III, n (%) |
3 (2,4) |
|
Однососудистое поражение КА, n (%) One-vessel CAD, n (%) |
48 (38,3) |
|
Двухсосудистое поражение КА, n (%) Two-vessel CAD, n (%) |
31 (24,4) |
|
Многососудистое поражение КА, n (%) Multivessel CAD (three or more CA), n (%) |
47 (37,3) |
Примечание: ИБС – ишемическая болезнь сердца, ИМ – инфаркт миокарда, КА – коронарные артерии, ОНМК – острое нарушение мозгового кровообращения, ТИА – транзиторные ишемические атаки, ФК – функциональный класс, ХСН – хроническая сердечная недостаточность.
Note: CAD – coronary artery disease, MI – myocardial infarction, CA – coronary arteries, ACVA – acute cerebrovascular accident, TIA – transient ischemic attacks, FC – functional class, CHF – chronic heart failure.
В анамнезе обследованных лиц преобладали артериальная гипертензия (74,4%), курение (38,4%), дислипидемия (24,0%). Для определения экспрессии генов и секреции адипоцитокинов были использованы изолированные адипоциты подкожной (ПЖТ), ЭЖТ и ПВЖТ, полученных во время коронарного шунтирования. Образцы ЭЖТ забирали из правых отделов сердца (правого предсердия и правого желудочка), ПЖТ – из подкожной клетчатки нижнего угла средостенной раны, ПВЖТ – из области ствола левой КА. Процедуру выделения адипоцитов из ЖТ осуществляли по методике, описанной ранее [1]. Экспрессию генов адипоцитокинов оценивали с помощью количественной полимеразной цепной реакции (ПЦР) с детекцией продуктов в режиме реального времени с использованием TaqMan зондов по Pfaffl-методу и выражали на логарифмической (log10) шкале в виде кратного изменения относительно контрольных образцов [2]. Нормирование результатов проводили по трем референсным генам (HPRT1, GAPDH и B2M) в соответствии с общепринятыми рекомендациями. Концентрацию адипо-нектина, лептина и ИЛ-6 в культуральной среде определяли с использованием тест-систем «Bender MedSystems GmbH» (Vienna, Austria), «Cloud-Clone Corp.» (USA) и «R&D Systems» (Canada) для иммуноферментного анализа согласно инструкции производителя тест-систем. Для оценки степени кальциноза КА пациентам выполнялась мультиспиральная компьютерная томография (МСКТ) области сердца с ЭКГ-синхронизацией на 64-сре-зовом спиральном компьютерном томографе «Siemens Somatom 64» (Siemens, ФРГ) по стандартной методике с пошаговым сканированием в краниокаудальном направлении. Область сканирования краниально была отграничена уровнем бифуркации трахеи, каудально – уровнем диафрагмы. Параметры сканирования: скорость вращения гентри – 1 с, толщина среза – 3 мм, напряжение на трубке – 120 мА, мощность – 120 кВ. Полученные нативные изображения в формате DICOM обрабатывались на мультимодальной рабочей станции «Leonardo» (Siemens, ФРГ). Кальциевый индекс (КИ) КА определялся по методу Агатстона с использованием программного пакета «Sygno Calcium Scoring» (Siemens AG Medical Solution, ФРГ). Полуавтоматически оценивался КИ для правой КА (CaScore RCA), ствола левой КА (CaScore LM), передней нисходящей (CaScore LAD) и огибающей (CaScore CX) артерий. Общий КИ (CaScore Total) определялся путем электронного маркирования участков плотностью более 130 ед. Хаусфилда (HU). На основании общего КИ по классификации Агатстона оценивались степени кальциноза КА: КИ = 0 – отсутствие кальциноза; КИ = 1–10 – минимальный кальциноз; КИ = 11–100 – средний кальциноз; КИ = 101–400 – умеренный кальциноз; КИ более 400 – массивный кальциноз.
В статистическом анализе полученных данных для описания количественных показателей использовались медиана ( Ме ) и межквартильный интервал ( Q 1; Q 3). Категориальные данные описывались абсолютными ( n ) и относительными (%) частотами. Проверка значимости различий между количественными показателями в общей группе проводилась по критерию Уилкоксона. Для выявления статистически значимых различий в независимых группах использовался критерий Манна – Уитни. Для оценки влияния на возникновение КК уровня мРНК ADIPOQ и его секреции в адипоцитах ЭЖТ, уровня мРНК LEР и секреции лептина в ЭЖТ, экспрессии IL6 и секреции ИЛ-6 в ПВЖТ применялась логистическая регрессия с вычислением отношения шансов (ОШ) и его 95%-го доверительного интервала (ДИ). Все статистические гипотезы проверялись при критическом уровне значимости p = 0,05.
Результаты
Установлено, что кальциноз КА в разной степени выраженности встречается в 95,2% случаев (119 пациентов). В общей группе пациентов медиана общего КИ составила 538,5 (209; 881). Среди пациентов с ИБС наиболее высокую распространенность имел массивный КК (58,8%). Чуть более трети пациентов имели признаки умеренного КК, тогда как средний КК встречался у 10,9%, минимальный КК выявлен не был (рис. 1).
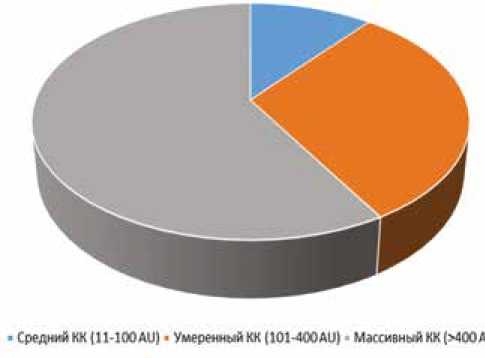
Рис. 1. Распространенность коронарного кальциноза у пациентов с ишемической болезнью сердца
Примечание: КК – коронарный кальциноз, AU – Agatston units.
Fig. 1. Prevalence of coronary calcification in patients with coronary artery disease
Note: CC – coronary calcification, AU – Agatston units.
В зависимости от выраженности КК пациенты с ИБС были разделены на две группы: первая группа – пациенты со средним и умеренным КК ( n = 72), вторая группа – с массивным КК ( n = 53). Клинико-анамнестическая характеристика пациентов представлена в таблице 2.
Таблица 2. Клинико-анамнестическая характеристика пациентов с ишемической болезнью сердца в зависимости от выраженности коронарного кальциноза
Table 2. Clinical and anamnestic characteristics of patients with coronary artery disease depending on the severity of coronary calcification
|
Показатели Parameters |
Пациенты с умеренным и средним КК ( n = 72) Patients with moderate and medium CC ( n = 72) |
Пациенты с массивным КК ( n = 53) Patients with massive CC ( n = 53) |
p |
|
1 |
2 |
||
|
Мужчины, n (%) Men, n (%) |
51 (70,8) |
41 (77,3) |
0,178 |
|
Возраст, Me [ Q 25; Q 75], лет Age, Me [ Q 25; Q 75], years |
61 [54; 67] |
66 [61; 71] |
0,131 |
|
Индекс массы тела, Me [ Q 25; Q 75], кг/м2 BMI, Me [ Q 25; Q 75], kg/m2 |
30,1 [26,4; 34] |
29,7 [26; 30] |
0,460 |
|
ОТ, Me [ Q 25; Q 75], см Waist, [ Q 25; Q 75], cm |
97 (88; 107) |
95 (86; 105) |
0,37 |
Окончание табл. 2
End of table 2
|
Показатели Parameters |
Пациенты с умеренным и средним КК ( n = 72) Patients with moderate and medium CC ( n = 72) |
Пациенты с массивным КК ( n = 53) Patients with massive CC ( n = 53) |
p |
|
1 |
2 |
||
|
ОТ/ОБ, Me [ Q 25; Q 75] Waist/Hip Ratio, Me [ Q 25; Q 75 ] |
0,98 (0,9; 1,1) |
0,96 (0,89; 1) |
0,28 |
|
Артериальная гипертензия, n (%) Arterial hypertension, n (%) |
55 (76,4) |
38 (71,7) |
0,478 |
|
Дислипидемия, n (%) Dyslipidemia, n (%) |
16 (22,2) |
8 (15) |
0,24 |
|
Курение, n (%) Smoking, n (%) |
27 (37,5) |
21 (39,6) |
0,422 |
|
Отягощенный семейный анамнез ИБС, n (%) Family history of CAD, n (%) |
4 (5,5) |
3 (5,6) |
0,34 |
|
ОНМК, ТИА в анамнезе, n (%) History of ACVA, TIA, n (%) |
1 (5,9) |
4 (19) |
0,155 |
|
ХСН в анамнезе, n (%) History of CHF, n (%) |
21 (29,1) |
11 (20,7) |
0,16 |
|
Атеросклероз других бассейнов, n (%) Atherosclerosis of other pools, n (%) |
24 (33,3) |
16 (30,2) |
0,093 |
|
Нет стенокардии, n (%) No angina, n (%) |
38 (52,7) |
25 (47,2) |
0,400 |
|
Стенокардия I ФК, n (%) Аngina I FC, n (%) |
14 (19,4) |
11 (20,8) |
0,76 |
|
Стенокардия II ФК, n (%) Аngina II FC, n (%) |
19 (26,3) |
14 (26,4) |
0,27 |
|
Стенокардия III ФК, n (%) Аngina III FC, n (%) |
2 (2,7) |
2 (3,7) |
0,14 |
|
ХСН I ФК, n (%) CHF FC I, n (%) |
4 (5,5) |
3 (5,6) |
0,41 |
|
ХСН II ФК, n (%) CHF FC II, n (%) |
21 (29,1) |
16 (30,2) |
0,24 |
|
ХСН III ФК, n (%) CHF FC III, n (%) |
2 (2,7) |
0 (0) |
0,58 |
|
ХСН IV ФК, n (%) CHF FC VI, n (%) |
0 (0) |
0 (0) |
– |
|
Однососудистое поражение КА, n (%) One-vessel CAD, n (%) |
26 (36,1) |
22 (41,5) |
0,18 |
|
Двухсосудистое поражение КА, n (%) Two-vessel CAD, n (%) |
17 (23,6) |
14 (26,4) |
0,33 |
|
Многососудистое поражение КА, n (%) Multivessel CAD (three or more CA), n (%) |
25 (34,7) |
21 (39,6) |
0,47 |
Примечание: ИБС – ишемическая болезнь сердца, ИМ – инфаркт миокарда, КА – коронарные артерии, ОНМК – острое нарушение мозгового кровообращения, ОТ – объем талии, ТИА – транзиторные ишемические атаки, ФК – функциональный класс, ХСН – хроническая сердечная недостаточность.
Note: CAD – coronary artery disease, MI – myocardial infarction, CA – coronary arteries, ACVA – acute cerebrovascular accident, TIA – transient ischemic attacks, FC – functional class, CHF –chronic heart failure.
Пациенты обеих групп были сопоставимы по полу и возрасту, а также распространенности факторов риска. Кроме того, вне зависимости от степени выраженности
КК не было выявлено различий в частоте встречаемости ОНМК, ТИА, атеросклеротического поражения других бассейнов, а также стенокардии и ХСН. По данным ко-ронароангиографии, распространенность одно-, двух- и трехсосудистого поражения КА в обеих группах не различалась.
При определении экспрессии ADIPOQ в различных типах ЖТ каждой из 2 групп пациентов было получено, что наибольший уровень экспрессии гена ADIPOQ во всех исследованных типах жировых депо наблюдался у пациентов с умеренным/средним КК по сравнению с лицами с массивным КК. Так, уровень мРНК адипонектина в культуре адипоцитов ПЖТ пациентов первой группы (с умеренным и средним КК) превышал показатели второй группы (с массивным КК) в 1,8 раза; в ЭЖТ – в 1,7 раза; в ПВЖТ – в 1,4 раза. Максимальная экспрессия ADIPOQ отмечалась в культуре адипоцитов ПВЖТ по сравнению с ПЖТ у лиц с умеренным/средним КК: уровень мРНК ADIPOQ в ПВЖТ превышал аналогичный показатель ПЖТ в 1,3 раза. Наименьшая медиана уровня экспрессии гена ADIPOQ наблюдалась в ЭЖТ относительно адипоцитов другой локализации как при умеренном/среднем КК, так и при массивном КК (рис. 2).
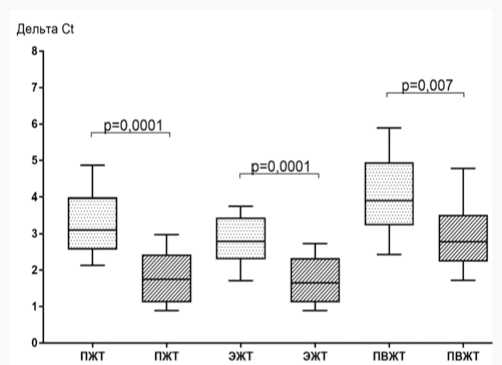
Рис. 2. Экспрессия ADIPOQ в различных жировых депо в зависимости от степени коронарного кальциноза у пациентов с ишемической болезнью сердца
Примечание: здесь и далее: p – уровень статистической значимости, ПВЖТ – периваскулярная жировая ткань, ПЖТ – подкожная жировая ткань, ЭЖТ – эпикардиальная жировая ткань, в – экспрессия адипоцитокинов у пациентов с умеренным/средним коронарным кальцинозом,
– экспрессия адипоцитокинов у пациентов с массивным коронарным кальцинозом.
Fig. 2. Expression of ADIPOQ in various fat depots depending on the degree of coronary calcification in patients with coronary artery disease Note: here and further: p – level of statistical significance, PVAT – perivascular adipose tissue, SAT – subcutaneous adipose tissue, EAT – epicardial adipose tissue,
– expression of adipocytokines in patients with moderate and medium coronary calcification,
– expression of adipocytokines in patients with massive coronary calcification.
Содержание адипонектина в культуре адипоцитов ЭЖТ было ниже, чем в ПЖТ как у пациентов с умерен-ным/средним КК, так и с массивным КК (в 1,3 и 1,4 раза соответственно), что говорит о его низкой секреции эпикардиальными адипоцитами по сравнению с подкожными. При этом медиана данного показателя у пациен- тов первой группы была выше, чем у пациентов второй группы (массивный КК) в 1,3 раза, что свидетельствует о снижении секреции адипонектина адипоцитами эпикардиальной локализации при увеличении степени КК. Секреция адипонектина адипоцитами ПВЖТ при массивном КК также была снижена относительно таковой при уме-ренном/среднем КК в 1,3 раза. Статистически значимых различий концентрации адипонектина в супернатанте культуры адипоцитов ПЖТ между группами пациентов выявлено не было (рис. 3).
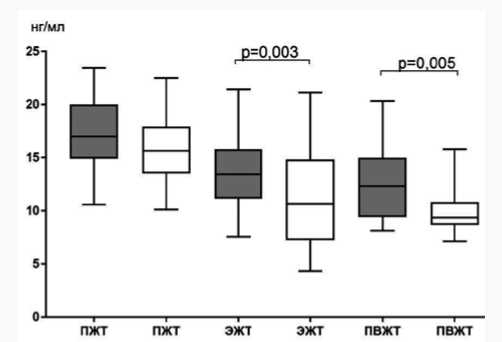
Рис. 3. Секреция адипонектина в различных жировых депо в зависимости от степени коронарного кальциноза у пациентов с ишемической болезнью сердца
Примечание:
– секреция адипоцитокинов у пациентов с умеренным/средним коронарным кальцинозом,
– секреция адипоцитокинов у пациентов с массивным коронарным кальцинозом.
Fig. 3. Secretion of adiponectin in various fat depots depending on the degree of coronary calcification in patients with coronary artery disease Note:
-
– secretion of adipocytokines in patients with moderate and medium coronary calcification,
-
– secretion of adipocytokines in patients with massive coronary calcification.
При изучении экспрессии гена LEP максимальные значения медиан наблюдались у пациентов обеих групп в культуре адипоцитов ЭЖТ относительно ПЖТ и ПВЖТ, при этом у лиц с массивным КК данный показатель превышал таковой у пациентов с умеренным/средним КК в 1,2 раза. При умеренном/среднем КК уровень мРНК гена LEP в ЭЖТ превышал показатели ПЖТ в 1,8 раза и ПВЖТ – в 2,5 раза, а в группе с массивным КК – в 1,8 и в 1,2 раза соответственно. Экспрессия гена LEP в ПВЖТ при массивном КК была выше, чем при умеренном/сред-нем КК в 2,3 раза, тогда как в ПЖТ статистически значимо не различалась в зависимости от степени КК (рис. 4).
Медиана концентрации лептина в супернатанте клеточных культур адипоцитов ЭЖТ при умеренном/среднем КК была в 1,2 раза ниже, чем при массивном КК. Секреция лептина в культуре адипоцитов ПЖТ и ПВЖТ у пациентов статистически значимо не различалась в зависимости от степени КК (рис. 5).
Определение экспрессии гена IL6 показало, что в ЭЖТ наблюдались максимальные уровни мРНК IL6 по отношению к ПЖТ и ПВЖТ как при умеренном/среднем КК (в 2,4 и 1,3 раза соответственно), так и при массивном КК
(в 2,0 и 1,4 раза соответственно). При этом уровень мРНК IL6 в адипоцитах ЭЖТ у лиц второй группы превышал таковой пациентов первой группы в 1,5 раза. Экспрессия гена IL6 в периваскулярных адипоцитах при умеренном/ среднем КК была в 1,4 раза ниже, чем при массивном КК. Подкожные адипоциты не отличались между собой по уровню экспрессии гена IL6 (рис. 6).
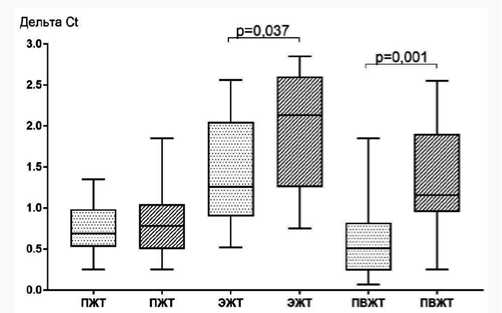
Рис. 4. Экспрессия LEР в различных жировых депо в зависимости от степени коронарного кальциноза у пациентов с ишемической болезнью сердца
Fig. 4. Expression of LEP in different fat depots depending on the degree of coronary calcification in patients with coronary artery disease
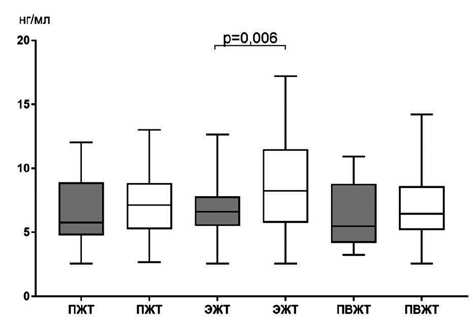
Рис. 5. Секреция лептина в различных жировых депо в зависимости от степени коронарного кальциноза у пациентов с ишемической болезнью сердца
Fig. 5. Secretion of leptin in various fat depots depending on the degree of coronary calcification in patients with coronary artery disease
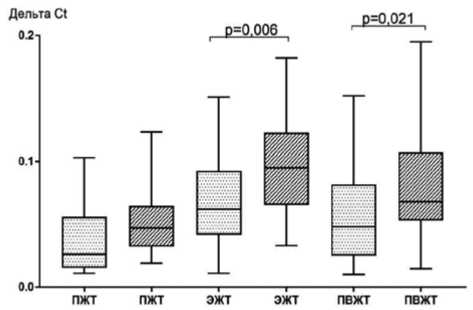
Рис. 6. Экспрессия IL6 в различных жировых депо в зависимости от степени коронарного кальциноза у пациентов с ишемической болезнью сердца
Fig. 6. Expression of IL6 in various fat depots depending on the degree of coronary calcification in patients with coronary artery disease
Секреция ИЛ-6 адипоцитами ЭЖТ также превышала показатели других изучаемых жировых депо как у пациентов с умеренным/средним КК, так и с массивным КК. Так, у пациентов первой группы концентрация ИЛ-6 в супернатанте ЭЖТ была выше, чем в адипоцитах ПЖТ и ПВЖТ в 2,5 и 2,0 раза соответственно, а у больных с массивным КК – в 2,0 и 1,8 раза соответственно.
При этом значения во второй группе (массивный КК) превышали аналогичные показатели первой группы сравнения (умеренный/средний КК) в 1,1 раза. Секреция данного цитокина адипоцитами подкожной и периваскулярной локализации при массивном КК превышала таковую при умеренном/среднем КК в 1,4 и 1,3 раза соответственно (рис. 7).
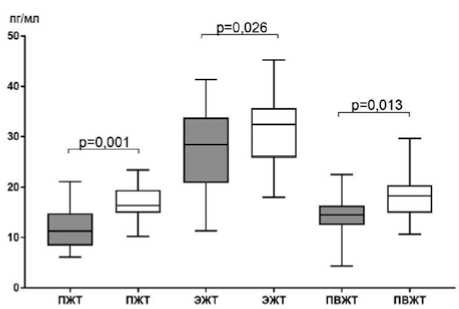
Рис. 7. Секреция интерлейкина-6 в различных жировых депо в зависимости от степени коронарного кальциноза у пациентов с ишемической болезнью сердца
Fig. 7. Secretion of interleukin-6 in various fat depots depending on the degree of coronary calcification in patients with coronary artery disease
По данным логистического регрессионного анализа, снижение уровня мРНК ADIPOQ и его секреции в адипоцитах ЭЖТ увеличивало шансы наличия кальциноза КА у пациентов с ИБС в среднем в 2 раза, снижение аналогичных показателей в ПВЖТ – в 1,25 и 1,6 раза соответственно. Увеличение уровня мРНК LEР и секреции лептина в ЭЖТ повышало КК в 1,7 и 1,5 раза соответственно, секреции в ПВЖТ – в 1,4 раза. Повышение экспрессии IL6 и секреции ИЛ-6 в ПВЖТ также увеличивало шансы наличия кальциноза КА в 1,2 и 1,3 раза соответственно (табл. 3).
Таблица 3 . Результаты логистического регрессионного анализа прогностической значимости адипоцитокинов локальных жировых депо в оценке наличия массивного кальциноза коронарных артерий
Table 3. Logistic regression analysis results on prognostic significance of adipocytokines from local fat deposits in assessing the presence of massive coronary artery calcification
|
Показатели Parameters |
Отношение шансов (ОШ) Odds ratio (OR) |
95% ДИ 95% CI |
p |
|
|
Нижняя граница Lower limit |
Верхняя граница Upper limit |
|||
|
Экспрессия ADIPOQ в ЭЖТ ADIPOQ expression in EAT |
0,5 |
0,18 |
0,79 |
< 0,001 |
|
Секреция адипонекти-на в ЭЖТ, мг/мл Secretion of adiponectin in EAT, mg/mL |
0,6 |
0,20 |
0,85 |
< 0,001 |
Окончание табл. 3
End of table 3
|
Показатели Parameters |
Отношение шансов (ОШ) Odds ratio (OR) |
95% ДИ 95% CI |
p |
|
|
Нижняя граница Lower limit |
Верхняя граница Upper limit |
|||
|
Экспрессия ADIPOQ в ПВЖТ ADIPOQ expression in PVAT |
0,8 |
0,31 |
1,25 |
< 0,001 |
|
Секреция адипонекти-на в ПВЖТ, мг/мл Secretion of adiponectin in PVAT, mg/mL |
0,6 |
0,19 |
0,87 |
< 0,001 |
|
Экспрессия LEР в ЭЖТ LEР expression in EAT |
1,7 |
1,23 |
2,13 |
< 0,001 |
|
Секреция лептина в ЭЖТ, мг/мл Leptin secretion in EAT, mg/mL |
1,5 |
1,17 |
1,84 |
< 0,001 |
|
Секреция лептина в ПВЖТ, мг/мл Leptin secretion in PVAT, mg/mL |
1,4 |
1,07 |
1,83 |
< 0,001 |
|
Экспрессия IL6 в ПВЖТ IL6 expression in PVAT |
1,2 |
1,03 |
1,75 |
< 0,001 |
|
Секреция ИЛ-6 в ПВЖТ, пг/мл IL-6 secretion in PVAT, pg/mL |
1,3 |
1,05 |
1,77 |
< 0,001 |
Обсуждение
В настоящее время ЖТ рассматривается как активный эндокринный орган, являющийся источником большого количества адипоцитокинов с различными биологическими эффектами. Появляется все больше данных о том, что адипоцитокины могут быть связующим звеном между атеросклерозом и кальцинозом КА, выступая в качестве промоторов или ингибиторов данных патологических процессов. Результаты проведенного исследования свидетельствуют о том, что у пациентов с ИБС, имеющих массивную степень кальциноза КА, наблюдались существенные отличия в экспрессии генов адипокинов (адипо-нектина и лептина) и провоспалительного цитокина ИЛ-6 в адипоцитах эпикардиальной и периваскулярной локализации. Вслед за экспрессией генов менялась и продукция адипоцитокинов; адипоциты эпикарда характеризовались усиленной продукцией ИЛ-6 и низким уровнем продукции адипонектина по сравнению с адипоцитами других жировых депо.
Существует несколько потенциальных механизмов, объясняющих данный феномен. Наиболее очевидная причина кроется в низком уровне оксигенации адипоцитов вследствие нарушения кровоснабжения миокарда (как известно, ЖТ сердца имеет общую циркуляцию с миокардом) у пациентов с ИБС. Гипоксия ЖТ, в свою очередь, индуцирует воспалительную реакцию и микрокальцификацию сосудистой стенки КА. Результаты иммуногистохимических исследований демонстрируют, что гипоксические области в ЖТ значительно обогащены макрофагами, что указывает на связь между низким парциальным давлением кислорода и накоплением иммунных клеток. Это предполагает непосредственную связь между гипоксией и активацией воспалитель- ной реакции в ЖТ. Кроме того, в ответ на низкое парциальное давление О2 в адипоцитах экспрессируются транскрипционные факторы (HIFs), запускающие синтез белков, участвующих в широком спектре клеточных функций, включая утилизацию глюкозы, ангиогенез, апоптоз, ремоделирование внеклеточного матрикса, воспаление и микрокальцификацию. В то же время экспрессия белков, обладающих кардиопротективными и антикальцифицирующими эффектами, уменьшается. К таким белкам относят адипонектин. Согласно данным B.-K. Son и соавт., адипонектин является ингибитором патогенеза кальцификации сосудов как in vitro, так и in vivo [4]. Адипонектин in vitro ингибирует действие фактора некроза опухоли а (ФНО-а) на фосфат-индуцирован-ный апоптоз ГМК. Через активацию аденозинмонофос-фат-активируемой протеинкиназы (AMPK) адипонектин увеличивает экспрессию гена остановки роста-6 (Gas6) [4]. В свою очередь, внутриклеточный путь Gas6/Фос-фатидилинозитол-3-киназа/протеинкиназа-В усиливает фосфорилирование AMPK и потенцирует защитные эффекты адипонектина против кальцификации сосудов [4]. О положительном влиянии адипонектина на уменьшение кальцификации артерий свидетельствуют данные X.H. Luo и соавт. Так, у мышей с дефицитом адипонектина наблюдалась спонтанная артериальная кальцификация, повышенная экспрессия щелочной фосфатазы, остеокальцина и ключевого фактора транскрипции (Runx2), связанного с дифференцировкой ГМК в остеобласты. При восполнении дефицита адипонектина подобных эффектов не наблюдалось, и кальцификация артериальной стенки не развивалась. Эти результаты являются прямым доказательством того, что адипонектин является важным регулятором кальцификации сосудов. Молекулярные механизмы ингибирующего действия адипонектина на остеобластную дифференцировку ГМК реализуются за счет подавления экспрессии Runx2 повышенным фосфорилированием p38 митоген-акти-вированных протеинкиназ (MAPK) и ингибированием образования минеральных узелков внеклеточного матрикса [5]. Результаты, полученные нами ранее, свидетельствуют о критически низком уровне экспрессии гена адипонектина в изолированных адипоцитах ЭЖТ в сравнении с адипоцитами другой локализации у пациентов с ИБС [3].
В рамках настоящего исследования показано, что снижение уровня мРНК ADIPOQ и секреции адипонек-тина в ЭЖТ и ПВЖТ ассоциировано с массивным КК. При этом максимальная экспрессия ADIPOQ отмечалась в культуре адипоцитов ПВЖТ по сравнению с ПЖТ у лиц с умеренным/средним КК: уровень мРНК ADIPOQ в ПВЖТ превышал аналогичный показатель ПЖТ в 1,3 раза. Наименьший уровень экспрессии гена ADIPOQ наблюдался в ЭЖТ относительно адипоцитов другой локализации как при умеренном/среднем КК, так и при массивном КК (см. табл. 3, рис. 2).
Низкая экспрессия адипонектина в ЭЖТ является индуктором синтеза провоспалительного ИЛ-6, экспрессия и секреция которого, по-видимому, не контролируются факторами, индуцируемыми гипоксией (HIFs), и поэтому ИЛ-6 способен запускать эскалацию атеросклеротических процессов в КА. Кроме того, показано, что высокая концентрация ИЛ-6 сопровождается эктопической кальцификацией [6], которая сопряжена с хроническим воспалением. Уровень ИЛ-6 связан с увеличением шан- сов наличия тяжелого КК с поправкой на возраст, пол, образ жизни, факторы риска ССЗ [7]. В проведенном нами исследовании экспрессия и секреция ИЛ-6 в ЭЖТ и ПВЖТ были ассоциированы с массивным КК. Предполагается стимулирующее действие на кальцификацию сосудов ИЛ-6 за счет множества эффекторов [8]. In vitro ИЛ-6 может противодействовать влиянию антиостеоген-ных генов, например, матриксного Gla белка (MGP), на остеогенную активность костного морфогенетического белка (BMP), способствуя продукции белка теплового шока 70 (HSP70) в эндотелиальных клетках аорты, тем самым усиливая BMP-индуцированную кальцификацию сосудов [9].
Другим адипокином, потенцирующим эффекты ИЛ-6, является лептин [7, 10, 11]. Следует отметить, что лептин обладает собственной прокальцифицирующей активностью. В исследованиях как in vitro [12], так и in vivo [13] показано, что лептин, как и ИЛ-6, может активировать маркеры дифференцировки остеобластов, включая щелочную фосфатазу, остеокальцин и остео-понтин в ГМК, и сигнальный путь ERK1/2 митоген-акти-вированных протеинкиназ, способствуя дифференцировке ГМК в остеобластоподобные клетки. Более того, лептин способен индуцировать окислительный стресс за счет увеличения экспрессии НАДФН-оксидазы и рецептора ангиотензина II типа-1 (AT1R) [14–16]. Было также установлено, что лептин оказывает свое биологическое действие на дифференцировку ГМК в остеобласты посредством генерации ФНО-α, ИЛ-6 и хемоаттрактантного белка моноцитов-1 [17–19]. Кроме того, активированный путь фосфатидилинозитол-3-киназа/протеинкиназа-B (PI3K/AKT) вносит существенный вклад в регуляцию экспрессии Runx2, повышая данный фактор транскрипции [20]. Эти факты убедительно указывают на то, что лептин оказывает прямое стимулирующее действие на дифференцировку и гипертрофию ГМК в остеобласты, что может способствовать патогенезу кальцификации сосудов. Полученные нами данные подтверждают наличие ассоциации высокого уровня лептина в ЖТ сердца и сосудов с КК.
Заключение
Среди пациентов с ИБС в условиях недостаточности кровоснабжения миокарда наблюдается ремоделирование ЖТ, что приводит к гипоксии адипоцитов и формированию провоспалительного фенотипа как самих адипоцитов, так и клеток микроокружения. Адипоциты в условиях гипоксии начинают усиленно секретировать хе-мокины, вызывающие инфильтрацию макрофагов, нейтрофилов, лимфоцитов и тучных клеток, инициирующих каскад воспалительных сигналов, таких как ИЛ-6, что усугубляет сосудистую дисфункцию за счет активации эндотелиальных клеток и пролиферации ГМК [21, 22]. ГМК, в свою очередь, дифференцируются в остеобласты и в условиях гипоксии подвержены апоптозу. Кроме того, провоспалительные адипокины, продуцируемые адипоцитами при гипоксии, вызывают кальцификацию сосудов за счет стимуляции окислительного стресса, дифференцировки остеобластов, апоптоза и пролиферации ГМК. Эндотелиальные клетки при стимуляции провоспалительными адипоцитокинами демонстрируют тенденцию к трансформации в остеобласты, что еще более усугубляет степень сосудистого воспаления и кальцификации.
Список литературы Взаимосвязь экспрессии генов адипоцитокинов и кальцификации коронарных артерий у пациентов с ишемической болезнью сердца
- Груздева О.В., Акбашева О.Е., Дылева Ю.А., Антонова Л.В., Матвеева В.Г., Учасова Е.Г. и др. Адипокиновый и цитокиновый профили эпикардиальной и подкожной жировой ткани у пациентов с ише-мической болезнью сердца. Бюллетень экспериментальной биологии и медицины. 2017;163(5):560-563. DOI: 10.1007/s10517-017-3860-5. Gruzdeva O.V., Akbasheva O.E., Dyleva Yu.A., Antonova L.V., Matveeva V.G., Uchasova E.G. et al. Adipokine and cytokine profiles of epicardial and subcutaneous adipose tissue in patients with coronary artery disease. Bull. Exp. Biol. Med. 2017;163(5):608-611 (In Russ.). DOI: 10.1007/s10517-017-3860-5.
- Дылева Ю.А., Груздева О.В., Белик Е.В., Акбашева О.Е., Учасова Е.Г., Бородкина Д.А. и др. Экспрессия гена и содержание ади-понектина в жировой ткани у пациентов с ишемической болезнью сердца. Биомедицинская химия. 2019;65(3):239-244. DOI: 10.18097/ pbmc20196503239. Dyleva Yu.A., Gruzdeva O.V., Belik E.V., Akbasheva O.E., Uchasova E.G., Borodkina D.A. et al. Gene expression and adiponectin content in adipose tissue in patients with coronary artery disease. Biomed. Khim. 2019;65(3):239-244 (In Russ.). DOI: 10.18097/pbmc20196503239.
- Gruzdeva O., Uchasova E., Dyleva Yu., Borodkina D., Akbasheva O., Antonova L. et al. Adipocytes directly affect coronary artery disease pathogenesis via induction of adipokine and cytokine imbalances. Front. Immunol. 2019;10:2163. DOI: 10.3389/fimmu.2019.02163.
- Son B.-K., Akishita M., Iijima K., Kozaki K., Maemura K., Eto M. et al. Adiponectin antagonizes stimulatory effect of tumor necrosis factor-a on vascular smooth muscle cell calcification: Regulation of growth arrest-specific gene 6-mediated survival pathway by adenosine 5'-mono-phosphate-activated protein kinase. Endocrinology. 2008;149(4):1646-1653. DOI: 10.1210/en.2007-1021.
- Luo X.H., Zhao L.L., Yuan L.Q., Wang M., Xie H., Liao E.Y. Development of arterial calcification in adiponectin-deficient mice: Adiponectin regulates arterial calcification. J. Bone Miner. Res. 2009;24(8):1461-1468. DOI: 10.1359/jbmr.090227.
- Fukuyo S., Yamaoka K., Sonomoto K., Oshita K., Okada Y., Saito K. et al. IL-6-accelerated calcification by induction of ROR2 in human adipose tissue-derived mesenchymal stem cells is STAT3 dependent. Rheumatology. 2014;53(7):1282-1290. DOI: 10.1093/rheumatology/ket496.
- Larsen B.A., Laughlin G.A., Cummins K., Barrett-Connor E., Wasse C.L. Adipokines and severity and progression of coronary artery calcium: Findings from the Rancho Bernardo Study. Atherosclerosis. 2017;265:1-6. DOI: 10.1016/j.atherosclerosis.2017.07.022.
- Du B., Ouyang A., Eng J.S., Fleenor B.S. Aortic perivascular adipose-derived interleukin-6 contributes to arterial stiffness in low-density lipopro-tein receptor deficient mice. Am. J. Physiol. Heart Circulatory Physiol. 2015;308(11):H1382-H1390. DOI: 10.1152/ajpheart.00712.2014.
- Yao Y., Watson A.D., Ji S., Bostrom K.I. Heat shock protein 70 enhances vascular bone morphogenetic protein-4 signaling by binding matrix Gla protein. Circ. Res. 2009;105(6):575-584. DOI: 10.1161/circresa-ha.109.202333.
- Reilly M.P., Iqbal N., Schutta M., Wolfe M.L., Scally M., Localio A.R. et al. Plasma leptin levels are associated with coronary atherosclerosis in type 2 diabetes. J. Clin. Endocrinol. Metab. 2004;89(8):3872-3878. DOI: 10.1210/jc.2003-031676.
- Qasim A., Mehta N.N., Tadesse M.G., Wolfe M.L., Rhodes T., Gir-man C. et al. Adipokines, insulin resistance and coronary artery calcification. J. Am. Coll. Cardiol. 2008;52(3): 231-236. DOI: 10.1016/j. jacc.2008.04.016.
- Parhami F., Tintut Y., Ballard A., Fogelman A.M., Demer L.L. Leptin enhances the calcification of vascular cells: artery wall as a target of leptin. Circ. Res. 2001;88(9):954-960. DOI: 10.1161/hh0901.090975.
- Zeadin M., Butcher M., Werstuck G., Khan M., Yee C.K., Shaughnessy S.G. Effect of leptin on vascular calcification in apolipoprotein E-deficient mice. Arterioscler. Thromb. Vasc. Biol. 2009;29(12):2069-2075. DOI: 10.1161/atvbaha.109.195255.
- Dong F., Zhang X., Ren J. Leptin regulates cardiomyocyte contractile function through endothelin-1 receptor-NADPH oxidase pathway. Hypertension. 2006;47(2):222-229. DOI: 10.1161/01. hyp.0000198555.51645.f1.
- Schroeter M.R., Stein S., Heida N.-M., Leifheit-Nestler M., Cheng I.-F., Gogiraju R. et al. Leptin promotes the mobilization of vascular progenitor cells and neovascularization by NOX2-mediated activation of MMP9. Cardiovasc. Res. 2012;93(1):170-180. DOI: 10.1093/cvr/cvr275.
- Zeidan A., Purdham D.M., Rajapurohitam V., Javadov S., Chakrabarti S., Karmazyn M. Leptin induces vascular smooth muscle cell hypertrophy through angiotensin II- and endothelin-1-dependent mechanisms and mediates stretchinduced hypertrophy. J. Pharmacol. Exp. Ther. 2005;315(3):1075-1084. DOI: 10.1124/jpet.105.091561.
- Fantuzzi G., Faggioni R. Leptin in the regulation of immunity, inflammation, and hematopoiesis. J. Leukoc. Biol. 2000;68(4):437-446.
- Bastard J.P., Maachi M., Lagathu C., Kim M.J., Caron M., Vidal H. et al. Recent advances in the relationship between obesity, inflammation, and insulin resistance. Eur. Cytokine Netw. 2006;17(1):4-12.
- Vaughan T., Li L. Molecular mechanism underlying the inflammatory complication of leptin in macrophages. Mol. Immunol. 2010;47(15):2515-2518. DOI: 10.1016/j.molimm.2010.06.006.
- Byon C.H., Javed A., Dai Q., Kappes J.C., Clemens T.L., Darley-Usmar V.M. et al. Oxidative stress induces vascular calcification through modulation of the osteogenic transcription factor Runx2 by AKT signaling. J. Biol. Chem. 2008;283(22):15319-15327. DOI: 10.1074/jbc. m800021200.
- Szasz T., Bomfim G.F., Webb R.C. The influence of perivascular adipose tissue on vascular homeostasis. Vascular Health and Risk Management. 2013;9:105-116. DOI: 10.2147/vhrm.s33760.
- Fernandez-Alfonso M.S., Gil-Ortega M., García-Prieto C.F., Aranguez I., Ruiz- Gayo M., Somoza B. Mechanisms of perivascular adipose tissue dysfunction in obesity. Int. J. Endocrinol. 2013;2013:402053. DOI: 10.1155/2013/402053.


