Взаимосвязь метаболизма жирных кислот и перекисного окисления липидов у двух видов байкальской эндемичной водоросли Draparnaldioides
Автор: Васильева Ульяна Андреевна, Кириченко Кузьма Анатольевич, Тимофеев Максим Анатольевич, Грабельных Ольга Ивановна
Журнал: Вестник Бурятского государственного университета. Биология, география @vestnik-bsu-biology-geography
Рубрика: Биология
Статья в выпуске: 1, 2023 года.
Бесплатный доступ
Макроводоросли являются одним из важных звеньев водных экосистем, служат источником органического вещества, местообитанием и источником биологически активных веществ для многих бентосных организмов. Изучение метаболических процессов в клетках эндемичных водорослей оз. Байкал представляет особый интерес. В работе оценивали жирнокислотный состав (ЖК-состав), содержание пероксида водорода и малонового диальдегида (МДА) у двух видов эндемичного рода Draparnaldioides (D. arnoldi и D. baicalensis) сразу после вылова и при культивировании в лабораторных условиях. При культивировании выявлены разнонаправленные изменения в содержании ЖК и МДА, но не пероксида водорода. Обсуждается связь метаболизма ЖК и перекисного окисления липидов у водных организмов.
Перекисное окисление липидов, жирные кислоты, эндемик, озеро байкал, водоросли, малоновый диальдегид
Короткий адрес: https://sciup.org/148326438
IDR: 148326438 | УДК: 57(577.2) | DOI: 10.18101/2587-7143-2023-1-3-11
Текст научной статьи Взаимосвязь метаболизма жирных кислот и перекисного окисления липидов у двух видов байкальской эндемичной водоросли Draparnaldioides
Введение. Эндемичные макроводоросли рода Draparnaldioides sp. выполняют немалую роль в растительной продукции оз. Байкал и являются основной водорослью третьего растительного пояса и захватывают глубины от 2,5 до 12–25 м [2; 4]. Род Draparnaldioides относится к отделу Chlorophita , класс Ulotrichophyceae , порядок Ulotrichales, подпорядок Chaetophorineae , семейство Chaetophoraceae , подсемейство Chaetophorideae , род Draparnaldioides (Meyer et Skabitsch ex Vishnyakov, 2020). С сентября 2020 г. род Draparnaldioides насчитывает 10 видов: D. arenaria, D. arnoldii, D. baikalensis, D. goroschankinii, D. lubrica, D. pumila, D. pilosa, D. plumose, D. simplex и D. vilosa [9]. Описание водоросли наиболее полно отображено у Л. А. Ижболдиной в книге «Атлас и определитель водорослей бентоса и перифитона озера Байкал (мейо- и макрофиты) с краткими очерками по их экологии» (2007). Талломы водоросли кустиковидные, высотой до 10–40 см, имеют главный ствол, от которого отходят крупные ветви 2-го и 3-го порядка, несущие боковые веточки, располагающиеся мутовками, реже одиночные или супротивные [4]. Водоросль имеет мощный ризоидный покров и слизистый чехол, защищающие растение от сильного волнового воздействия. Также у водоросли наблюдается сетчато-продырявленный хлоропласт, занимающий всю высоту клетки [4]. Активная вегетация водоросли приходится на весенне-осенний временной период (по данным Л. А. Ижболдиной — с июня по октябрь).
Все растительные и животные организмы оз. Байкал обитают в условиях невысоких температур, малого количества органических веществ, низкой минерализации и высокого содержания кислорода (до 14 мг/л). Макроводоросль ведет прикрепленный образ жизни, вследствие чего не может уйти от воздействия неблагоприятных факторов окружающей среды. Высокое содержание кислорода и прозрачность воды оз. Байкал в той или иной мере должны отражаться на процессах защиты водоросли от окислительного стресса. Индикатором окислительного стресса в талломах водорослей может служить оценка уровня перекисного окисления липидов (ПОЛ) в клеточных мембранах [5]. У прикрепленной формы морской красной водоросли Ahnfeltiopsis flabelliformis показана активация ПОЛ в периоды высокой освещенности (апрель, июль — сентябрь) [5]. В этот же период авторы наблюдали снижение концентрации фотосинтетических пигментов в результате фотоповреждения. В литературе отсутствуют какие-либо сведения по физиологии и биохимии макроводоросли рода Draparnaldioides sp. и ее устойчивости к неблагоприятным факторам среды. Ранее нами были обнаружены отличия между отдельными видами Draparnaldioides sp. (D. arnoldi и D. baicalensis) по содержанию фотосинтетических пигментов и жирных кислот (ЖК) суммарных липидов при культивировании макроводоросли в лабораторных условиях [1]. Разнонаправленные изменения ЖК-состава могут свидетельствовать о различиях в содержании активных форм кислорода (АФК) и/или интенсивности протекания ПОЛ [6].
Целью работы являлось изучение физиолого-биохимических параметров у макроводоросли в момент вылова и в процессе культивирования в лабораторных условиях.
В задачи данного исследования входило: 1) оценить содержание пероксида водорода и продуктов ПОЛ в талломах D. arnoldii и D. baicalensis сразу после вылова и в процессе культивирования в лабораторных условиях; 2) провести сравнительный анализ содержания продуктов ПОЛ и Н 2 О 2 с изменениями ЖК-состава у изученных видов.
Материалы и методы. Объектом исследования являются два вида — D. ar-noldii и D. baicalensis . Виды различаются между собой по форме боковых веточек и наличию/отсутствию у них рахиса. У D. arnoldii рахис в боковых веточках выражен, боковые веточки в очертаниях округлые, веерообразно разветвлены [4]. У D. baicalensis рахис в боковых веточках короткий, состоящий обычно из 1–2 клеток, от которых сразу начинаются ветви более-менее одинакового размера, обильно ветвящиеся в верхней части и имеющие округло-треугольную форму [4]. Если же сравнивать визуально, то D. arnoldii является более тонкой и изящной, не имеет массивного слизистого чехла, в то время как D. baicalensis — достаточно массивная и у нее присутствует заметный слизистый чехол, наблюдаемый при окраске препарата тушью (рис. 1).
Для работы пробы макроводоросли отбирали в конце августа — начале сентября на оз. Байкал в районе пос. Большое Голоустное по координатам от 52°01'33.6"N 105°25'06.7"E до 52°01'33.5"N 105°25'59.3"E. Температура воды в момент вылова составляла 11 ° С. Водоросль брали с уреза воды на глубинах до 0,5 м. Идентификацию проводили согласно определителю Л. А. Ижболдиной [4]. Часть талломов фиксировали сразу на месте в жидком азоте. Основную биомассу водоросли перевозили в сумках-холодильниках для постановки опыта по культивированию в лабораторных условиях. Культивировали водоросль в байкальской воде в течение 14 суток при непрерывном освещении с интенсивностью 2 500 лк в инкубаторе MIR-153 (Sanyo, Япония). На 7-е и 14-е сутки фиксировали материал (талломы) в жидком азоте для сравнения с точкой отбора.
Содержание H 2 O 2 определяли с ксиленоловым оранжевым [7]. Для этого навеску таллома водоросли (0,25 г) замораживали в жидком азоте и затем растирали в 2,5 мл 0,1%-ной трихлоруксусной кислоты (ТХУ) на льду. Гомогенат центрифугировали 15 мин на 12 000 g при 4 оС. Для определения содержания пероксида водорода супернатант разводили 0,1%-ной ТХУ (1:4) и готовили смесь

а б
Рис. 1. Внешний вид исследуемых макроводорослей. а — D. arnoldi ; б — D. baicalensis. Показан внешний вид без микроскопа (нижнее фото в чашках Петри), микроскопия талломов (среднее фото) и окрашенные тушью препараты (верхнее фото) Бар равен 500 μm.
супернатанта и реагента в соотношении 1:1 (по 0,5 мл каждого). Состав реагента: 0,5 мМ FeSO 4 × (NH 4 ) 2 SO 4 × 6H 2 O, 0,5%-ной (v/v) H 2 SO 4 , 200 мкМ ксиленолового
оранжевого (AppliChem, Германия) и 200 мМ сорбитола (Gerbu, Германия). Смесь инкубировали в течение 25 мин на мини-термошейкере TS-100 (BioSan, Латвия) при температуре 26 °С, затем пробы центрифугировали при 12 000 g в течение 5 мин. Определяли поглощение конечного продукта спектрофотометрически (SmartSpec Plus, Bio-Rad, США) при 560 нм. Содержание Н 2 О 2 рассчитывали по калибровочной кривой и выражали в мкМ/г сырого веса [3].
Содержание продуктов ПОЛ оценивали по накоплению в тканях продуктов, реагирующих с тиобарбитуровой кислотой (ТБК-РП) [8]. Для определения содержания ТБК-РП 0,5 мл супернатанта добавляли к 1 мл 0,5%-ной (w/v) ТБК (Диаэм, Россия) в 20%-ной ТХУ. Смесь инкубировали на кипящей водяной бане 30 мин, останавливали реакцию охлаждением, помещая пробирки в лед. Образцы центрифугировали 5 мин при 12 000 g и измеряли абсорбцию при 532 и 600 нм. Содержание ТБК-РП рассчитывали с использованием коэффициента экстинкции ТБК 155 мМ–1 см–1 после вычитания неспецифического поглощения при 600 нм и выражали в нМ/г сырого веса [3].
Данные представлены как среднее арифметическое с разбросом значений в виде стандартного отклонения в случае нормального распределения данных или как медианное значение с разбросом значений в виде интерквартильной широты (25; 75% процентиль) в случае распределения, отличающегося от нормального. Нормальность распределения проверяли с помощью критерия Шапиро — Уилка. Для доказательства значимых различий в случае нормального раcпределения данных использовали метод множественного сравнения средних Фишера или метод Тьюки, в случае распределения данных, отличающихся от нормального, использовали критерий Крас-келла — Уоллиса. Различия между данными считали статистически значимыми при p <0,05. Количество биологических повторностей было 2–3. Статистические расчеты осуществляли с помощью программного пакета SigmaPlot 12.0.
Результаты и обсуждение. Ранее было показано, что культивирование D. ar-noldii и D. baicalensis в лабораторных условиях приводило к изменению жирнокислотного состава талломов водоросли. Содержание ЖК у двух видов макроводоросли на момент вылова не различалось, но в процессе культивирования происходили разнонаправленные изменения. У D. arnoldii в процессе культивирования количество ненасыщенных ЖК увеличилось, в то время как у D. baicalensis количество ненасыщенных ЖК снизилось (рис. 2).
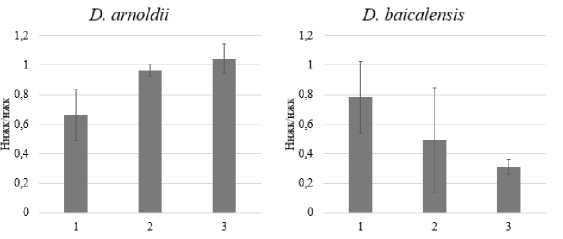
1 — 0 суток; 2 — 7 суток; 3 — 14 суток
Рис. 2. Изменение отношения суммы ненасыщенных ЖК к сумме насыщенных у двух видов Draparnaldioides сразу после вылова (0 суток), через 7 и 14 суток культивирования в лабораторных условиях . Представлено среднее значение и его стандартное отклонение
Снижение содержания ненасыщенных ЖК может свидетельствовать об интенсификации процессов ПОЛ. Одним из продуктов ПОЛ является малоновый диальдегид (МДА), который рассматривается в качестве маркера окислительного стресса. МДА наряду с другими «тиобарбитуро-реактивными продуктами» вступает в реакцию с тиобарбитуровой кислотой с образованием состава, который можно определить спектрофотометрически.
На рисунке 3 представлено содержание ТБК-РП в талломах анализируемых видов сразу после вылова и в течение 14 суток культивирования. Содержание МДА у двух видов макроводоросли изначально отличается и разнонаправленно изменяется в процессе культивирования (рис. 3). Содержание ТБК-РП было выше у D. baicalensis по сравнению с D. arnoldii на 39%. При этом у D. arnoldii наблюдали небольшой рост данных продуктов на 14-е сутки культивирования, однако различия в содержании были статистически незначимы (Р=0,069). У D. baicalensis происходило значимое снижение данного показателя в процессе культивирования (P = <0,001), на 7-е сутки снижение составило 30%, а на 14-е — 74% относительно точки вылова (0 суток).
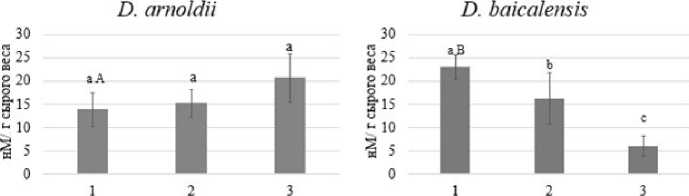
1 — 0 суток; 2 — 7 суток; 3 — 14 суток
Рис. 3. Изменение количества ТБК-РП у двух видов Draparnaldioides сразу после вылова (0 суток), через 7 и 14 суток культивирования в лабораторных условиях. Одинаковыми строчными буквами обозначены статистически не различающиеся варианты внутри вида. Прописными буквами обозначены различия между видами. Представлено среднее значение и его стандартное отклонение
Полученные результаты свидетельствуют, что у обоих видов макроводоросли отсутствует активация процессов ПОЛ, а изменения в содержании ТБК-РП, по-видимому, являются следствием изменений в содержании ненасыщенных ЖК-субстратов ПОЛ.
Процесс ПОЛ запускается активными формами кислорода, поэтому проанализировали содержание одного из видов АФК — пероксида водорода в талломах макроводоросли (рис. 4). Значимых изменений в содержании Н 2 О 2 как сразу после вылова, так и в процессе культивирования отдельных видов, не обнаружили, хотя у D. baicalensis видна тенденция к снижению данного параметра на 14-е сутки культивирования.
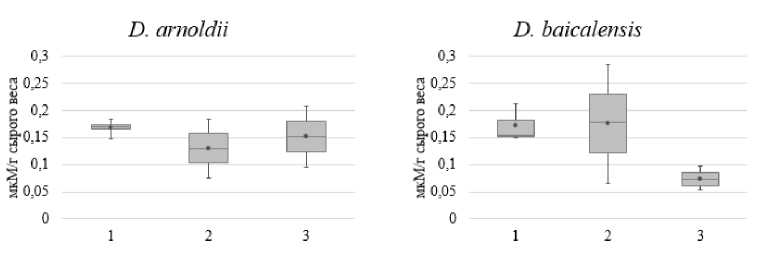
1 — 0 суток; 2 — 7 суток; 3 — 14 суток
Рис. 4. Изменение содержания пероксида водорода у двух видов Draparnaldioides сразу после вылова (0 суток), через 7 и 14 суток культивирования в лабораторных условиях
Макроводоросли ведут прикрепленный образ жизни и как и высшие растения они не могут изменить место своего произрастания для того, чтобы покинуть неблагоприятные условия окружающей среды. Интенсивность освещения и температура среды выступают основными абиотическими факторами, определяющими географическое распространение морских макроводорослей, их выживание и продуктивность [5]. Перенос из естественной среды обитания в лабораторные условия может также выступать стрессором, и его действие на разные виды может различаться. Кроме того, безусловно на физиолого-биохимические параметры влияет сезон вылова, так как существует различие в температуре вод и их освещенности.
Одними из первых на изменение условий обитания реагируют мембранные системы клетки, от состава и соотношения липидов зависит текучесть мембран, определяющая структуру и функции мембранных белков и жизнедеятельность клетки в целом. ЖК-состав липидов и интенсивность ПОЛ — это взаимосвязанные параметры. D. arnoldii и D. baicalensis отличались между собой по содержанию ТБК-РП и по направленности изменений ТБК-РП и ЖК-состава липидов.
Заключение. Таким образом, два изученных вида Draparnaldioides проявили различную реакцию при культивировании талломов в лабораторных условиях. Эти данные предполагают, что отдельные виды, возможно, имеют и различный адаптационный потенциал. Необходимы дальнейшие исследования состояния мембран клеток и других физиолого-биохимических показателей, отражающих адаптационные способности организмов, у представителей байкальского эндемичного рода Draparnaldioides.
Список литературы Взаимосвязь метаболизма жирных кислот и перекисного окисления липидов у двух видов байкальской эндемичной водоросли Draparnaldioides
- Сравнительный анализ состава жирных кислот двух видов байкальского эндемичного рода Draparnaldioides / У. А. Васильева, К. А. Кириченко, М. А. Тимофеев, О. И. Грабельных // Физиология, биотехнология и биоинформатика растений и микроорганизмов - путь в будущее: к 85-летию Р. А. Карначук: материалы всероссийской научной конференции / ответственный редактор О. В. Карначук. Томск, 2022. С. 35-37. Текст: непосредственный.
- Таксономический список макроводорослей прибрежной зоны бухты Большие Коты и залива Лиственичный (Южный Байкал) / В. С. Вишняков, О. А. Тимошкин, Л. А. Ижболдина [и др.] // Известия Иркутского государственного университета. Серия: Биология. Экология. 2012. Т. 5, №. 3. С. 147-159. Текст: непосредственный.
- Разнонаправленные эффекты тебуконазол-содержащего протравителя семян "Бункер" на рост побегов и корней озимой пшеницы / О. И. Грабельных, Е. А. Полякова, А. В. Корсукова [и др.] // Известия Иркутского государственного университета. Серия: Биология. Экология. 2020. Т. 34. С. 3-19. Текст: непосредственный.
- Ижболдина Л. А. Атлас и определитель водорослей бентоса и перифитона озера Байкал (мейо- и макрофиты) с краткими очерками по их экологии. Новосибирск: Наука, 2007. 248 с. Текст: непосредственный.
- Сезонные изменения содержания фотосинтетических пигментов у красной водоросли Ahnfeltiopsis flabelliformis Японского моря / А. О. Кравченко, Е. С. Белоциценко, И. М. Яковлева [и др.] // Известия ТИНРО (Тихоокеанского научно-исследовательского рыбохозяйственного центра). 2011. Т. 166. С. 138-148. Текст: непосредственный.
- Свободнорадикальное окисление: учебное пособие / Ф. Е. Путилина, О. В. Галкина, Н.Д. Ещенко [и др.]; под редакцией Н. Д. Ещенко. Санкт-Петербург: Издво С.-Петерб. ун-та, 2008. 161 с. Текст: непосредственный.
- Bellincampi D., Dipierro N., Salvi G. [et al.]. Extracellular H2O2 induced by oligogalacturonides is not involved in the inhibition of the auxin-regulated rolB gene expression in tobacco leaf explants // Plant physiology. 2000. T. 122, №. 4. C. 1379-1386.
- Heath R. L., Packer L. Photoperoxidation in isolated chloroplasts: I. Kinetics and stoichiometry of fatty acid peroxidation // Archives of biochemistry and biophysics. 1968. T. 125. № 1. C. 189-198.
- Vishnyakov V. S. Nomenclatural novelties in the endemic Lake Baikal genus Draparnaldioides (Chlorophyta, Chaetophoraceae) //Notulae Algrum. 2020. No. 158. P. 1-7.


