Взаимосвязь показателей обмена железа с параметрами углеводного обмена и липидного спектра у пациентов с избыточной массой тела и ожирением
Автор: Мусина Н. Н., Славкина Я. С., Петрухина Д. А., Зима А. П., Прохоренко Т. С., Завадовская В. Д., Саприна Т. В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.39, 2024 года.
Бесплатный доступ
Актуальность. Гиперферритинемия, связанная с ожирением и инсулинорезистентностью, является связующим звеном между компонентами метаболического синдрома и возможным пусковым фактором в патогенезе нарушений углеводного обмена (НУО) и дислипидемии.Цель исследования: установить взаимосвязи между показателями феррокинетики, параметрами липидного и углеводного обменов у пациентов с избыточной массой тела и ожирением, а также проанализировать возможность использования показателей метаболизма железа (ферритина и железа сыворотки) как предикторов НУО в данной когорте пациентов.Материал и методы. В исследование включены 52 пациента с избыточной массой тела или ожирением. В ходе исследования осуществлялась стратификация пациентов в группы в зависимости от наличия НУО и состояния обмена железа. Проводились оценка антропометрических данных, исследование гликированного гемоглобина, стандартный тест толерантности к глюкозе с 75 г глюкозы, исследование гематологических показателей, биохимических показателей обмена железа - концентрации сывороточного железа, трансферрина и ферритина.Результаты. Пациенты с нарушением толерантности к глюкозе (НТГ) или нарушением гликемии натощак (НГН) имели статистически значимо более высокое содержание ферритина сыворотки, чем пациенты с ожирением без НУО (р = 0,019). У лиц с высоким уровнем ферритина НУО развивались статистически значимо чаще, чем у пациентов, имевших содержание ферритина в диапазоне ниже 75-го процентиля (χ2 = 5,278; р = 0,022). Согласно проведенному ROC-анализу, ферритин показал достаточно высокую чувствительность - 75%, специфичность - 84,4% при диагностическом пороге 126,65 нг/мл (площадь под кривой = 0,738; р = 0,016) в диагностике предиабета у лиц с избыточной массой тела и ожирением.
Ожирение, ферритин, железо, дислипидемия, нарушение толерантности к глюкозе, нарушение гликемии натощак
Короткий адрес: https://sciup.org/149146288
IDR: 149146288 | УДК: 616-056.257-008.9:577.121 | DOI: 10.29001/2073-8552-2024-39-3-124-135
Текст научной статьи Взаимосвязь показателей обмена железа с параметрами углеводного обмена и липидного спектра у пациентов с избыточной массой тела и ожирением
Мусина Н.Н., Славкина Я.С., Петрухина Д.А., Зима А.П., Прохоренко Т.С., Завадовская В.Д., Саприна Т.В. Взаимосвязь показателей обмена железа с параметрами углеводного обмена и липидного спектра у пациентов с избыточной массой тела и ожирением. Сибирский журнал клинической и экспериментальной медицины. 2024;39(3):124–135. https://doi. org/10.29001/2073-8552-2024-39-3-124-135.
Ожирение тесно ассоциировано с развитием таких состояний, как неалкогольная жировая болезнь печени (НАЖБП), дислипидемия и нарушения углеводного обмена (НУО), в том числе сахарный диабет 2-го типа. В последние годы все больше внимания уделяется патологии обмена железа у лиц с избыточной массой тела и ожирением. Хроническое низкоинтенсивное воспаление при ожирении стимулирует экспрессию гормона гепсиди- на, приводя к нарушению распределения и депонирования железа в организме. Дизрегуляция феррокинетики в свою очередь способствует формированию метаболического синдрома.
Авторами российских и зарубежных исследований все чаще признается тот факт, что железо оказывает значительное влияние на метаболизм глюкозы на многих уровнях. В качестве потенциальных механизмов воздействия железа на углеводный обмен рассматриваются ферроптоз β-клеток поджелудочной железы и гепатоцитов, модуляция глюконеогенеза, включая гемопосредованное нарушение его циркадного ритма, а также снижение синтеза «антидиабетогенных» адипокинов [1].
С клинической точки зрения измерение содержания ферритина сыворотки является наиболее удобным и достоверным способом оценки депонированного железа в организме. Гиперферритинемия увеличивает риск развития сахарного диабета в 4,6 раза [2, 3]. Данный факт обусловливает необходимость тщательной оценки состояния углеводного обмена у пациентов с гиперфер-ритинемией, ожирением и НАЖБП после исключения воспалительного процесса [2, 3]. Повышение содержания ферритина сыворотки может также предшествовать развитию стеатоза печени и использоваться в качестве предиктора данного состояния. Эти данные позволяют предположить, что именно гиперферритинемия, связанная с ожирением и инсулинорезистентностью, является связующим звеном между компонентами метаболического синдрома и возможным пусковым фактором в патогенезе НУО и дислипидемии [2, 4].
Традиционно для диагностики сахарного диабета используется такой интегральный показатель гликемии, как уровень гликированного гемоглобина. Однако данный параметр углеводного обмена может быть достаточно вариабельным, поскольку подвержен влиянию факторов, регулирующих срок жизни эритроцитов. Такие маркеры метаболизма железа, как сывороточное железо и ферритин более стабильны и не имеют значительных колебаний, в связи с чем представляет определенный интерес возможность использования данных показателей в выявлении предиабета и сахарного диабета 2-го типа [2].
Цель исследования: установить возможные взаимосвязи между показателями феррокинетики, параметрами липидного и углеводного обменов у пациентов с избыточной массой тела и ожирением, а также проанализировать возможность использования показателей метаболизма железа (ферритина и железо сыворотки) как предикторов НУО в данной когорте пациентов.
Материал и методы
В исследование включались пациенты, находящиеся на плановом стационарном обследовании и / или лечении в эндокринологической клинике ФГБОУ ВО СибГМУ Минздрава России г. Томска. Лабораторные исследования проводились на базе Централизованной клинико-диагностической лаборатории СибГМУ. В исследование вошли 52 пациента с избыточной массой тела или ожирением. В ходе исследования проводилась стратификация пациентов в группы в зависимости от наличия НУО, а также состояния обмена железа. Все вошедшие в исследование пациенты подписали добровольное информированное согласие. Протокол исследования № 9388 одобрен локальным этическим комитетом ФГБОУ ВО СибГМУ Минздрава России 27.02.2023 г. Включение пациентов в исследование проводилось в период с марта по июль 2023 г.
Критериями включения в группу 1 являлись: отсутствие НУО по результатам оценки гликированного гемоглобина и / или проведения перорального глюкозотолерантного теста (ПГТТ) с 75 г глюкозы (глюкоза венозной плазмы натощак < 6,1 ммоль/л, глюкоза венозной плазмы через 2 ч после нагрузки глюкозой < 7,8 ммоль/л, уровень гликированного гемоглобина (HbA1c) < 6,0%); мужской и женский пол; возраст от 18 до 55 лет; индекс массы тела
(ИМТ) ≥ 25,0 кг/м² и < 40,0 кг/м²; отсутствие приема в анамнезе любых препаратов, влияющих на чувствительность к инсулину и углеводный обмен (метформин, ингибиторы дипептидилпептидазы 4-го типа (иДПП4), агонисты глюкагоноподобного пептида 1 (аГПП1), ингибиторы натрий-глюкозного котранспортера 2 (иНГЛТ2), сульфо-нилмочевина); подписание информированного согласия.
Критериями включения в группу 2 являлись: наличие нарушения толерантности к глюкозе (НТГ) или нарушенной гликемии натощак (НГН) по данным исследования HbA1c и проведения ПГТТ с 75 г глюкозы; уровень HbA1c < 6,5%; мужской и женский пол; возраст от 18 до 55 лет; ИМТ ≥ 25,0 кг/м² и <40,0 кг/м²; отсутствие приема в анамнезе любых препаратов, влияющих на чувствительность к инсулину и углеводный обмен (метформин, иДПП4, аГПП1, иНГЛТ2, сульфонилмочевина).
Критерии исключения: пред- и постоперационный период; гемотрансфузии и / или прием пероральных препаратов железа в период 1 мес. до включения в исследование и в момент включения; онкологические заболевания; наличие у пациента обострения инфекционных заболеваний, наличие специфических инфекционных заболеваний (ВИЧ / СПИД, вирусные гепатиты, туберкулез); цирроз печени; острая печеночная и сердечная недостаточность, почечная недостаточность со снижением скорости клубочковой фильтрации ниже 15 мл/мин по формуле CKD-EPI; острые и хронические в стадии обострения заболевания желудочно-кишечного тракта; не подписанное информированное согласие или отказ пациента от участия в исследовании.
Материалом исследования являлись сыворотка и плазма венозной крови, взятые утром натощак из локтевой вены в количестве 10 мл в вакуумные пробирки, соответствующие типам исследований. Всем включенным в исследование пациентам проводилась оценка антропометрических данных: измерение роста (см), веса (кг), расчет ИМТ по формуле: ИМТ = вес в кг / рост в м². В рамках оценки состояния углеводного обмена выполнялись: исследование гликированного гемоглобина с использованием анализатора D10 («BIORAD», США); ПГТТ с 75 г глюкозы. Биохимический анализ крови проводился с использованием анализатора ARCHITECT i2000SR («Abbott», США) и включал определение аспартатаминотрансферазы (АСТ, Ед/л), аланинаминотранс-ферразы (АЛТ, Ед/л), гамма-глутамилтранспептидазы (ГГТП, ммоль/л), мочевины(ммоль/л), мочевой кислоты (мкмоль/л), и показателей липидного спектра: общего холестерина (ммоль/л), липопротеинов низкой плотности (ЛПНП, ммоль/л), триглицеридов (ммоль/л), липопротеинов высокой плотности (ЛПВП, ммоль/л). Исследовались гематологические показатели: содержание гемоглобина, уровень гематокрита, средний объем эритроцита (MCV, 10–15/л), среднее содержание гемоглобина в эритроците (MCH, пг), а также насыщение эритроцита гемоглобином (MCHC, г/л) с применением гематологического анализатора XN1000 («Sysmex», Япония). Биохимические показатели обмена железа, а именно концентрации сывороточного железа (мкмоль/л), трансферрина (мг/ дл) и ферритина (нг/мл), определялись анализатором ARCHITECT i2000SR («Abbott», США).
Диагноз железодефицитной анемии (ЖДА) устанавливался в соответствии с критериями Всемирной организации здравоохранения, Клиническими рекомендациями «Железодефицитная анемия», разработанными Нацио- нальным гематологическим обществом, Национальным обществом детских гематологов, онкологов, для возрастных категорий «взрослые» и «дети» (2021)1 [5, 6]:
-
1. Снижение содержание гемоглобина менее 120 г/л у женщин и менее 130 г/л у мужчин.
-
2. Снижение содержания железа сыворотки менее 10,7 мкмоль/л.
-
3. Снижение содержания ферритина сыворотки менее 11,0 нг/мл.
-
4. Снижение насыщения трансферрина железом (НТЖ) менее 17,8%.
Дифференциальный диагноз между ЖДА и анемией хронических заболеваний (АХЗ) проводился в соответствии с критериями, представленными в Клинических рекомендациях (2021)2:
-
1. Снижение содержание гемоглобина менее 120 г/л у женщин и менее 130 г/л у мужчин.
-
2. Содержание железа сыворотки менее 10,7 мк-моль/л или в пределах референтных значений 10,7– 32,2 мкмоль/л.
-
3. Содержание ферритина сыворотки в пределах референтных значений 11,0–306,8 нг/мл или выше.
-
4. НТЖ в пределах референтных значений 17,8– 43,3%, ниже или выше референтных значений.
Латентный дефицит железа (ЛДЖ) устанавливался при нормальном уровне гемоглобина в сочетании со сниженным содержанием железа сыворотки (менее 10,7 мкмоль/л) и сниженным содержанием ферритина (менее 11,0 нг/мл).
За критерии дисметаболической перегрузки железом (ДСПЖ) были приняты критерии Европейского общества по изучению заболеваний печени3:
-
1. Повышение уровня ферритина более 300 мкг/л у мужчин и женщин в менопаузе и более 200 мкг/л у женщин детородного возраста.
-
2. Повышение содержания сывороточного железа.
-
3. Снижение общей железосвязывающей способности сыворотки (ОЖСС).
-
4. Повышение НТЖ более 45%.
-
23. Для проверки нормальности распределения признаков использовался критерий Колмогорова – Смирнова. Нормальному закону распределения подчинялись следующие параметры: ИМТ, уровень гемоглобина, гематокрита, MCV, MCH, MCHC, количество лейкоцитов, содержание ЛПВП- и ЛПНП-холестерина, уровень мочевины, содержание мочевой кислоты, уровень гликированного гемоглобина. Остальные параметры, а именно возраст, СОЭ, количество тромбоцитов, глюкоза крови, АСТ, АЛТ, ГГТП, содержание общего холестерина, триглицеридов, креатинин крови, содержание железа, ферритина, трансферрина, НТЖ и инсулин крови, не подчинялись нормальному закону распределения. Все количественные показатели представлены медианой и интерквартильным диапазоном Me [ Q 1 –Q 3] с целью унификации представления данных. Значимость различий показателей между независимыми группами сравнения оценивалась с помощью критерия Манна – Уитни. Корреляционные связи между признаками определялись с помощью коэффициента корреляции Спирмена. Сравнение частот бинарного признака в двух независимых группах осуществлялось с помощью двустороннего точного критерия Фишера или критерия χ 2 с поправкой Йейтса. Пороговый уровень статистической значимости составлял α = 0,05.
Статистическая обработка результатов осуществлялась с применением пакета программ SPSS STATISTICS
Результаты
За период с марта по июль 2023 г. в исследование были включены 52 пациента с избыточной массой тела и (или) ожирением. Включенные в исследование лица были разделены на две группы: группу 1 составили 39 пациентов без НУО, группу 2 – 13 пациентов с НТГ ( n = 11) и НГН ( n = 2). Среди включенных в исследование лиц было 19 (36,5%) мужчин и 33 (63,5%) женщины. Соотношение мужчин и женщин в группе 1 было аналогичным: 14 (35,9%) и 25 (64,1%) соответственно. В группе 2 мужчин было также меньше, чем женщин: 5 (38,5%) и 8 (61,5%) человек соответственно. Частота встречаемости избыточной массы тела и ожирения различной степени в общей выборке, а также в группах 1 и 2 представлена в таблице 1.
Клиническая и лабораторная характеристика групп представлена в таблице 2.
Таблица 1. Структура ожирения в общей выборке и группах исследования
Table 1. Structure of obesity in the general sample and study groups
|
Группы |
Общая выборка ( n = 52) |
Группа 1 ( n = 39) |
Группа 2 ( n = 13) |
|
Избыточная масса тела, n (%) |
15 (28,8) |
14 (35,9) |
1 (7,7) |
|
Ожирение 1-й степени, n (%) |
17 (32,7) |
12 (30,8) |
5 (38,4) |
|
Ожирение 2-й степени, n (%) |
16 (30,8) |
12 (30,8) |
4 (30,8) |
|
Ожирение 3-й степени, n (%) |
4 (7,7%) |
1 (2,5%) |
3 (23,1%) |
Таблица 2. Клиническая и лабораторная характеристика групп исследования
Table 2. Clinical and laboratory characteristics of the study groups
|
Параметры |
Общая выборка ( n = 52) |
Группа 1 (без НУО) ( n = 39) |
Группа 2 (НУО+) ( n = 13) |
р |
|
Возраст, лет |
34,5 [22,00–43,00] |
32,00 [20,00–42,00] |
38,00 [27,00–49,50] |
0,060 |
|
Индекс массы тела, кг/ м2 |
33,21 [29,13–36,71] |
32,70 [29,00–35,40] |
36,44 [31,56–39,60]* |
0,028 |
|
HbA1c, % |
5,50 [5,28–5,73] |
5,50 [5,20–5,65] |
5,80 [5,30–6,20] |
0,052 |
1 Национальное гематологическое общество, Национальное общество детских гематологов, онкологов. Железодефицитная анемия. Федеральные клинические рекомендации. М.; 2021. URL: (21.08.2024)
2 Там же.
Окончание табл. 1
End of table 1
|
Параметры |
Общая выборка ( n = 52) |
Группа 1 (без НУО) ( n = 39) |
Группа 2 (НУО+) ( n = 13) |
р |
|
Инсулин крови натощак, мкМЕ/мл |
12,90 [9,20–19,80] |
12,50 [8,50–19,80] |
13,25 [11,48–25,35] |
0,345 |
|
Креатинин, мкмоль/л |
70,00 [64,43–81,03] |
74,70 [67,50–83,20] |
63,90 [62,20–73,95] |
0,064 |
|
Мочевина, ммоль/л |
4,35 [3,53–4,80] |
4,30 [3,50–4,80] |
4,50 [3,55–5,45] |
0,561 |
|
Мочевая кислота, мкмоль/л |
0,35 [0,27–0,40] |
0,34 [0,26–0,39] |
0,40 [0,29–0,51] |
0,054 |
|
Аланинаминотрансферраза, Ед/л |
23,00 [16,00–34,00] |
23,00 [16,00–33,00] |
25,00 [17,25–65,50] |
0,131 |
|
Аспартатаминотрансферраза, Ед/л |
20,00 [16,00–26,00] |
20,00 [16,00–23,00] |
23,00 [14,50–37,50] |
0,346 |
Липидный обмен
|
Общий холестерин, ммоль/л |
5,00 [4,40–5,50] |
4,90 [4,30–5,30] |
5,20 [5,00–5,80]* |
0,050 |
|
Липопротеиды низкой плотности, ммоль/л |
2,95 [2,16–3,27] |
2,94 [2,09–3,38] |
2,96 [2,21–3,23] |
0,770 |
|
Липопротеиды высокой плотности, ммоль/л |
1,46 [1,20–1,83] |
1,44 [1,13–1,95] |
1,56 [1,33–1,81] |
0,815 |
|
Триглицериды, ммоль/л |
1,35 [0,90–1,73] |
1,20 [0,80–1,60] |
1,60 [1,50–2,10]* |
0,003 |
Обмен железа
|
Гемоглобин, г/л |
142,00 [132,00–157,00] |
142,00 [130,00–157,25] |
145,00 [138,00–159,00] |
0,475 |
|
Гематокрит, % |
42,10 [39,10–45,30] |
42,10 [38,83–45,43] |
43,00 [40,15–43,25] |
0,665 |
|
MCV – средний объем эритроцита, 10–15/л |
85,70 [83,85–89,40] |
85,55 [83,88–89,35] |
86,00 [80,10–93,10] |
0,914 |
|
MCH – среднее содержание гемоглобина в эритроците, пг |
29,60 [28,10–30,55] |
29,60 [28,10–30,40] |
29,90 [27,20–31,00] |
0,666 |
|
MCHC – средняя концентрация гемоглобина в эритроците, г/л |
340,00 [330,00–345,00] |
339,00 [330,50–345,50] |
340,00 [329,00–344,00] |
0,848 |
|
Железо сыворотки, мкмоль/л |
16,00 [10,25–26,00] |
15,00 [10,00–25,00] |
24,00 [14,00–26,50] |
0,216 |
|
Ферритин, нг/мл |
57,00 [21,20–148,45] |
38,20 [18,05–102,55] |
147,90 [42,35–211,50]* |
0,019 |
|
Трансферрин, мг/дл |
292,00 [273,25–343,50] |
292,00 [274,75–343,50] |
291,50 [270,75–366,00] |
0,915 |
|
Насыщение трансферрина железом, % |
24,85 [13,69–35,22] |
20,97 [12,74–33,15] |
32,78 [16,34–37,82] |
0,234 |
|
Индекс Железо/Ферритин |
0,29 [0,14–0,64] |
0,37 [0,18–0,69] |
0,16 [0,11–0,50]* |
0,029 |
|
Индекс Ферритин/Железо |
3,48 [1,56–7,32] |
2,74 [1,44–5,45] |
6,27 [2,02–9,05]* |
0,029 |
Примечание: * р < 0,05 при сравнении групп 1 и 2.
Пациенты групп 1 и 2 были сопоставимы по возрасту, уровню гликированного гемоглобина, содержанию инсулина крови и таких параметров метаболического контроля, как мочевая кислота, мочевина, креатинин и трансаминазы. Пациенты с НУО имели значимо более высокий ИМТ в сравнении с лицами без НТГ и / или НГН ( р = 0,028), более высокий уровень общего холестерина ( р = 0,050) и триглицеридов крови ( р = 0,003). Такие параметры обмена железа, как гемоглобин, гематокрит, MCV, MCH, MCHC, железо сыворотки, трансферрин и
НТЖ значимо не отличались у пациентов с НУО и лиц с нормальным состоянием углеводного обмена. При этом содержание ферритина сыворотки было значимо выше у пациентов с НТГ или НГН ( р = 0,019).
Был проведен анализ частоты встречаемости различных нарушений обмена железа в общей выборке и внутри каждой из групп исследования.
Значимых различий в структуре феррокинетики между группами 1 и 2 выявлено не было (χ 2 = 2,330; р = 0,312; рис. 1).
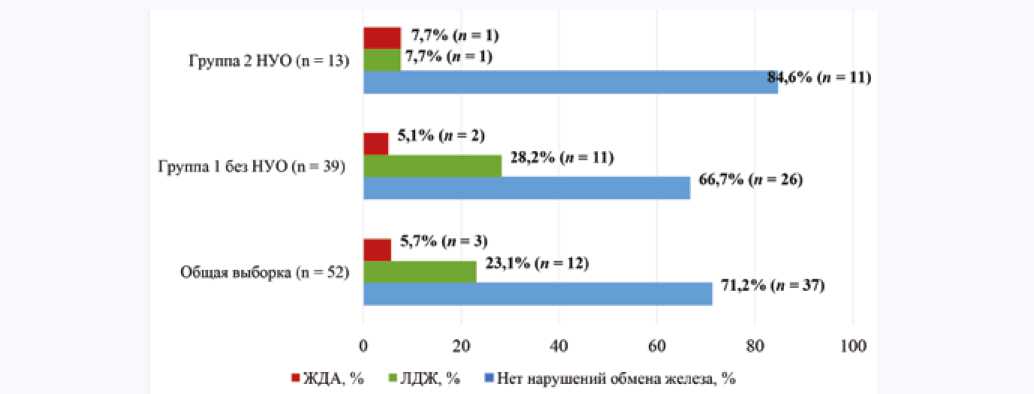
Рис. 1. Структура феррокинетики в исследуемых группах
Примечение: НУО – нарушения углеводного обмена; ЖДА – железодефицитная анемия; ЛДЖ – латентный дефицит железа.
Fig. 1. Structure of ferrokinetics in the studied groups
Note: CMD – carbohydrate metabolism disorders; IDA – iron deficiency anemia; LID – latent iron deficiency.
Все пациенты исследования были разделены на группы в зависимости от уровня ферритина сыворотки: 1) пациенты с уровнем ферритина сыворотки ниже 75 перцентиля – менее 148,45 нг/мл (n = 37); 2) пациенты с уровнем ферритина сыворотки выше 75 перцентиля ≥ 148,45 нг/мл n = 15). У лиц с высоким уровнем ферритина выявлена большая частота НУО, чем у пациентов, имевших содержание ферритина в диапазоне ниже 75 перцентиля (χ2 = 5,278; р = 0,022; точный критерий Фишера = 0,034; рис. 2).
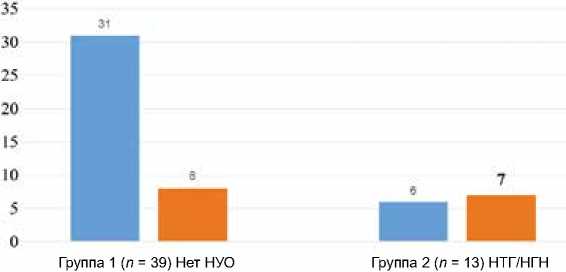
Пациенты с уровнем ферритина < 75%, чел
Пациенты с уровнем ферритина > 75%, чел
Рис. 2. Структура нарушений углеводного обмена в зависимости от содержания ферритина сыворотки Примечение: НУО – нарушения углеводного обмена;
НТГ – нарушение толерантности к глюкозе; НГН – нарушение гликемии натощак.
-
Fig. 2. Structure of carbohydrate metabolism disorders depending on serum ferritin content
Note: CMD – carbohydrate metabolism disorders; IGT – impared glucose tolerance; IFG – impared fasting glycaemia.
Во вновь созданных подгруппах (группа 1 – пациенты с уровнем ферритина сыворотки ниже 75 перцентиля – менее 148,45 нг/мл (n = 37) и группа 2 – пациенты с уровнем ферритина сыворотки выше 75 пер- центиля – ≥ 148,45 нг/мл(n = 15)) был проведен сравнительный анализ показателей метаболического контроля, липидного и углеводного обменов. Результаты данного анализа представлены в таблице 3.
Таблица 3. Показатели метаболического контроля, липидного и углеводного обменов у пациентов с избыточной массой тела и ожирением в зависимости от уровня ферритина
Table 3. Indicators of metabolic control, lipid and carbohydrate metabolism in patients with overweight and obesity depending on ferritin levels
|
Параметры |
Группа 1 ( n = 37) |
Группа 2 ( n = 15) |
р |
|
Возраст, лет |
38,00 [22,00–45,25] |
28,00 [22,00–37,00] |
0,199 |
|
Индекс массы тела, кг/ м2 |
33,21 [29,00–37,19] |
34,00 [30,00–36,44] |
0,673 |
|
HbA1c, % |
5,60 [5,30–5,80] |
5,40 [5,20–5,60] |
0,282 |
|
Инсулин крови натощак, мкМЕ/мл |
12,50 [8,25–16,90] |
16,00 [10,00–27,20] |
0,151 |
|
Креатинин, мкмоль/л |
69,60 [64,05–76,90] |
76,30 [63,10–85,00] |
0,200 |
|
Мочевина, ммоль/л |
4,30 [3,58–4,80] |
4,10 [3,30–4,80] |
0,874 |
|
Мочевая кислота, мкмоль/л |
0,34 [0,26–0,39] |
0,39 [0,33–0,47]* |
0,051 |
|
Аланинаминотрансферраза, Ед/л |
18,00 [15,00–28,00] |
34,00 [23,00–72,00]* |
0,003 |
|
Аспартатаминотрансферраза, Ед/л |
20,00 [15,75–26,25] |
23,00 [19,00–36,00] |
0,138 |
|
Общий холестерин, ммоль/л |
4,90 [4,35–5,65] |
5,10 [4,90–5,58] |
0,498 |
|
Липопротеиды низкой плотности, ммоль/л |
2,94 [2,09–3,31] |
2,93 [1,69–3,31] |
0,656 |
|
Липопротеиды высокой плотности, ммоль/л |
1,48 [1,23–1,96] |
1,50 [1,25–1,81] |
0,656 |
|
Триглицериды, ммоль/л |
1,30 [0,90–1,70] |
1,55 [1,28–2,10] |
0,084 |
У пациентов с высоким содержанием ферритина сыворотки уровень АЛТ был значимо выше, чем у лиц с концентрацией ферритина в пределах первых трех квартилей ( р = 0,003). Кроме того, именно в группе лиц с относительной гиперферритинемией значения АЛТ в третьем квартиле превышали референтные, что может отражать умеренный цитолиз у лиц с высоким уровнем депонированного железа. Также обращает на себя внимание тенденция к более высокому содержанию мочевой кислоты у пациентов группы 2 в сравнении с таковым в группе 1 ( р = 0,051).
Известно, что мочевая кислота является одним из естественных хелаторов трехвалентного железа (Fe III) и усиленно продуцируется в условиях гиперферремии.
Гиперурикемия на начальных стадиях перегрузки железом может отражать компенсаторную реакцию организма. При НТЖ ниже 30% повышение экскреции мочевой кислоты способствует адекватному выведению с мочой избытка железа и, таким образом, поддержанию его уровня в пределах физиологического. При прогрессировании перегрузки железом, когда НТЖ достигает значений 30–45%, наблюдается более выраженное повышение мочевой кислоты при недостаточно эффективной ее экскреции. В условиях дальнейшего нарастания запасов железа, характеризующегося повышением НТЖ более 45%, уровень урикемии уже не соответствует механизму антиоксидантной защиты [3].
Мы также разделили пациентов на группы в зависимости от содержания железа сыворотки: 1) пациенты с содержанием железа сыворотки ниже 75 процентиля – менее 26,0 мкмоль/л (n = 38), 2) пациенты с уровнем железа сыворотки выше 75 перцентиля ≥ 26,0 мкмоль/л (n = 14). Значимых различий в частоте наличия НУО в зависимости от уровня железа выявлено не было (χ2 = 1,173; р = 0,279; точный критерий Фишера = 0,30; рис. 3).
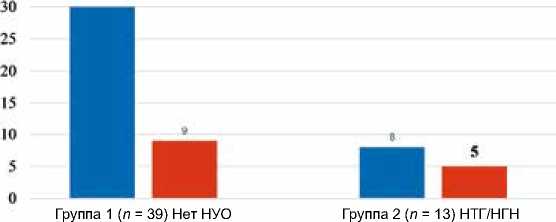
■ Пациенты с уровнем железа < 75%, чел в Пациенты с уровнем железа > 75%, чел
Рис. 3. Структура нарушений углеводного обмена в зависимости от содержания железа сыворотки
Примечение: НУО – нарушения углеводного обмена; НТГ – нарушение толерантности к глюкозе;
НГН – нарушение гликемии натощак.
-
Fig. 3. Structure of carbohydrate metabolism disorders depending on serum iron content
Note: CMD – carbohydrate metabolism disorders;
IGT – impared glucose tolerance; IFG – impared fasting glycaemia.
Во вновь созданных подгруппах (группа 1 – пациенты с содержанием железа сыворотки ниже 75 перцентиля – менее 26 мкмоль/л ( n = 38), группа 2 – пациенты с содержанием железа сыворотки выше 75 перцентиля –
≥ 26мкмоль/л ( n = 14)) был проведен сравнительный анализ показателей метаболического контроля, липидного и углеводного обменов. Результаты данного анализа представлены в таблице 4.
Таблица 4. Показатели метаболического контроля, липидного и углеводного обменов у пациентов с избыточной массой тела и ожирением в зависимости от уровня железа
Table 4. Indicators of metabolic control, lipid and carbohydrate metabolism in patients with overweight and obesity depending on iron levels
|
Параметры |
Группа 1 (n = 38) |
Группа 2 (n = 15) |
р |
|
Возраст, лет |
37,50 [22,00–45,25] |
24,50 [20,00–37,00] |
0,066 |
|
Индекс массы тела, кг/ м2 |
31,85 [29,00–35,90] |
34,80 [33,07–37,01] |
0,062 |
|
HbA1c, % |
5,60 [5,30–5,80] |
5,25 [5,08–5,60]* |
0,029 |
|
Инсулин крови натощак, мкМЕ/мл |
12,90 [8,65–18,40] |
13,20 [10,30–23,48] |
0,416 |
|
Креатинин, мкмоль/л |
69,50 [63,33–79,83] |
75,95 [69,28–83,88] |
0,065 |
|
Мочевина, ммоль/л |
4,40 [3,58–4,93] |
4,10 [3,45–4,45] |
0,302 |
|
Мочевая кислота, мкмоль/л |
0,33 [0,25–0,38] |
0,40 [0,35–0,43]* |
0,009 |
|
Аланинаминотрансферраза, Ед/л |
21,50 [14,00–32,50] |
30,00 [17,50–42,00] |
0,096 |
|
Аспартатаминотрансферраза, Ед/л |
19,50 [16,00–26,25] |
22,00 [18,75–26,25] |
0,326 |
|
Общий холестерин, ммоль/л |
5,05 [4,40–5,65] |
5,00 [4,20–5,23] |
0,626 |
|
Липопротеиды низкой плотности, ммоль/л |
2,9 [2,24–3,54] |
2,83 [1,66–3,13] |
0,117 |
|
Липопротеиды высокой плотности, ммоль/л |
1,52 [1,22–1,87] |
1,38 [1,12–1,84] |
0,642 |
|
Триглицериды, ммоль/л |
1,20 [0,83–1,60] |
1,55 [1,35–2,03]* |
0,046 |
У пациентов с относительной гиперферремией уровень HbA1c был значимо ниже, чем у лиц с содержанием железа до 75-й перцентили ( р = 0,029). Концентрация мочевой кислоты и содержание триглицеридов были значимо выше в группе лиц с высоким содержанием железа (группа 2). Был проведен парный корреляционный анализ в общей выборке включенных в исследование пациентов (пациенты без НУО и пациенты с НТГ / НГН, n = 52; табл. 5).
В общей выборке включенных в исследование лиц гемоглобин и гематокрит отрицательно коррелировали с возрастом пациентов. Кроме того, уровень гемоглобина отрицательно коррелировал с HbA1c. С HbA1c также отрицательно коррелировали MCH, MCHC, железо сыворотки и НТЖ, положительно – трансферрин. Полученные корреляционные связи в определенной степени соотносятся с данными о ложном «завышении» HbA1c при ЖДА. Сидеропеническая анемия характеризуется увеличением продолжительности жизни эритроцитов, что может влиять на повышение уровня HbA1c. Поскольку гликирование гемоглобина является необратимым процессом, его уровень в эритроцитах увеличивается прямо пропорционально «клеточному возрасту». Обнаружено, что у пациентов с нормогликемией, но с очень молодыми эритроцитами, коррекция сидеропенической анемии ведет к снижению концентрации HbA1с. Однако сохранение дефицита железа в течение длительного времени нарушает синтез красных клеток и приводит к эритропении. Развивается не только анемия, но и происходит «старение» циркулирующих эритроцитов, следовательно, повышается содержание HbA1с [7].
Таблица 5. Корреляционные связи между маркерами обмена железа, параметрами углеводного обмена и метаболического контроля в общей выборке пациентов, n = 52
Table 5. Correlations between markers of iron metabolism, parameters of carbohydrate metabolism and metabolic control in the general sample of patients, n = 52
|
Показатели |
Возраст |
ИМТ |
Глюкоза натощак |
HbA1c |
Инсулин |
АСТ |
АЛТ |
Креатинин |
Мочевина |
Мочевая кислота |
||
|
го ф 2 S с О Ф S S е е го о ^ |
Hb |
r |
–0,477* |
ns |
ns |
–0,365* |
ns |
ns |
0,479* |
0,623* |
ns |
0,664* |
|
Ht |
r |
–0,502* |
ns |
ns |
ns |
ns |
ns |
0,432* |
0,628* |
ns |
0,653* |
|
|
MCV |
r |
ns |
ns |
ns |
ns |
ns |
ns |
ns |
ns |
ns |
ns |
|
|
MCH |
r |
ns |
ns |
–0,355* |
–0,465* |
ns |
ns |
ns |
ns |
ns |
ns |
|
|
MCHC |
r |
ns |
ns |
–0,322* |
–0,589* |
ns |
ns |
0,365* |
0,378* |
ns |
0,429 |
|
|
Железо |
r |
ns |
ns |
ns |
–0,347* |
ns |
ns |
0,337* |
0,278* |
ns |
0,405* |
|
|
Ферритин |
r |
ns |
ns |
ns |
ns |
ns |
ns |
0,550* |
0,363* |
ns |
0,418* |
|
|
Трансферрин |
r |
ns |
ns |
0,318* |
0,349 |
ns |
ns |
ns |
ns |
ns |
ns |
|
|
НТЖ |
r |
–0,287* |
ns |
–0,300* |
–0,348* |
ns |
ns |
0,319* |
0,287* |
ns |
0,355* |
|
Примечание: r – коэффициент корреляции, ns – различия статистически не достоверны, * – р ˂ 0,05. Hb – гемоглобин; Ht – гематокрит; MCV – средний объем эритроцита, MCH – среднее содержание гемоглобина в эритроците, MCHC – средняя концентрация гемоглобина в эритроците; НТЖ – насыщение трансферрина железом.
С другой стороны, были получены слабые отрицательные корреляционные связи таких параметров обмена железа, как MCH, MCHC и НТЖ с тощаковой гликемией. При этом трансферрин положительно коррелировал с уровнем глюкозы крови. Учитывая данные за достоверно более низкий HbA1c у пациентов с относительной гиперферремией выше 75% (см. табл. 5), можно предположить, что у лиц с содержанием железа в пределах 75% большая доля данного металла депонирована, в том числе в составе ферритина в клетках ретикуло-эндотелиальной системы печени. Даже умеренная перегрузка печени железом у пациентов с избыточной массой тела и ожирением может способствовать формированию НУО.
Ожидаемо были получены положительные корреляционные связи, от слабой до средней, между АЛТ и такими параметрами феррокинетики, как гемоглобин, гематокрит, MCHC, железо, ферритин и НТЖ. Данные связи, как уже упоминалось, могут отражать умеренный цитолиз у лиц с высоким уровнем депонированного железа. Те же параметры обмена железа (гемоглобин, гематокрит, MCHC, железо, ферритин и НТЖ) положительно коррелировали с содержанием мочевой кислоты. Взаимосвязь гиперурике-мии с гиперферритинемией, вероятно, обусловлена хелаторной функцией мочевой кислоты и обсуждалась выше.
В таблице 6 представлены корреляционные связи между маркерами обмена железа и параметрами липидного обмена в общей выборке пациентов.
Таблица 6. Корреляционные связи между маркерами обмена железа и параметрами липидного обмена в общей выборке пациентов, n = 52
Table 6. Correlations between iron metabolism markers and lipid metabolism parameters in the general sample of patients, n = 52
|
Показатели |
Общий холестерин |
ЛПВП |
ЛПНП |
Триглицериды |
|
|
Hb |
r |
ns |
–0,372* |
ns |
ns |
|
Ht |
r |
ns |
–0,364* |
ns |
ns |
|
MCV |
r |
ns |
ns |
ns |
ns |
|
MCH |
r |
ns |
ns |
ns |
ns |
|
MCHC |
r |
ns |
–0,295* |
ns |
ns |
|
Железо |
r |
ns |
ns |
ns |
0,336* |
|
Ферритин |
r |
ns |
ns |
ns |
ns |
|
Трансферрин |
r |
ns |
ns |
ns |
ns |
|
НТЖ |
r |
ns |
ns |
ns |
0,312* |
Примечание: r – коэффициент корреляции, ns – различия статистически не достоверны, * – р ˂ 0,05. Hb – гемоглобин; Ht – гематокрит; MCV – средний объем эритроцита, MCH – среднее содержание гемоглобина в эритроците, MCHC – средняя концентрация гемоглобина в эритроците; НТЖ – насыщение трансферрина железом.
Были получены слабые отрицательные корреляционные связи между содержанием ЛПВП-холестерина и такими параметрами обмена железа, как гемоглобин, гематокрит и MCHC, а также положительные корреляционные связи между содержанием триглицеридов крови и уровнем железа сыворотки, а также НТЖ. Указанные корреляционные связи могут отражать роль железа в развитии и прогрессировании дислипидемии. Согласно так называемой «железной теории», железо в своей каталитически активной форме участвует в образовании активных форм кислорода и индуцирует перекисное окисление липидов, запуская такие проатерогенные процессы, как эндотелиальная дисфункция, пролиферация гладкомышечных клеток и активация макрофагов [8]. Появление данной теории обусловлено обнаружением накопления железа в сосудах в области атеросклеротических бляшек. Тем не менее, вопрос о том, является ли гиперфер-ремия причиной дислипидемии и атеросклероза, или накопление железа в бляшках – вторичный процесс, все еще остается открытым [8, 9].
С целью установления потенциальной значимости отдельных параметров обмена железа в диагностике ранних НУО нами был проведен ROC-анализ. В результате ROC-анализа однофакторной модели классификации пациентов в группы высокого и низкого риска предиабета (НТГ / НГН) было установлено, что ферритин имеет достаточно высокую чувствительность – 75%, и специфичность – 84,4% при диагностическом пороге 126,65 нг/мл (площадь под кривой = 0,738; р = 0,016) в диагностике предиабета (НТГ / НГН) у лиц с избыточной массой тела и ожирением. При этом железо сыворотки и НТЖ не показали высокой информативности в диагностике НУО. ROC-кривые для 3 однофакторных моделей представлены на рисунке 4.
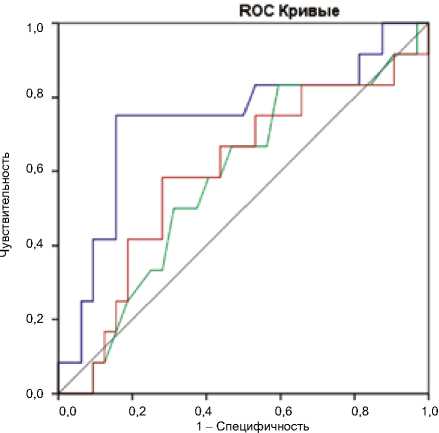
Диагональные сегменты сгенерированные связями
Источник кривой
^^н Ферритин, нг/мл ^^мЖелезо, мкмоль/л ^^м НТЖ ^^^н Опорная линия
Рис. 4. Информативность ферритина, железа сыворотки и насыщения трансферрина железом в диагностике предиабета (НТГ / НГН) Примечание: НТГ – нарушение толерантности к глюкозе; НГН – нарушение гликемии натощак; НТЖ – насыщение трансферрина железом. Fig. 4. Informativeness of ferritin, serum iron and IGN in the diagnosis of prediabetes (IGT / IFG)
Note: IGT – impared glucose tolerance; IFG – impared fasting glycaemia.
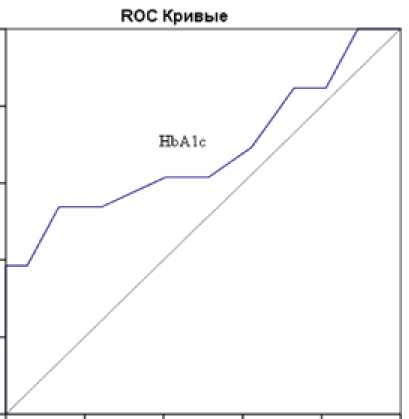
Интересно отметить, что HbA1c в нашей выборке пациентов с избыточной массой тела и ожирением не показал высокой информативности в отношении диагностики НТГ и / или НГН: чувствительность – 53,8%, специфичность – 86,5% при диагностическом пороге 5,75% (площадь под кривой = 0,682; р = 0,053) (рис. 5).
1,0
0,0
0,0
0,2
0,4 0,6
1 – Специфичность
0,8
1,0
Диагональные сегменты сгенерированные связями
Рис. 5. Информативность гликированного гемоглобина в диагностике предиабета (НТГ / НГН)
Примечание: НТГ – нарушение толерантности к глюкозе; НГН – нарушение гликемии натощак.
Fig. 5. Informativeness of glycated hemoglobin in the diagnosis of prediabetes (IGT / IFG)
Note: IGT – impared glucose tolerance; IFG – impared fasting glycaemia.
Обсуждение
В ходе проведенного исследования нами установлено наличие взаимосвязи между гиперферритинемией и развитием НУО у пациентов с избыточной массой тела и ожирением. Лица с НТГ / НГН имели значимо более высокий уровень данного маркера феррокинетики в сравнении с пациентами без НУО. В то же время, согласно частотному анализу, НУО у пациентов с относительной гиперферремией выявлялись чаще, чем у лиц с содержанием ферритина сыворотки в пределах 75-го перцентиля. Стоит отметить, что случаев истиной перегрузки железом, соответствующих критериям EASL, в созданной нами выборке выявлено не было.
Важно отметить, что критерии EASL разработаны и используются в клинической практике для диагностики синдрома перегрузки железом независимо от его этиологии – как первичного у лиц с наследственным гемохроматозом, так и вторичного – вследствие многократных трансфузий эритроцитсодержащих компонентов крови, неэффективного эритропоэза, или дисметаболического у лиц с хроническими заболеваниями печени1. На сегодняшний день клинических рекомендаций по диагностике и лечению именно ДСПЖ не разработано. Учитывая различия в патогенезе наследственной и дисметаболической перегрузки железом, а также в содержании внутрипеченочного железа при данных состояниях [10], можно предположить, что гиперферритинемия при ДСПЖ будет носить более умеренный характер. В связи с этим актуальным представляется проведение работ, направленных на уточне- ние потенциально отличных от предложенных EASL «отрезных» значений ферритина для диагностики ДСПЖ.
В целом полученные нами данные о связи гипер-ферритинемии с наличием НУО согласуются с данными литературы. Ассоциация повышенного содержания железа с риском развития сахарного диабета 2-го типа подтверждается результатами отдельных исследований и как минимум четырех метаанализов и систематических обзоров [11–13]. В 2014 г. были опубликованы результаты метаанализа, включавшего 12 поперечных исследований, одно исследование «случай – контроль» и два проспективных исследования с общим количеством включенных лиц более 50 тыс. Результаты данного метаанализа показали, что объединенное отношение шансов (ОШ) для развития метаболического синдрома при сравнении пациентов с наиболее высокими и наиболее низкими значениями ферритина в выборке составило 1,73 (95% ДИ: 1,54, 1,95; I2 = 75,4%), на основании чего был сделан вывод, что повышенный уровень ферритина независимо и положительно связан с наличием метаболического синдрома [14]. Согласно результатам поперечного обсервационного исследования (2020), пациенты с метаболическим синдромом имели значимо более высокий уровень ферритина в сравнении с группой здорового контроля.
В данном исследовании установлено, что содержание ферритина было прямо пропорционально ассоциировано с концентрацией инсулина в крови и индексом ин-сулинорезистентности HOMA. Как и в полученных нами результатах, отсутствовала связь между уровнями ферритина и HbA1c [15].
Несмотря на активное накопление данных, подтверждающих роль гиперферритинемии и перегрузки железом в развитии метаболического синдрома и НУО, работ, направленных на установление «отрезных» значений ферритина, обладающих диагностической ценностью в отношении предиабета и сахарного диабета 2-го типа, в литературе практически не представлено. В 2014 г. получены данные о диагностической ценности показателей метаболизма железа в выявлении сахарного диабета на когорте пациентов, страдающих хроническими гепатитами. Для сывороточного ферритина у пациентов с хроническим гепатитом при диагностическом пороге 234 мкг/л (= нг/мл) чувствительность оказалась равна 66,7%, специфичность – 73,9% (площадь под кривой = 0,735; р = 0,001) [2]. Диагностическая ценность маркеров феррокинетики в отношении ранних НУО, а именно предиабета, нами исследована впервые.
Вопрос взаимного влияния феррокинетики и липидного обмена является дискутабельным. Известно, что железо накапливается в атеросклеротических бляшках, однако является ли это причиной или следствием атеросклероза или только отражает процесс его прогрессирования, до сих пор предмет активного изучения.
В нашем исследовании были получены отрицательные корреляционные связи между содержанием ЛП-
ВП-холестерина и такими параметрами обмена железа, как гемоглобин, гематокрит и MCHC, а также положительные корреляционные связи между содержанием триглицеридов крови и уровнем железа сыворотки, а также НТЖ. Стоит отметить, что полученные результаты согласуются с данными недавних исследований. Так, в 2021 г. были опубликованы результаты перекрестного исследования Irish National Adult Nutrition Survey (период исследования 2008–2010 гг.). На выборке 1120 человек авторы оценивали влияние дизрегуляции феррокинетики на параметры метаболического контроля. С помощью линейного регрессионного анализа была выявлена значимая положительная взаимосвязь между содержанием триглицеридов и сывороточным ферритином у пациентов с ожирением и высоким риском развития перегрузки железом (концентрация ферритина сыворотки ≥ 200 нг/мл у мужчин и ≥ 150 нг/мл у женщин) в сравнении с группой лиц с ожирением, но нормальными запасами железа. Перегрузка железом была также ассоциирована с более низкими значениями ЛПВП-холестерина [16].
В ходе уже упомянутого исследования [15] в когорте пациентов с метаболическим синдромом также были выявлены положительные корреляционные связи между содержанием ферритина сыворотки и параметрами липидного спектра: общим холестерином, холестерином ЛПНП и триглицеридами. В той же группе пациентов ферритин отрицательно коррелировал с содержанием холестерина ЛПВП.
Отмеченные ассоциации сывороточного ферритина с маркерами дислипидемии, с одной стороны, «укладываются» в «железную теорию» атерогенеза и объясняют роль гиперферритинемии и ДСПЖ в развитии сердечно-сосудистой патологии, с другой стороны, могут быть преимущественно обусловлены ожирением, на фоне которого и развиваются как патология феррокинетики, так и нарушения липидного обмена.
Ограничения
Основным ограничением приведенного исследования является объем выборки. Для реализации заданной цели и оценки воспроизводимости полученных результатов продолжается набор пациентов. В рамках дальнейшего изучения проблемы планируется увеличить объем групп пациентов с НТГ и НГН, а также добавить группу впервые диагностированного сахарного диабета 2-го типа, что в перспективе позволит разработать алгоритм прогнозирования развития НУО с позиции состояния обмена железа.
Заключение
Таким образом, результаты проведенного исследования согласуются с результатами отечественной и мировой литературы и указывают на то, что высокие уровни железа и ферритина положительно ассоциированы с такими компонентами метаболического синдрома, как НУО и дислипидемия. Ферритин является перспективным маркером-предиктором предиабета и сахарного диабета 2-го типа.
Список литературы Взаимосвязь показателей обмена железа с параметрами углеводного обмена и липидного спектра у пациентов с избыточной массой тела и ожирением
- Fernández-Real J.M., McClain D., Manco M. Mechanisms linking glucose homeostasis and iron metabolism toward the onset and progression of type 2 diabetes. Diabetes Care. 2015;38(11):2169–2176. DOI: 10.2337/dc14-3082.
- Пальцев И.В., Калинин А.Л., Сницаренко Е.Н. Сывороточный ферритин – предиктор сахарного диабета 2 типа у пациентов с хроническими гепатитами. Проблемы здоровья и экологии. 2016;48(2):65–68. Paltsev I.V., Kalinin A.L., Snitsarenko E.N. Serum ferritin as a predictor of diabetes mellitus type 2 in patients with chronic hepatitis. Health and Ecology Issues. 2016;48(2):65–68. (In Russ.) URL: https://elib.gsmu.by/handle/GomSMU/983 (06.12.2023).
- Мехтиев С.Н., Мехтиева О.А. Синдром перегрузки железом при хронических заболеваниях печени: фокус на неалкогольную жировую болезнь печени. Лечащий врач. 2017;12:60–67. Mechtiev S.N., Mechtieva O.A. Iron overload syndrome in chronic hepatic diseases: the focus is on non-alcoholic fat hepatic disease. Lechaschi Vrach Journal. 2017;12:60–67. (In Russ.). URL: https://www.lvrach.ru/2017/12/15436872 (06.12.2023).
- Никоноров А.А., Тиньков А.А., Попова Е.В., Немерешина О.Н., Гатиатулина Е.Р., Скальная М.Г. и др. Железо и ожирение: потерпевший или подозреваемый. Микроэлементы в медицине. 2015;16(2):3–9. (In Russ.). DOI: 10.19112/2413-6174-2015-16-2-3-9. Nikonorov А.А., Tinkov A.A., Popova E.V., Nemereshina O.N., Gatiatulina E.R., Skalnaya M.G. et al. Iron in obesity: a victim or suspect. Microelements in Medicine. 2015;16(2):3–9. (In Russ.). DOI: 10.19112/2413-6174-2015-16-2-3-9.
- World Health Organization. Assessing the Iron Status of populations: including literature reviews: report of a Joint, 2-e ed. Geneva; 2007. [Electronic resource]. URL: https://apps.who.int/iris/handle/10665/75368 (27.02.2023).
- World Health Organization. Haemoglobin concentrations for the diagnosis of anemia and assessment of severity. Geneva; 2011. [Electronic resource]. URL: https://www.who.int/vmnis/indicators/haemoglobin/en/ (06.12.2023).
- Егшатян Л.В., Бирюкова Е.В. Влияния железодефицитной анемии на значения гликированного гемоглобина. Лечение и профилактика. 2015;2(14):60–64. Egshatyan L.V., Biryukova Ye.V. The effect of iron-deficiency anemia on glycosylated hemoglobin. Lechenie i profilaktika. 2015;2(14):60–64. (In Russ.). URL: https://elibrary.ru/item.asp?id=24071137 (06.12.2023).
- Vinchi F., Muckenthaler M.U., Da Silva M.C., Balla G., Balla J., Jeney V. Atherogenesis and iron: from epidemiology to cellular level. Front. Pharmacol. 2014;5:94. DOI: 10.3389/fphar.2014.00094.
- Юрьева Э.А., Сухоруков В.С., Воздвиженская Е.С., Новикова Н.Н. Атеросклероз: гипотезы и теории. Российский вестник перинатологии и педиатрии. 2014;59(3):6–16. Yuryeva E.A., Sukhorukov V.S., Vozdvizhenskaya E.S., Novikova N.N. Atherosclerosis: Hypotheses and theories. Russian Bulletin of Perinatology and Pediatrics. 2014;59(3):6–16. (In Russ.). URL: https://www.ped-perinatology.ru/jour/article/view/250/289 (06.12.2023).
- Fernández-Real J.M., McClain D., Manco M. Mechanisms linking glucose homeostasis and iron metabolism toward the onset and progression of type 2 diabetes. Diabetes Care. 2015;38(11):2169–2176. DOI: 10.2337/dc14-3082.
- Swaminathan S., Fonseca V.A., Alam M.G., Shah S.V. The role of iron in diabetes and its complications. Diabetes Care. 2007;30(7):1926–1933. DOI: 10.2337/dc06-2625.
- Simcox J.A., McClain D.A. Iron and diabetes risk. Cell. Metab. 2013;17(3):329–341. DOI: 10.1016/j.cmet.2013.02.007.
- Fernández-Real J.M., Manco M. Effects of iron overload on chronic metabolic diseases. Lancet Diabetes Endocrinol. 2014;2(6):513–526. DOI: 10.1016/S2213-8587(13)70174-8.
- Abril-Ulloa V., Flores-Mateo G., Solà-Alberich R., Manuel-y-Keenoy B., Arija V. Ferritin levels and risk of metabolic syndrome: meta-analysis of observational studies. BMC Public Health. 2014;14:483. DOI: 10.1186/1471-2458-14-483.
- Srivastav S.K., Mir I.A., Bansal N., Singh P.K., Kumari R., Deshmukh A. Serum ferritin in metabolic syndrome-mechanisms and clinical applications. Pathophysiology. 2022;29(2):319–325. DOI: 10.3390/pathophysiology29020023.
- Moore Heslin A., O’Donnell A., Buffini M., Nugent A.P., Walton J., Flynn A. et al. Risk of Iron overload in obesity and implications in metabolic health. Nutrients. 2021;13(5):1539. DOI: 10.3390/nu13051539.


