Взаимосвязь полиморфизмов в генах BDNF, TOMM40, APOE, AQP5 с эффективностью освоения перспективных интерфейсов человек-компьютер
Автор: Туровский Я.А., Гуреев А.П., Виткалова И.Ю., Чумаченко А.Г., Попов В.Н.
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Физиология
Статья в выпуске: 4, 2020 года.
Бесплатный доступ
Цель работы - оценка взаимосвязи между рядом полиморфизмов генов BDNF (brain derived neurotrophic factor), TOMM40 (translocase of outer mitochondrial membrane 40), APOE (apolipoprotein E), AQP5 (aquaporin 5), NFE2L2 (nuclear factor, erythroid 2 like 2), HTR2A (5-hydroxytryptamine receptor 2A), TPH2 и эффективностью освоения интерфейсов «человек - компьютер». Материалы и методы. В работе были использованы ИТ-методы, которые заключались в использовании интерфейсов типа «человек - компьютер», и молекулярно-генетичекие методы. В качестве интерфейсов «человек - компьютер» выбраны следующие технические решения: интерфейс «мозг - компьютер», электромиграфический интерфейс и дыхательный интерфейс. Точность работы всех интерфейсов определялась по числу правильно выбранных блоков, содержащих необходимый символ, заданный испытуемому. Молекулярно-генетический метод основывался на проведении генотипирования с использованием ПЦП-ПДРФ-анализа. Полученные результаты статистически обрабатывались. Результаты. Показано, что в полученном многомерном (до 14 осей) пространстве переменные, отражающие успешность освоения миографических и дыхательных интерфейсов, тесно соседствуют с переменными, отражающими неуспешность освоения интерфейсов «мозг - компьютер». При этом переоценка субъективного времени, затраченного на выполнение задания, характерна для пользователей, не достигших успеха. Выводы. Данные процессы находятся в тесной зависимости от факторов созревания и дифференциации нейронов, транспортеров питательных веществ через митохондриальную мембрану, от уровня аполипопротеинов, от мембранных водных каналов, но механизм данной взаимосвязи нуждается в дальнейшем изучении.
Генотипирование, полиморфизмы, нейрокомпьютерные интерфейсы
Короткий адрес: https://sciup.org/14117588
IDR: 14117588 | УДК: 575.22 | DOI: 10.34014/2227-1848-2020-4-110-121
Текст научной статьи Взаимосвязь полиморфизмов в генах BDNF, TOMM40, APOE, AQP5 с эффективностью освоения перспективных интерфейсов человек-компьютер
Введение. Развитие современных междисциплинарных подходов на стыке информационных технологий и физиологии привело к появлению в последние десятилетия большого числа устройств коммуникации между человеком и компьютером. Их планируется использовать для решения широкого спектра задач, связанных с реабилитацией пациентов неврологического и травматологического профилей, совершенствованием управления различными устройствами: от домашнего компьютера до авиационных систем. Наиболее распространённые задачи, решаемые в настоящее время, - это улучшение их аппаратной части, разработка новых алгоритмов обработки полученных сигналов и трансформации их в команды на устройства-эффекторы, поиск новых физиологических феноменов, которые можно использовать как основу для команд, передаваемых по новым интерфейсам. Однако использование традиционных эргати-ческих парадигм, основанных на опыте созда- ния и эксплуатации систем управления, в данном случае далеко не всегда оправдано. В первую очередь речь идёт о психофизиологических возможностях овладения теми или иными технологиями. При этом данные особенности могут быть как приобретёнными, так и генетически детерминированными.
Цель исследования. Оценка взаимосвязи между рядом полиморфизмов генов BDNF (brain derived neurotrophic factor), TOMM40 (translocase of outer mitochondrial membrane 40), APOE (apolipoprotein E), AQP5 (aquaporin 5), NFE2L2 (nuclear factor, erythroid 2 like 2), HTR2A (5-hydroxytryptamine receptor 2A), TPH2 и эффективностью освоения интерфейсов «человек – компьютер».
Материалы и методы. В качестве интерфейсов «человек – компьютер» были выбраны следующие технические решения: интерфейс «мозг-компьютер» (ИМК, НКИ), электроми-графический интерфейс (ЭИ), дыхательный интерфейс (ДИ).
Окулографический интерфейс показал высокую точность работы, дисперсия показателей его пользователей в аспекте освоения была не велика.
Испытуемыми были 23 добровольца в возрасте от 19 до 25 лет, давших информированное согласие на проведение исследования.
В ходе работы с дыхательным интерфейсом испытуемый должен был в эксперименте А, варьируя скорость и объём выдоха, добиваться изменения положения по оси Y курсора, перемещающегося в течении 8 с от левого края экрана к правому. В правой области экрана располагалось 6 блоков букв. При совмещении курсора с соответствующим блоком осуществлялся первый уровень выбора требуемого символа. Буквы выбранного блока после этого выбора формировали новый ряд из 6 блоков, каждый из которых содержал теперь только одну букву. Перемещение курсора начиналось заново, что в итоге обеспечивало выбор конкретного символа из представленных.
В эксперименте Б круговое поле графического интерфейса было разбито на 6 секторов, каждый из которых был активен в течение 2 с, о чём пользователь информировался изменением цвета соответствующего сектора. Для выбора необходимого сектора пользователю требовалось совершить интенсивный выдох. В том случае, если звуковое давление на мембрану микрофона превышало порог, считалось, что пользователь выбрал именно этот сектор. Символы, находившиеся в нем, автоматически перемещались на другие, предварительно очищенные, сектора. Таким образом, для выбора символа, как и в предыдущем случае, необходимо было два раза подряд правильно выбрать тот или иной блок. Данный вариант дыхательного интерфейса также продемонстрировал высокую точность работы и был исключен из дальнейшего анализа. В последующем под ДИ будет подразумеваться только вариант эксперимента А.
При работе с электромиографическим интерфейсом в качестве аппаратной части использовался электроэнцефалограф «Ней-рон-Спектр-4 ВП» (ООО «Нейрософт»). Электроды располагались в проекции плечелуче-вой мышцы на 7–10 см дистальнее латерального мыщелка плечевой кости. Межэлектродное расстояние составляло 4–5 см. Полиграфические каналы прибора обеспечивали регистрацию ЭМГ с частотой до 40 кГц, которая потом программно снижалась до 500 Гц. Дизайн графического интерфейса полностью соответствовал дизайну графического интерфейса эксперимента серии Б. Испытуемый должен был напрягать мышцы предплечья в случае, если подсвеченный сектор на графическом интерфейсе соответствовал блоку букв или букве, которую необходимо было выбрать.
Нейрокомпьютерный («мозг – компьютер») интерфейс являлся синхронным и неинвазивным и основывался на детекции устойчивых зрительных вызванных потенциалов (SSVEP). Регистрация ЭЭГ осуществлялась энцефалографом «Нейрон-Спектр-4 ВП» (ООО «Нейрософт») со включенным ре-жекторным фильтром и выключенными фильтрами высоких и низких частот. Фотостимуляция осуществлялась шестью диодами белого цвета (0,5 Вт), расположенными на специальной рамке по краям монитора. Частота стимуляции составляла 9,009, 10,10, 11,11, 12,19, 13,33, 14,49 Гц. Регистрация ЭЭГ-активности осуществлялась электродами в позициях O1, O2, Oz, P3, P4, Pz, референтным электродом служил объединённый ушной электрод. Логика изменения графического интерфейса соответствовала таковой для окулографических исследований.
Точность работы всех интерфейсов определялась по числу правильно выбранных блоков, содержащих необходимый символ, заданный испытуемому.
Генотипирование. Выделение ДНК из буккального эпителия проводилось с использованием набора «Проба-ГС» (ООО «НПО ДНК-Технология», Россия). Генотипирование проводилось методом ПДРФ-анализа. ПЦР осу- ществляли на приборе Bio-Rad CFX96TM (BioRad, USA) с использованием набора qPCRmix-HS (Evrogen, Россия). Общую денатурацию проводили при 95 °С в течение 3 мин; денатурацию в начале цикла – при 95 °С в течение 30 с; отжиг праймеров – при 59–71 °С в течение 30 с; элонгацию – при 72 °С в течение 30 с; количество циклов – 35. Информация об используемых праймерах и эндонуклеазах рестрикции представлена в табл. 1. Генотипы однонуклеотидных замен AQP5 rs3759129 и NFE2L2 rs7557529 были определены посредством ал-лель-специфической тетрапраймерной ПЦР.
Таблица 1
Table 1
Primers and restriction endonuclease used in the trial
|
SNP |
Праймеры Primers |
Эндонуклеаза рестрикции Restriction endonuclease |
Размер продукта Product size |
|
BDNF rs6265 |
F: AAACATCCGAGGACAAGGTG R: CGTGTACAAGTCTGCGTCCTT |
HpySE526 I |
G/G – 207 А/А – 124; 78 A/G – 78; 207; 124 |
|
BDNF rs2030324 |
F: TCACTCCAAACATCACACAGC R: TGGGCATAAGTTAGAGCTGACA |
HpySE526 I |
T/T – 188 C/C – 134; 54 C/T – 188; 134; 54 |
|
HTR 2A rs6313 |
F: TGAGCTCAACTACGAACTCCCTA R: AGAGACACGACGGTGAGAGG |
Msp I |
T/T – 172 C/C – 99; 72 C/T – 172; 99; 72 |
|
TOMM 40 rs10119 |
F: CAGTGGGCCTGGGGTCACGGGAG R: GGAAGCTCCTCTCGCTGCCC |
Msp I |
A/A – 155 G/G – 134; 32 A/G – 166; 134; 32 |
|
APOE rs429358 |
F: CGCCTCGCCTCCCACCTGAGCAAG R: CGCTCGTCGCCCTCGCGGG |
HspA I |
T/T – 72 C/C – 45; 27 T/C – 72; 45; 27 |
|
TPH 2 rs4570625 |
F: GGCTAAATTGAACCCTTACCTTT R: GGTAATCAAGATATCCATTGCC |
Psi I |
G/G – 301 T/T – 89; 212 G/T – 89; 212; 301 |
|
TPH 2 rs4290270 |
F: TTTTGTTTTGGGTGCCATTT; R: TGCATGGGAAGGGTATTTTC |
FauND I |
T/T – 209 A/A – 134; 76 T/A – 209; 134; 76 |
|
NFE2L2 rs7557529 |
R1: TCTACCAAATTGGGAAGCTGT; R2: TGAGAGTCCATGGAATAGAAAG; F1: AAGCAGACTACAACGAATGGA; F2: CCAACATAATTGTCTCCTGACAT |
- |
C/C – 152 C/T – 210; 152 T/T – 210 |
|
AQP 5 rs3759129 |
R1: CTTGATCTCTCTCCCCTCGA; R2: CTGTTTTTCCTTCCTGCCTT; F1: CTCCAGCCTCGTTCTCCACATG; F2: ACAGAGAGACTAAGACAGCAAC |
- |
A/A – 362 A/C – 362; 247 C/C – 247 |
Используемые праймеры и эндонуклеазы рестрикции
При статистическом анализе с учётом числа испытуемых и многомерных результатов было принято решение об использовании разведочных статистических подходов на основе анализа соответствий (Correspondence analysis). Полученные координаты в n-мерном пространстве фактически отражают степень «похожести» распределения значений переменных. В нашем случае это будут, с одной стороны, частоты встречаемости различных вариантов точечных мутаций, с другой – параметры успешного овладения интерфейсами «человек – компьютер». При этом полученные координаты в многомерном пространстве достаточно сложны для интерпретации, поскольку необходимо анализировать большое число двух- и трёхмерных проекций. В этом случае был применен подход на основе иерархических процедур кластерного анализа. В качестве алгоритмов кластеризации использован метод «дальнего соседа», взвешенные и невзвешенные центроидные методы и методы попарного среднего. Различные методы кластеризации и подходы к оценке расстояния между исследуемыми переменными (евклидово, Чебышева, манхэттенское) обеспечили оценку воспроизводимости выявленных феноменов. Обработка осуществлялась как в программном пакете Statistica 8.0, так и в оригинальном ПО. Конкретная версия пакета Statistica 8.0 верифицировалась тестовыми выборками с известными результатами обработки.
Результаты и обсуждение. В ходе эксперимента были проанализированы частоты встречаемости аллелей изучаемых полиморфизмов. В полиморфизме rs3759129 гена AQP5 встречаемость генотипа A/A составляла 81,4 %, A/C – 16,3 %, С/С – 2,3%. В полиморфизме rs429358 гена APOE частота встречаемости генотипа С/С составляла 74,5 %, С/Т – 25,5 %. В полиморфизме rs10119 гена TOMM40 генотип A/A встречался в 4,30 % случаев, G/A – в 23,40 %, G/G – в 72,30 %. В гене BDNF в полиморфизме rs6265 встречаемость генотипов составила: A/A – 4,30 %, G/A – 29,80 %, G/G – 65,90 %; в полиморфизме rs2030324: C/C – 23,40 %, C/T – 55,30 %, T/T – 21,30 %. В гене HTR2A в полиморфизме rs6313 наблюдалось следующее распределение: C/C – 19,10 %,
C/T – 66 %, T/T – 14,90 %; в полиморфизме rs4570625: G/G – 76,60 %, G/T – 23,40 %; в полиморфизме rs4290270: A/A – 2,10 %, A/T – 27,70 %, T/T – 70,20 %. Для полиморфизма rs7557529 гена NFE2L2 наблюдалось следующее распределение частот встречаемости генотипов: C/C – 18,37 %, C/T – 42,86 %, T/T – 38,77 %.
Полученные в ходе оценки соответствий многомерные координаты исследуемых переменных (успешность/неуспешность овладения интерфейсами «мозг – компьютер», мио-гафическим и дыхательным интерфейсами (рис. 1)) и генетические полиморфизмы были подвергнуты кластерному анализу с целью выявления пространственных групп. Предполагается, что близость переменных, связанных с параметрами работы интерфейса, с переменными, отражающими точечные мутации, может показать их взаимосвязь.
Рассмотрим результаты кластеризации для иерархических методов. Из рис. 2, где представлены результаты кластеризации в евклидовом пространстве с использованием метода «дальнего соседа», следует, что успешности овладения миографическим и дыхательными интерфейсами находятся достаточно близко друг к другу. Очевидно, это связано с тем, что сам дыхательный интерфейс по сути является вариантом миографического, где активность мышц трансформируется в параметры внешнего дыхания, являющиеся управляющими командами. При этом к этой же группе (выделено пунктирным прямоугольником) относятся и случаи с неуспешным овладением интерфейсом «мозг – компьютер». Использование критерия χ2 показало отсутствие статистически значимых связей успешности освоения пользователем тех или иных интерфейсов (p>>0,5), однако анализ соответствий с последующей кластеризацией только указанных параметров без учёта генетических маркеров показал, что формируется компактный кластер, в котором находятся маркеры успешного освоения ДИ, ЭИ и неуспешного освоения НКИ. На следующем этапе с учётом потенциала НКИ рассмотрим особенности формирования субъективных шкал времени при работе с данным классом устройств. Оче- видно, при любом виде операторской деятельности у выполняющего управляющие функции человека должно быть сформировано представление о том, сколько времени займёт выполнение тех или иных его действий и команд. При этом данные субъективные шкалы должны максимально соответствовать объективным.
1 5
ts7557529:CC
1 О
«6313 :TT
«6265 :G.A
«6265 :A G
0.5
s2030324:C'T neuro false нейро: неспешно ♦sl0119:GG
• Mio true Мио успешно
«3^f^^ * да™»
0,0
RI false
ДГI неуспешно
«6265 :GG
«6313 :CT r-429358:C^ п7557’Ж'Т
«6313:0€
«3759129 JVC
«6265
-0,5
-1,0
io false to неуспешно
ra755 7529:CT tsl0119GA
«203032400
-1,0
-0.5
0,0

1 0
1.5
Рис. 1. Пример представления проекции на фрагмент плоскости 14-мерного пространства, отражающего взаиморасположение успешности овладения НКИ, ЭИ, ОИ и точечными мутациями.
По осям OX и OY – условные единицы
Fig. 1. An example of a projection onto a fragment of a 14-dimensional space surface, reflecting the mutual location of the successful mastering of BCI, EI, ETI (eye tracking interface) and point mutations.
Relative units are marked along axes OX and OY
В этот же кластер попадают следующие генотипы: NFE2L2 rs7557529 (T/T), HTR2A rs6313 (C/T), BDNF rs6265 (G/G), AQP5 rs3759129 (A/A), TOMM40 rs10119 (G/G), BDNF rs2030324 (C/T), APOE rs429358 (C/C). При данной классификации значений точеч- ных мутаций видно, что, как и предполагалось во введении, значение имеет именно конкретный генотип. Действительно, например, три генотипа полиморфизма TOMM40 rs10119 (G/G, A/A, G/A) по результатам классификации находятся далеко друг от друга.
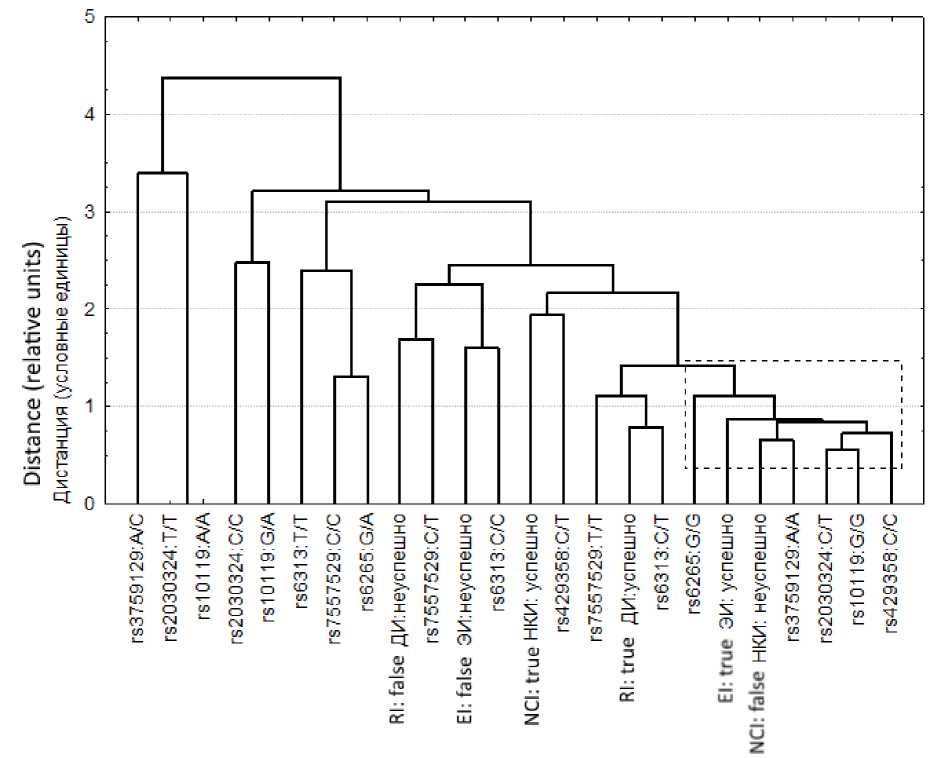
Рис. 2. Результаты кластеризации 14-мерного пространства данных, полученных на основе анализа соответствий
Fig. 2. Clustering results of 14-dimensional data space obtained on the basis of correspondence analysis
Из рис. 3 видно, что пользователи, не освоившие НКИ, т.е. не сумевшие сгенерировать число команд, превышающее порог случайного срабатывания устройства, демонстрировали переоценку времени, затраченного на выполнение задания. При этом набор генотипов полиморфизмов в аспекте расположения в следуемом пространстве в значительной степени повторял таковой, полученный для набора переменных согласно рис. 2.
Однонуклеотидные полиморфизмы, представленные в данных кластерах, главным образом ассоциированы с когнитивными функциями. Полиморфизм rs6265 гена BDNF связан с заменой валина на метеонин в 66-м положе- нии. G-аллель кодирует вариант гена с валином, А-аллель – с метеонином [1]. Ранее было выявлено, что полиморфизм BDNF rs6265 связан с когнитивными способностями: у лиц с генотипом A/A хуже кратковременная память и ниже способность к кратковременному обучению по сравнению с носителями генотипа G/G [2]. У носителей А-аллеля черепно-мозговые травмы в большей степени усугубляют нарушение когнитивных параметров по сравнению с носителями G-аллеля [3]. Среди людей с болезнью Альцгеймера у носителей A-аллеля быстрее происходит потеря кратковременной памяти и снижается объем гиппокампа, хотя влияния полиморфизма rs6265 на уровень β-амилоида (Aβ) не было обнаружено [4]. Люди G/G-генотипов обладают лучшей рабочей памятью и пространственной ориентацией, чем лица с А/А-генотипом [5]. Другой полиморфизм в гене BDNF – rs2030234 тоже связан с когнитивными способностями. Носители Т/Т-генотипа демонстрировали наихудшие результаты при выполнении теста на визуально-пространственную память [6].
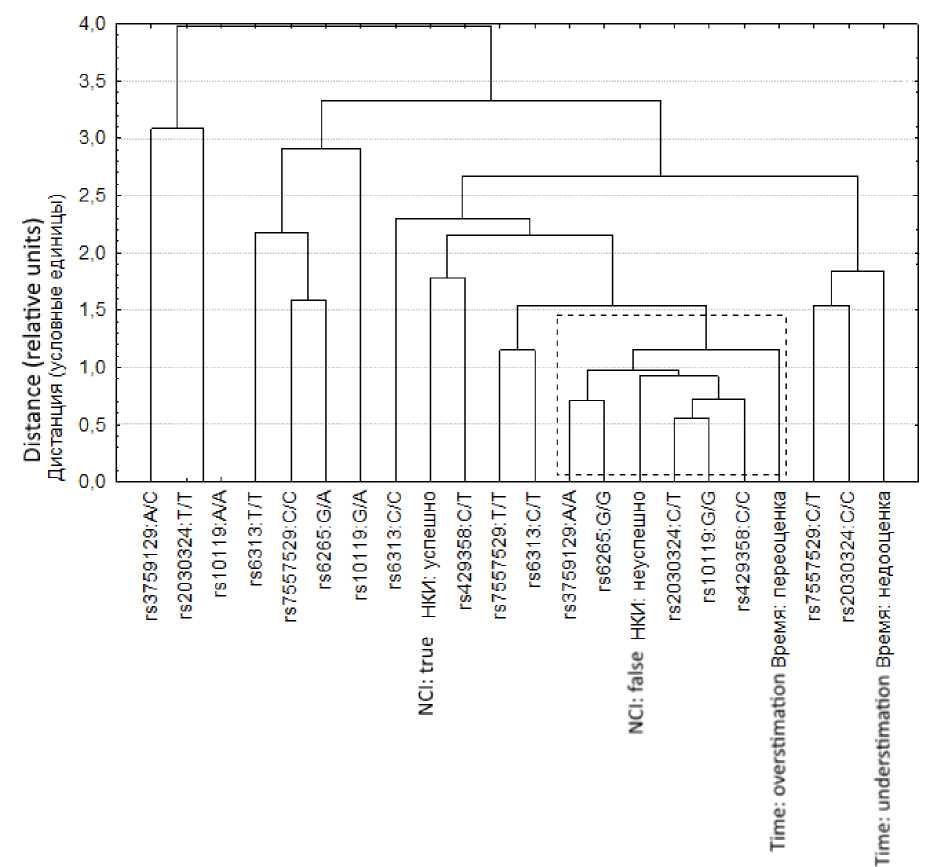
Рис. 3. Результаты кластерного анализа точечных мутаций, успешности освоения НКИ и субъективных шкал времени, сформировавшихся при работе с данным устройством
Fig. 3. Results of cluster analysis of point mutations, the successful BCI mastering and subjective time scales formed while working with the device
Локус 19q13.3 является крайне важным в аспекте когнитивных функций и когнитивных нарушений (например, при болезни Альцгеймера) [7]. Особый интерес представляют два гена – APOE и TOMM40. Генотип APOE rs429358 C/C увеличивает риск возникновения болезни Альцгеймера в молодом возрасте в 61 раз, в пожилом возрасте в 12 раз [8]. В полиморфизме TOMM40 rs10119 А-аллель оказывает эффект на когнитивные функции, но только у пожилых людей, тогда как у молодых людей эффект близок к нулю [9]. При этом мы показали, что со степенью успешности освоения интерфейсов связан полиморфизм rs3759129 в гене AQP5. Нет литературных данных о том, что полиморфизмы в генах, кодирующих аквапорины, ассоциированы с когнитивными способностями, так как данные белки представляют собой мембранные водные каналы, которые обеспечивают пассивный перенос воды через липидный бислой, что оказывает чрезвычайно значимое влияние на секрецию слюны [10]. Сайт однонуклеотидной замены -1364 A/C в промоторе гена ак-вапорина-5 (AQP5) определяет уровень экспрессии AQP5. При генотипе AQP5 A/A экспрессия выше, чем при альтернативных генотипах [11]. Влияние данного генетического полиморфизма на когнитивные функции показано нами впервые.
Примечательно, что не было обнаружено никакой взаимосвязи между успешностью освоения нейроинтерфейсов и полиморфизмами в гене NFE2L2. Данный ген кодирует транскрипционный фактор, который отвечает за широкий спектр функций в головном мозге, регулируя процессы митофагии, митохондриального биогенеза, антиоксидантной защиты [12]. По этой причине данный белок играет значительную роль при таких нейродегенера-тивных заболеваниях, как болезнь Альцгеймера [13] и болезнь Паркинсона [14], но мы не выявили его влияния на когнитивные способности здоровых субъектов. Кроме того, не было выявлено взаимосвязи для полиморфизма rs6313 гена HTR2A. Хoтя данный полиморфизм в значительной степени влияет на эмоциональность людей [15, 16], что связано с их когнитивными способностями [17].
Заключение. Методами многомерной разведочной статистики проведен анализ взаимосвязи показателей работы с дыхательными, миографическими и нейрокомпьютерными интерфейсами однонуклеотидных полиморфизмов генов BDNF , TOMM40 , APOE , AQP5 . Показано, что в полученном многомерном (до 14 осей) пространстве переменные, отражающие успешность освоения миографических и дыхательных интерфейсов, тесно соседствуют с переменными, отражающими не-успешность освоения интерфейсов «мозг – компьютер». При этом переоценка субъективного времени, затраченного на выполнение задания, характерна для пользователей, не достигших успеха в применении. Таким образом, можно сделать вывод, что данные процессы находятся в тесной зависимости от факторов созревания и дифференциации нейронов, транспортеров питательных веществ через митохондриальную мембрану, от уровня аполипротеинов и от мембранных водных каналов, но механизм данной взаимосвязи нуждается в дальнейшем изучении.
Работа выполнена при поддержке РФФИ офи-м 17-29-02505.
Список литературы Взаимосвязь полиморфизмов в генах BDNF, TOMM40, APOE, AQP5 с эффективностью освоения перспективных интерфейсов человек-компьютер
- Avgan N., Sutherland H.G., Spriggens L.K. BDNF Variants May Modulate Long-Term Visual Memory Performance in a Healthy Cohort. Int. J. Mol. Sci. 2017; 18 (3): E655. DOI: 10.3390/ijms18030655
- McHughen S.A., Rodriguez P.F., Kleim J.A. BDNF val66met polymorphism influences motor system function in the human brain. Cereb. Cortex. 2010; 20 (5): 1254-1262. DOI: 10.1093/cercor/bhp189
- McAllister T. W., Tyler A.L., Flashman L.A. Polymorphisms in the brain-derived neurotrophic factor gene influence memory and processing speed one month after brain injury. J. Neurotrauma. 2012; 29 (6): 1111-1118. DOI: 10.1089/neu.2011.1930
- Lim Y.Y., Villemagne V.L., Laws S.M. AIBL Research Group, Effect of BDNF Val66Met on memory decline and hippocampal atrophy in prodromal Alzheimer's disease: a preliminary study. PLoS One. 2014; 9 (1): e86498. DOI: 10.1371/journal.pone.0086498
- IsmailM., Qureshi S.A. Molecular nature of T-cell receptors. J. Pak. Med. Assoc. 1991; 41 (8): 202-204.
- Weinstock-Guttman B., Benedict R.H., Tamano-Blanco M. The rs2030324 SNP of brain-derived neurotrophic factor (BDNF) is associated with visual cognitive processing in multiple sclerosis. Pathophysiology. 2011; 18 (1): 43-52.
- DOI: 10.1016/j.pathophys.2010.04.005
- Kulminski A.M., Huang J., Wang J. Apolipoprotein E region molecular signatures of Alzheimer's disease. Aging Cell. 2018; 17 (4): e12779. DOI: Ш.ПП/acel. 12779.
- Rubinsztein D. C., Easton D.F. Apolipoprotein E genetic variation and Alzheimer's disease. A meta-analysis. Dement. Geriatr. Cogn. Disord. 1999; 10 (3): 199-209.
- DOI: 10.1159/000017120
- Davies G., Armstrong N., Bis J. C. Genetic contributions to variation in general cognitive function: a metaanalysis of genome-wide association studies in the CHARGE consortium (N=53949). Mol. Psychiatry. 2015; 20 (2): 183-192.
- DOI: 10.1038/mp.2014.188
- Matsuzaki T., Susa T., Shimizu K. Function of the membrane water channel aquaporin-5 in the salivary gland. Acta Histochem. Cytochem. 2012; 45 (5): 251-259.
- DOI: 10.1267/ahc.12018
- Rump K., Unterberg M., Bergmann L. AQP5-1364A/C polymorphism and the AQP5 expression influence sepsis survival and immune cell migration: a prospective laboratory and patient study. J. Transl. Med. 2016; 14 (1): 321.
- DOI: 10.1186/s12967-016-1079-2
- Dinkova-Kostova A.T., Abramov A.Y. The emerging role of Nrf2 in mitochondrial function. Free Radic. Biol. Med. 2015; 88 (Pt. B): 179-188.
- DOI: 10.1016/j.freeradbiomed.2015.04.036
- Bahn G., Jo D.G. Therapeutic Approaches to Alzheimer's Disease Through Modulation of NRF2. Neuromolecular Med. 2019; 21 (1): 1-11.
- DOI: 10.1007/s12017-018-08523-5
- Gureev A.P., Popov V.N. Nrf2/ARE Pathway as a Therapeutic Target for the Treatment of Parkinson Diseases. Neurochem. Res. 2019; 44 (10): 2273-2279.
- DOI: 10.1007/s11064-018-02711-2
- Racine S.E., Culbert K.M., Larson C.L. The possible influence of impulsivity and dietary restraint on associations between serotonin genes and binge eating. J. Psychiatr. Res. 2009; 43 (16): 1278-1286.
- DOI: 10.1016/j.jpsychires.2009.05.002
- Jakubczyk A., Wrzosek M., Lukaszkiewicz J. The CC genotype in HTR2A T102C polymorphism is associated with behavioral impulsivity in alcohol-dependent patients. J. Psychiatr. Res. 2012; 46 (1): 44-49.
- DOI: 10.1016/j.jpsychires.2011.09.001
- Gong P., Li J., Wang J., Lei X. Variations in 5-HT2A influence spatial cognitive abilities and working memory. Can. J. Neurol. Sci. 2011; 38 (2): 303-308.
- DOI: 10.1017/s0317167100011513


