Взаимосвязь результатов исследований in silico и in vivo гипогликемических, гиполипидемических, гепатопротекторных свойств нового производного 1,4-дигидропиридина
Автор: Кетова Е.С., Мязина А.В., Бибик И.В., Бибик Е.Ю., Кривоколыско С.Г.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Фармакология, клиническая фармакология
Статья в выпуске: 3 т.20, 2024 года.
Бесплатный доступ
Цель: определение взаимосвязи результатов исследований in silico и in vivo гипогликемических, гиполипидемических, гепатопротекторных свойств нового производного 1,4-дигидропиридина с шифром AZ-383. Материал и методы. Виртуальный биоскрининг соединения AZ-383 проведен с использованием программ Swiss Target Prediction. Выявленные биомишени явились перспективными в отношении фармакокоррекции комплекса метаболических нарушений, что подтвердилось в эксперименте, проведенном на крысах-самцах линии Wistar. In vivo исследовали уровень глюкозы, общего холестерина, триглицеридов, аланинаминотрансферазы, аспартатаминотрансферазы, общего билирубина крови; оценивали микроархитектонику печени крыс после фармакокоррекции смоделированных метаболических нарушений соединением AZ-383.
Производные цианотиоацетамида, производный 1, 4-дигидропиридина, алиментарная нагрузка, стероидный диабет, фармакологическая коррекция метаболических нарушений
Короткий адрес: https://sciup.org/149146948
IDR: 149146948 | УДК: 547:616.153.455-008.64:616.379-008.64 | DOI: 10.15275/ssmj2003333
Текст научной статьи Взаимосвязь результатов исследований in silico и in vivo гипогликемических, гиполипидемических, гепатопротекторных свойств нового производного 1,4-дигидропиридина
EDN: JYKGMN
1 Введение. В современном мире особую актуальность приобретают проблемы алиментарного ожирения, гипергликемии, дислипидемии, симпто-мокомплекса, составляющего метаболический синдром, а также сопровождающей их гепатобилиарной патологии [1–5]. Это обусловлено возрастающей распространенностью данных заболеваний, что можно связать с изменением образа жизни людей, дефицитом физической активности, высокожировым и высококалорийным питанием современного человека, а также другими немаловажными факторами, такими как лекарственно индуцированные нарушения метаболизма и прочие влияния [2, 4, 6–8]. Наравне со снижением качества и продолжительности жизни у пациентов с метаболическими нарушениями, стоит учитывать фактор увеличения экономических затрат в здравоохранении, связанных с терапией ожирения, сахарного диабета 2-го типа (СД 2), нарушений липидного обмена, заболеваний печени [3].
В настоящее время существует большое число групп фармакологических препаратов, оказывающих влияние на метаболизм человека и использующихся для фармакологической коррекции указанных нозологий [1, 2, 9]. Несмотря на это, ученые продолжают поиск новых лекарственных средств, а также точек их приложения, чтобы иметь комплексный подход к терапии метаболического синдрома. Следует отметить наличие у существующих сахароснижающих, ги-полипидемических препаратов, средств для лечения ожирения ряда нежелательных реакций и ограниченное влияния на сложный патогенез заболеваний [1, 9]. В связи со сказанным актуальным является поиск и доклиническое изучение новых средств комплексной фармакокоррекции метаболических нарушений, включающих алиментарное ожирение, гипергликемию, дислипидемию и патологию гепатобилиарной системы.
Цианотиоацетамид представляет собой многофункциональный реагент, который активно используется в синтетической органической химии [10]. Опираясь на научные данные отдельных исследователей, можно заключить, что гетероциклические производные α-цианотиоацетамида являются перспективными для поиска новых лекарственных средств с гипогликемической, гиполипидемической, гепато-протекторной активностью, а также способностью к снижению массы тела [11, 12]. Особый интерес в настоящее время представляют новые производные α-цианотиоацетамида, синтезированные нами на базе НИЛ «ХимЭкс» ЛГУ им. Владимира Даля, а далее прошедшие виртуальный биоскрининг на поиск потенциальных мишеней воздействия для прогнозирования фармакологической активности.
Цель — определение взаимосвязи результатов исследований in silico и in vivo гипогликемических,
гиполипидемических, гепатопротекторных свойств нового производного 1,4-дигидропиридина с лабораторным шифром AZ-383.
Материал и методы. Виртуальный биоскрининг синтезированных на базе научно-исследовательской лаборатории «ХимЭкс» ФГБОУ ВО «Луганский государственный университет имени Владимира Даля» соединений из ряда новых производных цианотиоацетамида проведен с использованием пакета программ Swiss Target Prediction, разработанных учеными из Швейцарского института биоинформатики.
Для ряда новых гетероциклических соединений in silico определялись предполагаемые биомишени, которые могут быть полезными для фармакокоррекции нарушений углеводного и липидного обмена, а также в спектре гепатопротекторной активности.
Согласно результатам данного исследования выбрано соединение из числа новых производных 1,4-дигидропиридина с шифром AZ-383, которое предположительно, с учетом влияния на определенные биомишени, обладает гипогликемической, гиполипидемической, гепатопротекторной активностью, положительным влиянием на массу тела. Структурная формула соединения AZ-383 (2-метил- N -(2-метилфенил)-4-(2-фурил)-5-циано-6-({2-[(4-этоксифенил) амино]-2-оксоэтил}тио)-1,4-дигидропиридин-3-карбоксамида) представлена на рис. 1.
Экспериментальное исследование in vivo проведено на базе Научно-исследовательского института экспериментальной биологии и медицины ФГБОУ ВО «Воронежский государственный медицинский университет имени Н. Н. Бурденко» Минздрава России (НИИ ЭБМ ВГМУ имени Н. Н. Бурденко) на 40 половозрелых крысах-самцах линии Wistar. Животные рандомно распределены на интактную группу ( n =8), контрольную ( n =8) — в дополнение к суточному рациону животные получали избыточное количество
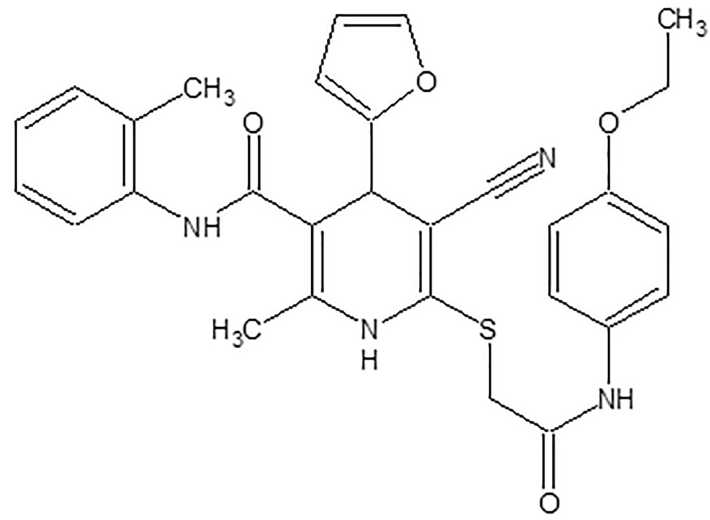
Рис. 1. Химическая формула соединения с лабораторным шифром AZ-383
пальмового масла из расчета 30 г/кг веса в течение 8 нед, затем дексаметазон внутрибрюшинно 0,125 мг/кг на протяжении 13 дней. Всем крысам групп сравнения и опытной группы были смоделированы метаболические нарушения путем высокожировой диеты и последующей глюкокортикоидной нагрузки. Период фармакокоррекции составил 14 дней. В опытной группе ( n =8) животным внутрижелудочно вводили соединение с шифром AZ-383 (1 мг/кг). Затем следовали группы сравнения 1 ( n =8) и 2 ( n =8): эти животные получали метформин 300 мг/кг и вил-даглиптин 8 мг/кг соответственно.
На всех этапах исследования отобраны половозрелые самцы крыс линии Wistar без внешних признаков заболеваний и анатомических нарушений, прошедшие необходимый карантин и период адаптации в НИИ ЭБМ ВГМУ имени Н. Н. Бурденко.
Все манипуляции с лабораторными животными осуществляли в соответствии с ГОСТ №33216–2014 «Руководство по содержанию и уходу за лабораторными животными. Правила содержания и ухода за лабораторными грызунами и кроликами», ГОСТ 33215–2014 «Руководство по содержанию и уходу за лабораторными животными. Правила оборудования помещений и организации процедур», ГОСТ 33044–2014 «Принципы надлежащей лабораторной практики». Дизайн эксперимента одобрен на заседании этического комитета ВГМУ имени Н. Н. Бурденко.
В ходе эксперимента еженедельно осуществляли взвешивание животных. Полученная информация о динамике массы тела подвергалась сравнению между группами и последующему анализу.
Оценка гипогликемической, гиполипидемической, гепатопротекторной активности проводилась при выводе животных из эксперимента. Оценку уровня глюкозы, общего холестерина (ОХ), триглицеридов (ТГ) крови проводили энзиматическим колориметрическим методом (производитель «Витал Диагностикс», Россия). Оценка биохимических маркеров печени проводилась кинетическим методом (аланинаминотрансферазы — АЛТ и аспартатаминотрансферазы — АСТ), методом Йендрашика — Грофа (общий билирубин — ОБ).
После вывода крыс из эксперимента микропрепараты печени подвергали стандартной методике пробоподготовки, срезы толщиной 4 мкм окрашивали гематоксилином Джилла и эозином, исследовали с помощью микроскопа ZEISS Axio Imager.А2. Осуществляли оценку среднего числа гепатоцитов в поле зрения, среднего размера гепатоцитов, подсчет ядерно-цитоплазматического отношения при изучении не менее 40 полей зрения.
Осуществляли проверку полученных данных на нормальность распределения по критерию Шапиро — Уилка. Поскольку все данные имеют нормальное распределение, их обработка производилась методами параметрической статистики. Для оценки достоверности различий между каждой из опытных групп и интактными животными применен критерий Стьюдента.
Результаты. Полученные данные виртуального биоскрининга определили для соединения из ряда производных 1,4-дигидропиридина с лабораторным шифром AZ-383 следующие предполагаемые биомишени: орексиновые рецепторы типа 1, 2; рецепторы желчных кислот, связанные с G-белком 1; киназа-3 гликогенсинтазы (GSK-3), никотинамидфосфорибо-зилтрансфераза (NAmPRTase), аденозиновые рецепторы A1, A2a, A2b, которые представляют интерес в отношении регуляции углеводного и липидного обмена, а также способности проявлять гепатопро-текторную активность.
Полученные in silico данные иллюстрируют перспективность соединения AZ-383 в спектре регуляции метаболических нарушений, наличия гипогликемической, гиполипидемической, гепатопротекторной активности, положительного влияния на массу тела.
Эти положения полностью согласуются с результатами проведенного нами эксперимента in vivo .
Смоделированные метаболические нарушения путем последовательной алиментарной и дексаме-тазоновой нагрузок приводили к развитию алиментарного ожирения, гипергликемии, дислипидемии, повышению печеночных маркеров крови, а также к нарушению микроархитектоники печени.
Продолжительный прием в пищу в дополнение к суточному рациону избытка пальмового масла приводил к увеличению массы тела крыс Wistar в динамике вплоть до развития ожирения I–II степени. Так, к концу 8-й недели наблюдения масса тела животных, употребляющих высокожировое питание, на 20% превышала массу тела крыс интактной группы. В последующем наблюдалось снижение веса под влиянием дексаметазона. Несмотря на это, масса крыс контрольной группы превышала вес интактных животных (386,8±12 г по сравнению с 376,5±12 г). По окончанию введения глюкокортикоидов происходил постепенный набор массы тела животных.
Смоделированные путем алиментарной и декса-метазоновой нагрузок нарушения отражались на биохимических показателях крови в виде изменений углеводного и липидного обмена, а также гепатоток-сического действия. Возрастание АЛТ и АСТ происходило на 77 и 31 % соответственно. Уровень ОБ увеличился на 118%, глюкозы — на 45%, ОХ — на 54%,
Значения показателей биохимического анализа крови подопытных животных в каждой группе согласно дизайну эксперимента, M ±σ
|
Параметр |
АЛТ, Ед/л |
АСТ, Ед/л |
ОБ, мкмоль/л |
Глюкоза, ммоль/л |
ОХ, ммоль/л |
ТГ, ммоль/л |
|
Интактная группа |
59,53±8,2 |
146,51±16,84 |
10,88±1,0 |
7,9±0,7 |
1,3±0,2 |
0,7±0,3 |
|
Контрольная группа |
105,29±9,9* |
192,65±9,0* |
23,72±3,5* |
11,44±1,1* |
2,0±0,2* |
1,9±0,4* |
|
Группа сравнения 1 (метфомин) |
57,49±6,6 |
181,67±10,90* |
10,70±1,1 |
7,3±0,5 |
1,6±0,2 |
0,9±0,2 |
|
Группа сравнения 2 (вилдаглиптин) |
53,23±6,4 |
156,23±8,5 |
11,93±1,5 |
7,9±0,4 |
1,6±0,2 |
0,6±0,2 |
|
Опытная группа (AZ-383) |
56,78±6,6 |
155,87±14,53 |
11,92±0,7 |
7,9±0,4 |
1,4±0,1 |
0,7±0,2 |
Примечание.* p <0,05 в сравнении с интактной группой.
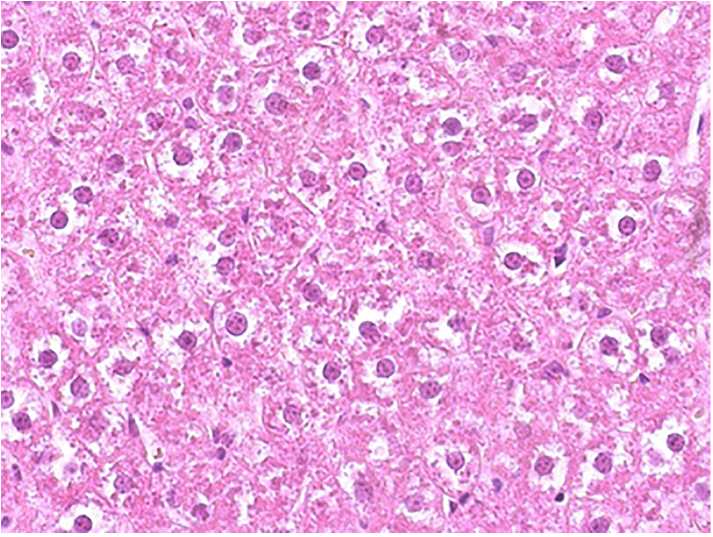
Рис. 2. Печень крысы контрольной группы (×400, окраска гематоксилином и Джилла-эозином)
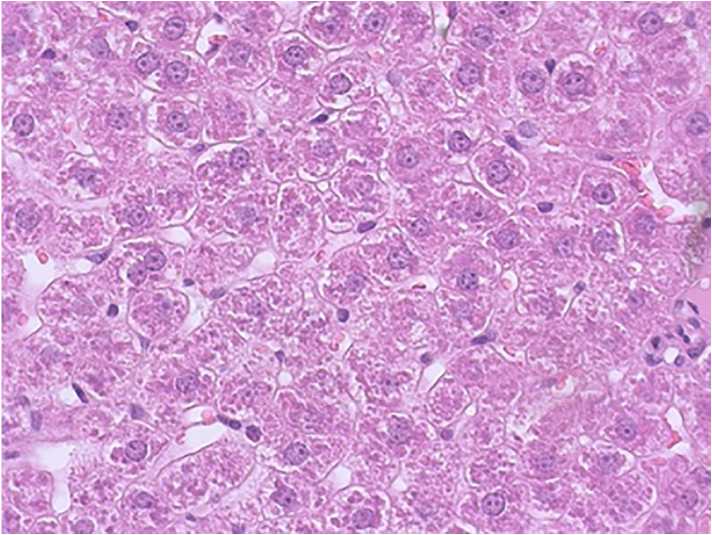
Рис. 3. Печень крысы опытной группы, получавшей новое производное цианотиоацетамида с шифром AZ-383 (×400, окраска гематоксилином и Джилла-эозином)
ТГ — на 171% в сравнении со значениями в интактной группе (см. таблицу).
При изучении путем светомикроскопии микропрепаратов печени контрольной группы крыс обнаружены выраженные структурные преобразования паренхимы данного органа детоксикации. Ткань печени представляла собой практически гомогенную массу, среди визуализирующихся гепатоцитов можно было выделить участки тканевого детрита, представляющие собой скопления гликогена и остатков ядер. Во всех образцах были зафиксированы явления паренхиматозного диспротеиноза, жировой дистрофии и некроза (рис. 2).
При сравнительном анализе полученных морфометрических данных видно, что алиментарная и дек-саметазоновая нагрузки у крыс контрольной группы приводили к увеличению на 6,7% среднего числа гепатоцитов в поле зрения (43,68±0,98) относительно показателей в интактной группе (40,92±1,04). Кроме того, смоделированные метаболические нарушения приводили к увеличению на 11,3% среднего размера гепатоцитов (90,79±0,48) относительно интактных животных (81,59±0,59), также происходило нарушение ядерно-цитоплазматического отношения, которое увеличилось на 30% (0,17±0,004) по сравнению с показателем интактной группы (0,13±0,004).
В опытной группе животных применение в качестве фармакокоррекции смоделированных метаболических нарушений нового соединения из ряда производных 1,4-дигидропиридина с шифром AZ-383 приводило к более сглаженному и достоверно менее интенсивному набору веса после завершения введения дексаметазона. Так, масса тела крыс после внутрижелудочного применения AZ-383 на протяжении 14 дней была на уровне 378±12 г, в то время как под действием метформина в группе сравнения 1 зарегистрирован показатель 419±14 г, а в группе сравнения 2 под влиянием вилдаглиптина — 416±13 г.
При анализе данных (см. таблицу) отмечается наличие у соединения AZ-383 гипогликемических, гиполипидемических свойств, а также способности восстанавливать печеночные маркеры после из возрастания в период моделирования высокожировой и дексаметазоновой нагрузок. Следует заметить, что соединение с шифром AZ-383 обладает равной по силе с вилдаглиптином гипогликемической активностью. Однако у данного соединения — более выраженные гиполипидемические и гепатопротекторные свойства, чем у метформина и вилдаглиптина, что является важным аспектом комплексной коррекции метаболических нарушений, учитывая комор-бидность, присущую пациентам.
На срезах паренхимы печени крыс опытной группы, получавших в качестве фармакокоррекции соединение AZ-383, видно, что печеночные балки отчетливо выражены, гепатоциты полигональной формы с выраженной цитоплазматической мембраной. Внутри цитоплазмы — большое количество включений гликогена. Ядра округлой/овальной формы с одним или двумя ядрышками ближе к центру клеток с хорошо окрашенной ядерной оболочкой (рис. 3).
Под воздействием AZ-383 отмечено достоверное увеличение числа гепатоцитов на 17,8% относительно контрольной группы животных. Под влиянием метформина данное увеличение составило 4,6%, вилдаглиптина — 12%. Размер гепатоцитов под воздействием метформина, вилдаглиптина, соединения с лабораторным шифром AZ-383 статистически достоверно уменьшался на 4; 4 и 7% соответственно относительно контрольной группы животных. Наиболее значимого снижения площади цитоплазмы и ядер гепатоцитов удалось достичь при применении соединения AZ-383. Оно составило уменьшение показателей площади цитоплазмы и ядер гепатоцитов на 5,2 и 18,7% соответственно относительно значений, зарегистрированных в паренхиме печени крыс контрольной группы. Фармакокоррекция метформином привела к снижению ядерно-цитоплазматиче-ского отношения на 11,8%. Применение соединения с лабораторным шифром AZ-383 и вилдаглиптина сопровождалось снижением ядерно-цитоплазмати-ческого отношения на 17,6% относительно такового значения у контрольных крыс.
Обсуждение. Полученные в ходе исследования данные согласуются с мнением ряда авторов. Рассматривая биомишени, определенные in silico для соединения AZ-383, можно заключить, что они являются важными звеньями патогенеза при развитии метаболических нарушений.
Так, согласно данным исследователей, орексин А является одним из регуляторов пищевого поведения, а также энергетического баланса [13]. Свои эффекты данный пептид реализует через орекси-новые рецепторы 1-го и 2-го типов. Орексиновые рецепторы 1-го и 2-го типов участвуют в регуляции углеводного обмена и аппетита. Уровень экспрессии гена орексинового рецептора 1-го типа и содержание иммунопозитивного орексина А в нейронах гипоталамуса регулируется в зависимости от длительности высокожирового/высококалорийного питания, выраженности метаболических нарушений. Это можно рассматривать в аспекте компенсаторной реакции, направленной на уменьшение выраженности нарушений липидного, а следовательно, и углеводного обменов [13, 14]. Таким образом, орексиновая система — важная мишень для коррекции и профилактики развития ожирения, а также связанной с ним инсули-норезистентности как одного из ключевых компонентов патогенеза СД 2.
Биосинтез желчных кислот — один из важных путей выведения холестерола. Желчные кислоты являются регуляторами экспрессии генов, участвующих в метаболизме первичных желчных кислот, холестерола и ТГ в гепатоцитах и плазме [15]. При СД 2 и сопровождающей его инсулинорезистент-ности периферических тканей функция желчных кислот нарушается, что ведет к уменьшению их абсорбции и увеличению жировой инфильтрации печени, накоплению ТГ и липопротеидов низкой плотности. Таким образом, нарушения углеводного и липидного обмена тесно связаны между собой через функционирование желчных кислот, а также их рецепторов. Стимулирование рецепторов желчных кислот, связанных с G-белком 1, повышает выработку инсулина β-клетками поджелудочной железы, способствует снижению инсулинорезистентности, уменьшению массы тела, нормализации липидного обмена в крови за счет снижения уровня холестерина [15].
Следует также отметить роль такого важного фермента, как GSK-3. Одна из функций GSK-3 — регуляция синтеза гликогена и обмена глюкозы [16]. Угнетения данного фермента приводит к повышению синтеза гликогена и вызывает пролиферацию β-клеток поджелудочной железы. Инсулин инактивирует GSK-3 путем фосфорилирования специфических остатков серина. Кроме того, GSK-3 является важным белком, регулирующим функции нейронов, принимающим участие в нейромедиаторном обмене, процессах нейрогенеза и синаптической пластичности. GSK-3 в последнее время стала предметом исследований, так как она вовлечена в ряд заболеваний, включая СД 2, ожирение, болезнь Альцгеймера, воспаление, онкологические заболевания и биполярное расстройство [16].
Развитие ряда заболеваний и состояний, таких как ожирение, инсулинорезистентность и СД, атеросклероз и артериальная гипертензия, первично провоцируется системным воспалением низкой интенсивности. Далее формируются эндотелиальная дисфункция и дислипидемия, которые поддерживают и усиливают воспаление. NAmPRTase катализирует I этап в биосинтезе никотинамидадениндинуклео-тида (NAD) из никотинамида. Провоспалительные молекулы влияют на обмен NAD, вызывая резкое увеличение экспрессии фермента, принимающего участие в ограничении синтеза NAD из никотинамида. Рассматривая влияние на углеводным обмен, следует отметить, что NAmPRTase обладает антидиабетической активностью. NAmPRTase подавляется при ожирении за счет повышения уровня микроРНК miR-34a, что приводит к снижению уровня НАД (+) и активности сиртуина 1, участвующего в развитии инсулинорезистентности [17].
Аденозиновые рецепторы широко представлены в организме человека, выполняя различные функции, в том числе регуляцию сердечно-сосудистой и центральной нервной систем, внутриглазного давления, кровообращения, функции почек, а также воспалительной реакции в крови. Стимулирование аденозиновых рецепторов A1, A2A, A2b повышает уровень антиоксидантной защиты, способствует цитопротекторному действию на различные органы и ткани, в том числе печень, тем самым проявляя ге-патопротекторные свойства [18, 19].
Полученные нами данные в ходе эксперимента in vivo подтверждают результаты виртуального биоскрининга, иллюстрирующие наличие у соединения AZ-383 вероятной гипогликемической, гиполипиде-мической, гепатопротекторной активности, положительного влияния на массу тела.
Длительное потребление пальмового масла в дополнение к стандартному суточному рациону и следовавшее за ним внутрибрюшинное введение дексаметазона приводили к развитию метаболических нарушений, которые проявлялись избыточной массой тела и ожирением, повышением уровней глюкозы в крови, печеночных маркеров (АЛТ, АСТ, ОБ крови), дислипидемией, дезорганизацией ткани печени на уровне микроскопии. Под влиянием смоделированных метаболических нарушений наблюдалось увеличение как числа, так и размера гепатоцитов. Данные изменения согласуются с мнением ряда авторов согласно развитию морфологических изменений печени, соответствующих гепатозу и СД. Выраженные нарушения структуры данного детоксицирующего органа с одновременным увеличением количества и размеров гепатоцитов можно расценивать как компенсаторную реакцию, развивающуюся в ответ на повреждающие экзотоксические факторы (алиментарная нагрузка избытком пальмового масла и введение глюкокортикоидов).
Фармакологическая коррекция соединением с лабораторным шифром AZ-383 ассоциировалась с нормализацией гликемии до уровня, зарегистрированного у интактных животных. Следует отметить, что выраженность гипогликемических свойств изучаемого соединения была равная вилдаглиптину из ряда ингибиторов дипептидилпептидазы-4. В нашем эксперименте наблюдался набор веса у подопытных крыс линии Wistar после отмены введения дексаметазона. Однако у животных групп сравнения и у опытной группы темпы увеличения массы тела были различными. Так, внутрижелудочное введение соединения AZ-383 было связано с менее интенсивным набором веса, что подтверждается разницей в 10% между массой тела крыс опытной группы и животных, принимавших метформин либо вилдаглиптин. Это иллюстрирует наличие у соединения AZ-383 положительного действия на липидный обмен, в частности вес крыс. Кроме того, уровень липидов крови (ОХ и ТГ) под действием нового соединения был статистически ниже, чем у животных групп сравнения. Изучая влияние AZ-383 на печень как главный орган детоксикации, активно участвующий в липидном и углеводном обмене, следует заметить, что данное соединение обладает выраженными гепатопротекторными свойствами. Под его влиянием отмечалось достоверное снижение печеночных маркеров, а также нормализация микроархитектоники печени, что подтверждается увеличением числа гепатоцитов. Как мы полагаем, это обусловлено пролиферативной активностью в ответ на повреждающее действие смоделированных алиментарной и декса-метазоновой нагрузок.
Сопоставляя данные in silico и in vivo , можно определить, что гипогликемическая, гиполипидеми-ческая, гепатопротекторная активность, а также положительное влияние на вес соединения с лабораторным шифром AZ-383 обусловлены его действием сразу на несколько биомишеней, участвующих в патогенезе метаболических нарушений. Это объясняет перспективность дальнейшего изучения новых производных 1,4-дигидропиридина в спектре фармакокоррекции нарушений углеводного и липидного обмена, а также гепатопротекторных свойств.
Заключение. Нами впервые in silico установлены биомишени нового производного 1,4-дигидропири-дина с лабораторным шифром AZ-383. Данные биомишени играют ключевую роль в патогенезе углеводных и липидных нарушений, а также имеют влияние на печень как главный орган детоксикации, участвующий в развитии метаболических нарушений. В эксперименте in vivo , проведенном на крысах линии Wistar, подтвердилось наличие у соединения AZ-383 гипогликемических, гиполипидемических, гепато-протекторных свойств и положительного влияния на массу тела. Полученные данные иллюстрируют необходимость дальнейшего изучения нового производного 1,4-дигидропиридина с шифром AZ-383 в качестве фармакокорректора метаболических нарушений, а также в аспекте других потенциальных положительных свойств.
Вклад авторов: все авторы сделали эквивалентный вклад в подготовку публикации.
Список литературы Взаимосвязь результатов исследований in silico и in vivo гипогликемических, гиполипидемических, гепатопротекторных свойств нового производного 1,4-дигидропиридина
- Galstyan GR, Shestakova EA, Sklyanik IA. Obesity and type 2 diabetes: can we find a compromised treatment solution? Diabetes mellitus. 2017; 20 (4): 270–8. (In Russ.) Галстян Г. Р., Шестакова Е. А., Скляник И. А. Ожирение и сахарный диабет 2 типа: поиск компромиссного терапевтического решения. Сахарный диабет. 2017; 20 (4): 270–8. DOI: 10.14341 / DM8726
- Amlaev KR, Dakhkilgova KhT. Obesity: epidemiology, etiopathogenesis, comorbidity, diagnosis and treatment. Medical News of North Caucasus. 2020; 15 (3): 434–9. (In Russ.) Амлаев К. Р., Дахкильгова Х. Т. Ожирение: эпидемиология, этиопатогенез, коморбидность, диагностика и лечение. Медицинский вестник Северного Кавказа. 2020; 15 (3): 434–9. DOI: 10.14300 / mnnc.2020.15104
- Dedov II, Shestakova MV, Melnichenko GA. Interdisciplinary clinical practice guidelines “Management of obesity and its comorbidities”. Obesity and Metabolism. 2021; 18 (1): 5–99. (In Russ.) Дедов И. И., Шестакова М. В., Мельниченко Г. А. Междисциплинарные клинические рекомендации «Лечение ожирения и коморбидных заболеваний». Ожирение и метаболизм. 2021; 18 (1): 5–99. DOI: 10.14341 / omet12714
- Balukova EV, Uspensky YuP, Fominykh YuA. Liver lesions of various origins (toxic, medicinal, dysmetabolic): From etiological heterogeneity to a single unified therapy for patients. Russian Medical Journal. Medical Review. 2018; 26 (1): 35–40. (In Russ.) Балукова Е. В., Успенский Ю. П., Фоминых Ю. А. Поражения печени различного генеза (токсического, лекарственного, дисметаболического): от этиологической гетерогенности к единой унифицированной терапии пациентов. РМЖ. Медицинское обозрение. 2018; 26 (1): 35–40.
- Koroleva MV. Exogenous toxic hepatitis. Modern view on etiology, pathogenesis, clinical course. Medicinal Herald. 2015; 9 (58-2): 18–22. (In Russ.) Королева М. В. Экзогенно-токсические гепатиты. Современный взгляд на этиологию, патогенез, клиническое течение. Лекарственный вестник. 2015; 9 (58-2): 18–22.
- Tereshchuk LV, Mamontov AS, Starovoytova KV. Products of palm-oil fractionation in production of spreads. Food Processing: Techniques and Technology. 2014; (3): 79–83. (In Russ.) Терещук Л. В., Мамонтов А. С., Старовойтова К. В. Продукты фракционирования пальмового масла в производстве спредов. Техника и технология пищевых производств. 2014; (3): 79–83.
- Hwang JL, Weiss RE. Steroid-induced diabetes: a clinical and molecular approach to understanding and treatment. Diabetes Metab Res Rev. 2014; 30 (2): 96–102. DOI: 10.1002 / dmrr. 2486
- Sabirov IS, Murkamilov IT, Fomin VV, et al. Steroidinduced diabetes: a modern perspective on the problem and treatment options. The Scientific Heritage. 2021; (70): 35–41. (In Russ.) Сабиров И. С., Муркамилов И. Т., Фомин В. В. и др. Стероидно-индуцированный диабет: современный взгляд на проблему и возможности терапии. Научное наследие. 2021; (70): 35–41.
- Vatutin NT, Taradin GG, Rakitskaya IV, et al. Lipidlowering therapy in case of insufficient effectiveness or intolerance of statins (literature review). Bulletin of Emergency and Reconstructive Surgery. 2020; 5 (4): 29–39. (In Russ.) Ватутин Н. Т., Тарадин Г. Г., Ракитская И. В. и др. Гиполипидемическая терапия при недостаточной эффективности или непереносимости статинов (обзор литературы). Вестник неотложной и восстановительной хирургии. 2020; 5 (4): 29–39.
- Dyachenko VD, Dyachenko IV, Nenaidenko VG. Cyanothioacetamide is a polyfunctional reagent with great synthetic potential. Advances in Chemistry. 2018; 87 (1): 1–27. (In Russ.) Дяченко В. Д., Дяченко И. В., Ненайденко В. Г. Цианотиоацетамид — полифункциональный реагент с большими синтетическими возможностями. Успехи химии. 2018; 87 (1): 1–27. DOI: 10.1070 / RCR4760
- Bibik EYu, Shipilova NV, Khrustaleva AN, et al. Screening of drugs used in alimentary obesity resulting from overexposure to palm oil. Bulletin of VolgSMU. 2017; 2 (62): 111–4. (In Russ.) Бибик Е. Ю., Шипилова Н. В., Хрусталева А. Н. и др. Скрининг средств для фармакоррекции алиментарного ожирения после избыточного потребления пальмового масла. Вестник ВолгГМУ. 2017; 2 (62): 111–4.
- Krivokolysko DS, Bibik EYu, Frolov KA, et al. Morphological changes in the liver while taking NSAIDs and new derivatives of 1,4‑dihydrothiopyridines with analgesic activity. Morphological almanac n. a. V. G. Koveshnikov. 2021; 19 (4): 19–32. (In Russ.) Кривоколыско Д. С., Бибик Е. Ю., Фролов К. А. и др. Морфологические изменения печени на фоне приема НПВС и новых производных 1,4‑дигидротиопиридинов с анальгетической активностью. Морфологический альманах им. В. Г. Ковешникова. 2021; 19 (4): 19–32.
- Morina IYu, Mikhailova EV, Romanova IV, et al. Orexin-A and its receptors in the hypothalamus of mice with diet-induced and melanocortin obesity. Russian Journal of Physiology. 2019; 105 (4): 481–91. (In Russ.) Морина И. Ю., Михайлова Е. В., Романова И. В. и др. Орексин-А и его рецепторы в гипоталамусе мышей с диета-индуцированным и меланокортиновым ожирением. Российский физиологический журнал им. И. М. Сеченова. 2019; 105 (4): 481–91. DOI: 10.1134 / S0869813919040046
- Dalantaeva NS, Pigarova EA, Dzeranova LK. Central mechanisms regulating energy metabolism and sibutramine. Obesity and Metabolism. 2012; (3): 33–6. (In Russ.) Далантаева Н. С., Пигарова Е. А., Дзеранова Л. К. Центральные механизмы, регулирующие энергетический обмен, и сибутрамин. Ожирение и метаболизм. 2012; (3): 33–6. DOI: 10.14341 / 2071‑8713‑4971
- Zvenigorodskaya LA, Petrakov AV, Nilova TV, et al. The role of bile acids in the regulation of lipid and carbohydrate metabolism in patients with nonalcoholic fatty liver disease and diabetes type 2. Eksperimental’naya i Klinicheskaya Gastroenterologiya. 2016; 11 (135): 31–4. (In Russ.) Звенигородская Л. А., Петраков А. В., Нилова Т. В. и др. Роль желчных кислот в регуляции липидного и углеводного обмена у больных неалкогольной жировой болезнью печени и сахарным диабетом 2 типа. Экспериментальная и клиническая гастроэнтерология. 2016; 11 (135): 31–4. PMID: 29889442
- Burda YuE, Nadezhdin SV, Zubareva EV, et al. Test system for assessing the activity of GSK-3 inhibitors as antihypoxants and inducers of differentiation of endothelial precursors in vitro. Gazette of the Scientific Center for Expertise of Medical Products. 2016; 1: 29–32. (In Russ.) Бурда Ю. Е., Надеждин С. В., Зубарева Е. В. и др. Тест-система для оценки активности ингибиторов GSK-3 в качестве антигипоксантов и индукторов дифференцировки эндотелиальных предшественников in vitro. Ведомости Научного центра экспертизы средств медицинского применения. 2016; 1: 29–32.
- Akhverdyan YuR, Zavodovsky BV, Polyakova YuV. The level of nicotinamide phosphoribosyltransferase in the blood serum of patients with osteoarthritis and its role in the development of rheumatic diseases. Innovative Science. 2016; 2–5 (14): 97–9. (In Russ.) Ахвердян Ю. Р., Заводовский Б. В., Полякова Ю. В. Уровень никотинамид-фосфорибозилтрансферазы в сыворотке крови пациентов с остеоартрозом и его роль в развитии ревматических заболеваний. Инновационная наука. 2016; 2–5 (14): 97–9.
- Muzyko EA, Perfilova VN. Role of A2A subtype adenosine receptors in the inflammation. Volgograd Scientific and Medical Journal. 2022; 2: 5–11. (In Russ.) Музыко Е. А., Перфилова В. Н. Роль аденозиновых рецепторов подтипа А2А в воспалении. Волгоградский научно-медицинский журнал. 2022; 2: 5–11.
- Chaulin AM. Adenosine and its role in the physiology and pathology of the cardiovascular system. Kardiologiya: novosti, mneniya, obuchenie = Cardiology: News, Opinions, Training. 2019; 7 (3): 37–45. (In Russ.) Чаулин А. М. Аденозин и его роль в физиологии и патологии сердечно-сосудистой системы. Кардиология: Новости. Мнения. Обучение. 2019; 7 (3): 37–45. DOI: 10.24411 / 2309‑1908‑2019‑13004


