Взаимосвязь субпопуляций FOXP3+ Т-лимфоцитов с метаболическими параметрами у пациентов с ишемической болезнью сердца при сахарном диабете 2-го типа
Автор: Сиротина М.А., Кологривова И.В.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.35, 2020 года.
Бесплатный доступ
Цель данного исследования: оценка взаимосвязи между субпопуляциями FoxP3+ Т-лимфоцитов и метаболическими параметрами периферической крови у пациентов с ишемической болезнью сердца (ИБС) в зависимости от наличия сахарного диабета 2-го типа (СД 2).Материал и методы. Материалом исследования служили мононуклеарные лейкоциты периферической крови. Методом проточной цитометрии с визуализацией оценивали содержание FoxP3+ Т-регуляторных лимфоцитов (Treg) и ядерную транслокацию FoxP3.Результаты и обсуждение. У диабетических пациентов выявлена обратная взаимосвязь (r = -0,900; p = 0,037) между содержанием холестерола липопротеинов низкой плотности (ХС ЛНП) и уровнем ядерной транслокации FoxP3 в CD4+CD25hiFoxP3+и CD4+CD25loFoxP3+ лимфоцитах. У пациентов без диабета установлена прямая взаимосвязь уровня ядерной транслокации FoxP3 в CD4+CD25loFoxP3+ лимфоцитах с содержанием холестерола не-ЛВП (общий холестерол без ХС ЛВП), r = 0,900; p = 0,037. Также наблюдалась прямая корреляция между концентрацией глюкозы и количеством CD4+CD25loFoxP3+ лимфоцитов (r = 0,900; p = 0,037).Выводы. При наличии СД 2 у пациентов с ИБС присутствуют взаимосвязи между уровнем ядерной транслокации транскрипционного фактора FoxP3 и содержанием ХС ЛНП, причем направленность связей различна для конвенционной и регуляторной субпопуляций Т-лимфоцитов. В отсутствии СД 2 у пациентов с ИБС метаболические параметры взаимосвязаны с уровнем транслокации транскрипционного фактора FoxP3 исключительно в конвенционных Т-клетках.
Foxp3+ т-регуляторные лимфоциты, ишемическая болезнь сердца, ядерная транслокация, сахарный диабет 2-го типа
Короткий адрес: https://sciup.org/149126199
IDR: 149126199 | УДК: 616.12-005.4-06:616.379-008.64]:577.121 | DOI: 10.29001/2073-8552-2020-35-3-93-99
Текст научной статьи Взаимосвязь субпопуляций FOXP3+ Т-лимфоцитов с метаболическими параметрами у пациентов с ишемической болезнью сердца при сахарном диабете 2-го типа
УДК 616.12-005.4-06:616.379-008.64]:577.121
По данным Международной диабетической федерации, на 2017 г. в мире насчитывается 451 млн человек (в возрасте 18–99 лет), страдающих диабетом [1]. В настоящее время сахарный диабет (СД) является актуальной медико-социальной проблемой для большинства стран мира. СД 2-го типа (СД 2) характеризуется высоким риском развития ишемической болезни сердца (ИБС), инфаркта миокарда, инсульта, сердечной недостаточности. Показано, что при СД 2 риск развития ИБС возрастает в 2–5 раз [2], также у пациентов с СД наблюдается более высокая смертность при наличии сердечно-сосудистых заболеваний [3].
Выделяют несколько возможных причин развития ИБС: внутрисосудистые (атеросклероз венечных артерий, их тромбоз и тромбоэмболия, спазм венечных артерий) и внесосудистые (тахикардия, гипертрофия миокарда, артериальная гипертензия). Согласно современным представлениям, основным звеном патогенеза ИБС является развитие атеросклероза в коронарных артериях [4]. A.C. Foks и соавт. (2015) указывают на взаимосвязь развития хронического субклинического воспаления у пациентов с ИБС и FoxP3+ T-регуляторных лимфоцитов (Treg) [5].
При наличии СД усугубляется течение ИБС ввиду прогрессирования атеросклероза [2]. Исследования C. Xia и соавт. (2017) показывают, что воспаление вносит значительный вклад в развитие СД 2. При этом адаптивная иммунная система, особенно Т-лимфоциты, также играет значительную роль [6]. Нарушение числа и функции Treg связывают с многочисленными заболеваниями, а дисбаланс между провоспалительными/проатерогенными клетками и Tregs способствует развитию атеросклеротических заболеваний [5]. Для Т-регуляторных лимфоцитов характерно наличие уникального фактора транскрипции, связанного с Х-хромосомой (FoxP3 – forkhead box P3) [7]. FoxP3 является основным фактором, определяющим дифференцировку, активацию и функционирование Treg
-
[8] . При активации наивных CD4+CD25- T-клеток экспрессия FoxP3 определяется в основном в цитоплазме в отличие от преимущественной локализации внутри ядра у CD4+CD25+ Treg. С точки зрения функционирования данного фактора в качестве транскрипционного активатора и супрессора представляется весьма важным его нахождение внутри ядра [9]. CD4+CD25+FoxP3+ клетки содержат стабильные регуляторные (CD4+CD25hiFoxp3+) и нестабильные конвенционные (CD4+CD25loFoxp3+) популяции. Про популяцию CD4+CD25loFoxP3+ лимфоцитов практически ничего не известно.
Таким образом, изучение роли FoxP3+ лимфоцитов в патогенезе ИБС и СД 2 является актуальным вопросом в иммунологии и кардиологии. В то же время данные о взаимосвязи субпопуляций FoxP3+ Т-лимфоцитов с метаболическими параметрами у пациентов с ИБС при СД 2 остаются немногочисленными.
Цель: оценка взаимосвязи между субпопуляциями FoxP3+ Т-лимфоцитов и метаболическими параметрами периферической крови у пациентов с ИБС в зависимости от наличия СД 2.
Материал и методы
Исследование проводилось у 10 пациентов в возрасте от 50 лет до 71 года, госпитализированных в отделение атеросклероза и хронической ишемической болезни сердца НИИ кардиологии Томского НИМЦ с диагнозом: стабильная ИБС, и было одобрено локальным этическим комитетом НИИ кардиологии Томского НИМЦ. До включения в исследование у всех пациентов получено письменное информированное согласие на участие в исследовании.
Сравнительная клиническая характеристика больных, включенных в исследование, представлена в таблице 1. Все пациенты были разделены на 2 группы: в группу 1 вошли пациенты с ИБС без СД 2, группу 2 составили пациенты с ИБС + СД 2.
Таблица 1. Характеристика пациентов, вошедших в исследование ( n = 10), Me ( Q 1; Q 3)
Table 1. Characterization of patients included in the study ( n = 10), Me ( Q 1; Q 3)
|
Параметры Parameters |
Группа 1 Пациенты с ИБС ( n = 5) Group 1 СHD patients ( n = 5) |
Группа 2 Пациенты с ИБС + СД 2 ( n = 5) Group 2 СHD + DM2 patients ( n = 5) |
р |
|
Мужчины/женщины, n Male/female, n |
3/2 |
2/3 |
0,549 |
|
Возраст, лет Age, years |
66 (32,5; 67) |
69 (53,5; 70) |
0,344 |
|
ОХС, мМ TC, mM |
3,28 (2,90; 4,19) |
3,63 (2,82; 5,08) |
0,602 |
|
ХС ЛНП, мМ LDL cholesterol, mM |
1,41 (1,21; 2,33) |
2,04 (0,76; 2,92) |
0,116 |
|
ХС ЛВП, мМ HDL cholesterol, mM |
1,35 (1,23; 1,6) |
0,98 (0,87; 1,36) |
0,917 |
|
ХС не-ЛВП, мМ Non-HDL cholesterol, mM |
1,89 (1,36; 3,48) |
2,65 (1,29; 3,91) |
0,806 |
|
ТГ, мМ TG, mM |
0,65 (0,79; 1,25) |
1,51 (1,05; 2,62) |
0,028 # |
|
Глюкоза натощак, мМ Fasting glucose, mM |
5,16 (4,71; 5,83) |
6,8 (6,18; 8,75) |
0,016 # |
Примечание: ИБС – ишемическая болезнь сердца; ОХС – общий холестерол; ТГ – триглицериды; ХС ЛНП – холестерол липопротеинов низкой плотности; ХС ЛВП – холестерол липопротеинов высокой плотности; ХС не-ЛВП – (общий холестерол без ХС ЛВП); n – количество человек в группе; # – уровень значимости различий между пациентами с ИБС + СД 2 и с ИБС, p < 0,05.
Note: СHD – coronary heart disease; TC – total cholesterol; TG – triglycerides; LDL cholesterol – low density lipoprotein cholesterol; HDL cholesterol – high density lipoprotein cholesterol; Non-HDL cholesterol – (total cholesterol without HDL cholesterol); n – is the number of people in the group; # – significance level of differences between patients with CHD + T2DM and with CHD p <0.05.
Все пациенты находились на постоянной антигипертензивной терапии и получали средние дозы статинов. Также пациенты группы 2 получали стандартную пероральную сахароснижающую терапию. Значимых межгрупповых различий по спектру и дозам принимаемых препаратов не отмечалось.
Материалом для исследования служила периферическая венозная кровь, взятая утром натощак. Монону-клеарные лейкоциты периферической крови получали из гепаринизированной крови путем центрифугирования на Histopaque 1077 (Sigma-Aldrich, США). Для феноти-пирования Т-регуляторных лимфоцитов мононуклеары окрашивали моноклональными антителами анти-CD4-FITC и анти-CD25-APC (BD Biosciences, США), фиксировали и пермеабилизировали соответствующим набором буферных растворов (BD Pharmingen, США) и добавляли моноклональные антитела анти-FoxP3-PE (BD Pharmingen, США). Окрашенные клетки ресуспенди-ровали в фиксирующем буфере (BD Pharmingen, США). Клетки анализировали на проточном цитометре FACS Calibur с использованием программного обеспечения Cell Quest Pro (BD Biosciences, США). Определяли количество истинных FoxP3+CD4+CD25hiТ-регуляторных лимфоцитов и конвенционных FoxP3+CD4+CD25lo лимфоцитов.
Оценивали транслокацию транскрипционного фактора FoxP3 в ядро методом проточной цитометрии с визуализацией (Amnis Flow Sight, Luminex, США). Для этого после стандартного окрашивания в суспензию клеток добавляли ДНК-краситель 7-аминоактиномицин D (7AAD). В дальнейшем с помощью мастера обработки клеточных изображений Nuclear Localization Wizzard оценивали параметр Similarity Morphology (ядерная метка 7AAD; транслоцируемая проба – FoxP3), который отражал % CD4+CD25hi и %CD4+CD25lo клеток с ядерной локализацией FoxP3.
Из венозной крови пациентов получали сыворотку методом центрифугирования. Концентрацию глюкозы определяли глюкозооксидазным методом. Исследовали липидный спектр крови (содержание общего холестерола (ОХС), триглицеридов (ТГ), холестерола липопротеинов высокой плотности (ХС ЛВП), холестерола липопротеинов низкой плотности (ХС ЛНП), соотношение ХС ЛНП/ ХС ЛВП), используя наборы ЗАО «Диакон-ДС» (Россия).
Статистическую обработку результатов проводили с помощью пакета программ SPSS 17.0 for Windows. Для определения характера распределения параметров в выборках применяли критерий Шапиро – Уилка. Результаты представляли в виде медианы и интерквартильного размаха Me ( Q 1; Q 3). Оценку статистической значимости различий между выборками проводили с помощью непараметрического U-критерия Манна – Уитни. Корреляционный анализ осуществляли по методу Спирмена. Различия считали значимыми при уровне р < 0,05.
Результаты и обсуждение
При анализе метаболических параметров мы не выявили статистически значимых межгрупповых различий по уровням ХС ЛНП, ЛВП, ХС не-ЛВП. У пациентов из группы ИБС + СД 2 было зарегистрировано достоверно повышенное содержание триглицеридов и глюкозы (см. табл. 1). Данные изменения указывают на количественные изменения в картине крови, характерные для СД 2.
Данные, полученные M. Jagannathan-Bogdan и соавт. (2011) и C. Zheng и соавт. (2012), показали, что количество клеток Treg у пациентов с СД 2 было снижено [10, 11]. В нашем исследовании при изучении содержания Т-регуляторных лимфоцитов у представленных групп пациентов различий обнаружено не было. Однако была выявлена тенденция к уменьшению количества истинных Т-регуляторных лимфоцитов у пациентов из группы ИБС + СД 2 (табл. 2).
Таблица 2. Характеристика субпопуляцийFoxP3+ лимфоцитов у пациентов, вошедших в исследование ( n = 10), Me ( Q 1; Q 3)
Table 2. Characterization of subpopulations of FoxP3 + lymphocytes in patients included in the study ( n = 10), Me ( Q 1; Q 3)
|
Параметры Parameter |
Группа 1 Пациенты с ИБС ( n = 5) Group 1 СHD patients ( n = 5) |
Группа 2 Пациенты с ИБС + СД 2 ( n = 5) Group 2 СHD + DM2 patients ( n = 5) |
р |
|
Относительное содержание CD4+CD25hiFoxP3+ лимфоцитов, % The relative content of CD4 + CD25hiFoxP3+lymphocytes, % |
8,76 (7,68; 9,00) |
5,96 (5,14; 7,76) |
0,117 |
|
Относительное содержание CD4+CD25loFoxP3+ лимфоцитов, % The relative content of CD4 + CD25loFoxP3+ lymphocytes, % |
3,63 (3,03; 5,27) |
4,05 (2,93; 5,56) |
0,602 |
|
% CD4+CD25hiFoxP3+ лимфоцитов с ядерной транслокацией FoxP3 % CD4+CD25hiFoxP3 + lymphocytes with nuclear translocation FoxP3 |
85,8 (78,8; 92,6) |
87,4 (82,30; 91,80) |
0,914 |
|
% CD4+CD25loFoxP3+ лимфоцитов с ядерной транслокацией FoxP3 % CD4+CD25loFoxP3+ lymphocytes with nuclear translocation FoxP3 |
75,6 (69,25; 79,35) |
69,9 (65,70; 79,80) |
0,347 |
Мы также провели оценку транслокации транскрипционного фактора FoxP3 в ядро. Различий между группами пациентов между уровнями ядерной транслокации FoxP3 в CD4+CD25hiFoxP3+- и CD4+CD25loFoxP3+ лимфоцитах также выявлено не было (табл. 2). С точки зрения функционирования фактора FoxP3 в качестве транскрипционного активатора и супрессора представляется весьма важным его нахождение внутри ядра [2], потому как такое расположение определяет функциональную активность Treg, что позволяет им эффективно реализовывать свою функциональную активность. В настоящее время механизм запуска транслокации фактора в ядро остается недостаточно изученным.
Результаты корреляционного анализа показали, что у пациентов с ИБС различается характер взаимосвязей между относительным содержанием FoxP3+ Т-лимфоцитов и метаболическими параметрами в зависимости от наличия СД 2. У диабетических пациентов выявлена обратная взаимосвязь ( r = –0,900; p = 0,037) между содержанием ХС ЛНП и уровнем ядерной транслокации
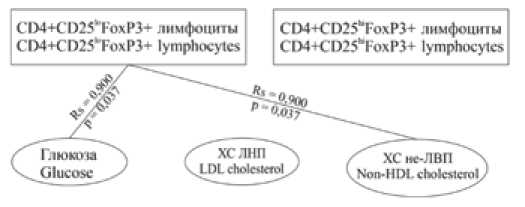
FoxP3 в CD4+CD25hiFoxP3+- и CD4+CD25loFoxP3+ лимфоцитах. У пациентов без диабета выявлена прямая взаимосвязь уровня ядерной транслокации FoxP3 в CD4+CD25loFoxP3+ лимфоцитах с содержанием холестерола не-ЛВП ( r = 0,900; p = 0,037). Также наблюдалась прямая корреляция между концентрацией глюкозы и количеством CD4+CD25loFoxP3+ лимфоцитов ( r = 0,900; p = 0,037), рисунок 1. По нашему мнению, различия в выявленных взаимосвязях свидетельствуют о нарушении процессов активации Т-регуляторных клеток при СД. Повышение проатерогенной фракции липопротеинов отрицательно влияет на процесс дифференцировки и функционирование Т-регуляторных лимфоцитов. Насколько нам известно, мы впервые описали взаимосвязи между транслокацией транскрипционного фактора FoxP3 в различных субпопуляцих Т-лимфоцитов и показали, что характер данных взаимосвязей различается в зависимости от принадлежности Т-клеток к регуляторной или конвенционной субпопуляции и от наличия/отсут-ствия СД 2.
Пациенты с ИБС ( n = 5) CHD patients ( n = 5)
Пациенты с ИБС + СД 2 ( n = 5) CHD + DM 2 patients ( n = 5)
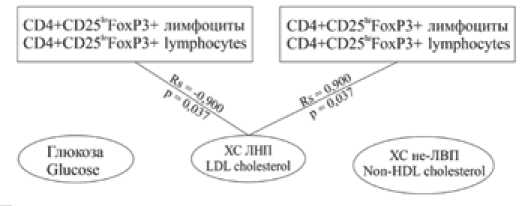
Рис. 1. Корреляционные взаимосвязи между субпопуляциями FoxP3+ лимфоцитов и метаболическими параметрами
Примечание: CD4+CD25hiFoxP3+ лимфоциты – уровень ядерной транслокации FoxP3 в CD4+CD25hiFoxP3+ лимфоцитах;
CD4+CD25loFoxP3+ лимфоциты – уровень ядерной транслокации FoxP3 в CD4+CD25loFoxP3+ лимфоцитах; ХС ЛНП – холестерол липопротеинов низкой плотности, ХС не-ЛВП – общий холестерол без ХС ЛВП; n – количество человек в группе; Rs – коэффициент ранговой корреляции Спирмена; р – уровень значимости коэффициента корреляции.
Fig. 1.Correlation between subpopulations of FoxP3 + lymphocytes and metabolic parameters
Note: CD4+CD25hiFoxP3+ lymphocytes – level of FoxP3 nuclear translocation in CD4+CD25hiFoxP3+ lymphocytes; CD4+CD25loFoxP3+ lymphocytes – level of FoxP3 nuclear translocation in CD4+CD25loFoxP3+ lymphocytes; LDL cholesterol – low density lipoprotein cholesterol;
Non-HDL cholesterol – (total cholesterol without HDL cholesterol); n is the number of people in the group; Rs is the Spearman rank correlation coefficient; p is the significance level of the correlation coefficient.
В то же время ранее был получен ряд доказательств непосредственной связи активности транскрипционного фактора FoxP3 с состоянием внутриклеточного метаболизма. Так, было показано, что FoxP3 подавляет фактор Myc и процессы гликолиза в Т-клетках, таким образом, способствуя активации окислительного фосфорилирования и окисления никотинамидадениндинуклеотида. В норме это позволяет Treg активно функционировать в условиях с низкой концентрацией глюкозы (слизистая кишечника, опухолевое микроокружение) [12]. В то же время ряд этапов развития Treg требуют активации гликолиза: тимическим tTregs гликолиз необходим для увеличения экспрессии иммуносупрессорных молекул CTLA4 (cytolytic Tlymphocyte-associated antigen- 4) и ICOS (inducible T cell costimulator), в то время как индуцибель-ным iTregs необходимо нормальное протекание гликолиза для оптимальной экспрессии FoxP3 [13]. В нашем исследовании мы показали, что ядерная транслокация FoxP3 напрямую связана с содержанием глюкозы при сохранении ее концентрации в нормальных пределах и исключительно в конвенционных CD4+CD25loFoxP3+ лимфоцитах. При увеличении концентрации глюкозы у диабетических пациентов и в случае субпопуляции клеток CD4+CD25hiFoxP3+ данная взаимосвязь утрачивается (см. рис. 1). Это подчеркивает наличие разных механизмов метаболической регуляции в различных субпопуляциях FoxP3+ лимфоцитов и свидетельствует об их нарушении при СД 2.
Было показано, что транскрипционная активность FoxP3 непосредственно взаимосвязана с внутриклеточным содержанием липидных тел. Образование липидных тел в регуляторных FoxP3+ лимфоцитах повышено за счет активации фермента диацилглицерол ацилтранс-феразы-1 (ДГАТ-1) по сравнению с конвенционными Т-клетками [14]. Известно, что ингибирование ДГАТ-1 при СД 2 ведет к увеличению чувствительности к инсулину и лептину [15]. В то же время было продемонстрировано и наличие обратной взаимосвязи: деплеция FoxP3+ Tregs у мышей приводила к увеличению содержания общего холестерола и ХС липопротеинов очень низкой плотности (ЛОНП), которые также входят в состав фракции ХС не-ЛВП [16]. В соответствии с нашими данными, характер взаимосвязи между системным обменом липидов и функциональной активностью фактора FoxP3 различается в конвенционных и регуляторных Т-клетках: прямая взаимосвязь с липидными фракциями в конвенционных и обратная – в регуляторных лимфоцитах (см. рис. 1). Причем при СД 2 отсутствует взаимосвязь с ХС не-ЛВП, предположительно в связи с изменением содержания ХС ЛОНП и ТГ у диабетических пациентов. Следует отметить, что функционирование FoxP3+ Тregs и Tconv при ИБС даже в отсутствии диабета может являться компрометированным, поскольку показано нарушение метилирования экзонов FoxP3 у пациентов с острым коронарным синдромом и увеличение транскрипции FoxP3 у пациентов со стабильной ИБС [17, 18].
К ограничениям проведенного исследования можно отнести небольшой объем выборки пациентов. Однако уже на данном этапе полученные результаты могут служить основой для разработки новых перспективных подходов для лабораторной диагностики иммунологических нарушений у пациентов высокого кардиометаболическо-го риска и указывают на необходимость дальнейших исследований в данной области.
Выводы
В ходе нашего исследования мы показали, что при наличии СД 2 у пациентов с ИБС присутствуют взаимосвязи между уровнем ядерной транслокации транскрипционного фактора FoxP3 и содержанием ХС ЛНП, причем направленность связей различна для конвенционной и регуляторной субпопуляций Т-лимфоцитов. В отсутствии СД 2 у пациентов с ИБС метаболические параметры взаимосвязаны с уровнем транслокации транскрипционного фактора FoxP3 исключительно в конвенционных Т-клетках.
Список литературы Взаимосвязь субпопуляций FOXP3+ Т-лимфоцитов с метаболическими параметрами у пациентов с ишемической болезнью сердца при сахарном диабете 2-го типа
- Ткачук В.А., Воротников А.В. Молекулярные механизмы развития резистентности к инсулину. Сахарный диабет. 2014;(2):29-40. DOI: 10.14341/DM2014229-40.
- Бардымова Т.П., Протасов К.В., Цыреторова С.С., Донирова О.С. Сахарный диабет 2-го типа и ишемическая болезнь сердца. Acta Biomedica Scientifca. 2017;2(1):100-106. DOI: 10.12737/arti-cle_5955e6b60d5bf2.66416553.
- Matheus A.S., Tannus L.R., Cobas R.A., Palma C.C., Negrato C.A., Gomes M.B. Impact of diabetes on cardiovascular disease: An update. Int. J. Hypertens. 2013;2013:653789. DOI: 10.1155/2013/653789.
- Pothineni N.V.K., Subramany S., Kuriakose K., ShiraziL.F., Romeo F., Shah P.K. et al. Infections, atherosclerosis, and coronary heart disease. Eur. Heart J. 2017;38(43):3195-3201. DOI: 10.1093/eurheartj/ehx362.
- Foks A.C., Lichtman A.H., Kuiper J. Treating atherosclerosis with regulatory T cells. Arterioscler. Thromb. Vasc. Biol. 2015;35(2):280-287. DOI: 10.1161/ATVBAHA.114.303568.
- Xia C., Rao X., Zhong J. Role of T-lymphocytes in type 2 diabetes and diabetes-associated inflammation. J. Diabetes Res. 2017;2017:6494795. DOI: 10.1155/2017/6494795.
- Baratelli F., Lin Y., Zhu L., Yang S.-C., Heuze-Vourc'h N., Zeng G., Reckamp K. et al. Prostaglandin E2 induces FOXP3 gene expression and T-regulatory cell function in human CD4+ T-cells. J. Immunol. 2005;175(3):1483-1490. DOI: 10.4049/jimmunol.175.3.1483.
- Смирнов Д.С., Курбачева О.М., Польнер С.А., Павлова К.С. Перспективы изучения экспрессии молекулы FOXP3 и ее изоформ при аллергических заболеваниях. Российский аллергологический журнал. 2017;14(2):22-29.
- Митин А.Н., Литвина М.С., Митина Т.А., Голенков А.К., Ярилин А.А. Анализ экспрессии молекулы FOXP3 и ее изоформ CD4+-Т-клетками периферической крови при различных формах течения множественной миеломы методом проточной цитометрии. Иммунология. 2014;35(4):215-219.
- Jagannathan-Bogdan M., McDonnell M.E., Shin H., Rehman Q., Has-turk H., Apovian C.M. et al. Elevated proinflammatory cytokine production by a skewed T cell compartment requires monocytes and promotes inflammation in type 2 diabetes. J. Immunol. 2011;186(2):1162-1172. DOI: 10.4049/jimmunol.1002615.
- Zheng Y., Rudensky A.Y. Foxp3 in control of the regulatory T cell lineage. Nat. Immunol. 2007;8(5):457-462. D0l:10.1038/ni1455.
- Angelin A., Gil-de-Gomez L., Dahiya S., Jiao J., Guo L., Levine M.H. et al. Foxp3 reprograms T-cell metabolism to function in low-glucose, high-lactate environments. Cell Metab. 2017;25(6):1282-1293. DOI: 10.1016/j.cmet.2016.12.018.
- Tanimine N., Germana S.K., Fan M., Hippen K., Blazar B.R., Markmann J.F. et al. Differential effects of 2-deoxy-D-glucose on in vitro expanded human regulatory T-cell subsets. PLoS One. 2019;14(6):e0217761. DOI: 10.1371/journal.pone.0217761.
- Howie D., Ten Bokum A., Cobbold S.P., Yu Z., Kessler B.M., Waldmann H. A novel role for triglyceride metabolism in Foxp3 expression. Front. Immunol. 2019;10:1860. DOI: 10.3389/fimmu.2019. 01860.
- Tomimoto D., Okuma C., Ishii Y., Kobayashi A., Ohta T., Kakutani M. et al. JTT-553, a novel Acyl CoA: Diacylglycerol acyltransferase (DGAT) 1 inhibitor, improves glucose metabolism in diet-induced obesity and genetic T2DM mice. J. Pharmacol. Sci. 2015;129(1):51-58. DOI: 10.1016/j. jphs.2015.08.005.
- Klingenberg R., Gerdes N., Badeau R.M., Gistera A., Strodthoff D., Ketel-huth D.F.J. et al. Depletion of FOXP3+ regulatory T cells promotes hypercholesterolemia and atherosclerosis. J. Clin. Invest. 2013;123(3):132-134.DOI: 10.1172/JCI63891.
- Lundberg A.K., Jonasson L., Hansson G.K., Mailer R.K.W. Activation-induced FOXP3 isoform profile in peripheral CD4+ T cells is associated with coronary artery disease. Atherosclerosis. 2017;267:27-33. DOI: 10.1016/j.atherosclerosis.2017.10.026.
- Zhu L., Jia L., Liu Z., Zhang Y., Wang J., Yuan Z. et al. Elevated methyl-ation of FOXP3 (Forkhead Box P3)-TSDR (Regulatory T-Cell-Specific Demethylated Region) is associated with increased risk for adverse outcomes in patients with acute coronary syndrome. Hypertension. 2019;74(3):581-589. DOI: 10.1161/HYPERTENSIONAHA.119. 12852.


