Взаимосвязь уровня липопротеинассоциированной фосфолипазы А2 с риском развития кардиоваскулярных событий, оценка эффективности профилактической терапии статинами
Автор: Тепляков Александр Трофимович, Сваровская Алла Владимировна, Суслова Татьяна Евгеньевна, Гусакова Анна Михайловна, Лавров Алексей Геннадьевич, Насрашвили Наталья Всеволодовна
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 4 т.31, 2016 года.
Бесплатный доступ
Цель: установить взаимосвязь уровня липопротеинассоциированной фосфолипазы А2 (ЛП-ФЛA2) с риском развития кардиоваскулярных событий, оценить эффективность профилактической терапии статинами. В исследование были включены 60 пациентов с ишемической болезнью сердца (ИБС), ассоциированной с сахарным диабетом (СД) 2-го типа, перенесших эндоваскулярную реваскуляризацию. Через 12 мес. наблюдения учитывались следующие события: смерть, инфаркт миокарда (ИМ), острое нарушение мозгового кровообращения (ОНМК), повторная коронарная реваскуляризация, рецидивы стенокардии. Отсутствие или наличие конечных точек определяло разделение пациентов на две группы: с неблагоприятным течением (1-я группа, 30 человек) и благоприятным течением (2-я группа, 30 человек). У всех обследованных определялись концентрация ЛП-ФЛА2, показатели гликемического профиля, гликированного гемоглобина, инсулина, Апо-В, Апо-А1, Lp (а), липидного спектра. Рассчитывался индекс инсулинорезистентности (ИИР) - HOMA (Homeostasis Model Assessment of Insulin Resistance). Все обследованные получали аторвастатин в дозе 20-40 мг/сутки. Через 12 мес. наблюдения на фоне терапии аторвастатином в средней дозе 30 мг/сутки в 1-й группе уменьшились показатели общего холестерина (ОХС) на 20,71%, триглицеридов (ТГ) на 26,21%, холестерина липопротеидов низкой плотности (ХС ЛПНП)) - на 25,84%. Во 2-й группе ОХС снизился на 30,52%, ХС ЛПНП - на 31,41%, уровень Апо-В - на 45,2%. Установлено снижение концентрации ЛП-ФЛА2 в 1-й группе на 21,28%, во 2-й группе - на 26,63% (р=0,004). В 1-й группе умер один больной (3,3%). Рецидив стенокардии развился у 96,7% обследованных, по данным коронарографии у 16,7% выявлено рестенозирование стентов, у 63,3% - прогрессирование атеросклероза. Повторный ИМ развился у 10% обследованных, ОНМК - у 3,3%. Повторная реваскуляризация выполнена у 70% пациентов. Уровень ЛП-ФЛА2 можно рассматривать как прогностический маркер развития неблагоприятных сердечно-сосудистых событий у больных ИБС, ассоциированной с СД 2-го типа, и выделить особые когорты пациентов для осуществления более агрессивной липидкорригирующей терапии с целью достижения целевого уровня ХС ЛПНП.
Ишемическая болезнь сердца, сахарный диабет 2-го типа, эндоваскулярная реваскуляризация, липопротеинассоциированная фосфолипаза a2, статины
Короткий адрес: https://sciup.org/14920143
IDR: 14920143 | УДК: 616.132.2-008.64-089:615.472.5.032.13:616.379-008.64
Текст научной статьи Взаимосвязь уровня липопротеинассоциированной фосфолипазы А2 с риском развития кардиоваскулярных событий, оценка эффективности профилактической терапии статинами
В последние годы убедительно продемонстрировано, что сочетание таких факторов риска, как ИР, дислипидемия и хроническое воспаление являются патогенетической основой прогрессирования коронарного атеросклероза [4, 7]. В качестве диагностических маркеров ИР приводят классические показатели не только углеводного, но и липидного обмена и регуляторов – адипокинов, факторов воспаления и тромбогенеза [2].
Как известно, повышение уровня воспалительных биомаркеров ассоциируется с увеличением риска развития сердечно-сосудистых заболеваний [2]. Одним из таких маркеров является липопротеинассоциированная фосфолипаза A2 (ЛП-ФЛA2). Особенностями ЛП-ФЛA2, привлекающими к ней внимание исследователей, являются специфичность в отношении сосудистого воспаления, минимальная биоизменчивость и стабильность при ишемии миокарда [15]. В ряде клинических исследований показано, что профицит ЛП-ФЛА2в крови может учитываться не только как маркер внутрисосудистого воспаления, но и как предиктор высокого риска неблагоприятных коронарных событий и сердечно-сосудистой смертности, в частности, в общей популяции больных ИБС после перенесенного ИМ у лиц, страдающих СД 2-го типа, у пациентов, перенесших трансплантацию сердца, и у пожилых людей [4, 13, 16, 20]. В последнее время ЛП-ФЛА2 позиционируется как новая мишень для терапии статинами [4, 10, 21]. Вместе с тем точное предикторное значение элевации сывороточного уровня ЛП-ФЛА2, а также связь последней с риском неблагоприятных событий после планового чрескожного коронарного вмешательства в особой когорте больных ИБС, ассоциированной с СД 2-го типа, не определены.
Цель: установить взаимосвязь уровня ЛП-ФЛА2 с риском развития кардиоваскулярных событий, оценить эффективность профилактической терапии статинами.
Материал и методы
Все пациенты, вошедшие в исследование, подписывали информированное согласие на участие в исследовании и дальнейшее проспективное наблюдение, дающее право на обработку данных. Исследование было проведено после одобрения протокола локальным этическим комитетом НИИ кардиологии.
В проспективное исследование были включены 60 пациентов (47 мужчин и 13 женщин) с ИБС, ассоциированной с СД 2-го типа. Возраст больных варьировал от 48 до 75 лет. Пациентов наблюдали в течение 12 мес. В конце исследования была дана оценка отдаленным результатам. Критериями исключения являлись: неконтролируемая артериальная гипертензия (АГ), атриовентрикулярная (АВ) блокада II–III степени, наличие гемодинамически значимых стенозов клапанов с недостаточностью III–IV степени, декомпенсированная хроническая сердечная недостаточность (ХСН) и нарушения углеводного обмена за исключением СД 2-го типа (нарушение гликемии натощак, нарушение толерантности к углеводам, СД 1-го типа). Диагноз СД 2-го типа устанавливали в соответствии с клиническими рекомендациями (2015).
Учитывались следующие события (первичные и вторичные конечные точки): смерть от сердечно-сосудистых событий, нефатальный ИМ, нефатальное ОНМК, коронарная реваскуляризация (хирургическая, эндоваскулярная) в связи с рестенозированием первично имплантированного стента или стенозированием нативных коронарных артерий, рецидивы стенокардии, а также комбинация конечных точек. Отсутствие или наличие конечных точек определяло разделение пациентов на две группы: с неблагоприятным течением (1-я группа, 30 человек) и благоприятным течением (2-я группа, 30 человек). Клиническая и анамнестическая характеристика пациентов обеих групп представлена в таблице 1.
Пациенты обеих групп были сопоставимы по полу и возрасту, а также по принимаемой терапии. Все пациенты страдали СД 2-го типа. Статистически значимых различий между группами выявлено не было, за исключени-
Таблица 1
Клинико-демографическая характеристика групп больных, сформированных в зависимости от течения заболевания, Ме [LQ;UQ]
|
Показатели |
1-я групп |
а (неблагоприятное течение), n=30 |
2-я группа (благоприятное течение), n=30 |
p |
|
Пол (м/ж) |
24/6 |
23/7 |
0,77 |
|
|
Возраст, годы |
60 [55,00;65,00] |
60 [56,00;67,00] |
0,47 |
|
|
ИМТ, кг/м 2 |
30,07 [28,73;33,81] |
30,59 [29,06;34,60] |
0,66 |
|
|
Ожирение, абс. число (%) |
17 (56,7) |
20 (66,7) |
0,42 |
|
|
Стаж ИБС, годы |
6,00 [5,00;10,00] |
5,00 [3,00;7,00] |
0,22 |
|
|
Стаж СД, годы Клиническая характеристика, абс. число (%) |
4,00 [1,00;6,25] |
5,00 [1,00;7,00] |
0,91 |
|
|
Стенокардия напряжения II ФК |
4 (13,33) |
8 (26,67) |
0,68 |
|
|
Стенокардия напряжения III ФК |
23 (76,67) |
22 (73,33) |
0,61 |
|
|
Стенокардия напряжения IV ФК |
1 (3,33) |
0,52 |
||
|
Безболевая ишемия ФК ХСН (NYHA): |
2 (6,67) |
0,09 |
||
|
II ФК |
20 (66,67) |
22 (73,33) |
0,37 |
|
|
III ФК |
10 (33,33) |
8 (26,67) |
0,53 |
|
|
Перенесенный ИМ, абс. число (%) |
22 (73,30) |
18 (60) |
0,27 |
|
|
Наличие АГ, абс. число (%) |
28 (93,30) |
28 (93,30) |
1,00 |
|
|
Наличие СД, абс. число (%) |
30 (100) |
30 (100) |
1,00 |
|
|
Курение, абс. число (%) |
8 (27) |
3 (10) |
0,08 |
|
|
Креатинин, мкмоль/л |
71,00 [68,75;76,25] |
74,00 [69,75;92,00] |
0,24 |
|
|
СКФ (CKD-EPI): мл/мин/1,73м2 |
91,00 [80,75;97,00] |
86,00 [76,25;99,25] |
0,67 |
|
|
ТФН, Вт |
25,00 [25,00;50,00] |
50,00 [25,00;75,00] |
0,04 |
|
Примечание: ИМТ – индекс массы тела, ФК – функциональный класс, СКФ – скорость клубочковой фильтрации, ТФН – толерантность к физической нагрузке.
ем ТФН, которая в 2 раза превышала этот показатель в группе с благоприятным течением ИБС (р=0,04).
Все пациенты перенесли успешное чрескожное коронарное вмешательство со стентированием коронарных артерий (стремились к максимально полной реваскуляризации миокарда), после чего было рекомендовано продолжить прием аспирина 75–325 мг/сутки (пожизненно) и клопидогрела 75 мг/сутки в течение не менее 12 мес. от даты выполнения эндоваскулярной реваскуляризации.
Биохимические показатели определяли на полуавтоматическом анализаторе ф. “Labsystems” FP-900 (Финляндия). Содержание в крови холестерина и триглицеридов оценивали ферментативным способом с использованием наборов ф. “Boehringer Mannheim”. Содержание ХС ЛПНП рассчитывали по формуле W. Friedwald. Контролем являлись сыворотки “Precinorm L”, “Precipath L” той же фирмы.
Уровень гликированного гемоглобина оценивали с помощью иммунотурбидиметрического метода наборами “DiaSys Diagnostic Systems” (Германия). Для определения базальной и постпрандиальной гликемии использовали глюкозооксидазный метод с использованием наборов “Bioсon” (Германия).
Концентрацию иммунореактивного инсулина (ИРИ) определяли методом иммуноферментного анализа с использованием набора реактивов фирмы ELISA Monobind (референсные значения составляли 2,6–24,9 мкЕд/мл). Оценку уровня ЛП-ФЛА2 выполняли иммуноферментным методом (ELISA).
Содержание аполипопротеина А-1 (апоА-1) и аполипопротеина В (апо-В) в сыворотке крови проводили им- мунотурбометрическим методом (ф. “Диакон Диагностика, Россия”), вычисляли соотношение апоВ/апоА1.
Для определения тканевой чувствительности к инсулину рассчитывался индекс ИР HOMA–IR по формуле:
HOMA-IR = глюкоза натощак (ммоль/л) х инсулин натощак (мкЕд/мл) / 22,5 (референсные значения <2,77).
Статистический анализ полученных данных проводили с использованием пакета программ STATISTICA for Windows 10.0 (StstSoft, Inc.). Количественные данные представлены в виде Медианы (Ме), а также верхнего и нижнего квартилей (LQ; UQ), качественные признаки – в виде n, % (число больных с данным признаком, процент от их количества в группе). Характер распределения полученных данных оценивали, используя критерий нормальности Колмогорова–Смирнова, а также визуальную проверку методом гистограмм. При отсутствии нормального распределения признака при сравнении двух независимых выборок использовали непараметрический критерий Mann–Whitney. Анализ повторных измерений проводили путем вычисления критерия Wilcoxon. Для определения различий качественных переменных выполняли анализ таблиц сопряженности с применением критерия χ 2 и точного теста ( ϕ ) Фишера. Для проведения корреляционного анализа использовали коэффициент ранговой корреляции Спирмена (Spearman R). Статистически значимыми считали различия при р<0,05.
Результаты
Проведенный анализ характера поражения коронарного русла у больных ИБС показал, что в группе с небла-
Таблица 2
Показатели липидного профиля у пациентов в группах с неблагоприятным и благоприятным течением патологии, Ме [LQ;UQ]
У всех пациентов начальная доза аторвастатина в первый месяц лечения составила 20 мг/сутки, затем при отсутствии достижения целевого уровня ХС-ЛПНП<1,8 ммоль/л через 3 мес. доза увеличивалась до 40 мг/сутки, в связи с чем средняя доза составила 30 [20,00–40,00] мг/сутки.
Результаты лабораторных тестов, выполненных в начале исследования, демонстрировали существенные межгрупповые различия по показателям, отражающим выраженность нарушений
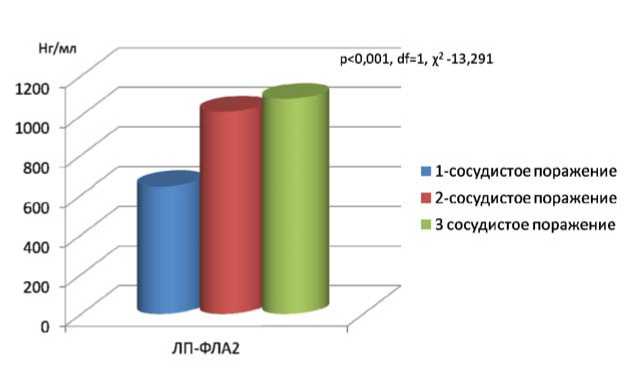
Рис. 1. Уровень ЛП-ФЛА2 в зависимости от количества пораженных артерий
обмена углеводов и липидов. Так, в 1-й группе больных с неблагоприятным течением ИБС наблюдалось статистически значимое (р=0,003) повышение уровня гликированного гемоглобина (HbA1c) – 6,80 [6,02;7,47]%; инсулина в плазме крови – 22,77 [18, 28, 40, 90] мкЕд/мл по сравнению со 2-й группой – 5,9 [5,32;6,40]% и 16,10 [12,97;19,20] мкЕд/мл (р=0,001) соответственно, это сопровождалось значительным увеличением ИРИ (HOMA-IR) в 1-й группе до 6,69 [4,69;8,77] усл. ед., что в 2,5 раза превышало референсные значения.
Исходно показатели липидного спектра в обеих группах статистически значимо различались по уровню ОХС, ХС липопротеидов высокой плотности (ЛПВП). Значения ТГ и ХС ЛПНП в 1-й группе существенно превышали референсные значения (табл. 2).
Концентрация ЛП-ФЛА2 в сыворотке крови у пациентов обеих групп превышала физиологический уровень (более 210 нг/мл) и составляла в 1-й группе 1191,30 [648,31;1357,02] нг/мл, статистически значимо (р=0,001) превышая этот показатель во 2-й группе – 641,58 [556,79;747,42] нг/мл.
Уровень ЛП-ФЛА2 в сыворотке крови статистически значимо различался в зависимости от степени поражения коронарных артерий (χ2–13,291; df=1; р=0,001). Так, концентрация ЛП-ФЛА2 у пациентов с однососудистым поражением составляла 641,58 [517,66; 737,99] нг/мл, с двухсосудистым – 1017,42 [876,56; 1251,90] нг/мл и с трехсосудистым – 1082,40 [579,95; 1272,60] нг/мл (рис. 1).
В обеих группах обследованных исходно и через 1 год показатели базальной глюкозы были в пределах нормальных значений. Постпрандиальный уровень глюкозы исходно в 1-й группе на 11,21% превышал таковой во 2-й группе (р=0,019), при этом через 1 год проспективного наблюдения показатели статистически значимо уменьшились на 7,14 и 9,19% соответственно (р=0,018 и р=0,004). Значения инсулина также претерпевали существенные изменения, уменьшившись на 18,84 и 22,42%. ИИР (HOMA-IR) исходно был повышен в обеих группах, а через 1 год наблюдения статистически значимо снизился на 28,10 и 41,28% соответственно, а во 2-й группе с благоприятным течением достиг рекомендованных значений – 2,66 [1,39;4,01] усл. ед. В 1-й группе пациентов отмечены более высокие значения HbA1c (р=0,003), и через 1 год этот показатель не изменился, а во 2-й группе наблюдалось статистически значимое уменьшение уровня HbA1c, который составил 5,35 [5,20;6,22]%. Обнаружены значимые межгрупповые различия (табл. 3).
Обнаружено статистически значимое снижение концентрации ЛП-ФЛА2 в 1-й группе на 21,28% – с 1191,30 [648,31;1357,02] до 937,70 [814,31;1050,02] нг/мл (р=0,021), во 2-й группе на 26,63% – с 641,58
Таблица 3
Показатели углеводного обмена у пациентов с ИБС, ассоциированной с СД 2-го типа в динамике через 12 мес., Ме [LQ;UQ]
|
Показатели |
1-я-группа (неблагоприятное течение), n=30 |
2-я-группа (благоприятное течение), n=30 |
p |
||
|
Исходно |
Через год |
Исходно |
Через год |
||
|
Глюкоза базальная, ммоль/л |
6,50 [5,30;7,20] |
6,60 [6,10;7,75] |
6,00 [5,40;6,40] |
5,75 [5,30;6,27] |
р1,2=0,864 р2,,4=0,000 р 1,3 =0,061 р3,4=0,990 |
|
Глюкоза постпрандиальная, ммоль/л |
9,80 [8,52;11,97] |
9,10 [7,45;10,50] |
8,70 [7,87;11,52] |
7,90 [7,50;8,95] |
р 1,2 =0,018 р 2,4 =0,292 р1,3=0,019 р3,4 =0,004 |
|
Инсулин, мкЕд/мл |
22,77 [18,40;28,90] |
18,48 [13,53;25,61] |
16,10 [12,97;19,20] |
12,49 [10,72;14,27] |
р 1,2 =0,047 р 2,4 =0,002 р 1,3 =0,001 р 3,4 =0,034 |
|
HOMA-IR, усл. ед. |
6,69 [4,69;8,77] |
4,81 [3,12;6,71] |
4,53 [3,04;5,58] |
2,66 [1,39;4,01] |
р 1,2 =0,031 р 2,4 =0,002 р 1,3 =0,001 р3,4=0,004 |
|
HbA1c,% |
6,80 [6,02;7,47] |
6,70 [5,90;6,90] |
5,90 [5,32;6,40] |
5,35 [5,20;6,22] |
р 1,2 =0,426 р 2,4 =0,001 р 1,3 =0,003 р3,4=0,005 |
Примечание: HbA1c – гликированный гемоглобин.
Таблица 4
Показатели липидного спектра у пациентов с ИБС, ассоциированной с СД 2-го типа, в динамике через 12 мес., Ме [LQ;UQ]
|
Показатели |
1-я группа (неблагоприятное течение), n=30 |
2-я группа (благоприятное течение), n=30 |
p |
||
|
Исходно |
Через год |
Исходно |
Через год |
||
|
ОХС, ммоль/л |
6,18 [5,22;6,84] |
4,92 [3,82;5,91] |
5,64 [5,21;6,11] |
3,92 [3,50;4,70] |
р12=0,004 р2,,4<0,001 р 1,3 =0,002 р3,4<0,001 |
|
ТГ, ммоль/л |
2,48 [1,84;2,99] |
1,83 [1,32;2,28] |
1,96 [1,12;2,69] |
1,63 [0,97;2,10] |
р1,2<0,001 р 2,4 =0,292 р 1,3 =0,021 р 3,4 =0,021 |
|
ХС ЛПНП, ммоль/л |
3,25 [2,29;4,32] |
2,41 [1,51;3,42] |
2,61 [2,28;3,87] |
1,79 [1,63;2,01] |
р 1,2 =0,002 р 2,4 =0,003 р 1,3 =0,038 р3,4<0,001 |
|
ХС ЛПВП, ммоль/л |
0,99 [0,84;1,05] |
1,01 [0,82;1,19] |
1,11 [0,94;1,24] |
1,13 [0,98;1,29] |
р 1,2 =0,394 р 2,4 =0,298 р 1,3 =0,036 р3,4=0,909 |
|
Апо-В, г/л |
1,62 [1,42;1,82] |
1,13 [0,99;1,26] |
1,57 [1,41;1,83] |
0,86 [0,71;0,99] |
р12=0,866 р 2 , ,4 =0,038 р 1,3 =0,093 р3,4=0,007 |
|
Апо-А1, г/л |
1,18 [0,85;1,29] |
1,12 [0,88;1,37] |
1,11 [0,84;1,24] |
1,31 [1,12;1,49] |
р 1,2 =0,091 р 2,4 =0,043 р 1,3 =0,607 р3,4=0,046 |
|
Lp (а), мг/л |
318,22 [104,37;345,46] |
319,14 [288,01;350,13] |
308,75 [286,12;330,09] |
303,14 [276,01;330,46] |
р 1,2 =0,897 р 2,4 =0,097 р 1,3 =0,382 р3,4=0,684 |
[556,79;747,42] до 470,71 [220,01;725,24] нг/мл (р=0,004).
Через 12 мес. проспективного наблюдения на фоне терапии аторвастатином в средней дозе 30 мг/сутки в 1-й группе статистически значимо уменьшились показатели ОХС на 20,71% (р=0,004), ТГ – на 26,21% (р<0,001) и ХС ЛПНП – на 25,84% (р<0,002). Во 2-й группе, с благоприятным течением, также было отмечено значимое, но более выраженное уменьшение уровней ОХС на 30,52%, ХС ЛПНП – на 31,41%, достигавшее целевых значений. Кроме того, концентрация Апо-В уменьшилась на 45,2% (р=0,038), в то время как показатели ХС ЛПВП и Апо-А1, Lp (а) существенно не изменялись ни в одной из групп. Установлены межгрупповые различия через 12 мес. проспективного наблюдения по показателям ОХС, ХС ЛПНП, ХС ЛПВП (табл. 4).
В 1-й группе умер (внезапная сердечная смерть) один больной (3,3%) с трехсосудистым стенозирующим коронарным атеросклерозом и клиническими признаками постинфарктной дисфункции левого желудочка. Остальные пациенты завершили исследование. При этом рецидив стенокардии после планового чрескожного коронарного вмешательства развился у 96,7% обследованных. Всем пациентам была проведена контрольная коронарография, по результатам которой у 16,7% пациентов выявлено рестенозирование стентов, у 63,3% – прогрессирование атеросклероза в нативных коронарных артериях. Повторный ИМ развился у 3 (10%) обследованных, ОНМК – в 1 (3,3%) случае. Повторная реваскуляризация в связи с рестенозированием стентов или прогрессирования атеросклероза выполнена у 21 (70%) пациента (рис. 2).
Обнаружены корреляционные связи между концентрацией ЛП-ФЛА2, с одной стороны, и уровнями ОХС (r=0,45, р=0,0003), ТГ (r=0,35, р=0,005), ХС ЛПНП (r=0,52, р=0,001), базальной глюкозы (r=0,34, р=0,006), HOMA-IR (r=27, р=0,03) – с другой стороны.
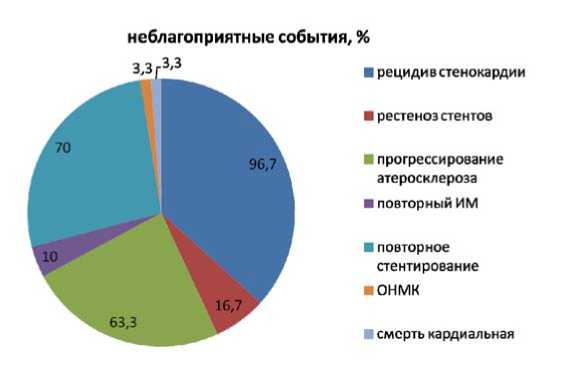
Рис. 2. Основные кардиоваскулярные события в течение 1 года после эндоваскулярной реваскуляризации у пациентов с неблагоприятным течением патологии (1-я группа)
Обсуждение
Одним из важных и приоритетных направлений в вопросе вторичной профилактики развития неблагоприятных сердечно-сосудистых осложнений у пациентов с ИБС, ассоциированной с СД 2-го типа, является эффективное воздействие на факторы риска. Хотя традиционные факторы риска развития ИБС, ассоциированной с СД 2-го типа, широко известны, они позволяют прогнозировать течение заболевания не у всех больных. В последние годы активно изучаются биомаркеры – это вещества, появление или изменение концентрации которых может быть диагностическим критерием какого-либо заболевания или имеет прогностическое значение.
Данные нашего исследования показали, что концентрация ЛП-ФЛА2 существенно превышала значения аналогичного показателя в других работах. Так, уровень ЛП-ФЛА2 в 1-й группе с неблагоприятных течением составлял 1191,30 [648,31;1357,02] нг/мл, а во 2-й группе с благоприятным течением данный показатель был практически в 2 раза ниже – 641,58 [556,79;747,42] нг/мл, по-види-мому, это связано с тем, что в исследование включалась такая тяжелая когорта пациентов, как пациенты с ИБС, ассоциированной с СД 2-го типа, и пациенты, перенесшие коронарную реваскуляризацию, причем у этих же больных отмечался и самый низкий уровень ХС ЛПВП, что позволяет говорить о вкладе этих показателей в развитие коронарного атеросклероза и тяжесть атеросклеротического поражения.
Согласно современным данным, установлена связь между высокой концентрацией ЛП-ФЛА2 и риском развития сердечно-сосудистых событий [5, 7, 18].
Тот факт, что статины снижают концентрацию ЛП-ФЛА2, свидетельствует о том, что ЛП-ФЛА2 можно рассматривать как мишень для терапии с целью подавления процессов воспаления и достижения стабилизации атеросклеротической бляшки [10]. Результаты нашего исследования показали, что терапия статинами не только дает гиполипидемический эффект, но и приводит к значительному снижению концентрации ЛП-ФЛА2 у пациентов с ИБС, ассоциированной с СД 2-го типа.
Так, на фоне терапии аторвастатином в средней дозе 30 мг/сутки доказано статистически значимое уменьшение уровня ЛП-ФЛА2, которое более выражено в группе с благоприятным течением ИБС – на 26,63% и в 1-й группе – на 21,28% (р=0,004). При этом в 1-й группе уровни ОХС уменьшились на 20,71% (р=0,004), ТГ – на 26,21% (р<0,001), ХС ЛПНП – на 25,84% (р<0,002). Во 2-й группе с благоприятным течением также было отмечено значимое, но более выраженное уменьшение уровней ОХС на 30,52%, ХС ЛПНП – на 31,41%, которое достигло целевых значений. Кроме того, концентрация Апо-В уменьшилась на 45,2% (р=0,038), в то время как показатели ХС ЛПВП и Апо-А1, Lp (а) существенно не изменялись ни в одной из групп.
Это согласуется с данными других исследователей. В работах, где оценивалось влияние статинов на концентрацию ЛП-ФЛА2, получены следующие результаты: в исследовании WOSCOPS у пациентов с ИБС правастатин 40 мг/сутки по сравнению с плацебо снижал концентрацию ЛП-ФЛА2 на 17%, а концентрацию ХС ЛПНП – на 24% [11]. В исследовании M.A. Albert et al. [7] правастатин 40 мг/сутки снижал концентрацию ЛП-ФЛА2 и ХС ЛПНП на 22% у пациентов без сердечно-сосудистых заболеваний. В исследовании Heart Protection Study монотерапия симвастатином 40 мг/сут-ки снижала концентрацию ЛП-ФЛА2 на 27% и ХС ЛПНП – на 41% [14]. По данным E. Schaefer et al. [23], монотерапия аторвастатином 40 мг/сутки у 84 пациентов снижала концентрацию ЛП-ФЛА2 на 26% и ХС ЛНП – на 48%. В этой же работе монотерапия симвастатином 20–40 мг/сутки у 16 пациентов снижала концентрацию ЛП-ФЛА2 на 10% и ХС ЛПНП – на 37%.
Так, в исследовании MIRACL (Myocardial Ischemia Reduction With Aggressive Cholesterol Lowering) показано, что высокие дозы аторвастатина достоверно снижали уровни секреторной ЛП-ФЛА2 на 35,8% после острого коронарного синдрома. На основании этого исследователи пришли к выводу, что аторвастатин может оказывать противовоспалительное влияние на ЛП-ФЛА2, что способствует его терапевтическим эффектам после острого коронарного синдрома [22]. E. Moutzouri еt al. провели открытое, рандомизированное, проспективное исследование, в которое были включены 153 пациента с гиперхолестеринемией. Пациенты были рандомизированы по приему симвастатина 40 мг, симвастатина/эзети-миба 10/10 мг и розувастатина 10 мг в день. Показано, что как моно-, так и комбинированная терапия достоверно снижает эти показатели в одинаковой степени [17]. Учитывая, что ЛП-ФЛА2 главным образом связана с апоB, не удивительно, что эффективные дозы статинов уменьшают и активность, и массу ЛП-ФЛА2 наряду с ХС ЛПНП.
Таким образом, терапия статинами достоверно снижает уровень ЛП-ФЛА2 как в плазме крови, так и в атеросклеротической бляшке, сдерживая локальный воспалительный ответ и повышая стабильность этой бляшки путем подавления воспаления и снижения апоптоза макрофагов [19]. Обнаружены корреляционные связи между концентрацией ЛП-ФЛА2, с одной стороны, и уровнями ОХС (r=0,45, р=0,0003), ТГ (r=0,35, р=0,005), ХС ЛПНП (r=0,52, р=0,001), базальной глюкозы (r=0,34, р=0,006), HOMA-IR (r=27, р=0,03), с другой стороны, что свидетельствует о тесной взаимосвязи нарушений углеводного и липидного метаболизма у пациентов с ИБС, ассоциированной с СД 2-го типа. Наши результаты по корреляции согласуются с данными мировой литературы. Так, в наиболее крупных исследованиях максимальная корреляция ЛП-ФЛА2 и ХС ЛПНП (r=0,51) получена в исследовании Women’s Health Study [9]. В других известных исследованиях получены примерно одинаковые результаты, выявлена слабая корреляция концентрации ЛП-ФЛА2 с показателями липидного состава крови (ХС ЛПНП, ОХС), в случае с ХС ЛПВП в ряде работ корреляция отсутствует, а в некоторых работах выявляется слабая отрицательная корреляция [12, 13]. Корреляцию уровня ЛП-ФЛА2 и ХС ЛПНП, как правило, объясняют тем фактом, что 80% циркулирующей в крови ЛП-ФЛА2 связано с ХС ЛПНП [11].
Таким образом, ЛП-ФЛА2 – высокоспецифический маркер васкулярного воспаления. В целом, ЛП-ФЛА2 сегодня рассматривается как важный сердечно-сосудистый маркер, независимый от традиционных факторов риска (и от hsСРБ) и дополняющий оценку риска, получаемую с помощью традиционных факторов риска. ЛП-ФЛА2 обладает рядом существенных отличий от известных маркеров воспаления, с помощью которых можно прогнозировать увеличение риска сердечно-сосудистых событий. Так, ЛП-ФЛА2 обладает специфичностью в отношении сосудистого воспаления, в то время как прочие биомаркеры, например, С-реактивный белок (CРБ), отражают наличие системного воспаления. Обнаружение того, что ЛП-ФЛА2 активно синтезируются в местах атеросклеротических повреждений и оказывает множественные проате-рогенные и протромботические эффекты обусловливает актуальность определения таких маркеров для диагностики и оценки степени тяжести атеросклероза [6].
По результатам проведенного нами исследования уровень ЛП-ФЛА2 можно рассматривать как прогностический маркер развития неблагоприятных сердечно-сосудистых событий у больных ИБС, ассоциированной с СД 2-го типа, и выделить особые когорты пациентов с повышенным риском для осуществления более агрессивной липидкорригирующей терапии с целью достижения целевого уровня ХС ЛПНП.
Список литературы Взаимосвязь уровня липопротеинассоциированной фосфолипазы А2 с риском развития кардиоваскулярных событий, оценка эффективности профилактической терапии статинами
- Алгоритмы специализированной помощи больным сахарным диабетом/под ред. И.И. Дедова, М.В. Шестаковой//Сахарный диабет. -2015. -Т. 18(1S). -С. 1-112. - DOI: 10.14341/DM20151S1-112
- Барбараш O.Л., Груздева О.В., Акбашева О.Е. и др. Биохимические показатели, ассоциированные с развитием сахарного диабета через год после перенесенного инфаркта миокарда//Клиническая медицина. -2014. -№ 11. -С. 52-59.
- Беспалова И.Д., Рязанцева Н.В., Калюжин В.В. и др. Влияние аторвастатина на провоспалительный статус (in vivo и in vitro) больных гипертонической болезнью с метаболическим синдромом//Кардиология. -2014. -№ 8. -С. 37-43.
- Миклищанская С.В., Власик Т.Н., Хеймец Г.Н. и др. Влияние интенсивной гиполипидемической терапии на концентрацию липопротеинассоциированной фосфолипазы А2 в крови больных ишемической болезнью сердца//Кардиология. -2013. -№ 9. -С. 4-11.
- Тепляков А.Т., Кузнецова А.В., Гракова Е.В. и др. Способ прогнозирования риска развития неблагоприятных сердечно-сосудистых событий у больных ишемической болезнью сердца с СД 2-го типа, перенесших стентирование коронарных артерий: пат. 2582291 Российская Федерация, МПК G01N33/48(2006.01). -Заявитель и патентообладатель: Федеральное государственное бюджетное научное учреждение "Научно-исследовательский институт кардиологии" (RU). -№ 2015122211/15, 09.06.2015; заявл. 09.06.2015; опубл. 20.04.2016, Бюл. № 11. -3 с.
- Самойлова Е.В., Пиркова А.А., Проказова Н.В. Влияние липидов ЛПНП на активность секреторной фосфолипазы А2 группы IIА//Бюл. эксперим. биологии и медицины. -2010. -№ 7. -C. 45-47.
- Тепляков А.Т. Хроническая сердечная недостаточность. Цитокиновая экспрессия, иммунная активация и защита органов-мишеней. -Томск: Изд-во Том. ун-та, 2012. -294 с.
- Albert M.A., Glynn R.J., Wolfert R.L. et al. The effect of statin therapy on lipoprotein associated phospholipase A2 levels//Atherosclerosis. -2005. -Vol. 182. -P. 193-198.
- Blake G.J., Dada N., Fox J.C. et al. A prospective evaluation of lipoprotein-associated phospholipase A2 levels and the risk of future cardiovascular events in women//J. Am. Coll. Cardiol. -2001. -Vol. 38. -P. 1302-1306.
- Braun L.T., Davidson M.H. Lipoprotein-associated phospholipase A2: a new target for statin therapy//Cur. Atherosclerosis Rep. -2010. -Vol. 12. -P. 29-33.
- Caslake M.J., Packard C.J. Lipoprotein-associated phospholipase A2 (platelet-activating factor acetylhydrolase) and cardiovascular disease//Lipidol. -2003. -Vol. 14. -P. 347-352.
- Danesh J., Thompson A., Orfei L. et al. Lipoprotein-associated phospholipase A2 and risk of coronary disease, stroke, and mortality: collaborative analysis of 32 prospective studies//Lancet. -2010. -Vol. 375. -P. 1536-1544.
- Gerber Y., Dunlay S.M., Jaffe A.S. et al. Plasma lipoprotein-associated phospholipase A2 levels in heart failure: association with mortality in the community//Atherosclerosis. -2009. -Vol. 203, No. 2. -Р. 593-598.
- Heart Protection Study Collaborative Group. Lipoprotein-associated phospholipase A2 activity and mass in relation to vascular disease and nonvascular mortality//J. Intern. Med. -2010. -Vol. 268. -P. 348-358.
- Iribarren C. Lipoprotein-associated phospholipase A2 and cardiovascular risk: state of the evidence and future directions//Arterioscler. Thromb. Vasc. Biol. -2006. -Vol. 26. -P. 5-6.
- Iwase M., Sonoki K., Sasaki N. et al. Lysophosphatidylcholine contents in plasma LDL in patients with type 2 diabetes mellitus: relation with lipoprotein-associated phospholipase A2 and effects of simvastatin treatment//Atherosclerosis. -2008. -Vol. 196, No. 2. -P. 931-936.
- Moutzouri E., Liberopoulos E.N., Tellis C.C. et al. Comparison of the effect of simvastatin versus simvastatin/ezetimibe versus rosuvastatin on markers of inflammation and oxidative stress in subjects with hypercholesterolemia//Atherosclerosis. -2013. -Vol. 231(1). -P. 8-14.
- Persson M., Berglund G., Nelson J.J. et al. Lipoprotein-associated phospholipase A2 activity and mass are associated with increased incidence of ischemic stroke: a population-based cohort study from Malmo, Sweden//Atherosclerosis. -2008. -Vol. 200. -P. 191-198.
- Racherla S., Arora R. Utility of Lp-PLA2 in Lipid-Lowering Therapy//Am. J. Ther. -2012 Mar. -Vol. 19(2). -P. 115-120.
- Raichlin E., McConnell J.P., Bae J.H. et al. Lipoprotein-associated phospholipase A2 predicts progression of cardiac allograft vasculopathy and increased risk of cardiovascular events in heart transplant patients//Transplantation. -2008. -Vol. 85, No. 7. -Р. 963-968.
- Ridker P.M., Macfadyen J.G., Wolfert R.L. et al. Relationship of lipoprotein-associated phospholipase A2 mass and activity with incident vascular events among primary prevention patients allocated to placebo or to statin therapy: an analisis from the JUPITER Trial//Clin. Chem. -2012. -Vol. 58. -P. 877-886.
- Ryu S.K., Mallat Z., Benessiano J. et al. Myocardial Ischemia Reduction With Aggressive Cholesterol Lowering (MIRACL) Trial Investigators. Phospholipase A2 enzymes, high-dose atorvastatin, and prediction of ischemic events after acute coronary syndromes//Circulation. -2012, Feb. 14. -Vol. 125 (6). -P. 757-766.
- Schaefer E.J., McNamara J.R., Asztalos B.F. et al. Effects of atorvastatin versus other statins on fasting and postprandial C-reactive protein and lipoprotein-associated phospholipase A2 in patients with coronary heart disease versus control subjects//Am. J. Cardiol. -2005. -Vol. 95. -P. 1025-1032.


