Замещение тотальных и субтотальных дефектов пяточной кости у пациентов с остеомиелитом с использованием индивидуальных 3D имплантатов
Автор: Оснач С.А., Оболенский В.Н., Процко В.Г., Тамоев С.К., Мазалов А.В., Кузнецов В.В., Качесов А.В., Рыбинская А.Л., Сулейманов А.Р., Задорожний Д.К.
Журнал: Кафедра травматологии и ортопедии @jkto
Рубрика: Клинический случай
Статья в выпуске: 3 (61), 2025 года.
Бесплатный доступ
Введение. Тотальные и субтотальные дефекты пяточной кости являются сложной и актуальной проблемой в современной травматологии, не имеющей однозначного решения. Однако лечение пациентов с дефектами, возникшими на фоне дистальной нейропатии, осложнённой хронической инфекцией, является ещё более сложной задачей. Цель: оценить эффективность метода замещения тотальных и субтотальных дефектов пяточной кости с использованием эндопротеза, изготовленного на основе 3D реконструкции КТ исследования, у пациентов с дистальной нейропатией, сопровождающейся инфекционными осложнениями и дефектом мягких тканей. Материалы и методы. В 2022–2023 годах было этапно пролечено 3 пациента с остеомиелитом пяточной кости на фоне сахарного диабета и дистальной нейропатии и один пациент с тотальным дефектом пяточной кости и контактным остеомиелитом после мотоциклетной травмы. Всем в результате установлены индивидуальные титановые 3D имплантаты. Срок наблюдения после завершения лечения – более 1,5 лет. Заключение. Применение индивидуальных 3D имплантатов из пористого титана у пациентов с дистальной нейропатией, осложнённой инфекционным процессом, является более простым способом замещения сформированных дефектов в сравнении с техникой одномоментного замещения дефекта заднего отдела стопы и опороспособности конечности и может служить альтернативой ранее используемым методам лечения.
Остеомиелит, 3D-печать, полинейропатия
Короткий адрес: https://sciup.org/142246163
IDR: 142246163 | УДК: 617.3 | DOI: 10/17238/issn2226-2016.2025.3.28-39
Текст научной статьи Замещение тотальных и субтотальных дефектов пяточной кости у пациентов с остеомиелитом с использованием индивидуальных 3D имплантатов
Тотальные и субтотальные дефекты пяточной кости являются сложной и актуальной проблемой в современной травматологии, не имеющей однозначного решения. Среди возможных причин развития – посттравматические изменения, новообразования пяточной кости. Однако лечение пациентов с дефектами, возникшими на фоне дистальной нейропатии, осложнённой хронической инфекцией, является ещё более сложной задачей.
При периферической нейропатии и, в частности, при диабетической нейропатии, может развиться снижение минеральной плотности костной ткани [1]. За счёт продолжающейся осевой нагрузки на конечность повышается риск развития патологических переломов. К тому же у пациентов со сниженной чувствительностью повышен риск травматизации кожного покрова, а из-за повышенного локального давления выступающих частей костей – риск развития язвенных дефектов, что в дальнейшем может приводить к инфицированию и развитию остеомиелита. Все вышеописанные изменения могут приводить к развитию тотальных и субтотальных дефектов пяточной кости, что в свою очередь нарушает опор-ность конечности, меняет её биомеханику, а также, ввиду развившихся осложнений, в ряде случаев вынуждает выполнять ампутации на различных уровнях.
Среди возможных вариантов лечения – выполнение тотальной или субтотальной кальканэктомии. Целью данного типа вмешательства является устранение очага инфекции. При этом некоторые авторы рассматривают кальканэктомию в качестве альтернативы выполнения ампутации. В литературе представлены кейс-репорты с единичными наблю- дениями, серии с небольшим количеством случаев, авторы которых заявляют о благоприятных исходах, отсутствии или небольшом проценте осложнений и рецидивов язвенных дефектов, удовлетворённости пациентов после проведённых вмешательств [2-5]. Но в представленных случаях рассматривается непродолжительный период наблюдения, на основании которого нельзя сделать вывод об отсутствии развития осложнений. Так по данным Han et al. [6] в серии из 57 случаев после проведённого хирургического лечения (тотальная/частичная кальканэктомия, резекция пяточной и таранной костей) только в 58 % случаев было достигнуто полное заживление, причём больше, чем у половины пациентов были проблемы в заживлении ран или присоединение вторичной инфекции. В оставшихся 42 % случаях были выполнены ампутации на различных уровнях. Согласно Cook et al. [7], после проведённой частичной кальканэктомии полное заживление послеоперационной раны встречалось от 51% до 83 % случаев, и средняя продолжительность заживления составляла около 200 дней, что зависело от сопутствующих заболеваний и бактериальной флоры. Согласно Waibel et al. [8], у 40 % пациентов, с проведённой частичной кальканэктомией, требуются повторные ревизии, а у пациентов с тотальной резекцией пяточной кости – в 100 %. Также за счёт резекции пяточной кости, тотальной или частичной, меняется биомеханика стопы, что в дальнейшем вынуждает пациентов использовать индивидуальную ортопедическую обувь, – специализированные ортезы, компенсирующие высоту заднего отдела стопы. Подобные изделия сложны в изготовлении, достаточно громоздки и дискомфортны при использовании. Также пациенты отмечали хронический болевой синдром, невозможность перемещаться на дальние расстояния или находится длительное время в положении стоя, необходимость использования дополнительной опоры.
Описаны различные варианты остеотомий с последующим костным транспортом, осуществляющие замещение дефектов пяточной кости, при помощи компрессионно-дистракционного аппарата. Среди возможных вариантов: остеотомия сохранённой части пяточной кости [9, 10], остеотомия дистального метадиафиза большеберцовой кости [11], выполнение артродеза таранно-ладьевидного и голеностопного суставов с последующей одновременной остеотомией большеберцовой кости в проксимальной и дистальной третях и шейки таранной кости [12, 13], остеотомия фрагмента заднедистального отдела большеберцовой кости трапециевидной формы [14], Г-(Т)-образная остеотомия таранной кости [15]. Также возможен способ вывихивания таранной кости с переводом её в положение пяточной кости с удержанием в приемлемом положении при помощи аппарата наружной фиксации [16]. Однако все вышеописанные методы требуют длительного времени, необходимого для формирования костного регенерата, что в свою очередь исключает осевую нагрузку на конечность в течение продолжительного периода. Долгое ношение аппарата требует от пациентов тщательного ухода за ним. К сожалению, порой пациенты не столь внимательно следят за компонентами аппарата, что чревато развитием воспаления в местах выхода спиц или стержней, нестабильности аппарата и необходимости выполнения перемонтажа. Выполнение остеотомии, особенно на нескольких уровнях, при наличии инфекционного процесса может быть сопряжено с развитием осложнений в послеоперационном периоде, связанных с нарушением формирования регенерата. При осуществлении артродеза, особенно голеностопного сустава, происходит «выключение» движений в суставе, а также перераспределение и повышение нагрузки на другие суставы, что может способствовать ускоренному развитию в них остеоартроза и, как следствие, болевого синдрома.
Wang et al. [17] представили клинический случай, при котором сформированный дефект пяточной кости был замещён при помощи цементного спейсера. Подобная техника, вероятно, может быть использована и требует дальнейшего наблюдения. Однако при замещении дефекта среднего отдела стопы костным цементом в серии случаев в сроки наблюдения до 52 месяцев сохранение спейсера отмечалось только в 66 % [18]. Соответственно, использование спейсера может быть рассмотрено как временное решение и в дальнейшем имеющийся дефект требует замещения другим способом.
Ещё одним возможным вариантом лечения является использование липофиброзного аутотрансплантата [19]. Согласно методике, выполняется остеонекрэктомия пяточной кости с формированием дефекта, который заполняется «отжатым» липофиброзным аутотрансплантатом, забранным с боковой поверхности живота, таким образом, чтобы полностью закрыть дефект, не оставив «мертвого пространства». Подобная техника, вероятно, применима при небольших сформированных дефектах пяточной кости, но не после выполненной тотальной или субтотальной кальканэктомии, поскольку в данном случае восстановление опороспособности конечности не представляется возможным.
Еще одна возможная опция лечения пациентов с подобной-патологией – замещение дефекта пяточной кости ауто- и/или аллографтом с или без использования микрохирургической техники. Описаны варианты использования костных алло-графтов как гетеротопических [20], так и ортотопических [21]. Применение аллографтов имеет свои преимущества, такие как отсутствие дополнительных доступов для забора трансплантата, возможность использования необходимого объёма кости, но при этом сохраняется риск замедленной перестройки или лизиса графта из-за недостаточного кровоснабжения в ложе, предусмотренном для трансплантата. Использование аллографта в комбинации с кровоснабжаемым аутотрансплантатом [22–24] увеличивает шансы на перестройку графта, создавая условия для лучшего кровоснабжения аллокости, а также восполняя его остеогенность.
Среди кровоснабжаемых аутотрансплантатов описаны случаи использования рёбер в комбинации с мышечным компонентом из передней зубчатой мышцы [25], малоберцовой кости [26-28], но применение кровоснабжаемого трансплантата из гребня подвздошной кости, вероятно, является наиболее удачным вариантом аутографта. Во-первых, данный вид графта состоит как из кортикальной кости, так и из губчатой кости. Во-вторых, подобный графт имеет три кортикальных слоя, которые обладают более плотной структурой и позволяют расположить трансплантат «перевёрнутым» кортикальным слоем книзу, имитируя подошвенную поверхность пяточной кости. И, в-третьих, данный вид аутотрансплантата имеет форму максимально приближённую к нативной пяточной кости. Практически во всех найденных нами публикациях [29–32] реконструкции с использованием кровоснабжаемых ауто-трасплантатов выполнялись пациентам после резекции пяточной кости по поводу онкологических заболеваний и только в одном случае при посттравматическом остеомиелите пяточной кости [33]. Во всех представленных случаях авторы смогли добиться сохранения трансплантата, его перестройки и полного костного сращения. Пациенты не испытывали ограничений в повседневной активности, не нуждались в дополнительной опоре или специальных ортопедических изделиях. Как правило, подобные вмешательства не выполнялись при инфекционном поражении, однако в отечественной литературе имеются наблюдения [34], где пациентам с тотальными и субтотальными дефектами, среди которых встречались пациенты с хроническим остеомиелитом, выполнялось замещение кровоснабжаемым аутотрансплантатом из гребня подвздошной кости. Использование данной техники продемонстрировало свою эффективность, восстановление высоты заднего отдела стопы и опорности конечности, а также купирование инфекционного процесса.
Также возможным вариантом лечения является использование имплантов, замещающих пяточную кость. Первый случай использования эндопротеза пяточной кости, найденный нами в литературе, был описан у пациентки с остеосаркомой [35]. Протез был изготовлен на основе 3D-модели КТ исследования, проведённого в предоперационном периоде поражённой пяточной кости. Имплант полностью соответствовал размерам поражённой кости, имел пористую поверхность для лучшей интеграции мягких тканей и гладкие поверхности в области суставных фасеток, а также заранее запланированные отверстия для винтов, обеспечивающих фиксацию протеза к таранной кости. Авторы смогли продемонстрировать отдалённый результат [36]: согласно данным статьи, наблюдение пациентки осуществлялось в течение 12 лет. За истекший период наблюдения признаков развития нестабильности протеза, не смотря на перелом фиксирующих винтов, не было выявлено. Наличие импланта позволило сохранить опор- ность конечности, перемещаться пациентке самостоятельно без дополнительной опоры или специальных ортопедических изделий. Однако в представленном клиническом примере не указано, из какого материала изготовлен протез, являлся ли он цельным или обладал пористой структурой, а также сталкивались ли авторами с какими-то осложнениями в послеоперационном периоде.
При исследованиях был определен оптимальный размер стороны ячейки – 2,5 мм и размер поры ячейки 0,4–0,6мм, при этом глубина прорастания могла достигать 2,5–5 мм и время наибольшей остеоинтеграции составляла от 3–9 месяцев [37, 38]. В зарубежной литературе описаны единичные случаи использования индивидуальных 3D-имплантов [39–42]. Протез изготавливался на основе зеркального КТ изображения контралатеральной пяточной кости [39, 40] или поражённой пяточной кости [41], был выполнен из титанового сплава, имел заранее предусмотренные отверстия для винтов и, как правило, полностью соответствовал поражённой кости, и лишь по данным Park et al. [40] при печати протеза были уменьшены его размеры для избежания потенциальных проблем с мягкими тканями при ушивании. В различных модификациях импланты имели разные поверхности как основной части, так и в проекции суставных фасеток. Протезирование проводилось при тотальных дефектах пяточной кости [39, 40] и при частичных дефектах [41, 42]. Протезы [39, 40], используемые после тотальной кальканэктомии, содержали отверстия для фиксации ахиллова сухожилия и связочного аппарата. Во всех клинических примерах авторы отмечали благоприятный исход, отсутствие осложнений и рецидива основного заболевания. Однако во всех представленных случаях эндопротезирование пяточной кости проводилось также после резекции кости по поводу онкологического поражения без признаков наличия инфекции и дефекта мягких тканей.
Отечественными авторами описан эндопротез пяточной кости [43]. Протез представлен в виде цельной конструкции, выполненной из заготовки пористого никелида титана и состоящей из горизонтальной платформы и вертикального стержня. Также в импланте предусмотрен ряд отверстий и пазов для фиксации связочного аппарата и ахиллова сухожилия. Однако форма данного протеза имеет лишь приближенную форму пяточной кости и, учитывая, что изготавливается на основе титановой заготовки, не обладает индивидуальными особенностями размеров дефекта кости, что в свою очередь может приводить к несоответствию размеров дефекта и протеза, а также возможному профициту или дефициту мягких тканей, что в последнем случае требует одномоментного пластического замещения. Также подобная конструкция не применима при частичных дефектах пяточной кости. Однако публикаций по непосредственному использованию подобного эндопротеза в клинической практике не найдено.
При анализе литературы выполнение реконструктивных вмешательств на заднем отделе стопы в виде замещения дефектов костными кровоснабжаемыми и некровоснабжаемыми трансплантатами, протезирование пяточной кости осуществлялось, в большинстве случаев, у пациентов с новообразованиями пяточной кости. Однако лечение пациентов с дистальной нейропатией, осложнённой хронической инфекцией, в основном, выполнялось исключительно за счёт создания костного регенерата при помощи компрессионно-дистракционного аппарата.
Цель: оценить эффективность метода замещения тотальных и субтотальных дефектов пяточной кости с использованием эндопротеза, изготовленного на основе 3D реконструкции КТ исследования, у пациентов с дистальной нейропатией, сопровождающейся инфекционными осложнениями и дефектом мягких тканей.
Материалы и методы
В 2022-2023 годах на базе центра хирургии стопы ГБУЗ ГКБ им. С.С. Юдина ДЗ г. Москвы было прооперировано 3 пациента с остеомиелитом пяточной кости на фоне сахарного диабета и дистальной нейропатии и один пациент с тотальным дефектом пяточной кости и контактным остеомиелитом после мотоциклетной травмы. Средний возраст пациентов составил 44,6 + 12,5 (22–65) лет.
Первым этапом выполнялась тщательная хирургическая обработка пяточной кости с иссечением всех нежизнеспособных тканей и кости в необходимом объёме. В зону сформировавшегося дефекта устанавливался цементный спейсер с антибиотиком, с моделированием формы под контролем электронно-оптического преобразователя (ЭОП) до соответствия формы цемента замещаемому дефекту пяточной кости. Язвенный дефект иссекался с последующим его закрытием либо местными тканями, либо при помощи кровоснабжаемого комплекса тканей. Стабилизация стопы проводилась аппаратом внешней фиксации (АВФ) с наложением базы на голень и передний отдел стопы. Тем самым осуществлялась большая неподвижность сегмента, нежели при фиксации гипсовой лонгетой. Кроме того, это служило защитой лоскута и его сосудистой ножки от возможного сдавления и фиксацией стопы в функционально выгодном положении.
В послеоперационном периоде выполнялась компьютерная томография оперированного сегмента, по результатам которой проводилось сегментация с последующим моделированием в специализированных программах и печать из пористого титана индивидуального 3D-имплантата, полностью соответствующего размерам дефекта. На этапе моделирования имплантата проводилось планирование отверстий для винтов, фиксирующих имплант к пяточной кости или при ее тотальном дефекте – к таранной кости. Поверхность имплантата полировалась за исключением части, контактирующей с костью, оставляя ее пористой для остеоинтеграции. Второй этап про- водился через 8 недель после формирования индуцированной мембраны по Masquelet [44]. В случае выполнения замещения дефекта мягких тканей лоскутом, второй этап выполнялся через 3–4 месяца.
На втором этапе проводилось удаление цементного спей-сера, не повреждая мембрану, и на его место устанавливали титановый 3D-имплантат, фиксация которого осуществлялась тремя спонгиозными винтами 3.5 мм. Ушивание раны производилось послойно с одномоментной коррекцией лоскута при необходимости. Иммобилизация осуществлялась посредством гипсовой лонгеты до момента снятия швов. Осевая нагрузка исключалась полностью в течение 2 месяцев с момента операции. В послеоперационном периоде проводились этапные КТ-исследования с интервалом 1,5 месяца для оценки интеграции костной ткани в имплант и решения вопроса о возможности дозирования осевой нагрузки на конечность. Несмотря на варьирование сроков остеоинтеграции костной ткани в имплантат по данным литературы, нами проводились этапные КТ-исследования и решение о нагрузке принимались индивидуально. Нагрузка на конечность исключалась в течение минимум 4 месяцев с момента последней операции. Дозирование нагрузки осуществлялось, начиная с 20–30 % от массы тела, с увеличением на 20–30 % каждый месяц. В последующем пациентам показано использование индивидуальной ортопедической обуви.
Клинические примеры
Клинический пример 1. Пациентка К., 65 лет, в анамнезе спинальная травма и сахарный диабет 2 типа. За 5 лет до обращения отметила появление язвенного дефекта по подошвенной поверхности правой стопы, в дальнейшем присоединился хронический остеомиелит пяточной кости. В медицинских учреждениях по месту жительства предпринимались попытки консервативной терапии, выполнялись неоднократные санации, остеонекрэктомии, однако проводимое лечение эффекта не возымело. При поступлении у пациентки по наружному краю подошвенной поверхности правой стопы имелся язвенный дефект округлой формы размером 4,0 х 4,0 см, края уплотнены, дно представлено грануляционной тканью розового цвета, имелось скудное серозное отделяемое (рис. 1). На рентгенограммах часть пяточной кости отсутствовала, в мягких тканях – пузырьки газа (рис. 2). Первым этапом было выполнено иссечение язвенного дефекта, остеонекрэктомия, обработка поверхностей ультразвуковым кавитатором «Sonoca 185», в зону костного дефекта были уложены цементные «бусы» с антибиотиком и установлен спейсер, смоделированный под ЭОП-контролем по форме, напоминающую пяточную кость (рис. 3–5). Учитывая сформированный дефект мягких тканей, который не представлялось возможности закрыть местными тканями, была выполнена пластика суральным лоскутом (Рис. 6, 7). На первые сутки после операции развился венозный стаз лоскута (рис. 8). При ревизии была выявлена гематома, вероятно, образовавшаяся за счёт наружной компрессии лоскута. В связи с этим было принято решение, что на первом этапе пациентам необходимо накладывать аппарат наружной фиксации для максимального покоя конечности, а в случаях с наличием перемещенных комплексов тканей – также и для защиты лоскута и сосудистой ножки от сдавления. Гематома была эвакуирована, наложен аппарат наружной фиксации «голень-стопа» в функционально выгодном положении для стопы. Однако через 1,5 месяца у пациентки развился рецидив инфекции с формированием свища, при ревизии которого дном являлся цементный спейсер. В связи с этим была выполнена повторная ревизия, удаление спейсера и бус, тщательная санация, установка нового цемент- ного спейсера (рис. 9–11). После полного заживления раны и отсутствия признаков рецидива инфекции была выполнена компьютерная томография, на основе которой была спроектирована модель имплантата и изготовлен сам имплантат (рис. 12,13). Через 4 месяца после предшествующей операции был выполнен демонтаж АВФ, удаление цементного спей-сера, остеоперфорация контактных костных поверхностей и установка титанового эндопротеза (рис. 14–17), гипсовая иммобилизация.
Длительность этапного лечения составила суммарно 11 месяцев, срок наблюдения после завершения – 2 года; осложнений в этот период не выявлено (рис. 18–21).
Клинический пример 1.
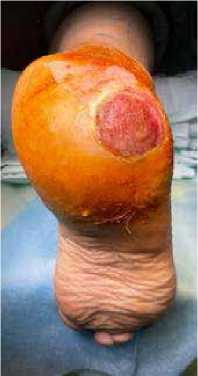
Рисунок 1 . Внешний вид стопы пациентки К.
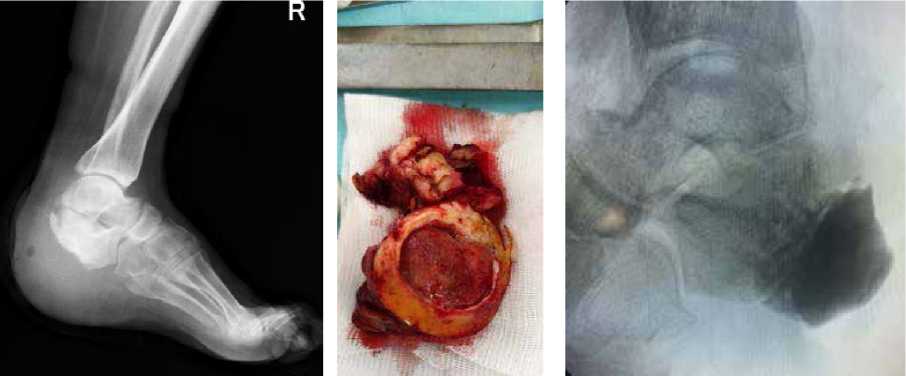
Рисунок 4. Смоделированный цементный язвенный дефект спейсер под ЭОП-контролем
Рисунок 2 . Рентгенограмма при поступлении
Рисунок 3 . Иссечённый
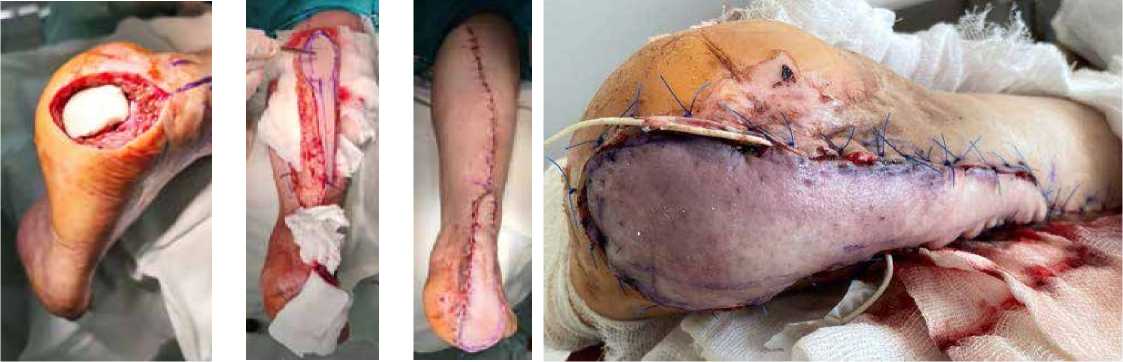
Рисунок 8 . Первые сутки после операции, венозный стаз сурального лоскута
Рисунок 5 . Установленный цементный спейсер и сформированный дефект мягких тканей
Рисунок 6 . Выделение сурального лоскута
Рисунок 7 .
Закрытие дефекта мягких тканей пяточной области
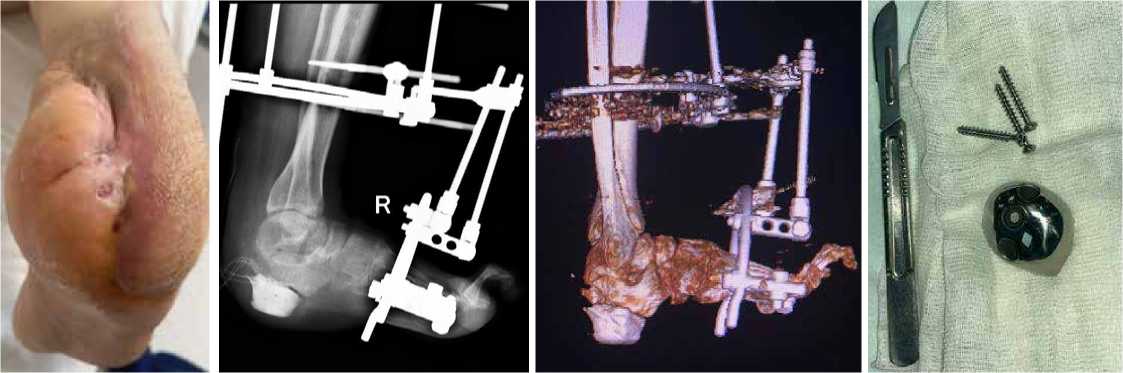
Рисунок 12 . Внешний вид титанового 3D-импланта
Рисунок 9 . 1,5 месяца после операции, рецидив инфекции и формирование свищевого хода
Рисунок 10 . Rg-контроль после замены цементного спейсера
Рисунок 11 . КТ-реконструкция
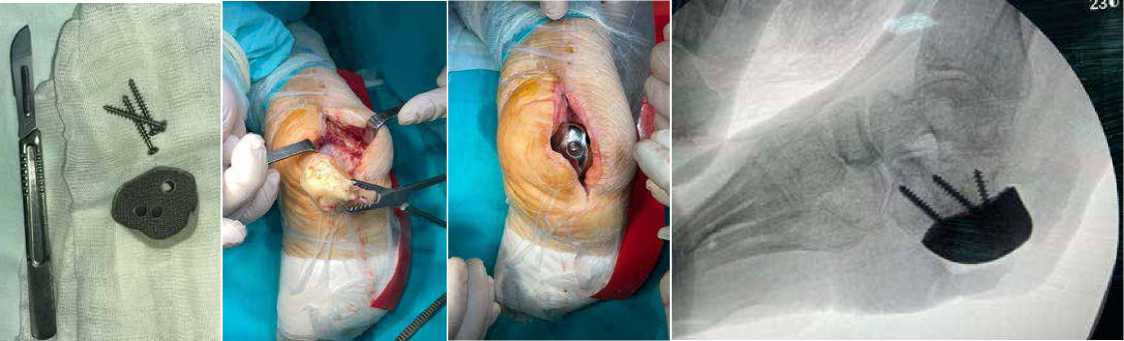
Рисунок 13 . Внешний вид титанового 3D-импланта
Рисунок 14 . Удаление цементного спейсера
Рисунок 15 . Установка титанового импланта в зону дефекта
Рисунок 16 . ЭОП-контроль
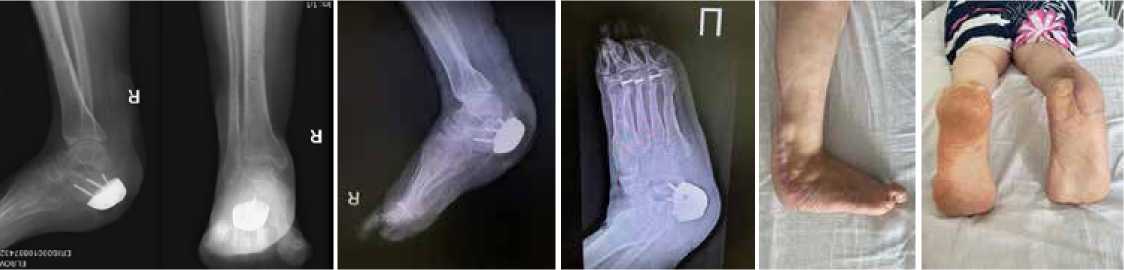
Рисунок 21 . Вид стопы через 8 месяцев после операции
Рисунок 17 . RG-контроль после операции
Рисунок 18 . RG-контроль через 8 месяцев после операции
Рисунок 19 . RG-контроль через 8 месяцев после операции
Рисунок 20 .
Вид стопы через 8 месяцев после операции
Клинический пример 2. Пациент Ф., 23 лет, мотоциклист, пострадал в результате ДТП, цепью мотоцикла была отсечена большая часть пяточной кости с мягкими тканями. Первично пациент был госпитализирован в медицинское учреждение по месту нахождения, где выполнена санация, частичная осте-онекрэктомия. В дальнейшем развился посттравматический остеомиелит. При поступлении конечность фиксирована в АВФ, в проекции пяточной области имелся дефект мягких тканей (около 2 % площади поверхности) и кости. Дно дефекта представлено оставшейся частью пяточной кости серого цвета без признаков кровотечения при выполнении перфорации (Рис. 22–24). Была выполнена остеонекрэктомия с практически полной резекцией пяточной кости, тщательная санация. В зону дефекта установлен цементный спейсер, смоделированный под ЭОП (Рис. 25, 26). Дефект мягких тканей закрыт кожно-фасциальным антеролатеральным лоскутом бедра, взятого с контралатеральной конечности (Рис. 27). Выполнены микроанастомозы двух вен и артерии лоскута с задней большеберцовой артерией конец в бок. Завершающий шаг – наложение АВФ. На третьи сутки после операции развилась картина артериального тромбоза лоскута. При ревизии выявлено слабое заполнение артерии лоскута и её экстравазальная компрессия венами. Было выполнено иссечение анастомоза артерии, удаление тромботических масс, промывание просвета сосудов, реанастомоз. Также выполнен реанастомоз двух комитантных вен. После заживления ран выполнена КТ, на основе которой изготовлен титановый 3D имплантат (Рис. 28). Через 7 месяцев после предшествующей операции выполнено удаление спейсера, остеоперфорация и установка имплантата (Рис. 29–33), гипсовая иммобилизация.
Длительность этапного лечения составила суммарно 7 месяцев, срок наблюдения после завершения – 1,5 года; осложнений в этот период не выявлено (Рис. 34, 35).
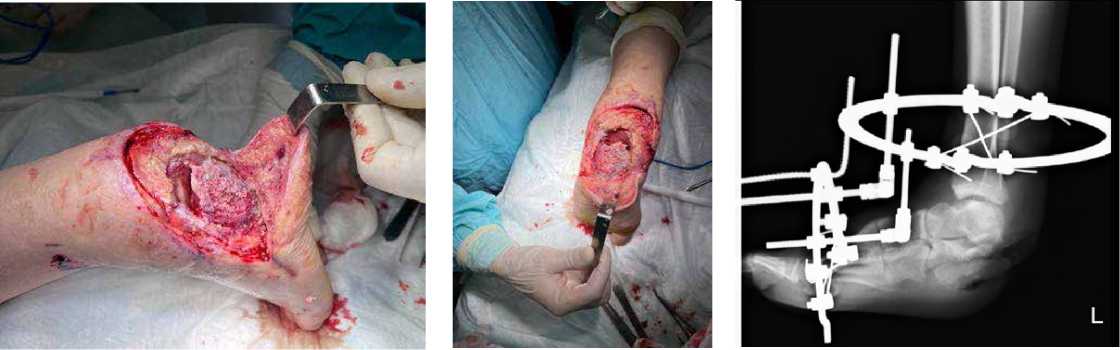
Рисунок 22 . Внешний вид стопы при поступлении
Рисунок 24 . Рентгенограмма стопы при поступлении
Рисунок 23 . Внешний вид стопы при поступлении
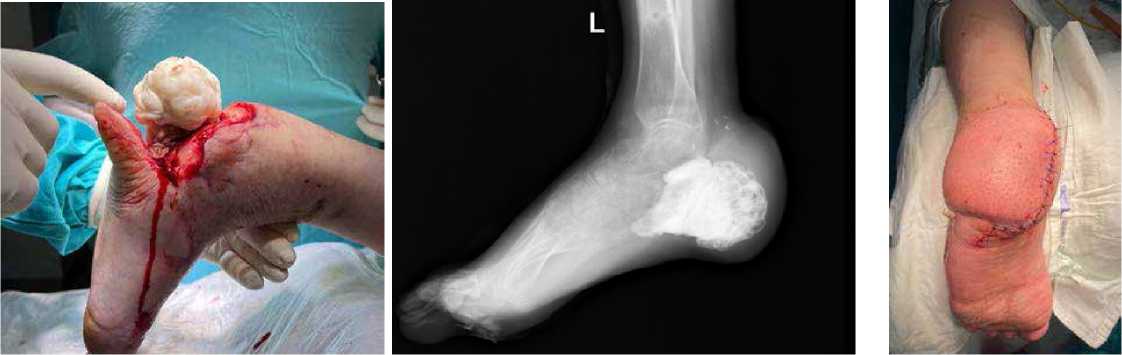
Рисунок 25 . Установка цементного спейсера
Рисунок 26 . RG-контроль после операции
Рисунок 27 . Закрытие дефекта мягких тканей кожно-фасциальным антеролатеральным лоскутом бедра
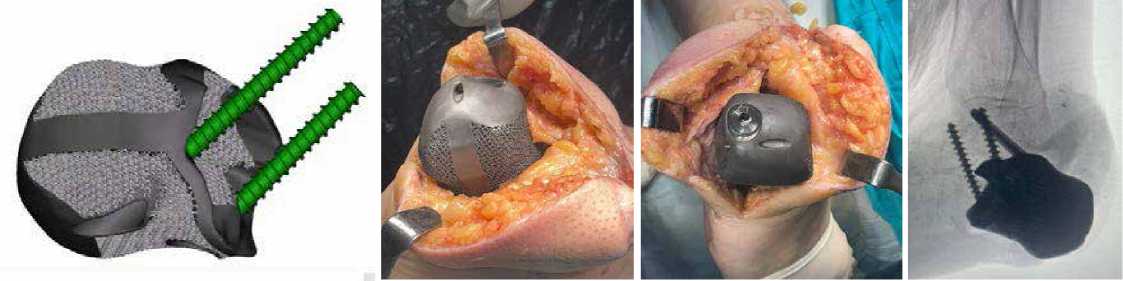
Рисунок 28 . Спроектированная модель титанового импланта
Рисунок 29 . Установка импланта в зону дефекта
Рисунок 30 . Установка импланта в зону дефекта
Рисунок 31 . ЭОП-контроль
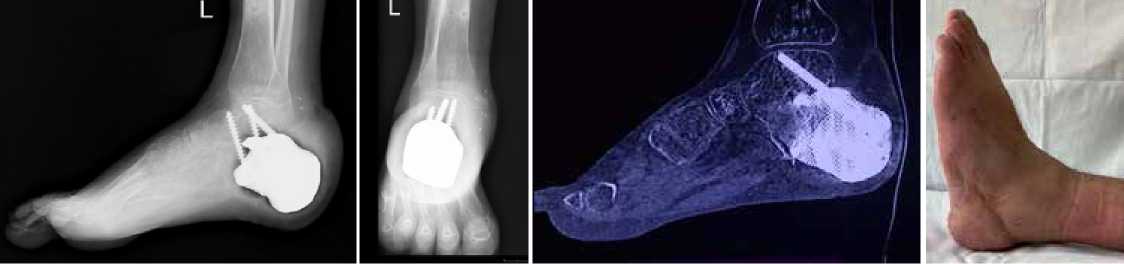
Рисунок 33 . Rg-контроль после операции
Рисунок 32 . Rg-контроль после операции
Рисунок 34 . КТ-контроль через 2 месяца после операции
Рисунок 35 . Вид стопы через год
Обсуждение
Лечение пациентов с дистальной нейропатией, осложнённой хроническим инфекционным процессом, остаётся сложной проблемой. Нередко пациентам с данной патологией предлагается выполнение ампутации ниже коленного сустава с последующим экзопротезированием. Резекция пяточной кости (тотальная или частичная) зачастую в дальнейшем требует повторных хирургических вмешательств и приводит к пяточной установке стопы и перегрузке заднего отдела с повторным язвообразованием, что не решает проблему. Также это вынуждает пациентов использовать специализированные ортопедические изделия, которые не очень эффективны либо требуют более тщательного и регулярного наблюдения в кабинете диабетической стопы. Среди реконструктивных методов лечения рассматриваются различные варианты остеотомий с костным транспортом. Но данный вид лечения длителен по времени и требует от пациентов более продолжительного исключения нагрузки на оперированную конечность.
Задачей двухэтапного хирургического метода, предложенного нами, является устранение инфекционного очага, сохранение конечности и восстановление её опороспособ-ности. Тщательная остеонекрэктомия с использованием техники Маскуле способствует купированию инфекционного процесса, а 3D-технологии позволяют создать имплантаты, учитывающие индивидуальные размеры дефекта, способствующие восстановлению высоты пяточной кости и биомеханики стопы, насколько это возможно, а также отказаться от использования громоздких ортопедических изделий при относительно непродолжительных сроках лечения.
В ранее представленных вариантах эндопротеза пяточной кости имелись отверстия для фиксации связочного аппарата и ахиллова сухожилия. Поскольку протезирование выполнялось у пациентов с онкологическим поражением пяточной кости, авторами предусматривалось сохранение суставов и движений в них. Подобная конструкция, вероятно, оправдана у пациентов данной группы. Но как показывает практика, пациентам с дистальной нейропатией, осложнённой хроническим инфекционным процессом, неоднократно выполняются хирургические вмешательства с целью ревизии и санации ввиду обострении хронического остеомиелита с формированием свищевых ходов, рецидивирующих флегмон, абсцессов. После подобных вмешательств развивается выраженный рубцовый процесс. В связи с этим нет необходимости при печати протеза планировать отверстия или пазы для фиксации связочного аппарата, который к моменту реконструкции зачастую отсутствует, или ахиллова сухожилия, в месте крепления которого формируется рубцовый блок, имитируя бугристость пяточной кости. Важной особенностью установленных имплантатов было наличие полированной опорной поверхности. К сожалению, в процессе реабилитации мы отметили подобие «скольжения» (трения) мягких тканей относительно импланта. Авторы считают это дополнительным фактором для язвообразования и отказались от полировки опорной поверхности.
Заключение
Применение индивидуальных 3D имплантатов из пористого титана у пациентов с дистальной нейропатией, осложнённой инфекционным процессом, является более простым способом замещения сформированных дефектов в сравнении с техникой одномоментного замещения дефекта заднего отдела стопы и опороспособности конечности и может служить альтернативой ранее используемым методам лечения.


