Зараженность вирусами желтой карликовости ячменя и полосатой мозаики пшеницы сортов озимой ржи (Secale cereale L.), выращиваемых на Среднем Урале
Автор: Печенкина В.А., Наговицына В.О., Васильева Ю.С., Фомин Д.С., Фомин Д., Боронникова С.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Генетика
Статья в выпуске: 1, 2024 года.
Бесплатный доступ
Рожь является стратегически важной культурой в России, которая менее требовательна, чем другие культуры, к плодородию почвы, условиям минерального питания и проведению мероприятий по защите растений. Мониторинг фитосанитарного состояния озимых сортов ржи является необходимой мерой для ее стабильной урожайности. У четырех сортов отечественной селекции Secale cereale L. (‘Ника', ‘Викрас', ‘Паром' и ‘Чусовая'), выращиваемых в условиях Среднего Урала на опытных полях Пермского и Уральского НИИСХ, проведена ПЦР-диагностика вирусных инфекций. Пробы РНК 4 сортов озимой ржи проанализированы методом ПЦР в реальном времени (Real-time) на зараженность вирусом Желтой карликовости ячменя (BYDV - Barley yellow dwart virus) и вирусом Полосатой мозаики пшеницы (VSMV - Wheat streak mosaic virus). У 60% всех исследованных проб листьев озимой ржи был диагностирован вирус Желтой карликовости ячменя, а у 15% исследованных проб - вирус Полосатой мозаики пшеницы. На основании полученных данных можно предположить, что наиболее устойчивым к вирусу Желтой карликовости ячменя листьев оказался сорт озимой ржи ‘Чусовая', т.к. инфицирован только на поле Пермского НИИСХ. Сорта ‘Ника 3', ‘Викрас' и ‘Чусовая' наиболее устойчивы к вирусу Полосатой мозаики пшеницы. Зараженным этим вирусом оказался сорт озимой ржи ‘Паром' (30%). Необходим дальнейший мониторинг фитосанитарной обстановки и проведение профилактики вирусных инфекций сортов озимой ржи на территории Среднего Урала.
Вирус полосатой мозаики пшеницы, вирус желтой карликовости ячменя, пцр-рв, сорта озимой ржи, secale cereale, средний урал
Короткий адрес: https://sciup.org/147243414
IDR: 147243414 | УДК: 632:633 | DOI: 10.17072/1994-9952-2024-1-74-82
Текст научной статьи Зараженность вирусами желтой карликовости ячменя и полосатой мозаики пшеницы сортов озимой ржи (Secale cereale L.), выращиваемых на Среднем Урале
Рожь посевная ( Secale cereale L.) играет важную роль в мировом земледелии как ценная зерновая культура. Ее преимущества заключаются в высокой зимостойкости, возможности давать стабильную урожайность на низкоплодородных почвах, низкой чувствительности к кислотности почвы, т.е. в высокой способности адаптироваться к нестабильным метеорологическим условиям на территориях возделывания, что позволяет выращивать озимую рожь в регионах со сложными почвенно-климатическими условиями [Пономарева и др, 2015; Уткина, Кедрова, 2018; Щеклеина, 2020]. Рожь относится к самым распространённым и наиболее ценным сидератам. Она превосходит другие сидераты по способности эффективно подавлять сорняки и болезни растений из-за особенно быстрого развития. Рожь способна делать суглинистые почвы более лёгкими и водопроницаемым, поскольку она оказывает сильное разрыхляющее действие. Несмотря на все преимущества озимой ржи, в последние годы в России сохраняется тенденция к сокращению ее посевных площадей. В период с 2010 по 2021 гг. площади сократились практически наполовину: в 2010 г. посевные площади ржи составляли 1 757 тыс. га, а уже в 2021 – только 980 тыс. га [Бояркин, Новак, 2021]. Данному явлению способствует множество факторов, в том числе и ухудшение фитосанитарной обстановки [Молекулярно-генетические …, 2012].
Сельскохозяйственные растения поражаются различными патогенными бактериями, грибами, а также вирусами. Заражение вирусами посевов сельскохозяйственных культур может приводить к гибели отдельных сортов. В настоящее время известно более 600 фитопатогенных вирусов, из которых 90 поражают злаковые культуры [Глинушкин и др, 2013]. Основную опасность для выращивания озимой ржи представляют вирусы, переносимые тлями, цикадками и клещами. К таким вирусам относят в том числе вирус Желтой карликовости ячменя (BYDV– Barley yellow dwart virus ) и вирус Полосатой мозаики пшеницы (VSMV – Wheat streak mosaic virus ) [Можаева, 2 002 ].
Характерный признак поражения растения вирусом Желтой карликовости ячменя проявляется в изменении окраски пораженных листьев в цвет от золотисто-желтого до оранжевого. Такая окраска листовой пластинки распространяется от верхушки вниз листа, чаще по краям пластинки. Спустя время листья становятся жесткими, при этом мозаичность и крапчатость отсутствуют. Поражение вирусом Желтой карликовости ячменя молодых растений приводит к интенсивному кущению и карликовости. При этом пораженные растения не достигают половины нормальной высоты, корневая система развита слабо. Колосья часто не образуются, или они короткие и дают незначительный урожай. Пораженные после кущения растения имеют пожелтевшие молодые листья, однако задержки роста не происходит [Дорофеева, Шкаликов, 2007]. Вирус Желтой карликовости ячменя могут передавать около 25 видов тлей. В неблагоприятный период вирус сохраняется в зимующих растениях [Можаева, 2011; Какарека, Волков, Гапека,
-
2015]. Риск заражения сельскохозяйственных культур высок при их раннем посеве осенью из-за увеличения численности инфицированных вирусами тлей или цикадок. Также риск возрастает в случае мягкой и продолжительной осени, когда переносчики вирусов могут активно передавать их на протяжении длительного времени. Это может привести к потере урожая до 70% и более [Можаева, 2012].
Вирус Полосатой мозаики пшеницы распространен во многих районах выращивания злаковых культур, включая регион исследований. Переносчиками инфекции являются галлообразующие клещи Eriophyes [Богоутдинов, Кастальева, Гирсова, 2017]. Первые признаки заражения злаковых культур наблюдаются с осени. В период кущения между жилками листовых пластинок формируется желтоватая или хлоротическая пятнистость. Вскоре пятна сливаются в штрихи и полоски, резко отличающиеся структурой и цветом от здоровой ткани листа. По мере дальнейшего прогрессирования инфекции штрихи образуют крупные продольные полосы, ограниченные только жилками. Пораженные растения отличают по сильному хлорозу, а в некоторых случаях и некрозу листовых пластинок [Маркелова, Кириллова, 20 10] . Растения, зараженные на ранних стадиях развития, не способны к кущению и образованию колоса, но иногда они могут формировать слаборазвитый колос, который, как правило, не выходит из листового влагалища и продуцирует недоразвитые зерна [Глазко, Глазко, 2006]. Заболевание распространено во всех регионах мира, где выращивается пшеница. Урожай снижается на 18–65% [Богоутди-нов, Кастальева, Гирсова, 2017].
Вирусные болезни злаковых растений широко распространены и обладают высокой вредоносностью. При этом у растениеводов возникают трудности диагностики вирозов из-за схожести их вредоносного действия с факторами абиотической природы. Поскольку озимая рожь является стратегически важной культурой, необходимо сократить потери урожая от вирусных заболеваний. В связи с этим требуется проводить мониторинг зараженности злаковых культур, в том числе озимой ржи, вирусными патогенами.
Цель данного исследования – выявление вируса Желтой карликовости ячменя и вируса Полосатой мозаики пшеницы у растений 4 сортов озимой ржи на двух разных опытных полях Пермского и Уральского НИИСХ, расположенных на Среднем Урале на разных склонах Уральских гор, с использованием ПЦР в реальном времени.
Материал и методы исследования
В исследовании были использованы сорта озимой ржи ( Secale cereale L.) отечественной селекции: ‘Ника’, ‘Викрас’, ‘Паром’ и ‘Чусовая’. Озимая рожь относится к перекрестно опыляемым видам, поэтому важен контроль морфологических характеристик и генетического разнообразия ее сортов. Сорт ‘Ника 3’ длинностебельный, высота растений колеблется от 143.0 до 161.0 см. ‘Викрас’ и ‘Чусовая’ – среднестебельные с высотой растений 105–118 см, высота растений сорта ‘Паром’ находится в промежутке от 112 до 153 см. Все исследуемые сорта имеют высокую морозостойкость и семенную продуктивность, которая в среднем составляет 4.5 т/га. Масса 1000 зерен достаточно разнится, от 24 до 45.7 г, при этом у сорта ‘Ника 3’ масса зерен наибольшая – 37.0–45.7 г. Такие сорта как ‘Чусовая’ и ‘Ника 3’ имеют высокую устойчивость к полеганию. Сорт ‘Викрас’ отличается наличием устойчивости к снежной плесени. Сорт ‘Паром’ восприимчив к бурой и стеблевой ржавчине, тогда как сорт ‘Чусовая’ имеет к ним устойчивость [Потапова, Галимов, Зобнина, 2020; Парфенова, 2023; Государственная…, 2024; ФГБНУ…, 2024].
На зараженность вирусом Желтой карликовости ячменя и Полосатой мозаики пшеницы было исследовано 4 сорта озимой ржи, выращиваемых в условиях Среднего Урала, а именно на опытном поле, обозначенном как № 1, Пермского научно-исследовательского института сельского хозяйства «Пермский федеральный исследовательский центр Уральского отделения Российской академии наук» (Пермский НИИСХ – филиал ПФИЦ УрО РАН; Пермский край), и на опытном поле, обозначенном № 2, Уральского научно-исследовательского института сельского хозяйства – филиал Федерального государственного бюджетного научного учреждении «Уральский федеральный аграрный научно-исследовательский центр Уральского отделения Российской академии наук» (Уральский НИИСХ – филиал ФГБНУ УрФАНИЦ УрО РАН, г. Екатеринбург), расположенных на разных макросклонах Уральских гор.
Сбор фрагментов подфлаговых листьев растений для выделения РНК производился в 2023 г. на делянках опытных полей № 1 и 2 у растений генеративного периода. Всего было собрано и проанализировано 80 образцов, т.е. по 40 образцов на каждом опытном поле. Выделение РНК производили из 20 мг гербаризированного растительного материала каждого образца. Концентрацию и качество РНК определяли на спектрофотометре NanoDrop2000 стандартным методом [Шакирова, 2019]. Методом обратной транскрипции РНК вирусов перевели в кДНК в процессе полимеразной цепной реакции в реальном времени (ОТ-ПЦР-РВ), которая была проведена на термоциклере CFX96 (Bio-Rad, USA) с использованием реактивов производства ООО «НПФ Синтол». Наборы реактивов состояли из: реакционной смеси; поло- жительного контрольного образца (ПКО), содержащего фрагменты кДНК; ДНК-полимеразы и обратной транскриптазы (syntaq+RT); отрицательного контрольного образца (ОКО). Набор реагентов позволяет выявлять специфичные фрагменты вируса Желтой карликовости ячменя и вируса Полосатой мозаики пшеницы. По каналу флуоресценции FAM (синий) качественно определяется наличие в пробе РНК вируса. Второй канал флуоресценции HEX (зеленый) необходим для внутреннего положительного контроля [Артемьева, Карпухин, 201Ошибка! Источник ссылки не найден.9]. Каждая проба была проанализирована индивидуально.
ПЦР-РВ проведена при условиях, предусмотренных в инструкции производителя ООО «НПФ Син-тол». Интерпретация результатов ОТ-ПЦР-РВ была проведена в программе Bio-Rad CFX Manager по инструкции компании ООО «НПФ Синтол».
Результаты и обсуждение
Для диагностики вирусной инфекции в пробах ДНК четырех сортов озимой ржи был применен метод ОТ-ПЦР-РВ. Наличие в пробе РНК вируса Желтой карликовости было определено по росту флюоресценции по каналу флюоресценции FAM (линия синего цвета). Рост по каналу флюоресценции HEX (линия зеленого цвета) свидетельствует об успешности процесса амплификации ПЦР в реальном времени, что показало наличие РНК вируса Желтой карликовости ячменя в двух пробах озимой ржи сорта ‘Вик-рас’, собранных с опытного поля № 2 (рис. 1), поскольку был зафиксирован рост по каналу флюоресценции FAM . Амплификация в пробах сорта ‘Викрас’ прошла успешно, поскольку виден рост по каналу флюоресценции HEX .
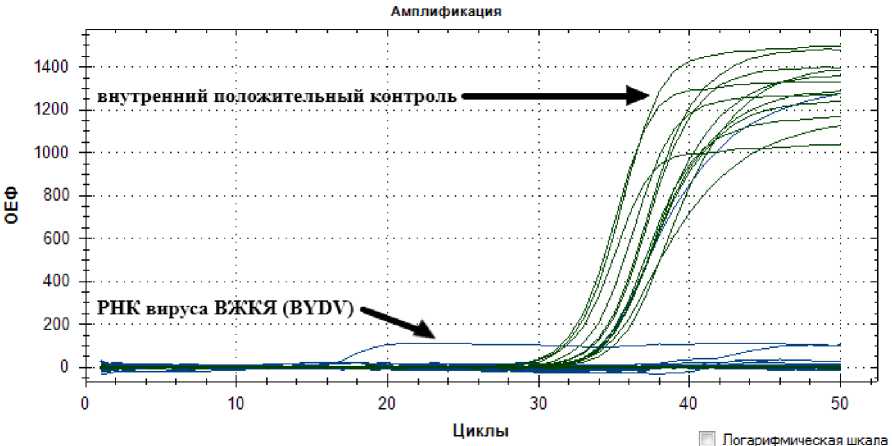
Рис. 1. Кинетические кривые флуоресценции проб РНК вируса Желтой карликовости ячменя (ВЖКЯ), выделенных из листьев сорта ‘Викрас’ с опытного поля Уральского НИИСХ (поле № 2). Цвета, соответствующие каналам детекции флуоресценции: FAM (РНК вируса Желтой карликовости ячменя (Barley yellow dwart virus) – синий, HEX (внутренний положительный контроль) – зеленый; ОЕФ – относительные единицы флуоресценции, циклы – циклы амплификации
[Kinetic fluorescence curves of RNA samples of barley yellow dwarf virus (BYDV) isolated from the leaves of the ‘Vikras’ variety from the experimental field of the Ural NIISH (field № 2) ]
На рис. 2 виден рост флюоресценции по каналу FAM (линии синего цвета) у 5 образцов, что свидетельствует о наличии вирусной инфекции в этих пробах. Амплификация в данных пробах прошла успешно, о чем свидетельствует рост кривых флюоресценции по каналу HEX. В связи с этим 5 из 10 исследуемых проб у образцов сорта ‘Чусовая’, собранных на опытном поле № 1, инфицированы вирусом Желтой карликовости ячменя.
Наличие РНК вируса Полосатой мозаики пшеницы в пробах РНК, проанализированных в ПЦР-РВ, иллюстрируется ростом по каналу флюоресценции FAM (линии синего цвета), а успешно прошедшая амплификация демонстрируется ростом по каналу флюоресценции HEX (линии зеленого цвета). Данный вирус был обнаружен лишь в исследованных пробах озимой ржи сорта ‘Паром’, собранных на опытных полях № 1 и № 2 (см. таблицу). На рис. 3 можно заметить рост сигнала флюоресценции по каналу FAM у 4 проб озимой ржи сорта ‘Паром’, собранных на опытном поле № 1, что свидетельствует о наличии в этих пробах РНК вируса Полосатой мозаики пшеницы.
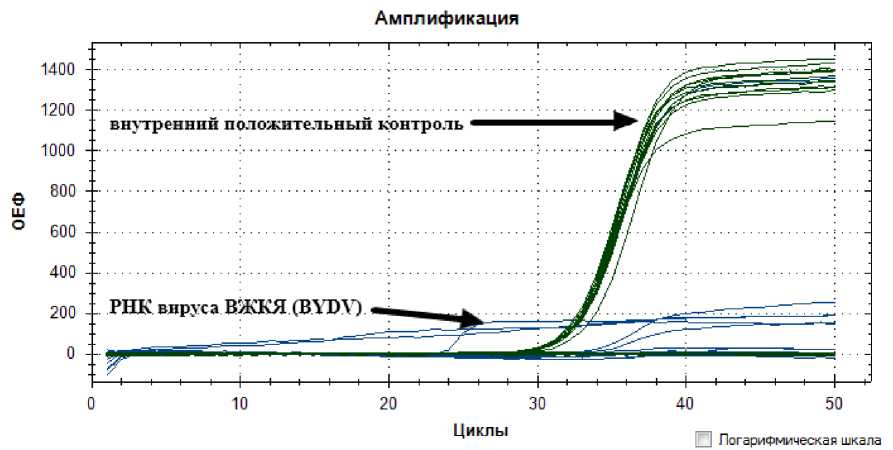
Рис. 2. Кинетические кривые флуоресценции проб РНК вируса Желтой карликовости ячменя (ВЖКЯ), выделенных из листьев сорта ‘Чусовая’ с опытного поля Пермского НИИСХ (поле № 1). Цвета, соответствующие каналам детекции флуоресценции: FAM (РНК вируса Желтой карликовости ячменя (Barley yellow dwart virus) – синий, HEX (внутренний положительный контроль) – зеленый; ОЕФ – относительные единицы флуоресценции, циклы – циклы амплификации
[Kinetic fluorescence curves of RNA samples of barley yellow dwarf virus (BYDV) isolated from the leaves of the ‘Chusovaya’ variety from the experimental field of the Perm NIISH (field № 1) ]
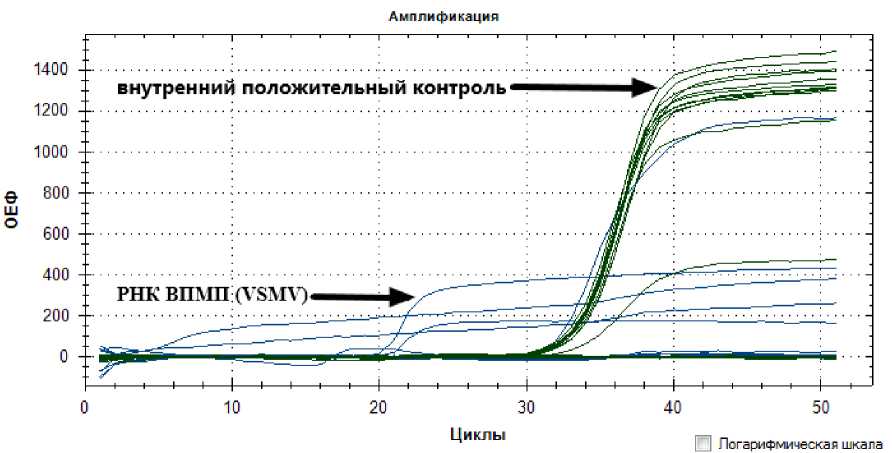
Рис. 3. Кинетические кривые флуоресценции проб РНК вируса Полосатой мозаики пшеницы (ВПМП), выделенных из листьев сорта ‘Паром’ с опытного поля Пермского НИИСХ (поле № 1). Цвета, соответствующие каналам детекции флуоресценции: FAM (РНК вируса Полосатой мозаики пшеницы (Wheat streak mosaic virus)) – синий, HEX (внутренний положительный контроль) – зеленый; ОЕФ – относительные единицы флуоресценции, циклы – циклы амплификации
[Kinetic fluorescence curves of RNA samples of wheat streak mosaic virus (VSMV) isolated from the leaves of the ‘Parom’ variety from the experimental field of the Perm NIISH (field № 1) ]
В ходе лабораторных исследований образцов РНК с поля №1 было обнаружено наличие РНК вируса Желтой карликовости ячменя в 18 пробах (45% от всех исследованных проб с этого поля). Наибольшее число зараженных проб на поле № 1 выявили в сорте ‘Паром’ (60%), а наименьшее – у сорта ‘Викрас’ (20%), сорта ‘Ника 3’ и ‘Чусовая’ были наполовину поражены данной инфекцией (таблица).
На опытном поле № 2 вирусом Желтой карликовости ячменя не было обнаружено заражения только в пробах сорта ‘Чусовая’, при этом все остальные сорта оказались заражены данным вирусом в 20% исследованных проб. Исследуемые образцы с опытного поля № 1 в 3 раза больше заражены вирусом Желтой карликовости ячменя, чем образцы, полученные с опытного поля № 2. Самым восприимчивым к данному вирусу оказался сорт ‘Паром’, поскольку каждая пятая проба в общей выборке данного сорта оказалась заражена данным вирусом. Наличие РНК вируса Желтой карликовости ячменя обнаружилось в 60% исследованных проб озимой ржи с двух опытных полей, т.е. больше половины проб оказались заражены этим вирусом.
Зараженность вирусом Желтой карликовости ячменя и вирусом Полосатой мозаики пшеницы проб 4 сортов озимой ржи, выращиваемых на опытных полях Пермского НИИСХ и Уральского НИИСХ (n = 80)
[Infection with the Barley yellow dwarf virus and the Wheat streak mosaic virus samples of 4 varieties of winter rye grown in the experimental fields of the Perm NIISH and the Ural NIISH (n = 80)]
|
Место сбора образцов |
Сорта озимой ржи |
Наличие вирусной инфекции, в % (от исследованных проб) |
|||
|
‘Ника 3’ |
‘Паром’ |
‘Викрас’ |
‘Чусовая’ |
||
Вирус Желтой карликовости ячменя листьев ( BYDV– Barley yellow dwarf virus)
|
Опытное поле № 1 (n=40) |
50 |
60 |
20 |
50 |
45 |
|
Опытное поле № 2 (n=40) |
20 |
20 |
20 |
- |
15 |
|
На общую выборку |
35 |
40 |
20 |
25 |
60 |
Вирус Полосатой мозаики пшеницы (VSMV – Wheat streak mosaic virus)
|
Опытное поле № 1 (n=40) |
- |
20 |
- |
- |
5 |
|
Опытное поле № 2 (n=40) |
- |
40 |
- |
- |
10 |
|
На общую выборку |
- |
30 |
- |
- |
15 |
Примечание. Опытное поле № 1 – Пермский НИИСХ, опытное поле № 2 – Уральский НИИСХ.
В результате анализа на зараженность исследуемых проб сортов озимой ржи вирусом Полосатой мозаики пшеницы установлено, что на двух опытных полях данная инфекция присутствует только в образцах сорта ‘Паром’ (таблица). При этом наибольшее заражение приходится на образцы с поля № 2, поскольку инфекция в пробах сорта ‘Паром’ с данного места сбора встречается в 2 раза чаще, чем в образцах этого сорта с опытного поля № 1. Наличие РНК вируса Полосатой мозаики пшеницы было обнаружено в 15% от исследованных проб озимой ржи с опытных полей. Одновременное присутствие двух вирусов обнаруживается только в пробах озимой ржи сорта ‘Паром’ независимо от места сбора образцов.
Исследование злаковых культур на зараженность вирусами обычно проводят двумя методами: имму-ноферментного анализа (ИФА) и ПЦР. К недостаткам метода ИФА можно отнести трудоемкость и длительность анализа (занимает около двух суток) и невозможность использования этого метода с сухими семенами. Преимуществом метода ПЦР является возможность идентифицировать наличие вирусной инфекции на ранних стадиях развития вироза, а также его длительность анализа и возможность работать с сухими семенами [Кириллов, 2023]. Метод ПЦР, а именно его модификация ПЦР с обратной транскрипцией, в настоящее время является основным методом обнаружения вирусов в растительном материале [Звягинцева, 2021].
В 2013 г. вирусы Желтой карликовости ячменя и Полосатой мозаики были обнаружены на Южном Урале у озимой пшеницы при помощи визуальной и молекулярно-генетической диагностики [Глинуш-кин, Райов, Белошапкина, 2013]. Также в 2013 г. в условиях Оренбургского Предуралья методом ПЦР был обнаружен вирус Полосатой мозаики пшеницы у сортообразцов озимой пшеницы.
По данным проведенного исследования, наиболее устойчивым к вирусу Желтой карликовости ячменя листьев является сорт озимой ржи ‘Чусовая’, т.к. инфицирован только на поле № 1. Кроме этого, по литературным данным этот сорт устойчив и к бурой и стеблевой ржавчине [Потапова, Галимов, Зобнина, 2020; Государственная …, 2024]. Установлено, что сорта ‘Ника 3’, ‘Викрас’ и ‘Чусовая’ не инфицированы вирусом полосатой мозаики пшеницы ни на одном из двух опытных полей, поэтому они наиболее устойчивы к этому вирусу.
В литературе имеются данные о том, что зараженный вирусами посадочный материал теряет свою продуктивность [Глинушкин и др., 2013]. В связи с этим необходимо проводить мониторинг зараженности озимой ржи вирусами и различные профилактические меры. К мерам профилактики заражения вирусами Желтой карликовости ячменя и Полосатой мозаики пшеницы можно отнести своевременную обработку инсектицидами, чтобы сократить численность переносчиков данных вирусов (тлей и цикадок).
Заключение
Проведена молекулярно-генетическая диагностика зараженности вирусами Желтой карликовости ячменя и Полосатой мозаики пшеницы 4 сортов озимой ржи отечественной селекции, произрастающих в условиях Среднего Урала на опытных полях № 1 Пермского НИИСХ и № 2 Уральского НИИСХ. С использованием метода ОТ-ПЦР-РВ были обнаружены зараженные данными вирусами образцы озимой ржи. Наибольшее число исследованных проб инфицированы вирусом Желтой карликовости ячменя (60% исследованных образцов). При этом число зараженных проб больше на опытном поле № 1 (40%), чем на поле № 2 (30%). Наиболее восприимчивым к вирусу Желтой карликовости ячменя из исследованных сортов оказался сорт озимой ржи ‘Паром’. Сорт ‘Паром’ оказался также восприимчив к вирусу Полосатой мозаики пшеницы, поскольку оказался единственным сортом, зараженным данным вирусом из исследованных сортов. При этом зараженность проб озимой ржи вирусом Полосатой мозаики пшеницы на поле № 2 выше, чем на поле № 1. Это может быть связано с завозом сорта ‘Паром’ на территорию опытного поля № 1 с опытного поля № 2. По данным проведенного исследования, наиболее устойчивым к вирусу Желтой карликовости ячменя листьев является сорт озимой ржи ‘Чусовая’, так как инфицирован только на поле № 1. Сорта ‘Ника 3’, ‘Викрас’ и ‘Чусовая’ наиболее устойчивы к вирусу Полосатой мозаики пшеницы, т.к. они не инфицированы этим вирусом ни на одном из двух опытных полей. Необходим дальнейший мониторинг зараженности данными вирусами злаковых культур на территории Среднего Урала. На исследованных территориях рекомендуется производить обработку инсектицидами во избежание дальнейшего распространения вирусов. Кроме этого, необходимо производить мониторинг переносчиков вирусов. В дальнейшем рекомендуется возделывание устойчивых к вирусам сортов зерновых культур, включая озимую рожь.
Список литературы Зараженность вирусами желтой карликовости ячменя и полосатой мозаики пшеницы сортов озимой ржи (Secale cereale L.), выращиваемых на Среднем Урале
- Артемьева Т.А., Карпухин М.Ю. Сравнение методов ИФА и ПЦР анализа при определении вирусной патологии у растений картофеля // Молодежь и наука. 2019. № 7-8. С. 35.
- Богоутдинов Д.З., Кастальева Т.Б., Гирсова Н.В. Вирусные заболевания зерновых культур в Самарской области // Вестник ОГУ. 2017. № 4. С. 46-52.
- Бояркин Е.В., Новак С.О. Современное состояние производства озимой ржи // Актуальные вопросы агропромышленного комплекса России и за рубежом: материалы всерос. науч.-практ. конф. Иркутск, 2021. С. 29-37.
- Глазко В.И., Глазко Т.Т. ДНК технологии в генетике и селекции. Краснодар, 2006. 399 с.
- Глинушкин А.П., Райов А.А., Белошапкина О.О. Практические аспекты вирусологического обследования озимой пшеницы на Южном Урале //Аграрный вестник Урала. 2013. № 7 (113). С. 4-8.
- Глинушкин А.П. и др. Диагностика вирусных симптомов у сортообразцов озимой пшеницы из коллекции ВНИИР // Достижения науки и техники АПК. 2013. № 2. С. 24-26.
- Государственная комиссия Российской Федерации по испытанию и охране селекционных достижений // Государственный реестр селекционных достижений, допущенных к использованию. Т. 1. Сорта растений. URL: https://reestr.gossortrf.ru (дата обращения: 28.01.2024).
- Дорофеева Л.Л., Шкаликов В.А. Болезни зерновых культур. М.: Печатный город, 2007. 96 с.
- Звягинцева Д.Д. Методы лабораторной диагностики почвообитающих вирусов зерновых культур // Материалы Всерос. с междунар. участием науч. конф. молодых учёных и специалистов. М., 2021. С. 384387.
- Какарека Н.Н., Волков Ю.Г., Гапека А.В. Желтая карликовость ячменя и ее переносчики в Приморском крае // Защита и карантин растений. 2015 №. 8. С. 49-50.
- Кириллов В.В. Применение метода полимеразной цепной реакции для исследования растительных патогенов // Фундаментальные и прикладные исследования в науке и образовании: сб. статей. Уфа, 2023. С. 5-8.
- Маркелова Т.С., Кириллова Т.В. Вирусные болезни пшеницы // Защита и карантин растений. 2010. № 4. С. 21-23.
- Можаева К.А. Итоги изучения желтой карликовости ячменя // Известия Тимирязевской сельскохозяйственной академии. 2011. № 1. С. 24-33.
- Можаева К.А. Современные проблемы иммунитета растений к вредным организмам // Желтая карликовость ячменя: материалы III Всерос. и Междунар. конф. СПб., 2012. С. 32-34.
- Молекулярно-генетические и биохимические методы в современной биологии растений / под ред. Вл.В. Кузнецова, В.В. Кузнецова, Г.А. Романова. М.: Бином. Лаб. знаний, 2012. 487 с.
- Оптимизация методики выделения ДНК некоторых хвойных видов растений Пермского края / Ю.С. Нечаева и др. // Синтез знаний в естественных науках. Родник будущего: проекты, технологии, оборудование: материалы Междунар. конф. Пермь, 2011. С. 278-282.
- Парфенова Е.С. Источники селекционно-ценных признаков для создания сортов озимой ржи с высоким потенциалом урожайности в условиях Кировской области // Актуальные вопросы развития отраслей сельского хозяйства: теория и практика: материалы V Всерос. науч.-практ. конф молодых ученых АПК. п. Рассвет, 2023. С. 147-151.
- Пономарева М.Л. и др. Результаты селекции озимой ржи на устойчивость к болезням и продуктивность в НИИСХ Северо-Востока // Вестник КрасГАУ. 2015. № 6. С. 1-9.
- Потапова Г.Н., Галимов К.А., Зобнина Н.Л. Продуктивность и адаптивность сортов озимой ржи на Среднем Урале // Достижения науки и техники АПК. 2020. Т. 34, № 10. С. 28-33.
- Уткина Е.И., Кедрова Л.И. Зимостойкость озимой ржи: проблемы и решения // Аграрная наука Евро-Северо-Востока. 2018. № 1(62). С. 11-18.
- ФГБНУ «Уральский федеральный аграрный научно-исследовательский центр УрО РАН». URL: https:// urfanic.ru (дата обращения: 28.01.2024).
- Шакирова А.Р. Подбор эффективных ISSR-праймеров для редких видов растений Pulsatilla fla-vescens (Zucc.) Juz. и Pulsatilla patens (L.) Mill. // Симбиоз-Россия 2019: материалы XI Всерос. конгресса молодых ученых-биологов с междунар. участием. Пермь, 2019. С. 162-164.
- Щеклеина Л.М. Мониторинг болезней озимой ржи в Кировской области и возможные направления селекции на иммунитет // Аграрная наука Евро-Северо-Востока. 2020. Т. 21, № 2. С. 124-132.
- Эффективность экономики России: Федеральная служба государственной статистики. URL: http://rosstat.gov.ru (дата обращения: 25.01.2024).
- Rogers S.O., Bendich A.J. Extraction of DNA from milligram amounts of fresh, herbarium and mummifi ed plant tissues // Plant Molecular Biology. 1985. Vol. l, № 19. P. 69-76.


