Защита головного мозга и внутренних органов при реконструктивных вмешательствах на дуге аорты: особенности интраоперационной тактики и мониторинга
Автор: Белов Ю.В., Чарчян Э.Р., Аксельрод Б.А., Гуськов Д.А., Федулова С.В., Еременко А.А., Скворцов А.А., Хачатрян Зара Рубеновна, Медведева Л.А., Ойстрах А.С.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Хирургия дуги аорты
Статья в выпуске: 4 т.20, 2016 года.
Бесплатный доступ
Цель Представить и оценить эффективность протокола интраоперационной органопротекции пациентов при реконструкциях дуги аорты. Оценить частоту послеоперационных осложнений в данной группе больных. Методы В исследовании участвовали 141 пациент. Больным I группы (n = 70) выполнили реконструктивные вмешательства на дуге аорты в условиях антеградной перфузии головного мозга и циркуляторного ареста (центральная температура тела 26 °C). Пациентов II группы (n = 71) оперировали на восходящем отделе аорты (центральная температура тела 32 °C). Во всех случаях проводили интраоперационный мониторинг тканевой и церебральной оксигенации, пациентам первой группы выполняли транскраниальную допплерографию. 33 пациентам первой группы и 34 больным второй после операции осуществляли анализ когнитивных нарушений. Состояние пациентов оценивали в течение госпитального периода, который в среднем составил 15,97±20,54 сут. результаты Госпитальная летальность составила 4,2% в I группе и 0% во II группе (p = 0,12). Частота инсульта - 1,4% в первой и 0% во второй группе. Энцефалопатию в качестве ведущего симптома наблюдали в 7,1 и 5,6% случаев соответственно. Мультимодальный мониторинг позволил динамически оценивать и корректировать объемную скорость антеградной перфузии головного мозга. Благодаря этому показатели SctO2, а также линейная скорость сохранялись в пределах допустимых значений. Заключение Представленный протокол органопротекции позволяет выполнять вмешательства на дуге аорты с циркуляторным арестом, сопоставимые по частоте послеоперационных неврологических осложнений с операциями на восходящем отделе аорты. Мы рекомендуем проводить реконструкцию дуги аорты в условиях умеренной гипотермии (26-28 °С) и селективной антеградной перфузии головного мозга. Ключевыми моментами во время подобных операций являются быстрое выполнение дистальной части реконструкции с максимально быстрым началом согревания пациента (что позволит сократить общую продолжительность искусственного кровообращения и, как следствие, снизить частоту послеоперационных осложнений) и тщательный интраоперационный мониторинг как состояния головного мозга (совместное использование церебральной оксиметрии и транскраниальной допплерографии), так и центральной температуры тела.
Протезирование дуги аорты, антеградная перфузия головного мозга, циркуляторный арест, гипотермия
Короткий адрес: https://sciup.org/142140767
IDR: 142140767 | DOI: 10.21688-1681
Текст научной статьи Защита головного мозга и внутренних органов при реконструктивных вмешательствах на дуге аорты: особенности интраоперационной тактики и мониторинга
Разработка и внедрение в практику глубокой гипотермии в середине 1970-х гг. Borst H.B. и Griepp R.B. являлась прорывом в лечении патологии грудной аорты, в настоящее время подобные операции стали рутинными во многих лечебных центрах [1, 2]. Прогресс хирургической техники, интраоперационной органопротек- ции, мониторинга, а также анестезиологического и перфузионного обеспечения способствовал значительному снижению хирургической летальности и частоты послеоперационных осложнений. Так, сердечно-сосудистая хирургия сделала шаг к более радикальным вмешательствам при лечении тяжелой группы пациентов с патологией всей аорты. Тем не менее существует значительная гетерогенность в результатах подобных
Статья доступна по лицензии Creative Commons Attribution 4.0.
вмешательств в различных хирургических центрах. Согласно данным Urbanski P. и соавт., госпитальная летальность при операциях на дуге аорты составляет в среднем 11,4% (варьируя от 1,7 до 19,0%), частота инсульта равна 5,7%, параплегии — 1,1%, дыхательной недостаточности — 21,3%, почечной — 8,8% [3].
Интраоперационная тактика при реконструкциях дуги аорты по-прежнему вызывает разногласия, единых стандартизированных протоколов подобных вмешательств не существует. Ключевые аспекты в хирургии дуги аорты — селективная антеградная перфузия головного мозга (АПГМ) во время циркуляторного ареста (ЦА) и выбор оптимального уровня гипотермии при искусственном кровообращении (ИК). В рекомендациях Американского колледжа кардиологов (American College of Cardiology, ACC) и Американской ассоциации сердца (American Heart Association, AHA) по диагностике и лечению пациентов с патологией аорты эти методы защиты головного мозга и внутренних органов признаны оптимальными в хирургии аорты (класс IIa, уровень доказательности В) [4]. С начала разработки гипотермии и перфузии головного мозга провели большое количество исследований с целью сравнения эффективности и рисков той или иной тактики ведения больных, тем не менее нет единого подхода к защите головного мозга среди ведущих центров, занимающихся патологией дуги аорты. Недавно одни хирурги пропагандировали ЦА при гипотермии 10–13 °С [5], другие применяли ретроградную 8–10-градусную перфузию головного мозга при гипотермии 8–12 °С [6]. Некоторые авторы предлагают АПГМ с температурой перфузата 8–10 °С, в то время как ЦА осуществляют при гипотермии 25–28 °С [7]. Однако наиболее распространенной тактикой при операциях на дуге аорты является АПГМ перфузатом 22–28 °С при умеренной гипотермии (26–28 °С) [8]. Также следует отметить тенденцию к вмешательствам на дуге аорты при целевой температуре 30 °С и выше, что в центрах, обладающих не столь значительным опытом реконструкций на дуге аорты, может быть ассоциировано с повышенным риском послеоперационных осложнений [9].
Цель исследования: представить и оценить эффективность протокола хирургического и анестезиологического обеспечения реконструкций дуги аорты, разработанного в РНЦХ им. Б.В. Петровского на основе многолетнего опыта подобных операций.
Методы
В данном ретроспективном контролируемом нерандомизированном исследовании участвовал 141 пациент, оперированный в РНЦХ им. акад. Б.В. Петровского с января 2013 г. по апрель 2016 г. (Москва, Россия). Исследование одобрено локальным этическим комитетом РНЦХ им. акад. Б.В. Петровского. Все пациенты до включения в исследования подписали согласие на обработку данных и результатов лечения с целью дальнейшего использования в ретроспективном анализе. Пациенты также подписали информированные согласия при проведении тестов на когнитивную функцию. Пациенты были сопоставимы по антропометрическим параметрам, возрасту и сопутствующим заболеваниям, данные представлены в табл. 1. Больные имели сниженные показатели физического статуса согласно классификации Американской ассоциации анестезиологов (American Society of Anaesthesiologists (ASA): (III–IV) и относились к группе высокого анестезиологического риска (IV по классификации МНОАР).
В I группу (n = 70) вошли пациенты, которым выполнили реконструктивные вмешательства на дуге аорты (изолированные или в сочетании с тем или иным вариантом операций на восходящей аорте) в условиях гипотермии (целевая температура 26 °С), ЦА и АПГМ. Пациентам
Таблица 1 Антропометрические данные пациентов и сопутствующая патология
|
Параметр |
I группа, n = 70 |
II группа, n = 71 |
|
Возраст, лет |
52,0±10,1 (25,0–71,0) |
59±11,0 (39,0–74,0) |
|
Мужчины/женщины, n |
46/24 |
51/20 |
|
Синдром дисплазии соединительной ткани, % |
28,6 |
15,5 |
|
Артериальная гипертензия, % |
85,7 |
76,1 |
|
Сахарный диабет, % |
14,3 |
7,0 |
|
Ишемическая болезнь сердца, % |
20,0 |
21,2 |
|
Острое нарушение мозгового кровообращения в анамнезе, % |
7,1 |
1,4 |
|
Хроническая обструктивная болезнь легких, % |
15,7 |
12,7 |
|
Хроническая болезнь почек, % |
14,3 |
12,7 |
Таблица 2 Параметры оперативных вмешательств
|
А — варианты вмешательств в обеих группах |
Б — параметры операций |
|||
|
I группа, n = 70 |
n |
Параметр |
I группа |
II группа |
|
Протезирование полудуги (hemiarch) |
17 |
Длительность искусствен- |
||
|
Протезирование дуги аорты |
8 |
ного кровообращения*, мин |
162±41 |
101±35 |
|
Операция Borst |
31 |
|||
|
Операция Frozen Elephant Trunk |
14 |
Длительность инфар- |
103±40 |
81±36 |
|
из них E-vita |
7 |
кта миокарда*, мин |
||
|
Thoraflex |
1 |
|||
|
интраоперационное стентирование |
6 |
Температурный режим ис- |
||
|
Из всех операций в группе в сочетании с: |
кусственного кровообра- |
26,3±1,4 |
32,5±2,3 |
|
|
20 |
щения*, Т центральная, °С |
|||
|
протезированием восходящего отдела аорты |
||||
|
11 |
Антеградная перфу- |
|||
|
протезированием восходящей аорты и пластикой аортального клапана |
зия головного мозга в со- |
|||
|
операцией Bentall – DeBono / раздельным протезирова- |
32 (25/7) |
четании с циркулятор- |
41±15,3 |
– |
|
нием аортального клапана и восходящей аорты |
ным арестом, мин |
|||
|
операцией David |
7 |
|||
|
реваскуляризацией миокарда |
15 |
Примечание . * — между группами р<0,05 |
||
|
пластикой митрального / трикуспидального клапана |
1/1 |
|||
|
Всего повторных операций |
8 |
|||
|
II группа, n = 71 |
n |
|||
|
Протезирование восходящего отдела аорты |
13 |
|||
|
Операция Bentall – DeBono / раздельное протезирова- |
43 (37/6) |
|||
|
ние аортального клапана и восходящей аорты |
||||
|
Операция David |
15 |
|||
|
Из всех операций в группе в сочетании с: |
||||
|
реваскуляризацией миокарда |
15 |
|||
|
каротидной эндартерэктомией |
1 |
|||
|
пластикой митрального / трикуспидального клапана |
3/2 |
|||
II группы (n = 71) провели различные варианты операций на восходящем отделе аорты (Bentall – DeBono, David и др.) в условиях ИК при целевой температуре 32 °С. Спектр вмешательств представлен в табл. 2.
Во всех случаях проводили сбалансированную многокомпонентную анестезию на основе пропофола, мидазолама, кетамина, фентанила и севофлурана. Поддержание миоплегии осуществляли дробным введением пипекурония бромида. С целью защиты миокарда использовали кардиоплегические растворы «Консол» или «Кустодиол» в I группе, во II группе пациентов с 2016 г. применяли кровяную кардиоплегию. В первой группе выбрали тактику distal-first, при которой формируют дистальный анастомоз на ЦА, после чего возобновляют ИК и начинают согревание пациента во время реконструкции корня аорты. Пациентам, перенесшим протезирование дуги аорты или операцию Borst, имплантацию брахиоцефальных ветвей на единой площадке выполнили в 20 случаях, протезирование ветвей дуги осуществили у 33 больных. Проводили АПГМ через баллонные катетеры в моно- или бигемисферальном режиме, начиная с объемной скорости 10 мл/кг/мин. С помощью транскраниальной допплерографии (ТКД) и церебральной оксиметрии (ЦО) в I группе выполняли коррекцию объемной скорости и оценку ее адекватности, а также необходимости перехода с моно- на бигемисферальную АПГМ. Фармакологическую защиту в период ЦА осуществляли с помощью натрия тиопентала, маннитола, β-адреноблокаторов, блокаторов кальциевых каналов, кортикостероидных гормонов, мекси-дола, лидокаина и др. Во время ИК у больных I группы выполняли ультрадиафильтрацию.
Интраоперационный мониторинг в I группе проводили несколькими методами. При ТКД («АНГИО-ДИН-2К», БИОСС, Россия) выполняли двухканальный билатеральный мониторинг кровотока в среднемозговой артерии с автодетекцией микроэмболии. При естественном кровообращении оценивали максимальную систолическую скорость кровотока (Vs, cм/с), индекс периферического сопротивления (PI). Во время ИК и АПГМ измеряли максимальную линейную скорость кровотока (Vm, см/с), которую поддерживали на уровне не менее 20 см/с. Анализировали симметричность кровотока по обеим среднемозговым артериям, допустимой считали асимметрию кровотока не более 25%. Также осуществляли мониторинг региональной оксигенации для оценки церебральной оксигенации (SсtO2) (лазерный тканевой оксиметр FORE-SIGHT™, CAS Medical System's™, США). С целью управления температурой тела у всех больных использовали водяной матрас Hico-Aquatherm 660 (Hitrz, Германия). У больных I группы дополнительно применяли воздушное подогревающее устройство Bair Hugger (3М, США) с матрасом, расположенным под пациентом. Согревание больных начинали при поступлении в операционную (целевая центральная температура 36 °С) и продолжали до ИК. После основного этапа во время ИК согревание больных осуществляли ступенчато, параллельно росту температуры в теплообменнике аппарата ИК. Мониторинг центральной температуры проводили в мочевом пузыре и носоглотке. Дополнительно мониторировали периферическую температуру (термодатчик располагался на подушечке указательного пальца правой руки).
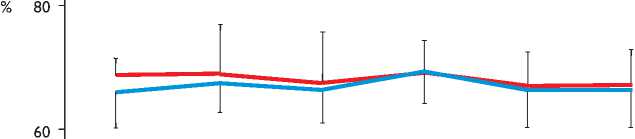
Анализ описанных выше показателей проводили исходно, после введения гепарина, в начале, середине и конце ИК, а также через 15 мин после введения протамина. Отдельно оценивали показатели во время АПГМ (5, 15 и 30 мин АПГМ, на этапе согревания 34 °С и через 15 мин после протамина) (рис. 1, 2). Состояние пациентов отслеживали в течение госпитального периода, который в среднем составил 15,97±20,54 сут.
Оценка когнитивных функций
В предоперационном периоде на 1-е и 3-е послеоперационные сутки 33 пациентам из I группы проводили психометрические тесты. Для этого выбрали тесты рисования часов, «информация – память – концентрация внимания» и на кратковременную зрительную память.
-
■ Левое полушарие / Left hemisphere
40 т
■ Правое полушарие / Right hemisphere
ИК начало / Start of CPB
15 мин АПГМ /
15 minutes of antegrade cerebral perfusion
Окончание АПГМ / End of antegrade cerebral perfusion
5 мин ИК / Согревание ИК конец/
5 minutes 34 °С / End of CPB of CPB Warming
34°C
Рис. 1. Церебральная оксигенация во время антеградной перфузии головного мозга (АПГМ). ИК — искусственное кровообращение
Fig. 1. Cerebral oxygenation during antegrade perfusion of the brain. CPB — cardiopulmonary bypass мл/кг 20 -J ml/kg
15 1
10 1

Минимум / Minimum
■ Менялась / Changed
Максимум / Maximum
-
■ Не менялась / Did not change
Рис. 2. Вариабельность объемной скорости (ОС) во время антеградной перфузии головного мозга
Fig. 2. Flow rate variability during antegrade cerebral perfusion
На тесте рисования часов пациенту дают карандаш и чистый лист нелинованной бумаги и просят изобразить круглые часы, поставить цифры в нужные позиции циферблата и нарисовать стрелки, показывающие заданное время. Результат теста менее 10 баллов свидетельствует о когнитивных расстройствах. В тесте «информация – память – концентрация внимания» 24 вопроса и 2 задания, в том числе на персональную и неперсональную память. Правильный ответ оценивают в один балл, за исключением пунктов, где указана иная система оценки в баллах. Максимальный балл — 42, чем меньше баллов, тем выше нарушения памяти и внимания. Тест на кратковременную зрительную память: испытуемые за 20 с должны запомнить, а затем воспроизвести максимальное количество чисел из 12 предъявленных в таблице . По количеству правильно воспроизведенных чисел оценивают кратковременную зрительную память. Средний уровень выполнения теста — 6-7 единиц.
Статистический анализ
Данные представлены в виде M±SD (средняя арифметическая ± стандартное квадратическое отклонение). Различия считали достоверными при p<0,05. Для выявления различия между средними значениями двух независимых нормально распределенных выборок использовали t-критерий Стьюдента. Для бинарных исходов вычисляли критерий χ2. Для связанных выборок использовали ранговый критерий Уилкоксона. Статистический анализ проводили при помощи пакета программ Statistica 7.0 for Windows (StatSoft, США).
Результаты
Госпитальная летальность составила 4,2% в I группе, во II группе летальных исходов не было. Спектр послеоперационных осложнений в обеих группах представлен в табл. 3.
Закономерным последствиeм ЦА были более высокая частота дыхательной и полиорганной недостаточности в I группе. Подобные осложнения свидетельствуют о необходимости органопротективных технологий во время операций на дуге аорты. Частота почечной недостаточности, требующей гемодиализа, достоверно не различалась, что свидетельствует о достаточной защите почек.
По данным интраоперационного мониторинга, у больных I группы до АПГМ, а также пациентов II груп-
Таблица 3 Периоперационные осложнения
|
Осложнение |
I группа, n = 70 |
II группа, n = 71 |
|
Рестернотомия по поводу кровотечения, n (%) |
5 (7,1) |
2 (2,8) |
|
Дыхательная недостаточность, n (%)* |
20 (28,6) |
9 (12,7) |
|
Почечная недостаточность, n (%)* |
6 (8,6) |
1 (1,4) |
|
Полиорганная недостаточность, n (%)* |
5 (7,1) |
0 |
|
Инфаркт миокарда, n (%) |
0 |
1 (1,4) |
|
Инсульт, n (%) |
1 (1,4) |
0 |
|
Энцефалопатия на фоне соматических нарушений, n (%)* |
9 (12,8) |
2 (2,8) |
|
Энцефалопатия — ведущий симптом, n (%) |
5 (7,1) |
4 (5,6) |
|
Раневые осложнения, n (%) |
5 (7,1) |
1 (1,4) |
|
Бактериальный эндокардит, n (%) |
0 |
2 (2,8) |
|
Диспозиция гибридного стента, n (%) |
1 (1,4) |
0 |
|
Госпитальная летальность, n (%) |
3 (4,2) |
0 |
Примечание. * — между группами, р<0,05
пы на протяжении операции не отметили эпизодов падения SсtO2 ниже нормы (рис. 1). Однако в обеих группах SсtO2 уменьшался после введения гепарина, во время ИК, с возращением к исходному уровню к концу операции. Выраженной межполушарной асимметрии показателей церебральной оксиметрии не наблюдали.
Случаев с выраженной энцефалопатией (как изолированной, так и на фоне соматических нарушений) ожидаемо больше в I группе (14 против 6 больных, p = 0,057). Однако частота случаев, когда энцефалопатия была симптомом, определяющим тяжесть состояния больного, и частота ее проявления на фоне соматических нарушений не различались между двумя группами. 33 пациентам первой группы и 34 больным второй после операции проводили анализ когнитивных нарушений. В данных группах пациентов с выраженной энцефалопатией в дальнейшем исключили из оценки когнитивных функций. Исходные и послеоперационные результаты психометрических тестов представлены в табл. 4.
Обсуждение
Важным аспектом на основном этапе хирургического вмешательства является быстрое формирование дистального анастомоза и возобновление ИК и согревания пациента. В ряде случаев с целью упрощения и ускорения реконструкции дистального отдела дуги аорты осуществляли проксимализацию дистального анастомоза.
Анализ эффективности защиты головного мозга
Нервная система является наиболее чувствительной к ишемии тканью, поэтому главной целью гипотермии является защита головного и спинного мозга. Потребление мозгом кислорода при температуре 28 °C снижается на 50%, по сравнению с нормотермией (37 °C), при температурном режиме 18 °C — на 80% и при гипотермии 8 °C — почти на 90% [10]. Несмотря на про-тективное действие гипотермии, а также удобство выполнения реконструкции дуги аорты при «сухом» операционном поле, вскоре отмечены некоторые недостатки метода, в частности специфические ослож-
Таблица 4 Результаты психометрических тестов
|
Тест |
Группа |
Исход |
1-e сут. |
3-e сут. |
|
Рисование часов |
I, n = 33 |
9,26±0,81 |
8,65±1,23* |
8,91±1,2 |
|
II, n = 34 |
9,5±0,67 |
8,83±0,72* |
9,25±0,87** |
|
|
«Информация – память – концентрация внимания» |
I, n = 33 |
28,56±5,38 |
24,97±5,41* |
25,65±6,42* |
|
II, n = 34 |
29,9±3,04 |
26,6±5,16* |
27,7±4,8*/** |
|
|
На кратковременную память |
I, n = 33 |
5,3±1,49 |
4,0±1,53* |
4,64±1,62*/** |
|
II, n = 34 |
5,67±1,97 |
4,17±2,29* |
5,08±2,19** |
Примечание. * — относительно исхода, р<0,05; ** — между 1-ми и 3-ми сут., р<0,05
нения (коагулопатия, полиорганная недостаточность, системный воспалительный ответ). При этом доказано, что они вызваны не столько гипотермией, сколько продолжительным согреванием больного после основной реконструкции и, как следствие, длительным ИК [11]. У пациентов старшей возрастной группы глубокая гипотермия длительностью свыше 25 мин ассоциирована с высокой частотой послеоперационных неврологических осложнений и длительной реабилитацией [12]. Согласно данным Reich D. и Ergin M.A., неврологическая дисфункция в послеоперационном периоде ассоциирована с ЦА и глубокой гипотермией длительностью более 40 мин. Увеличение продолжительности ЦА до 65 мин и более связано с исключительно высокой летальностью [13]. Принципиально новая эра в хирургии дуги аорты началась с публикации в 1956 г. хьюстонской группой ученых опыта успешной нормотермической АПГМ через обе сонные артерии, однако ввиду высокой частоты неврологических осложнений при канюляции сонных артерий методика не распространилась широко [14]. Очередным прорывом стала представленная в 1986 г. Guilmet D. и Bachet J. в Европе и Kazui T. в Японии методика АПГМ, которая позволила значительно снизить частоту послеоперационных неврологических осложнений [15, 16].
Спорным остается выбор между моно- и бигемисфе-ральной перфузией головного мозга. Ученые обосновывают применение бигемисферальной АПГМ атеросклеротическим поражением одной из сонных артерий, ранее перенесенными транзиторной ишемической атакой или острым нарушением мозгового кровообращения, а также анатомическими особенностями, например разомкнутым Виллизиевым кругом (хотя доказано, что роль замкнутости Виллизиева круга в адекватном кровоснабжении головного мозга при моногемисфе-ральной перфузии значимо преувеличена [17]). Исследования Leshnower B. и Urbanski P. указывают на положительные результаты моногемисферальной перфузии (16 °С) с гипотермическим ЦА 26 °С длительностью 30±15 мин [18, 19]. В то же время Krahenbuhl E. и соавт. доказали, что в случае длительного ЦА (более 40 мин) бигемисферальная перфузия обеспечивает более эффективные результаты в среднеотдаленном послеоперационном периоде по сравнению с моногемисфераль-ной АПГМ [20]. Немаловажной является и скорость перфузии головного мозга. Известно, что гиперперфузия мозга ведет к более высокой частоте неврологических осложнений, чем умеренная гипоперфузия. Это происходит ввиду повышения мозгового кровотока и внутричерепного давления, что в свою очередь приводит к отеку и повреждению клеток головного мозга. Оптимальной считается объемная скорость перфузии 8–12 мл/мин/кг массы тела (0,6 мл/мин/г массы ткани головного мозга) при перфузионном давлении 40–60 мм рт. ст. и температуре 23–28 °С [21, 22].
Проблемой при интраоперационном мониторинге является отсутствие стандартизированных подходов для интраоперационной оценки состояния головного мозга. В одних клиниках при мониторировании используют церебральную оксиметрию, в других — оценку кровотока в среднемозговых артериях, в третьих — оценку метаболизма головного мозга. Однако каждый из описанных методов имеет недостатки: ТКД и ЦО позволяют мониторировать лишь состояние лобных долей головного мозга и кровоснабжение бассейна среднемозговых артерий, исследование метаболизма головного мозга по артериовенозной разнице оценивает смешанную кровь со всего головного мозга и позволяет оценить усредненный метаболизм головного мозга в целом, электроэнцефалография и вызванные потенциалы также имеют недостатки. В РНЦХ им. акад. Б.В. Петровского используют все методы оценки состояния центральной нервной системы, что позволяет установить корреляцию интраоперационных параметров с клиническим состоянием больных в послеоперационном периоде.
На основании одновременного снижения SсtO2 и Vs по средней мозговой артерии принимали решение о недостаточности объемной скорости АПГМ и необходимости ее увеличения. Оба метода в большинстве случаев реагировали содружественно (80% наблюдений). Определяли признаки гиперперфузии преимущественно по ТКД, церебральная оксиметрия в этом отношении была менее информативна: обнаруживали содружественные изменения в 30%. Это обусловлено тем, что ЦО более чувствительный метод оценки снижения доставки кислорода в ткани [23]. В 4% (n =3) случаев осуществили переход на бигемисферальную АПГМ после выявления неэффективности моногемис-феральной перфузии. Динамическое наблюдение данных церебральной оксиметрии и транскраниальной допплерографии позволяло контролировать адекватность АПГМ, диагностировать случаи смещения или дислокации баллонных катетеров и избежать асимметрии кровотока по полушариям.
Основываясь на данных мультимодального мониторинга, динамически коррегировали объемную скорость. Благодаря этому во время АПГМ показатели SсtO2, а также линейная скорость у всех больных были в пределах допустимых значений. При этом объемная скорость варьировала в широких пределах от 5,6 до 16,8 мл/кг (средний показатель 13,2±3,72 мл/кг). Данный метод контроля защиты головного мозга не является основным, так как он дискретно оценивает транспорт кислорода и может только дополнять методы непрерывного мониторинга. Это определяет его ограниченное использование при реконструктивных операциях на дуге аорты.
Интересным аспектом является проблема дополнительной фармакологической протекции. Сложно сказать, какие препараты защищают головной мозг от ишемии ввиду трудности сбора доказательной базы. Интраоперационно на пациента воздействует слишком много различных факторов, проводят операции в условиях полипрагмазии, поэтому трудно выделить эффекты отдельных веществ. В связи с этим фармакопротекция занимает последние места в протоколах защиты головного мозга. Тем не менее в протокол РНЦХ им. акад. Б.В. Петровского включили препараты с предполагаемыми защитными свойствами, например барбитураты, об эффективности которых пишут многие авторы [24]. Это обусловлено тем, что в экстренной ситуации хирургическая бригада должна быть готова к реконструкции в условиях полного ЦА и глубокой гипотермии. Таким образом, анестезиологу необходимо иметь «запас» церебропротекции. Несмотря на обилие методов контроля, АПГМ — нефизиологическое состояние, при котором дополнительная защита не будет лишней.
Основное внимание в оценке эффективности протокола защиты головного мозга уделяют анализу когнитивной функции. Исходно по результатам психометрических тестов группы не различались (табл. 4). Показатели теста рисования часов у пациентов обеих групп были ниже в 1-е сут. после операции и восстанавливались к исходному уровню на 3-е сут. Результаты теста «информация – память – концентрация внимания» у пациентов обеих групп на 1-е сут. были хуже, чем в исходе, и оставались сниженными на 3-е сут. Во II группе они улучшились на 3-е сут. В обеих группах тест на кратковременную память показывал снижение в 1-е сут. после операции с последующим улучшением на 3-е сут. В I группе он оставался сниженным относительно исходных показателей. При этом на всех этапах раз- личия между сравниваемыми группами больных отсутствовали. При сравнении результатов психометрических тестов между группами с антеградной моно- и бигемис-феральной перфузией головного мозга различий также не выявили. Полученные результаты свидетельствуют о достаточном уровне защиты головного мозга при предлагаемом протоколе.
Анализ эффективности температурного сопровождения
Эффективное температурное сопровождение является одним из ключевых моментов обеспечения безопасности больного во время операций на дуге аорты. Внедрение в РНЦХ им. акад. Б.В. Петровского мониторинга температуры мочевого пузыря обусловлено большей точностью и меньшей инерционностью данного метода, по сравнению с определением температуры в прямой кишке, которое мы использовали ранее [25]. В обеих группах начинали согревание до вводной анестезии. Применение воздушного согревания дополнительно к водяному позволило поддерживать уже в исходе более высокую центральную температуру у больных I группы. У пациентов II группы на данном этапе чаще регистрировали непреднамеренную интраоперационную гипотермию. Согревание больного перед охлаждением позволяет предотвратить температурную вазоконстрикцию, сохранить нормальную работу микрососудов и, следовательно, быстро и с меньшим температурным градиентом охладить больного. Таким образом, комбинированное воздушное и водяное согревание позволяет более эффективно согревать пациента после циркуляторного ареста. Согревание больного до целевой температуры 36 °C позволяет нормализовать гемостаз, уменьшить послеоперационную кровопотерю и снизить частоту рестернотомий. Быстрое восстановление микроциркуляции положительно влияет на результаты хирургического лечения [25].
Заключение
Эффективность выбранного протокола защиты головного мозга и висцеральных органов во время реконструктивных вмешательств на дуге аорты подтверждают послеоперационные результаты. Мы рекомендуем подобные реконструкции в условиях умеренной гипотермии (26–28 °C) и селективной антеградной перфузии головного мозга. Ключевыми моментами во время таких операций является быстрое выполнение дистальной части реконструкции с возобновлением ИК и началом согревания пациента (что позволит сократить общую продолжительность ИК и, как следствие, снизить частоту послеоперационных осложнений) и тщательный интраоперационный мониторинг как состояния головного мозга (совместное использование церебральной оксиметрии и транскраниальной допплерографии), так и центральной температуры тела.
Финансирование
Исследование не имело спонсорской поддержки.
Список литературы Защита головного мозга и внутренних органов при реконструктивных вмешательствах на дуге аорты: особенности интраоперационной тактики и мониторинга
- Griepp R.B., Stinson E.B., Hollingsworth J.F., Buehler D. Prosthetic replacement of the aortic arch//J. Thorac. Cardiovasc. Surg. 1975. Vol. 70. No. 6. P. 1051-1063.
- Borst H.G., Schaudig A., Rudolph W. Arteriovenous fistula of the aortic arch: repair during deep hypothermia and circulatory arrest//J. Thorac. Cardiovasc. Surg. 1964. Vol. 48. P. 443-447.
- Urbanski P.P., Luehr M., Di Bartolomeo R., Diegeler A., De Paulis R., Esposito G., Bonser R.S., Etz C.D., Kallenbach K., Rylski B., Shrestha M.L., Tsagakis K., Zacher M., Zierer A. Multicentre analysis of current strategies and outcomes in open aortic arch surgery: heterogeneity is still an issue//Eur. J. Cardiothorac. Surg. 2016. Vol. 50. No. 2. P. 249-255. http://dx.doi.o DOI: rg/10.1093/ejcts/ezw055
- 2010 ACCF/AHA/AATS/ACR/ASA/SCA/SCAI/SIR/STS/SVM Guidelines for the Diagnosis and Management of Patients With Thoracic Aortic Disease: Executive Summary//Circulation. 2010. Vol. 121. P. 1544-1579. http://dx.doi.org/10.1161/CIR.0b013e3181d47d48
- Griepp R.B., Bonser R., Haverich A., Kazui T., Kouchoukos N.T., Safi H.J., Sasaki H., Spielvogel D., Takamoto S. Panel Discussion: Session П-Aortic Arch.//Ann. Thorac. Surg. 2007. Vol. 83. No. 2. P. S824-831. http://dx.doi.o DOI: rg/10.1016/j.athoracsur.2006.11.093
- Coselli J.S., LeMaire S.A. Experience with RCP during proximal aortic surgery in 290 patients//J. Card. Surg. 1997. Vol. 12. Suppl. 2. P. 322-325.
- Bachet J., Guilmet D., Goudot B., Dreyfus G.D., Delentdecker P., Brodaty D., Dubois C. Antegrade cerebral perfusion with cold blood: a 13-year experience//Ann. Thorac. Surg. 1999. Vol. 67. No. 6. P. 1874-1878.
- De Paulis R., Czerny M., Weltert L., Bavaria J., Borger M.A., Carrel T.P., Etz C.D., Grimm M., Loubani M., Pacini D., Resch T., Urbanski P.P., Weigang E.; EACTS Vascular Domain Group. Current trends in cannulation and neuroprotection during surgery of the aortic arch in Europe//European Journal of Cardio-Thoracic Surgery. 2015. Vol. 47. No. 5. P. 917-923. http://dx.doi. org/10.1093/ejcts/ezu284
- Luehr M., Bachet J., Mohr F.W., Etz C.D. Modern temperature management in aortic arch surgery; the dilemma of moderate hypothermia//Eur. J. of CardioThorac. Surg. 2014. Vol. 45. No. 1. P. 27-39. http://dx.doi.o DOI: rg/10.1093/ejcts/ezt154
- Ehrlich M.P., McCullough J.N., Zhang N., Weisz D.J., Juvonen T., Bodian C.A., Griepp R.B. Effect of hypothermia on cerebral blood flow and metabolism in the pig//Ann. Thorac. Surg. 2002. Vol. 73. No. 1. P. 191-197.
- Haverich A., Hagl C. Organ protection during hypothermic circulatory arrest//J. Thorac. Cardiovasc. Surg. 2003. Vol. 125. No. 3. P. 460-462. http://dx.doi.o DOI: rg/10.1067/mtc.2003.291
- Reich D.L., Uysal S., Sliwinski M., Ergin M.A., Kahn R.A., Konstadt S.N., McCullough J., Hibbard M.R., Gordon W.A., Griepp R.B. Neuropsychologic outcome after deep hypothermic circulatory arrest in adults//J. Thorac. Cardiovasc. Surg. 1999. Vol. 117. No. 1. P. 156-163.
- McCullough J.N., Zhang N., Reich D.L., Juvonen T.S., Klein J.J., Spielvogel D., Ergin M.A., Griepp R.B. Cerebral metabolic suppression during hypothermic circulatory arrest in humans//Ann. Thorac. Surg. 1999. Vol. 67. No. 6. P. 1895-1899.
- Cooley D.A., De Bakey M.E. Resection of entire ascending aorta in fusiform aneurysm using cardiac bypass//J. Am. Med. Assoc. 1956. Vol. 162. No. 12. P. 1158-1159.
- Guilmet D., Roux P.M., Bachet J., Goudot B., Tawil N., Diaz F. A new technique of cerebral protection. Surgery of the aortic arch//Presse Med. 1986. Vol. 15. No. 23. P. 1096-1098.
- Kazui T. Update in surgical management of aneurysms of the thoracic aorta//Rinsho Kyobu Geka. 1986. Vol. 6. No. 1. P. 7-15.
- Urbanski P.P., Lenos A., Blume J.C., Ziegler V., Griewing B., Schmitt R., Diegeler A., Dinkel M. Does anatomical completeness of the circle of Willis correlate with sufficient cross-perfusion during unilateral cerebral perfusion?//Eur. J. Cardiothorac. Surg. 2008. Vol. 33. No. 3. P. 40208. http://dx.doi.org/10.1016/j. ejcts.2007.12.021
- Urbanski P.P., Lenos A., Bougioukakis P., Neophytou I., Zacher M., Diegeler A. Mild-to-moderate hypothermia in aortic arch surgery using circulatory arrest: a change of paradigm?//Eur. J. Cardiothorac. Surg. 2012. Vol. 41. No. 1. P. 185-191. http://dx.doi. org/10.1016/j.ejcts.2011.03.060
- Leshnower B.G., Myung R.J., Kilgo P.D., Vassiliades T.A., Vega J.D., Thourani V.H., Puskas J.D., Guyton R.A., Chen E.P. Moderate hypothermia and unilateral selective antegrade cerebral perfusion: a contemporary cerebral protection strategy for aortic arch surgery//Ann. Thorac. Surg. 2010. Vol. 90. No. 2. P. 547-554. http://dx.doi.o DOI: rg/10.1016/j.athoracsur.2010.03.118
- Krahenbuhl E.S., Clement M., Reineke D., Czerny M., Stalder M., Aymard T., Schmidli J., Carrel T. Antegrade cerebral protection in thoracic aortic surgery: lessons from the past decade//Eur. J. Cardiothorac. Surg. 2010. Vol. 38. No. 1. P. 46-51. http://dx.doi. org/10.1016/j.ejcts.2010.01.016
- Haldenwang P.L., Strauch J.T., Amann I., Klein T., Sterner-Kock A., Christ H., Wahlers T. Impact of pump flow rate during selective cerebral perfusion on cerebral hemodynamics and metabolism//Ann. Thorac. Surg. 2010. Vol. 90. No. 6. P. 1975-1984. http://dx.doi.o DOI: rg/10.1016/j.athoracsur.2010.06.111
- Misfeld M., Leontyev S., Borger M.A., Gindensperger O., Lehmann S., Legare J.F., Mohr F.W. What is the best strategy for brain protection in patients undergoing aortic arch surgery? A single center experience of 636 patients//Ann. Thorac. Surg. 2012. Vol. 93. No. 5. P. 15021508. http://dx.doi.o DOI: rg/10.1016Zj.athoracsur.2012.01.106
- Gregory A., Kohl B.A. n: Near-Infrared Spectroscopy has not Proven its dinical Utility as a Standard Monitor in CardiacSurgery//J. Cardiothorac. Vasc. Anesthesia. 2013. Vol. 27. No. 2. P. 390-394. http://dx.doi.o DOI: rg/10.1053/j.jvca.2012.11.010
- Hashimi S., Zaman M., Waterworth P., Bilal H. Does the use of thiopental provide added cerebral protection during deep hypothermic circulatory arrest?//Interact. Cardiovasc. Thorac. Surg. 2013. Vol. 17. No. 2. P. 392-397. http://dx.doi.org/10.1093/icvts/ivt184
- Sessler D. Temperature monitoring and perioperative thermoregulation//Anesthesiology 2008. Vol. 109. No. 2. P. 318-338. http://dx.doi.o DOI: rg/10.1097/ALN.0b013e31817f6d76


