Зависимость карбоксилэстеразной активности почвенных грамотрицательных микроорганизмов от стадии роста и состава среды
Автор: Ремезовская Наталья Борисовна, Максимов Александр Юрьевич, Демаков Виталий Алексеевич
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Микробиология
Статья в выпуске: 1, 2011 года.
Бесплатный доступ
Изучена зависимость роста и карбоксилэстеразной активности почвенных грамотрицательных бактерий рода Pseudomonas от концентрации источника углерода, азота и фосфора. Установлено, что карбоксилэстеразная активность исследуемых культур имеет высокий уровень конститутивного выражения. При высоких концентрациях глюкозы (более 1%) наблюдается угнетение роста и понижение эстеразной активности. Карбоксилэстеразная активность культур P. fluorescens в оптимальных условиях достигала 10 мкмоль/мг/мин.
Биотрансформация, карбоксилэстераза, сложные эфиры
Короткий адрес: https://sciup.org/147204535
IDR: 147204535 | УДК: 579.24+579.222.4
Текст научной статьи Зависимость карбоксилэстеразной активности почвенных грамотрицательных микроорганизмов от стадии роста и состава среды
В настоящее время бактериальные эстеразы эффективно применяют в органическом синтезе оптически чистых компонентов. Кроме того, они активно используются в качестве биодеструкторов при деградации органических соединений в загрязненных природных объектах. Интерес к данной группе ферментов связан еще и с тем, что эстеразы не являются зависимыми от кофакторов, а также обычно стабильны и даже активны в органических растворах (Bornscheuer, 2002). Несмотря на значительные успехи в области селекции микроорганизмов – продуцентов ферментов, потребность промышленности в новых штаммах непрерывно возрастает (Коновалов, 2002; Мубараков, 2002). В связи с этим поиск новых эффективных микроорганизмов, содержащих высокоактивные карбоксилэстеразы с целью создания на их основе биокатализаторов, является актуальной задачей (Доронина и др., 2006). Основным источником для скрининга и селекции высокоактивных штаммов для биотрансформации и биодеградации органических соединений являются почвы естественной среды и техногенно-измененные грунты (Звягинцев, 1987; Bornscheuer, 2002, Демаков и др., 2007).
Ранее нами были селекционированы и идентифицированы культуры грамотрицательных почвенных микроорганизмов, аэробных протеобакте-рий, относящиеся главным образом к роду Pseudomonas , обладающие высокой карбоксилэстеразной активностью, определены минимальные ингибирующие концентрации эфиров спиртов в диапазоне С1–С10 и исследована эстеразная активность штаммов в отношении ряда ацетатных эфиров (Старкова, Ремезовская, 2007).
В данной работе исследуются зависимость роста и карбоксилэстеразной активности почвенных грамотрицательных бактерий рода Pseudomonas от соотношения концентраций источника углерода, азота и фосфора.
Объекты и методы исследования
Объектами исследования являются штаммы почвенных псевдомонад, выделенные из образцов подзолистой луговой и аллювиальной болотной почв, не несущих значительной антропогенной нагрузки, собранных в Нытвенском районе Пермского края с глубины 5 и 20 см от поверхности.
Для выращивания штаммов микроорганизмов, утилизирующих эфиры карбоновых кислот, была использована синтетическая среда N, имеющая следующий состав (г/л): KH 2 PO 4 – 1.0; K 2 HPO 4 × 3H 2 O – 1.6; NaCl – 0.5; MgSO 4 × 7H 2 O – 0.5; CaCl 2 – 0.005; CoCl 2 × 6H 2 O – 0.01; FeSO 4 × 7H 2 O – 0.005; pH 7.2 ± 0.2. (Максимов и др., 2003). В качестве источника азота использовали NH 4 Cl в концентрации 10 mM, источника углеводов – глюкозу в концентрации 0.1% или бутилацетат в концентрации 2–10 мМ. Ростовые субстраты асептически добавляли до конечной концентрации в автоклавированную и охлажденную до 25 ° С среду в соответствии с условиями эксперимента.
Количественное определение эстеразной активности по высвобождению р-нитрофенола из соответствующих его эфиров осуществляли с помощью фотоэлектроколориметра КФК–3 в кюветах с длиной оптического пути 0.5 см при Х =410 нм. В качестве субстрата использовали p-нитрофенил (NP)-ацетат.
25 мкл 10 мМ субстрата вносили в 2 мл среды, содержащей тестерную клеточную культуру. Реакцию проводили при температуре 22 ° С или 30 ° С (согласно условиям эксперимента) в течение 30 мин. Единица эстеразной активности (1ЕД) соответствует 1 мкмоль р-нитрофенола /мин /мг сухого веса клеток.
Результаты исследований
Зависимость роста и эстеразной активности бактерий от состава ростовой среды
Исследовали влияние сочетаний различных концентраций фосфатов и глюкозы на рост штаммов. Обнаружили, что для всех штаммов восьмикратное от 6.25 до 50 мМ изменение концентрации фосфатов (при стандартной концентрации в среде N– 25 мМ) приводит к незначительным изменениям в эффективности утилизации глюкозы в диапазоне от 0.05 до 0.5% (рис. 1). Во всех случаях плотность культуры увеличивалась пропорционально концентрации глюкозы (до 0.25%). При дальнейшем увеличении её содержания в среде накопление биомассы снижалось в разной степени в зависимости от индивидуальных биохимических характеристик изучаемых изолятов.
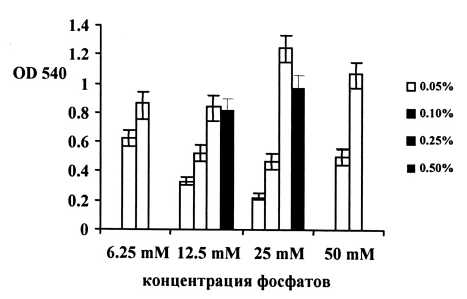
Рис. 1 . Зависимость роста штамма P. fluorescens ОН 5 от различных концентраций глюкозы и фосфатов
При изучении влияния различных сочетаний глюкозы и фосфатов в ростовой среде на эстеразную активность исследуемых культур обнаружили, что для большей их части зависимость активности от концентрации фосфатов детектируется только на низких концентрациях глюкозы (рис. 2).
Установлено, что в отличие от большинства штаммов специфическая активность штамма P. fluorescens ЛН 4 не зависит от изменения содержания глюкозы и фосфатов в широком диапазоне концентраций.
Определяли зависимость роста и активности выделенных штаммов от сочетания различных концентраций глюкозы и аммония в ростовой среде. Обнаружено, что количество вносимого источника азота незначительно оказывает влияние на плотность культуры при содержании глюкозы в среде 0.1%, притом утилизация псевдомонадами больших количеств глюкозы прямо зависела от увеличения концентрации аммония (рис. 3). При дальнейшем повышении концентрации изучаемых ростовых агентов наблюдалось снижение плотности культуры, в первую очередь, при повышении содержания глюкозы. Совместное внесение до высоких концентраций глюкозы и аммония приводило к ингибированию роста всех культур.
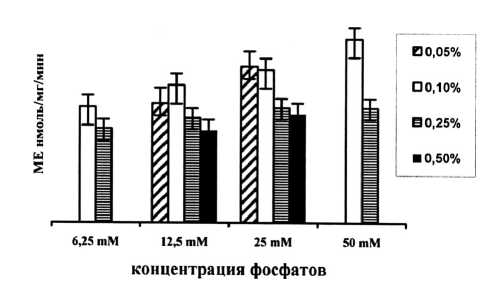
Рис. 2 . Карбоксилэстеразная активность штамма P. fluorescens ОН5 при различных концентрациях глюкозы и фосфатов
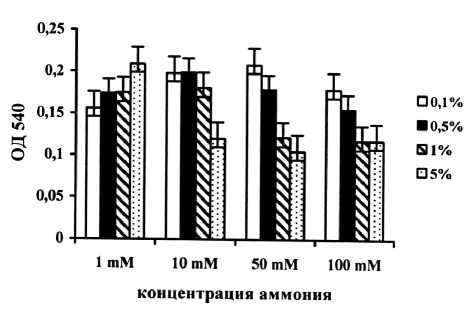
Рис. 3. Зависимость роста штамма Pseudomonas sp.ОН 1 от различных концентраций глюкозы и аммония
Показано, что эстеразная активность изучаемых штаммов не имеет линейной зависимости от концентрации источника азота в ростовой среде в широком диапазоне концентраций (рис. 4).
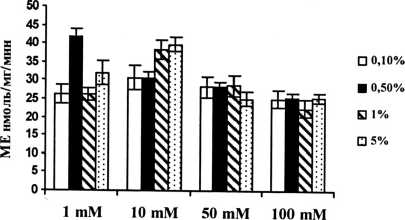
концентрация аммония
Рис. 4 . Зависимость активности штамма Pseudomonas sp. ОН 1 от различных концентраций глюкозы и аммония
Обнаружено также, что высокий уровень карбоксилэстеразной активности (более 4 мкмоль/мг/ мин), близкий к наблюдаемому на минеральной среде с глюкозой, достигается на полноценных питательных средах, таких как среда Luria-Bertani.
Полученные результаты изучения влияния источников азота, углеводов и энергии на рост и карбоксилэстеразную активность бактерий свидетельствуют о том, что синтез эстераз изучаемыми культурами имеет в большей степени конститутивный характер и не требует специфической индукции.
Зависимость роста и активности штаммов от фазы роста культуры
Для определения зависимости эстеразной активности культуры от фазы роста клетки исследуемых штаммов выращивали в течение 7 сут. на среде N разного состава (рис. 5). Измерения плотности и активности производились каждые 12 ч. Перед опытом штаммы длительно пассировали на жидкой среде LB.
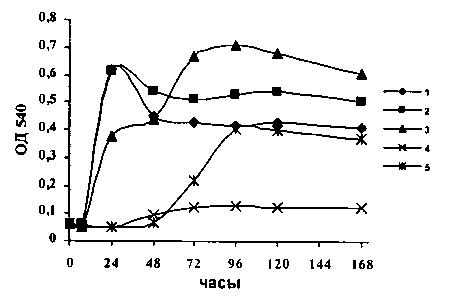
Рис. 5 . Рост штамма Ps. fluorescens ОН 6 на средах: 1 – 0.1% глюкоза; 2 – 0.1% глюкоза + 2мМ бутилацетат; 3 – 0.1% глюкоза + 10 мМ бутилацетат;
4 – бутилацетат 2 мМ; 5 – бутилацетат 10 мМ
Обнаружено, что при росте изолятов, выделенных из аллювиальной почвы, на средах, содержащих глюкозу в качестве единственного источника углерода или в сочетании с бутилацетатом, период адаптации составляет 6 ч., стадия логарифмического роста имеет протяженность не более 24 ч., и далее культура переходит в стационарную фазу. Показано, что в варианте с 10 мМ бутилацетатом лаг-фаза затягивается до 48 ч. Очевидно, что это связано с длительностью.
Как видно из представленного графика, период активного роста в варианте с 10 мМ бутилацетатом совпадает со второй зоной логарифмического роста в варианте с глюкозой и 10 мМ бутилацетатом, что свидетельствует о переключении ферментных систем с утилизации глюкозы на утилизацию бутилацетата. Бутилацетат как единственный источник углеводов не является оптимальным ростовым агентом, плотность культуры на среде с его концентрацией 2 мМ не превышает 15%, а при концентрации 10 мМ – 55–60% максимальной, детектируемой в варианте с двумя источниками углерода.
Среди штаммов, выделенных из луговой почвы, только ЛН 4 рос на средах, содержащих глюкозу. Как видно из представленных данных (рис.
6), сочетание глюкозы и бутилацетата в разных концентрациях оказывает стимулирующее влияние на ростовые процессы описываемого штамма, в то время как на средах с единственным ростовым источником наблюдается задержка стадии адаптации до 48 ч. К концу периода измерения максимальная плотность была зафиксирована в варианте с 10 мМ бутилацетатом.
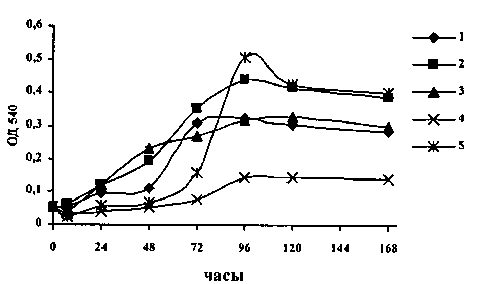
Рис. 6. Рост штамма Pseudomonas sp. ЛН 4 на средах различного состава:
1 – 0.1% глюкоза; 2 – 0.1% глюкоза + 2мМ бутилацетат; 3 – 0.1% глюкоза + 10 мМ бутилацетат;
4 – бутилацетат 2 мМ; 5 – бутилацетат 10 мМ
При изучении зависимости эстеразной активности штаммов от фазы роста культуры обнаружили, что в первые часы после переноса клеток с полной среды на минимальную наблюдается незначительное повышение активности фермента, связанное с адаптацией к новым ростовым условиям, после чего на всех штаммах во всех вариантах детектируется значительное снижение активности эстеразы.
Анализ динамики изменения ферментной активности штамма ОН 6 свидетельствует о том, что повышение активности на 48-м часу роста культуры связано, вероятно, с переходом от утилизации глюкозы к бутилацетату и экспрессией соответствующих генов. В конце периода измерения на стационарной стадии роста на всех вариантах наблюдалось повышение эстеразной активности культур, в ряде вариантов до 150% от исходного уровня, что может быть вызвано истощением ростовых агентов и активацией ферментных систем клетки в стрессовых условиях.
Сходная динамика изменения эстеразной активности наблюдается и при росте штамма ЛН 4, однако в этом случае повышение скорости конверсии маркерного субстрата детектируется только в варианте с 10 мМ бутилацетатом.
Заключение
Исходя из полученных данных о влиянии источников азота, фосфора, углеводов и энергии на рост и специфическую активность штаммов можно сделать вывод, что синтез эстераз изучаемыми культурами имеет в большей степени конститутивный характер и не требует специфической индукции. При этом увеличение концентрации глюкозы до 1%, фосфата в интервале 6.25–25 мМ и аммония в интервале 1–50 мМ стимулировало рост культуры, но приводило к лишь небольшому повышению уровня эстеразной активности. Этим изучаемые культуры отличаются от ранее исследованных продуцентов нитрилгидратаз, уровень активности которых был чувствителен к концентрации источников основных элементов (Максимов и др., 2003). Карбоксилэстеразная активность культур P. fluores-cens в оптимальных условиях достигала 10 мкмоль/мг/мин, что выше, чем у ранее описанных аналогов (Доронина и др., 2006).
Показано, что при высоких концентрациях глюкозы (5%) наблюдается угнетение роста бактерий и, у некоторых культур, понижение эстеразной активности. Таким образом, для получения высокого выхода активной биомассы могут быть использованы следующие концентрации источников углерода, азота и фосфора: глюкоза – 1%, аммоний – 50 мМ, фосфат – 25 мМ.
Работа поддержана ФЦП «Научные и научнопедагогические кадры инновационной России на 2009–2013 годы» (ГК№ 02.740.11.0078) и АВЦП «Развитие научного потенциала высшей школы (2009–2010 годы)», проект № 2.1.1.6252.
Список литературы Зависимость карбоксилэстеразной активности почвенных грамотрицательных микроорганизмов от стадии роста и состава среды
- Демаков В.А. и др. Биологическое разнообразие нитрилметаболизирующих бактерий антропогенно-измененных почв Пермского края//Экология. 2007. № 3. С. 1-6.
- Доронина Н.В. и др. Биодеградация метилацетата и этилацетата иммобилизованными клетками Pseudomonas esteropholus//Прикл. биохим. и микробиол. 2006. Т. 42, № 1. С. 52-54.
- Звягинцев Д.Г. Почва и микроорганизмы. М.: Изд-во МГУ, 1987. 256 с.
- Коновалов А.А. Разработка методов разделения рацемических эфиров с помощью гидролаз микроорганизмов: автореф. дис. канд. биол. наук. Уфа, 2002. 16 с.
- Максимов А.Ю и др. Влияние нитрилов и амидов на рост и нитрилгидратазную активность штамма Rhodococcus sp. gt1//Прикл. биохим. и микробиол. 2003. Т. 39, № 1. С. 63-68.
- Мубараков А.И. Разработка энантиоселективных биокатализаторов парциального ацилирования спиртов: автореф. дис. канд. биол. наук. Уфа, 2002. 18 с.
- Старкова М.К., Ремезовская Н.Б. Селекция грамотрицательных микроорганизмов, обладающих эстеразной активностью//Современные проблемы экологии, микробиологии и иммунологии. Екатеринбург-Пермь, 2007. С. 107-109.
- Bornscheuer U.T. Microbial carboxyl esterases: classification, properties and application in biocatalysis//FEMS Microbiology reviews. 2002. Vol. 26. P. 73-81.


