Зависимость процессов репаративного остеогенеза от поверхностных свойств имплантатов для остеосинтеза
Автор: Карлов А.В., Хлусов И.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2003 года.
Бесплатный доступ
В экспериментах in vitro и in vivo изучены растворимость имплантатов для остеосинтеза и их влияние на репаративный остеогенез. Динамику растворения биоактивных (кальций фосфатных) покрытий на титановых имплантатах оценивали по накоплению ионов кальция в стерильном 0,9 % растворе хлорида натрия. Накопление радиоактивной и тетрациклиновой меток в сломанных бедренных костях 26 крыс определяли через 45 суток после интрамедуллярного введения имплантатов. Полученные результаты позволили выявить логичную цепочку: различная технология нанесения покрытий – различные параметры их деградации – различная динамика репаративной регенерации и минерализации костной ткани. Таким образом, существует реальная возможность на основе выявленных фундаментальных закономерностей формировать панель индивидуальных имплантатов для конкретных клинических ситуаций.
Биоинертные и биоактивные имплантаты, деградация, 99mtc-пирофосфат, доксициклин, перелом бедренной кости, крысы
Короткий адрес: https://sciup.org/142120628
IDR: 142120628
Текст научной статьи Зависимость процессов репаративного остеогенеза от поверхностных свойств имплантатов для остеосинтеза
Лечение заболеваний и повреждений опорно-двигательного аппарата представляет до настоящего времени сложную клиническую задачу, поскольку частота ортопедической и травматологической патологии остается на практически постоянном высоком уровне. Традиционным методом выбора ортопедов-травматологов вот уже более 100 лет, начиная с конструкции доктора Clayton Parkhill (1897), являются системы внешней фиксации (СВФ) [1]. Внешняя фиксация – это непрерывное противостояние между растущей стабильностью, обеспечиваемой созреванием костной мозоли и дестабилизирующим влиянием расшатывания погружных конструкций [2], которое является в определенной степени естественным для внешней фиксации процессом [3]. В последние годы стало понятно, что биомеханический период, в классическом понимании связанный с модернизацией многочисленных вариантов аппаратов внешней фик- сации (АВФ), после фундаментальных открытий Г.А. Илизарова практически исчерпал себя. Очевидно, что СВФ, как макроуровень регуляции костеобразования, конструкционно подошли к пределу своих возможностей.
При фиксации стандартными стальными имплантатами, независимо от их типа, имеет место прогрессирующее механическое ухудшение границы раздела кость/имплантат [4], приводящее к расшатыванию [5] и развитию инфекции [3]. Для любой системы конструкций (спиц, стержней, винтов) рекомендуется до 11 шагов, направленных на увеличение стабильности АВФ [3], кардинально не меняющих, по мнению A. Moroni, P. Aspenberg, S. Toksvig-Larsen et al., ситуацию.
Хорошо известна способность имплантатов потенцировать инфекцию посредством синергичного провоспалительного действия бактериальных тел и чужеродной поверхности имплантируемых устройств на организм хозяина. При этом имплантируемые материалы, в зависимости от их биосовместимости, могут снижать порог дозы, вызывающей инфекционное воспаление [6].
Различные биоматериалы (полимеры, керамика, композиты) находят все более широкое распространение в медицине [7]. В травматологии и ортопедии особое внимание уделяется кальций фосфатам, естественным метаболитам и регуляторам костной ткани, обладающим максимальной биосовместимостью и способностью к интеграции с костью [8]. Нанесение гидроксила-патита (ГА) на металлические имплантаты [9, 10, 11] дало возможность минимизировать негативные процессы на границе костная ткань/имплантат [4], усилить фиксацию погружных элементов АВФ в кости [4, 12]. Далее, нами
МАТЕРИАЛ
Эксперименты проводились в осенне-зимний период с использованием биологического материала 26 беспородных белых крыс-самцов массой 300-400 грамм (виварий НИИ кардиологии ТНЦ СО РАМН). До начала исследования животных выдерживали в течение недели на обычном пищевом рационе.
Имплантаты изготавливали из титана марки ВТ-6. Для исследований in vitro применяли диски диаметром 12 мм и толщиной 0,5 мм (по 3 изделия на группу), для экспериментов in vivo использовали штифты длиной 15 мм и толщиной 1,5 мм (по 5 штук на группу). Двусторонние покрытия формировали как описано ранее [13]: биоинертное (металлокерамическое) покрытие (МК), нанесенное анодно-искровым способом в 10% растворе фосфорной кислоты; биоактивное, кальций фосфатное плотное покрытие (КФП), нанесенное анодно-искровым способом в растворе 10% фосфорной кислоты и гидроксилапа-тита; биоактивное, кальций фосфатное стеклокерамическое покрытие (КФС), нанесенное по шликерной технологии и отожженное при 600оС. Для получения кристаллических форм МК и КФП покрытий имплантаты дополнительно отжигали при 750оС.
Экстракты имплантатов (общая площадь 2-х поверхностей каждого диска 226 мм2) получали согласно требованиям ISO 10993-5 [15] в условиях их культивирования in vitro в 4 мл стерильного 0,9% раствора хлорида натрия при 37 ° С. Половину растворов забирали через 1, 2, 3, 4 и 7 недель экстрагирования с добавлением свежего растворителя в объеме 2 мл, разливали по 1 мл в пластиковые контейнеры и хранили при - 16 ° С.
В недельных экстрактах определяли концентрацию ионизированного (биологически активного) кальция методом амперометрического титрования [16] при помощи сотрудников научно-исследовательской лаборатории № 506 (зав.
была выявлена зависимость биомедицинских свойств имплантатов от способов формирования их поверхности [11, 13]. Это предопределяет возможность через физико-химические свойства поверхности изделий контролировать процессы репаративного остеогенеза на уровне пролиферации, дифференцировки и функциональной активности остеогенных клеток. Однако до сих пор значение структурных и химических свойств биоматериалов для их взаимодействия с тканями организма точно не определено [14].
В связи с постоянным совершенствованием методов нанесения покрытий на имплантаты выявление этих фундаментальных закономерностей в условиях остеосинтеза весьма актуально для ортопедии и травматологии.
И МЕТОДЫ
– к.х.н. Г.Б. Слепченко) кафедры физической и аналитической химии ХТФ ТПУ. Присутствие фосфат-ионов в растворе не мешало выполнению методики.
Влияние биоинертных и биоактивных имплантатов на костный обмен изучали в условиях репаративной регенерации. Под эфирным наркозом при ламинарном потоке стерильного воздуха выполняли винтообразный оскольчатый перелом бедренной кости, при помощи мандре-на, посредством доступа через коленный сустав, в костномозговую полость вводили каждой крысе по 1 штифту с различными типами покрытий. Условия постановки эксперимента не исключали подвижность отломков бедра. Контролем служила интактная бедренная кость противоположной конечности.
Сцинтиграфические исследования проводили через 45 суток после операции при помощи внутривенного введения каждой крысе по 0,5 мKu радиофармакологического препарата пир-фотех (комплекс технеция-99м и пирофосфата, “ДИАМЕД“, Москва) в 0,2 мл физиологического раствора. Через 2 часа животных умерщвляли под эфирным наркозом, бедренные кости делили на 2 фрагмента и определяли излучение на гамма-счетчике “Гамма-12“ в лаборатории радионуклидных методов исследования (зав.-профессор Ю.Б. Лишманов) НИИ кардиологии ТНЦ СО РАМН. Количество импульсов за 1 минуту пересчитывали на 1 г кости, а также в процентах от фона здорового бедра.
В качестве флуоресцентной костной метки применяли препарат тетрациклинового ряда [6, 17] в нашей модификации. Для этого доксициклина гидрохлорид (“Брынцалов А“, Россия) назначали внутримышечно в дозе 25 мг/кг [6] трехкратно (через неделю), начиная с 20-го дня после установки штифтов. Выделенные сегменты бедренных костей помещали в 5 мл 10% рас- твора диметилсульфоксида в изотоническом растворе хлорида натрия и экстрагировали метку в течение 14 дней при комнатной температуре. Забирали по 1,5 мл экстракта, центрифугировали при 3000 g для удаления осадка. Фотометрические исследования выполняли на спектрофотометре-флуориметре “Hitachi“ в лаборатории молекулярной фармакологии (зав. – профессор В.А. Хазанов) НИИ фармакологии ТНЦ СО РАМН. Определение флуоресценции препарата в супернатантах при возбуждении светом с длиной волны 355-405 нм не позволило выявить измеримой эмиссии в рекомендуемом [6] диапазоне 445-550 нм. Это могло быть связано с известным феноменом тушения флуоресценции в водных растворах [18]. В то же время пики поглощения доксициклина (376 нм) и экстрактов кости без метки (408 нм) позволяли определить оптическую плотность изучаемых растворов с меткой напротив экстракта бедренной кости интактного животного (без введения доксициклина) при длине пути светового луча 1 см (объем жидкости 1 мл). Полученные результаты выражали в условных единицах оптической плотности на 1 г кости, переводили в концентрацию метки в растворе (мкг/мл) по калибровочной прямой для стандарта доксициклина гидрохлорида (уравнение регрессии y=59,838x-0,1453).
Статистическую обработку результатов выполняли с применением непараметрических U-критерия Вилкоксона-Манна-Уитни (Pu) и Т-критерия Вилкоксона (P T ) для независимых и зависимых выборок соответственно [19].
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Модификация поверхности имплантатов посредством нанесения биоактивных (кальций фосфатных) или биоинертных покрытий призвана улучшать их биосовместимость, в том числе [20, 21]: 1) предотвращать либо уменьшать выход металла и примесей из титана и его сплавов в ткани, т.е. улучшать коррозионную стойкость изделия; 2) тормозить протекание электрохимических реакций на границе имплан-тат/ткань, ухудшающих его интеграцию (концепция биоинертности); 3) способствовать взаимодействию имплантата с живой тканью за счет стимуляции биохимических (биологических) процессов (концепция биоактивности).
Концепция биоактивности рассматривает высвобождение в окружающую среду (в результате деградации искусственного материала) биологически активных ионов (в частности, ионов кальция и фосфора), которые используются организмом для образования на поверхности имплантатов слоя биологического апатита [22, 23], приводящего к построению функциональной системы имплантат/кость.
Наиболее чувствительным методом получения информации о скорости растворения имплантатов является химический анализ электролита [24], в большей степени мониторирование концентрации ионов кальция [8, 25]. При этом данные по растворимости фосфатов кальция in vitro позволяют предсказать кинетику их биодеградации после имплантации в организм [26].
Измерения выхода ионизированного (биологически активного) кальция в раствор показали, что деградация имплантатов in vitro имеет неоднозначный, экстремальный характер и зависит от вида покрытия. Так, для КФС поверхности максимальные величины растворимости отмечались на 2-й и 7-й неделях. При этом в начале эксперимента (2-я неделя) уровень ионов кальция достоверно превышал таковой для КФП покрытия (более чем в 2,5 раза, Рu<0,05), а также показатели КФП и КФС покрытий на 10-й неделе их растворения (соответственно в 2,5-3,5 раза, Рu<0,05). Линия регрессии в определенной степени подчеркивает замедление деградации КФС слоя по мере увеличения сроков растворения имплантатов (рис. 1).
В то же время изменения уровня Са2+ в физиологическом растворе свидетельствуют о достаточно стабильной деградации КФП покрытий (рис. 1), поскольку в данной группе статистически значимых различий показателя в начале и конце растворения отмечено не было.
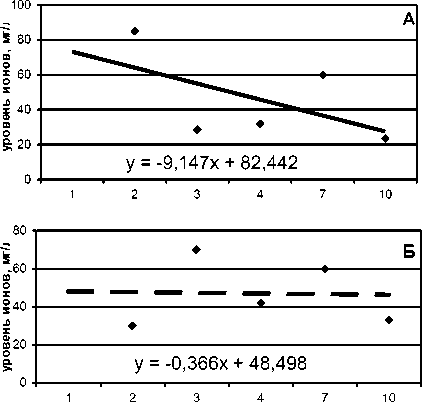
Рис. 1. Уровень ионов кальция в экстрактах имплантатов с кальций фосфатными стеклокерамическим (А) либо анодно-искровым плотным (Б) покрытиями. По оси абсцисс – сроки экстракции изделий в физиологическом растворе, недели; по оси ординат – уровень ионов кальция в растворе, мг/л
Экстремальный (протекающий через точки экстремума) тип растворения кальций фосфатных покрытий на имплантатах отмечен также в других работах [27], что связано с присутствием растворимых (аморфных) и нерастворимых (кристаллических) фаз фосфатов кальция в составе покрытий. Известно, что растворимость фосфатов кальция ранжируется следующим образом: ГА<β-ТКФ<α-ТКФ<ТТКФ<кальций-дефицитный апатит [27]. При этом степень растворения покрытий, являющихся по своей структуре бифазными или полифазными, определяется процентным содержанием растворимых солей фосфатов кальция [22] и снижается при повышении соотношения Ca/P в покрытии [28].
Результаты физико-химического тестирования позволяют говорить о том, что структурные свойства поверхности в значительной мере определяют активность процессов биодеградации имплантатов. Так, отжиг изделий с КФП покрытием способствует его полной кристаллизации, регистрируемой уже при рентгеновской дифрактометрии. Одновременно снижается растворимость КФП слоя. В рентгеноаморфном состоянии КФП покрытие, как отмечалось выше, активно теряет ионы кальция (рис. 1), что сопровождается убылью его массы в среднем на 0,5 мг (интервал 0,55-0,70 мг, n=5) в течение 8 недель экстракции в физиологическом растворе. Напротив, масса КФП в кристаллическом виде в тех же условиях эксперимента увеличивалась на 1 мг (разброс 0,65-1,3 мг, n=5, Pu<0,05), что свидетельствует об активной абсорбции ионов из растворителя (рис. 2). Во многом аналогичные данные были получены в работе [29]. Бифазные кальций фосфаты, в частности КФС покрытие, характеризуются обменом ионов с окружающими тканями, протекающим через процессы растворения и обратного осаждения (преципитации) [22].
i
0,5--В о--
-0,5---
КФП аморфное
КФП кристаллическое
Рис. 2. Изменение массы (мг) рентгеноаморфного и кристаллического кальций фосфатных плотных покрытий через 8 недель культивирования в изотоническом растворе хлорида натрия
Другими словами, посредством различных технологий формирования поверхности имплантатов существует реальная возможность управлять вектором минерализации костной ткани, ее биологической реакцией на имплантируемые изделия в условиях проведения остеосинтеза. Кристаллические структуры выполняют роль “строительных лесов“ (scaffold) для адгезии и продвижения остеогенных клеток (остеокондук-ции) по поверхности материала [22], способст- вуют врастанию кости в имплантат [30]. Растворимые (резорбируемые) элементы покрытия содействуют обмену ионов между имплантатом и костью, формированию биологического апатита, необходимого для успешного ремоделирования кости [22] вокруг имплантата [30].
Действительно, сцинтиграфическое исследование показало различия в накоплении радиоактивной метки в кости крыс в зависимости от вида изделия, применяемого для интрамедуллярного остеосинтеза переломов бедренной кости. Пирфотех (комплекс технеция-99м и пирофосфата) интенсивно откладывается в слабоминерализованном матриксе, имеет сродство к незрелому коллагену [31] и обладает высоким сродством к кристаллам гидроксиапатита [32]. Таким образом, данный радиофармакологиче-ский препарат накапливается в местах усиленного остеогенеза, характеризует состояние обменных процессов [31] и может служить маркером синтетической функции остеобластов и репаративной регенерации костной ткани.
Оказалось, что изучение распределения радиофармпрепарата в интактной и сломанной бедренных костях крыс через 7 недель после интрамедуллярного остеосинтеза переломов показало значительное (Р Т <0,05 по сравнению с фоном здоровой конечности) падение γ-излучения в дистальном отделе бедра – месте имплантации биоинертных штифтов с МК рентгеноаморфным покрытием (табл. 1). При этом отмечалась высокая частота формирования ложного сустава (80%) и единичные случаи воспалительных процессов. Технологическая кристаллизация биоинертного покрытия посредством отжига при высокой температуре выравнивала распределение радиоактивной метки в сегментах сломанной конечности вследствие повышения накопления пирфотеха в месте введения имплантата (табл. 1).
Более существенное значение для распределения пирфотеха играла структура покрытия в случае применения биоактивных имплантатов. Например, при использовании штифтов с КФП рентгеноаморфным покрытием максимальный индекс γ-излучения имел место в проксимальном отделе сломанного бедра. Напротив, имплантаты с КФП кристаллическим покрытием приводили к достоверному перераспределению метки в зону введения штифта (дистальный отдел кости). В обоих случаях показатели достигали практически двукратного превышения (Р Т <0,05) аналогичных величин в здоровом бедре (табл. 1).
Значительное накопление пирфотеха наблюдалось при остеосинтезе биоактивными имплантатами с КФС покрытием, в большей степени – в месте введения штифта (на 77% выше фона здоровой конечности, на 70% – проксимального отдела сломанной кости, РТ<0,05) (табл. 1). Следует отметить, что различие с соответствующим значением для МК рентгеноаморфного покрытия достигало 121% (Pu<0,05). Кроме того, абсолютное число импульсов на 1 г костной ткани значительно повышалось в проксимальном отделе сломанного бедра и, в отличие от других типов имплантатов, в здоровой конечности. Накопление метки в здоровом бедре в случае применения изделий с КФС покрытием было отмечено нами в ранних экспериментах [13], что может свидетельствовать об инициации системной регенераторной реакции.
Таблица 1
Накопление пирфотеха в бедренных костях крыс через 45 суток после имплантации различных типов биоинертных и биоактивных штифтов, М
|
Индекс |
Здоровое бедро |
Сломанная бедренная кость |
|
|
проксимальный отдел |
дистальный отдел (со штифтом) |
||
|
Металлокерамическое покрытие рентгеноаморфное |
|||
|
Число импульсов на 1 г кости |
200471 n=8 |
186864 n=5 |
127078* n=5 |
|
% |
100 |
129,21 |
56,32* |
|
Металлокерамическое покрытие кристаллическое |
|||
|
Число импульсов на 1 г кости |
197269 n=4 |
194836 n=3 |
236875 n=3 |
|
% |
100 |
103,13 |
11,0 |
|
Кальций фосфатное плотное покрытие рентгеноаморфное |
|||
|
Число импульсов на 1 г кости |
193612 n=5 |
299058* n=5 |
244156# n=5 |
|
% |
100 |
172,99* |
110,15# |
|
Кальций фосфатное плотное покрытие кристаллическое |
|||
|
Число импульсов на 1 г кости |
247722 n=5 |
320756 n=5 |
430514* # n=5 |
|
% |
100 |
142,37 |
186,48* # & |
|
Кальций фосфатное покрытие стеклокерамическое |
|||
|
Число импульсов на 1 г кости |
308583 n=5 |
304849 n=5 |
427358 n=5 |
|
% |
100 |
107,11 |
177,00# & |
В связи с этим в дальнейших исследованиях изучалось распределение в костной ткани тетрациклиновой метки. Тетрациклины могут официально использоваться у людей [6], имеют сродство к костной ткани [33], накапливаются в зоне вновь сформированной кости [6] и при многократных введениях свидетельствуют о кальцификации остеоида [32]. Таким образом, тетрациклиновая метка, в большей степени по сравнению с пирфотехом, позволяет судить о процессах минерализации костной ткани.
Трехкратное (каждую неделю) введение доксициклина гидрохлорида, начиная с 3-й недели после имплантации биоактивных штифтов, приводило к увеличению уровня метки в зоне введения имплантатов (дистальный отдел сломанного бедра). Так, для КФП и КФС покрытий исследуемый индекс составлял соответственно 159% и 163% от уровня интактной кости. В то же время выход антибиотика из дистального отломка бедра, имплантированного биоинерт-ным штифтом с МК покрытием, достоверно снижался не только с показателями биоактивных изделий, но и с индексом в здоровой конечности (табл. 2). Другими словами, использование биоактивных имплантатов для проведения интрамедуллярного остеосинтеза значительно усиливало процессы минерализации кости в сломанной конечности.
Таблица 2
Концентрация доксициклина (мкг/мл) в экстрактах бедренных костей крыс через 7 недель после имплантации различных типов биоинертных и биоактивных штифтов, Х, PT, Pu
|
Интактное бедро |
Сломанная бедренная кость |
|
|
проксимальный отдел |
дистальный отдел (со штифтом) |
|
|
Металлокерамическое покрытие рентгеноаморфное |
||
|
11,86 n=5 |
16,69 (n=5) |
8,07* (n=5) |
|
Кальций фосфатное плотное покрытие рентгеноаморфное |
||
|
18,62 n=5 |
5,31 (n=5) |
29,59* # & (n=5) |
|
Кальций фосфатное покрытие стеклокерамическое |
||
|
10,14 n=5 |
7,51 (n=5) |
16,48* & (n=5( |
Итак, различная структура поверхности имплантатов определяет степень деградации покрытий и, в свою очередь, уровень реакции костной ткани на интрамедуллярный остеосинтез. Распределение пирфотеха в определенной степени свидетельствует о векторе репарации костной ткани (рис. 3). В связи с этим можно заключить, что биоинертные имплантаты не влияют на регенерацию в зоне перелома. Биоактивные имплантаты с КФП покрытием, напротив, способствуют локальной регенерации сломанной конечности. При этом рентгеноаморфные слои усиливают репаративные процессы в удалении от места введения штифтов, кристаллизация покрытия способствует направлению вектора регенерации в область перелома (введения имплантата). Наличие на имплантатах КФС покрытия определяет запуск как локальной, так и системной репарации, приводящей к значительному накоплению пирфотеха в сломанной, а также в здоровой бедренных костях. При этом тетрациклиновая метка показала позитивное влияние биоактивных (кальций фосфатных) покрытий, в отличие от биоинертных, на процессы минерализации кости в месте перелома в условиях подвижности отломков.
Полученные данные могут быть основой, во-первых, для поиска покрытий, оптимально сочетающих биологические, физико-химические и механические характеристики, во-вторых, для выявления сферы клинического применения каждого вида имплантатов (травматология, ортопедия на фоне локального либо системного остеопороза, замедленная консолидация, несрастаю-щиеся переломы, ложные суставы и др.), в-третьих, для формирования панели имплантатов для конкретных клинических ситуаций на основе индивидуальных характеристик их поверхности.
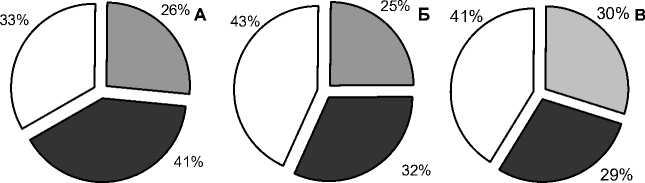
□ здоровая кость;
□ проксимальный сегмент;
о дистальный сегмент (с имплантатом) сломанного бедра
Рис. 3. Влияние различных типов кальций фосфатных покрытий на накопление радионуклидной метки в различных сегментах сломанной и здоровой бедренных костей крыс: А – кальций фосфатное плотное покрытие, рентгеноаморфное; Б – кальций фосфатное плотное покрытие кристаллическое; В – кальций фосфатное стеклокерамическое


