Зависимость выживаемости и метастазирования у больных колоректальным раком от транскрипционной активности РТ-генов
Автор: Кутилин Д.С., Кит О.И.
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 1 т.21, 2022 года.
Бесплатный доступ
Введение. Высокие показатели заболеваемости колоректальным раком и летальности от этого заболевания свидетельствуют об острой необходимости применения новых высокоспецифичных диагностических и прогностических молекулярных маркеров. В этом аспекте особый интерес представляют раково-тестикулярные антигены. Целью исследования явился анализ транскрипционной активности генов раково-тестикулярных антигенов у больных колоректальным раком с наличием метастазов (t1-4N1-2m1-2) и без них (t1-3N0m0) и её связи с отдаленной выживаемостью. Материал и методы. Величины относительной экспрессии 16 генов (MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-B1, MAGE-B2, GAGE-1, GAGE-3, GAGE-4, MAGE-C1, BAGE, XAGE3, NY-ESO1, SSX2, SCP1, PRAME1) определяли методом ПЦР в режиме реального времени. результаты. Обнаружены статистически значимое (р
Колоректальный рак, раково-тестикулярные антигены, экспрессия, метастазы, выживаемость
Короткий адрес: https://sciup.org/140290555
IDR: 140290555 | УДК: 616.34-006.6-033.2:575.113 | DOI: 10.21294/1814-4861-2022-21-1-37-46
Текст научной статьи Зависимость выживаемости и метастазирования у больных колоректальным раком от транскрипционной активности РТ-генов
Колоректальный рак (КРР) – группа злокачественных новообразований, которая занимает 4-е место среди всех онкологических заболеваний по числу летальных случаев. Ежегодно во всем мире фиксируют около 1 000 000 новых случаев КРР и более 700 000 смертей от этого заболевания. В Российской Федерации за последние 10 лет значительно увеличилась заболеваемость КРР. В настоящее время уровень летальности в течение 1-го года достигает 40 %, частота метастазов превышает 50 %, а пятилетняя выживаемость без специального лечения составляет не более 2 % [1]. Эти показатели свидетельствуют о необходимости применения новых высокоспецифичных диагностических и прогностических молекулярногенетических маркеров КРР. Из известных опухолевых антигенов особое внимание в этом плане привлекают раково-тестикулярные антигены (РТА, Cancer Testis Antigens (СТА)) [2–4].
При КРР транскрипционная активность генов раково-тестикулярных антигенов (РТ-генов) охарактеризована недостаточно полно [2, 5]. Первые исследования РТ-генов при КРР, проведенные в конце прошлого века, показали гиперэкспрессию MAGEA-1, MAGEA-2 и MAGEA-3 не более чем в 30 % случаев (в выборку были включены 54 больных), при этом экспрессия РТ-генов чаще была повышена у больных КРР с метастазами [2, 3]. Существует предположение, что агрессивные формы опухолей толстой кишки гиперэкспрессируют гены семейства MAGE, и это может способствовать метастазированию. Однако степень со-экспрессии данных генов или экспрессии, по крайней мере, одного РТ-гена из семейства MAGE практически не исследована в первичных опухолях толстой кишки (анализ транскрипционной активности проводился в основном в метастазах в печень), что накладывает определенные ограничения на выводы, сделанные на основании этих данных [2, 6].
Целью исследования явились анализ транскрипционной активности РТ-генов у больных КРР с наличием (T1–3N1–2M1–2) и без регионарных и отдаленных метастазов (T1–3N0M0) и её связи с отдаленной выживаемостью.
Материал и методы
В исследование были включены 30 больных с первичным раком толстой кишки (группа 1) и 30 больных с метастатическим раком толстой кишки (группа 2), проходивших лечение в Ростовском научно-исследовательском онкологическом институте в 2016–19 гг. Все пациенты, участвующие в исследовании, подписали информированное согласие. Выборку гистологически подтвержденных КРР-опухолей составили аденокарциномы (G2-G3).
Фрагменты тканей (опухолевой и условно нормальной) толстой кишки, полученные в ходе оперативного вмешательства, гомогенизировали в лизирующем буфере, содержащем 4М гуанидин тиоцианат, цитрат натрия, саркозил и меркаптоэтанол. Выделение суммарной РНК из лизата тканей проводили методом фенол-хлороформной экстракции. Для очистки от примесей геномной ДНК образцы суммарной РНК обрабатывали препаратами ДНК-азы-1. Концентрацию полученных препаратов РНК измеряли на флюориметре Qubit 2.0® (Invitrogen, США). Для оценки качества полученного препарата РНК проводили электрофорез в 2 % агарозном геле (интенсивность полос 18S и 28S в соотношении 1:1 свидетельствовала о приемлемом для дальнейшей работы качестве РНК) (рис. 1) [7].
Синтез кДНК проводили с использованием наборов «Reverta-L» («Интерлабсервис», Россия). Методом ПЦР в режиме реального времени (RT-qPCR)
Рис. 1. Электрофореграмма РНК, выделенной из тканей опухолей толстой кишки (визуализация на GelDoc XR PLUS)
Fig. 1. Electropherogram of RNA isolated from colon tumor tissues (visualized on GelDoc XR PLUS)
определяли величины относительной экспрессии 16 генетических локусов: MAGE-A1, MAGE-A2, MAGE-A3, MAGE-A4, MAGE-B1, MAGE-B2, GAGE-1, GAGE-3, GAGE-4, MAGE-C1, BAGE, XAGE3, NY-ESO1, SSX2, SCP1 и PRAME1 . Выбор референсного локуса осуществляли с использованием алгоритма, описанного в работе Д.И. Водолажского и др. [8]. При выполнении алгоритма вычисляются значения M Value и Stability (Ln(1/M)). Гены со значениями М менее 0,50 считаются «идеальными». В качестве референсных были выбраны два генетических локуса GAPDH (M=0,06, Stability=2,70) и GUSB (M=0,18, Stability=1,70) .
В исследовании использовали синтетические олигонуклеотиды (праймеры) (табл. 1), разработанные Д.И. Водолажским и соавт. [9]. RT-PCR-амплификацию (в трех технических повторах для каждого образца) проводили на термоциклере CFX96 («Bio-Rad», США) в 25 мкл реакционной смеси (содержащей 12 нг кДНК, 0,25мМ каждого из dNTP, 2,5 мМ MgCl2, 1х-ый ПЦР-буфер и 1 ед. акт. SynTaq ДНК-полимеразы с ингибирующими активность фермента антителами («Синтол», Россия), краситель EVA-Green и по 400 нМ прямого и обратного праймеров для референсных генов или гена-мишени) по следующей программе: t=950 С 3 мин, 40 циклов: t=950 С 10 сек, t=580 С (отжиг праймеров, Ta подбиралась экспериментальным путем с использованием температурного градиента) 30 сек (+регистрация сигнала), t=720 С 30 сек. Относительную экспрессию (RЕ) рассчитывали по формуле RЕ=2–ΔΔCt. Нормализацию результатов проводили по двум референсным генам GAPDH, GUSB и уровню экспрессии соответствующих генов мишеней в образцах нормальной ткани, последовательно по схеме, приведенной ниже [10]:
-
1. Нормализация по среднему референсных генов:
-
2. Расчёт 2 –ΔC( t ) по каждому гену для контрольной (условно-нормальная ткань) и опытной (опухолевая ткань) групп.
-
3. Расчёт медианы для матрицы данных 2 –ΔC( t ) по каждому гену для контрольной и опытной групп.
-
4. Нормализация по контрольной группе (окончательный результат – кратное различие):
ΔC(t) = C(t)target – C(t)g_reference, таблица 1/table 1
Панель праймеров [9]
primer panel [9]
-
n —AC ^медиана опытной группы
-
2 —AAC^t) _ ___________________________
2~ 1^С(Ъ)медиана контрольной группы
-
2 —АС ^.медиана опытной группы
-
— _______________________________ 2- (^C(t) медиана опытной группы—
-
2 —А С ^медиана контрольной групы
-
— АС ^медиана контрольной группы)
Статистический анализ выполняли с использованием STATISTICA 8.0 и IBM SPSS Statistics v.23.0. Оценку различий проводили с использованием критерия Манна–Уитни для порогового уровня статистической значимости р<0,05. Оценку выживаемости в клинических группах проводили с помощью метода Каплана–Мейера. Сравнение кривых выживаемости в различных группах пациентов, построенных по методу Каплан–Майера, проводилось с использованием логарифмического рангового критерия (Log-rank test) . Различия считались статистически значимыми при р<0,05 (95 % точности). Для изучения связи экспрессии РТ-генов с наблюдаемыми временами жизни больных КРР использовали модель пропорциональных интенсивностей Кокса. Силу влияния на выживаемость характеризовали β-стандартизированный коэффициент регрессии по величине и его статистическая значимость. Для проверки ограничений на параметры статистических моделей, оценённых на основе выборочных данных, использовали статистику (тест) Вальда. Оценку взаимосвязи сопряжения между признаками (летальный исход и экспрессия генов, метастазирование и экспрессия генов) осуществляли с помощью лог-линейного метода и метода построения таблиц сопряженности. Коэффициент сопряженности Пирсона χ 2 с поправкой на правдоподобие Мантеля–Хэнзеля позволял оценить силу взаимосвязи между признаками.
Результаты
В исследовании, проведенном на объединенной выборке, включающей 60 пациентов с наличием (T1–4N1–2M1–2) и без (T1–3N0M0) регионарных и отдаленных метастазов, обнаружено значимое (р<0,05) изменение транскрипционной активности РТ-генов: увеличение в 3,8 и 8,5 раза для SSX2 и PRAME1 соответственно и снижение для BAGE в 1,9 раза в опухолевой ткани относительно нормальной (рис. 2). Экспрессия генов MAGEA1, MAGEA2, MAGEA3, MAGEB1, MAGEB2, GAGE1, GAGE3, GAGE4, MAGEC1, MAGEA4, XAGE3, NY-
ESO1 и SCP1 в ткани опухоли значимо (р>0,05) не отличается от уровня экспрессии в нормальной ткани толстой кишки.
У больных КРР без метастазов обнаружено значимое (р<0,05) изменение транскрипционной активности РТ-генов: снижение для гена BAGE в 1,9 раза и увеличение для генов MAGEB1 и SSX2 в 2,0 и 5,2 раза соответственно в опухолевой ткани относительно нормальной (рис. 3). У больных КРР с метастазами выявлено значимое (р<0,05) увеличение транскрипционной активности РТ-генов GAGE1, SCP1 и PRAME1 в 2,1; 3,1 и 9,9 раза соответственно, а также снижение транскрипционной активности генов MAGE-A2, MAGE-B1, MAGE-B2, GAGE4 и NY-ESO1 в 2,8; 2,3; 2,7; 3,1 и 2,5 раза соответственно в опухолевой ткани относительно нормальной (рис. 3). При этом в данной группе в опухолевой ткани экспрессия генов GAGE1 и SCP1 была в 3,3 и 3,6 раза соответственно выше (р<0,05), чем экспрессия у пациентов без метастазов. Экспрессия генов MAGE-A2, MAGE-B1, MAGE-B2, GAGE3, GAGE4, NY-ESO1 и SSX2 в опухолевой ткани была значимо ниже в 2,6; 4,7; 3,8; 2,4; 3,1; 3,6 и 3,1 раза соответственно (р<0,05), чем у пациентов без метастазов (рис. 3).
Дифференциально для пациентов 1 и 2-й групп проведена оценка выживаемости (рис. 4). В группе 1 летальный исход наблюдался у 2 (6,7 %) больных, 3-летняя выживаемость составила 93,3 % (n=28). В группе 2 летальный исход наблюдался у 22 (73,3 %) больных, 3-летняя выживаемость составила 26,7 % (n=8). Медиана общей выживаемости больных в группе 2 составила 35 мес. В группе 2 у всех больных в разные сроки за 36 мес возникли отдаленные метастазы. В зависимости от сроков их появления у пациентов этой группы рассчитана трехлетняя динамика безметастати-ческой выживаемости (рис. 5), которая составила 24 мес, нижний квартиль (25 %) – 15,5 мес, верхний квартиль – 28,5 мес. Таким образом, у 50 % пациентов безметастатическая выживаемость равнялась 15,5–28,5 мес.
С использованием регрессионного анализа оценено влияние экспрессии РТ-генов в ткани опухоли на общую выживаемость больных всей выборки, объединенных в группы 1 и 2. Транскрипционная активность РТ-генов ранжирована следующим образом: 0 – снижена в опухоли относительно нормы, 1 – не изменена в опухоли относительно нормы, 2 – повышена в опухоли относительно нормы, 4 – повышена в опухоли относительно нормы более чем в 9,0 раз. Установлено, что на общую выживаемость в обеих группах значимое влияние (р<0,001) оказывала экспрессия генов GAGE1, BAGE, SSX2, MAGEA2 и SCP1 (табл. 2). β-стандартизированные коэффициенты регрессии, выражающие силу взаимосвязи, имели высокие значения. Статистика Вальда имела высокое значение, что с большой вероятностью позволяло отвергнуть нулевую ги-
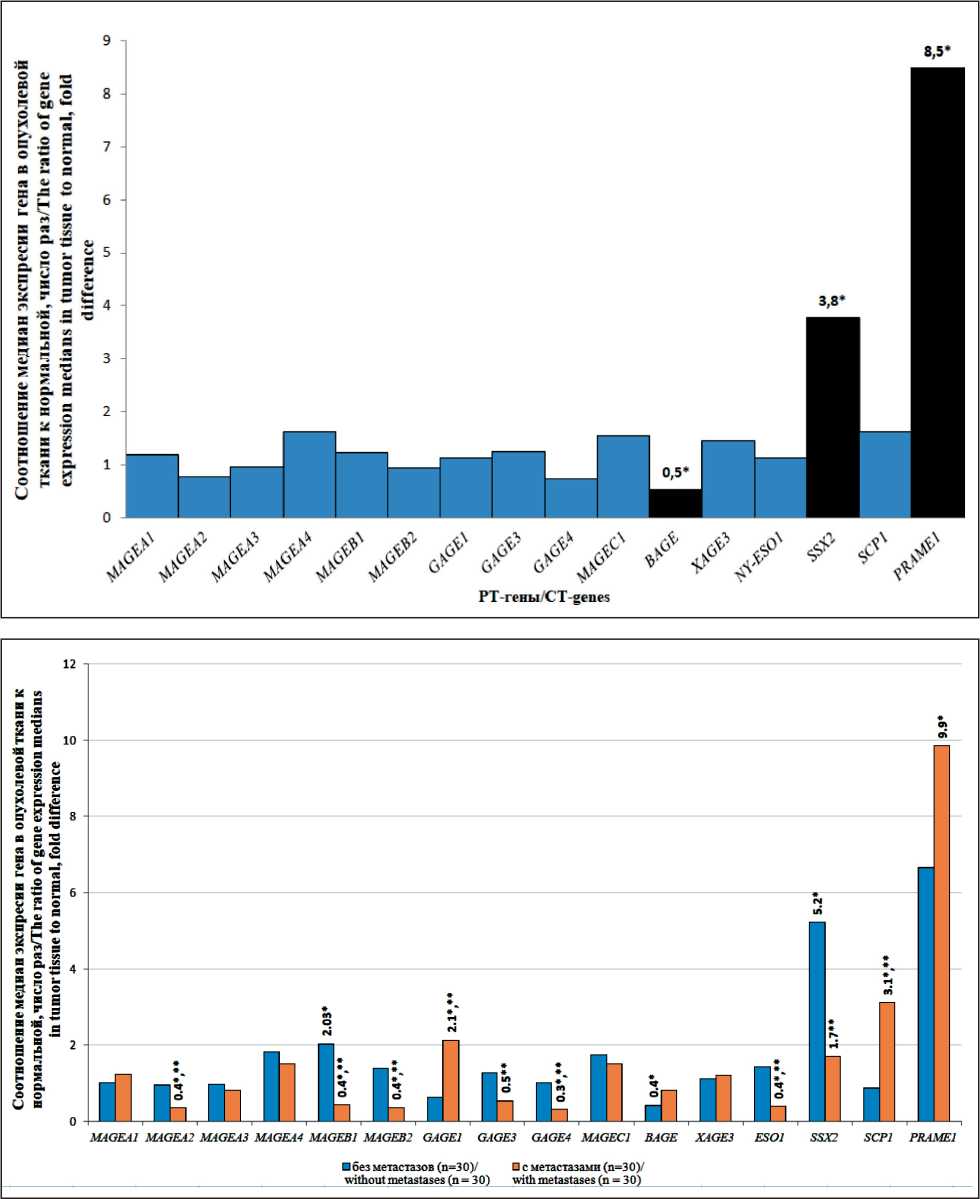
Рис. 2. Транскрипционная активность РТ-генов в опухолевой ткани толстой кишки относительно нормальной (n=60). Примечание: * – отличия между опухолевой и нормальной тканью толстой кишки статистически значимы (р<0,05)
Fig. 2. Transcriptional activity of CT genes in colon tumor tissue compared to normal tissue (n=60). Note: * – statistically significant differences between tumor and normal tissues of the colon (p<0.05)
Рис. 3. Транскрипционная активность РТ-генов в опухолевой ткани толстой кишки относительно нормальной у пациентов с метастазами (n=30) и без них (n=30). Примечание: * – отличия между опухолевой и нормальной тканью статистически значимы (р<0,05);
** – отличия между пациентами с метастазами и без них статистически значимы (р<0,05)
Fig. 3. Transcriptional activity of CT genes in tumor tissue compared to normal tissue in patients with metastases (n=30) and without metastases (n=30).
Note: * – statistically significant differences between tumor and normal tissues (p<0,05); ** – statistically significant differences between patients with and without metastases (p<0,05)
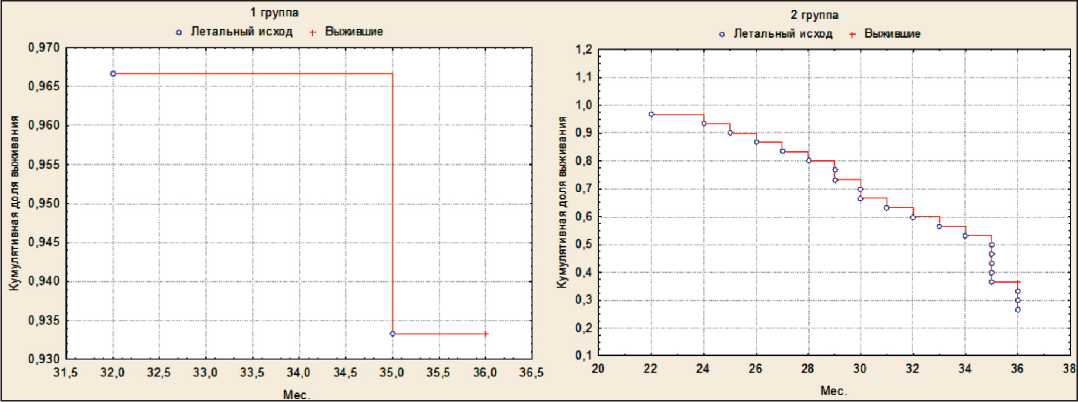
Рис. 4. Кривая Каплана–Мейера общей выживаемости больных 1 и 2-й группы Fig. 4. Kaplan–Meier curve of overall survival of patients in groups 1 and 2
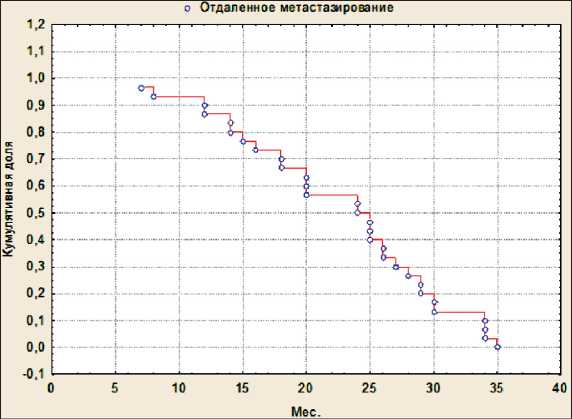
Рис. 5. Кривая Каплана–Мейера безметастатической выживаемости больных 2-й группы Fig. 5. Kaplan–Meier curve of metastasis-free survival in group 2 patients
таблица 2/table 2
результаты регрессионной модели кокса пропорциональных рисков по сопряжению экспрессии генов в опухолевой ткани и общей выживаемости больных крр
Results of the cox regression model of proportional risks for the coupling of gene expression in tumor tissue and overall survival of patients with colorectal cancer
сопряжения между экспрессией генов и общей выживаемостью в течение 36 мес после операции coupling characteristics between gene expression and overall survival 36 months after surgery
|
Ген/Gene |
Критерий/Criterion |
Величина критерия/Criterion value |
р |
|
MAGEB1 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
80,76 |
<0,0001 |
|
GAGE1 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
31,27 |
<0,0001 |
|
NY-ESO1 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
61,92 |
<0,0001 |
|
BAGE |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
31,27 |
<0,0001 |
|
SSX2 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
53,47 |
<0,0001 |
|
MAGEA2 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
39,80 |
<0,0001 |
|
SCP1 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
39,80 |
<0,0001 |
Примечание: МХ – поправка Мантеля–Хэнзеля.
Note: Mantel–Haenszel test.
таблица 5/table 5
направленность изменения экспрессии генов, ассоциированная с развитием летального исхода direction of changes in gene expression associated with the development of a lethal outcome
Results of the cox regression model of proportional risks for the coupling of gene expression in tumor tissue and metastasis
распределение пациентов 1 и 2-й групп в зависимости от рангов экспрессии генов в опухолевой ткани и отдаленного метастазирования distribution of patients in groups 1 and 2 depending on the ranks of gene expression in tumor tissue and distant metastasis
характеристики сопряжения между экспрессией генов и метастазированием в течение 36 мес после операции coupling characteristics between gene expression and metastasis 36 months after surgery
|
Ген/Gene |
Критерий/Criterion |
Величина критерия/ Criterion value |
р |
|
MAGEB1 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
69,41 |
<0,0001 |
|
GAGE1 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
83,18 |
<0,0001 |
|
NY-ESO1 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
40,85 |
<0,0001 |
|
BAGE |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
83,18 |
<0,0001 |
|
SSX2 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
60,99 |
<0,0001 |
|
MAGEA2 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
50,25 |
<0,0001 |
|
SCP1 |
Критерий Пирсона χ 2 с МХ/ Pearson's criterion χ 2 with MH |
50,25 |
<0,0001 |
Примечание: МХ – поправка Мантеля–Хэнзеля.
Note: Mantel – Haenszel test.
таблица 9/table 9
направленность изменения экспрессии генов, ассоциированная с развитием отдаленного метастазирования, по сравнению с пациентами без отдаленных метастазов direction of changes in gene expression associated with the development of distant metastasis, compared with patients without distant metastases
В табл. 3 представлены данные по распределению пациентов с КРР в зависимости от летального исхода и ранга экспрессии изучаемых генов в опухолевой ткани. Сопряжение между экспрессией генов MAGEB1, GAGE1, NY-ESO1, BAGE, SSX2, MAGEA2, SCP1 и общей выживаемостью в течение 36 мес после операции было статистически значимым (табл. 4). Анализ таблиц кросстабуляции выявил различную направленность изменения экспрессии генов, ассоциированных с развитием летального исхода, по сравнению с пациентами без прогрессирования (табл. 5).
Корреляция между транскрипционной активностью РТ-генов в опухолевой ткани и метастазированием у больных КРР была установ- лена только для гена MAGEB1. Отрицательный β-стандартизированный коэффициент регрессии между экспрессией MAGEB1 и метастазированием свидетельствовал о высоком влиянии снижения экспрессии этого гена (по сравнению с больными КРР без метастазов).
Распределение пациентов групп 1 и 2 в зависимости от рангов экспрессии генов в опухолевой ткани и отдаленного метастазирования представлено в табл. 6. Распределение частот в таблицах сопряженности подвергали логлинейному анализу (табл. 7–8). При этом установлено, что от экспрессии изучаемых генов зависела также и реализация отдаленного метастазирования (р<0,0001). Логлинейный анализ более адекватно отражал сопряжение экспрессии генов в опухолевой ткани с отдаленным метастазированием по сравнению с регрессионным анализом. Направленность измене- ния экспрессии изучаемых генов, ассоциированная с развитием отдаленных метастазов, отражена в табл. 9.
Таким образом, у больных КРР установлены закономерности, связывающие транскрипционную активность РТ-генов с выживаемостью и метастазированием.
Обсуждение
У больных метастатическим и неметастатическим КРР профили экспрессии РТ-генов значительно отличаются. В обеих группах наблюдается дифференциальная экспрессия ряда РТ-генов, относящихся к разным классам: CT-X ( MAGEB1, SSX2 и др.) и non-X ( SCP1 и др.), тестикулярно-селективным ( SSX2, GAGE1, SCP1 ) и тестикулярно-ограниченным ( MAGEB1/2 ). Изменение экспрессии генов SSX2, GAGE1, MAGEB1, MAGEB2, GAGE3 , GAGE4 и NY-ESO1 согласуется с данными, полученными J. Sammut et al. [6]. В отличие от данных H.M. Shantha Kumara et al. [11] и M. Li et al. [12] для РТА из семейства MAGEA в нашем исследовании не выявлено значимого увеличения транскрипционной активности. Следует отметить, что в основном (исключение ген BAGE ) только в опухолевой ткани толстой кишки пациентов с метастазами наблюдается значительное снижение транскрипционной активности ряда РТ-генов относительно опухолевой и нормальной ткани пациентов без метастазов. Снижение экспрессии данных генов может иметь важное значение для развития метастазирования. РТА достаточно давно используются в качестве мишений для иммунотерапии основанной на ДКВ (дендритно-клеточных вакцинах), и хорошо известно, что увеличение
Список литературы Зависимость выживаемости и метастазирования у больных колоректальным раком от транскрипционной активности РТ-генов
- Кутилин Д.С., Кошелева Н.Г., Гусарева М.А., Харагезов Д.А., Донцов В.А., Полуэктов С.И., Зема Т.В., Лиман Н.А., Шляхова О.В., Удаленкова И.А. Влияние транскрипционной активности генов, регулирующих репарацию ДНК, на эффективность лучевой терапии опухолей прямой кишки. Современные проблемы науки и образования. 2019; 6: 142. [Kutilin D.S., Kosheleva N.G., Gusareva M.A., Kharagezov D.A., Dontsov V.A., Poluektov S.I., Zema T.V., Liman N.A., Shlyakhova O.V., Udalenkova I.A. The effect of transcriptional activity of genes that regulate DNA repair on the effectiveness of radiation therapy of rectal tumors. Modern Problems of Science and Education. 2019; 6: 142. (in Russian)].
- Солдатова К.И., Колесников Е.Н., Габричидзе П.Н. Особенности транскрипционной активности раково-тестикулярных антигенов у больных метастатическим и неметастатическим колоректальным раком. Современные проблемы науки и образования. 2018; 5: 108. [Soldatova K.I., Kolesnikov E.N., Gabrichidze P.N. Transcriptional activity features of cancer-testis antigens in patients with metastatic and nonmetastatic colorectal cancer. Modern Problems of Science and Education. 2018; 5: 108. (in Russian)].
- Кит О.И., Солдатова К.И., Кутилин Д.С., Водолажский Д.И. Раково-тестикулярные антигены в диагностике опухолей толстой кишки. Современные проблемы науки и образования. 2018; 2: 10. [Kit O.I., Soldatova K.I., Kutilin D.S., Vodolazhsky D.I Cancer-testis antigens in colon tumors diagnostics. Modern Problems of Science and Education. 2018; 2: 10. (in Russian)].
- Chi Soh J.E., Abu N., Jamal R. The potential immune-eliciting cancer testis antigens in colorectal cancer. Immunotherapy. 2018 Sep; 10(12): 1093–1104. doi: 10.2217/imt-2018-0044.
- Голышко П.В., Новиков Д.В., Ананьев С.В., Барышников К.А., Новиков В.В. Раково-тестикулярные гены в крови и опухоли больных колоректальным раком. Российский биотерапевтический журнал. 2015; 14(1): 19–24. [Golyshko P.V., Novikov D.V., Ananev S.V., Baryshnikov K.A., Novikov V.V. A Search for cancer-testis genes expression in blood and biopsy of patients with colorectal cancer. Russian Journal of Biotherapy. 2015; 14(1): 19–24. (in Russian)].
- Sammut J., Wakeman J.A., Stuart N., McFarlane R.J. Cancer/Testis Antigens and Colorectal Cancer. J Genet Syndr Gene Ther. 2013; 4: 149.
- Кутилин Д.С., Никитин И.С., Кит О.И. Особенности экспрессии генов некоторых транскрипционных факторов при малигнизации тканей тела матки. Успехи молекулярной онкологии. 2019; 6(1): 57–62. [Kutilin D.S., Nikitin I.S., Kit O.I. Features of some transcription factors gene expression in the malignancy tissues of the corpus uteri. Advances in Molecular Oncology. 2019; 6(1): 57–62. (in Russian)].
- Водолажский Д.И., Кутилин Д.С., Солдатова К.И. Изучение стабильности экспрессии референсных генетических локусов при малигнизации тканей толстой кишки. Сборник материалов 5-й итоговой научной сессии молодых учёных РостГМУ. 2018: 33–34. [Vodolazhsky D.I., Kutilin D.S., Soldatova K.I. Study of the stability of expression of reference genetic loci during malignancy of colon tissues. 5 itogovaya nauchnaya sessiya molodykh uchonykh. RostGMU. 2018: 33–34. (in Russian)].
- Водолажский Д.И., Кутилин Д.С., Могушкова Х.А., Кит О.И. Транскрипционный профиль раково-тестикулярных антигенов у больных раком молочной железы. Медицинская иммунология. 2018; 20(3): 38390. [Vodolazhskiy D.I., Kutilin D.S., Mogushkova Kh.A., Kit O.I. Transcriptional profile of cancer-testicular antigens in patients with breast cancer. Medical Immunology. 2018; 20(3): 383–90. (in Russian)].
- Кутилин Д.С., Димитриади С.Н., Водолажский Д.И., Франциянц Е.М., Кит О.И. Влияние тепловой ишемии-реперфузии на экспрессию апоптоз-регулирующих генов в почечной ткани больных с почечно-клеточным раком. Нефрология. 2017; 21(1): 80–6. [Kutilin D.S., Dimitriadi S.N., Vodolazhsky D.I., Frantsiyants H.M., Kit O.I. Effect of thermal ischemia-reperfusion on expression of apoptosis-regulating genes in the renal tissue of patients with renal cell carcinoma. Nephrology. 2017; 21(1): 80–6. (in Russian)].
- Shantha Kumara H.M., Grieco M.J., Caballero O.L., Su T., Ahmed A., Ritter E., Gnjatic S., Cekic V., Old L.J., Simpson A.J., Cordon-Cardo C., Whelan R.L. MAGE-A3 is highly expressed in a subset of colorectal cancer patients. Cancer Immun. 2012; 12: 16.
- Li M., Yuan Y.H., Han Y., Liu Y.X., Yan L., Wang Y., Gu J. Expression profile of cancer-testis genes in 121 human colorectal cancer tissue and adjacent normal tissue. Clin Cancer Res. 2005 Mar 1; 11(5): 1809–14. doi: 10.1158/1078-0432.CCR-04-1365.
- Wei X., Chen F., Xin K., Wang Q., Yu L., Liu B., Liu Q. Cancer-Testis Antigen Peptide Vaccine for Cancer Immunotherapy: Progress and Prospects. Transl Oncol. 2019 May; 12(5): 733–8. doi: 10.1016/j.tranon.2019.02.008.
- Salmaninejad A., Zamani M.R., Pourvahedi M., Golchehre Z., Hosseini Bereshneh A., Rezaei N. Cancer/Testis Antigens: Expression, Regulation, Tumor Invasion, and Use in Immunotherapy of Cancers. Immunol Invest. 2016 Oct; 45(7): 619–40. doi: 10.1080/08820139.2016.1197241.


