Жизнеспособность иммобилизованной микрокапсулированием культуры Bifidobacterium bifidum в кисломолочном напитке и смоделированных желудочно-кишечных жидкостях
Автор: Вобликова Т. В.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Статья в выпуске: 3 т.22, 2019 года.
Бесплатный доступ
Существующие технологии обогащенных кисломолочных напитков предполагают обогащение продукта живыми микроорганизмами, так называемыми пробиотиками, в основном лактобациллами и бифидобактериями. Однако жизнеспособность пробиотиков и качество многих обогащенных пробиотиками продуктов по-прежнему представляют собой серьезную проблему, поскольку количество жизнеспособных пробиотиков и особенно бифидобактерий уменьшается в молочных продуктах во время хранения и впоследствии во время желудочно-кишечного транзита. Для защиты пробиотических культур в процессе обработки, хранения в пищевых продуктах и во время желудочно-кишечного транзита исследовалась одна из инновационных технологий – микроинкапсуляция. Целью исследования было изучение влияния иммобилизации Bifidobacterium bifidum в структуре альгинатных микрокапсул на жизнеспособность штамма в процессе хранения в кисломолочном напитке и воздействия на него смоделированных желудочно-кишечных жидкостей. Объектом исследования стали штамм Bifidobacterium bifidum 791, иммобилизованный микрокапсулированием в альгинатную матрицу, и микрокапсулы, состоящие из природных биодеградируемых природных полимеров. Исследовано влияние альгинатной матрицы на морфологические особенности Bifidobacterium bifidum 791 в результате микроинкапсуляции. В микропрепарате не отмечено инвалютных измененных форм, что свидетельствует об отсутствии негативного влияния состава микрокапсулы на бифидобактерии. Установлено значительное снижение количества жизнеспособных бифидобактерий в модельной среде желудка (pH 1,2) до 62,2 % в образце, не защищенном микрокапсулой. В образце иммобилизованного Bifidobacterium bifidum 791 в структуру гидрогеля альгината происходило снижение концентрации жизнеспособных бифидобакетрий на 37,5 % от исходной концентрации при прохождении модельной среды желудка (рН 1,2). Полученные микрокапсулы имели замкнутую поверхность и средний диаметр 150 мкм. Концентрация клеток бифидобактерий в кисломолочном напитке, содержащем инкапсулированные пробиотики, не снижалась ниже рекомендуемого уровня (106–107 КОЕ/г) в течение 14 дней хранения. Кисломолочный напиток отвечал требованиям Технического регламента Таможенного союза "О безопасности молока и молочных продуктов" (ТС ТР 033/2013) по физико-химическим показателям.
Пробиотики, микрокапсулирование, кисломолочный напиток, овечье молоко, probiotics, microencapsulation, dairy drink, sheep milk
Короткий адрес: https://sciup.org/142221501
IDR: 142221501 | УДК: 663.1 | DOI: 10.21443/1560-9278-2019-22-3-305-313
Текст статьи Жизнеспособность иммобилизованной микрокапсулированием культуры Bifidobacterium bifidum в кисломолочном напитке и смоделированных желудочно-кишечных жидкостях
Ставропольский государственный аграрный университет, г. Ставрополь, Россия; ORCID: , e-mail:
Пробиотики характеризуются как живые микроорганизмы, которые при введении в адекватных количествах приносят пользу здоровью хозяина. Кисломолочные напитки являются одними из старейших продуктов и самыми распространенными молочными продуктами, потребляемыми во всем мире. С годами потребители осознали преимущества употребления ферментированных продуктов, содержащих пробиотики. Целью их производства и потребления является улучшение здоровья и снижение частоты возникновения желудочно-кишечных заболеваний (McClements et al., 2009). Растущая популярность обогащенных кисломолочных напитков побуждает предприятия пищевой промышленности и исследователей разрабатывать способы повышения ценности продуктов для привлечения потребителей, заботящихся о своем здоровье (Coghetto et al., 2016). В настоящее время разработаны технологии обогащенных молочных напитков, которые предполагают обогащение продукта живыми микроорганизмами, так называемыми пробиотиками: в основном лактобациллами и бифидобактериями. Однако жизнеспособность пробиотиков и качество многих обогащенных пробиотиками продуктов по-прежнему представляют собой серьезную проблему, поскольку количество жизнеспособных пробиотиков и особенно бифидобактерий со временем уменьшается в молочных продуктах во время хранения и впоследствии во время желудочно-кишечного транзита. Плохая выживаемость и жизнеспособность бифидобактерий в кисломолочных напитках приводит к количеству менее 10 6 –10 7 КОЕ/г, необходимому для оказания пользы для здоровья (Coghetto et al., 2016).
На выживаемость пробиотиков в ферментированных продуктах влияет целый ряд факторов, в том числе рН, растворенный кислород, температура хранения и последующее подкисление. Чтобы защитить пробиотические культуры во время обработки, хранения в пищевых продуктах и во время желудочнокишечного транзита, были исследованы инновационные технологии, такие как микроинкапсуляция. Микроинкапсуляция может изменять цвет, форму, объем, чувствительность к давлению, чувствительность к теплу и светочувствительность инкапсулированного вещества. В настоящее время микрокапсуляция применяется в различных областях промышленности, таких как пищевая, текстильная, фармацевтическая, косметическая и агрохимическая отрасли (Krasaekoopt et al., 2014; Xiao et al., 2014; Huang et al., 2006; Bae et al., 2008; Scalia et al., 2011; Lam et al., 2012; 2014; Alonso et al., 2014; Onwulata, 2013; Трубников и др., 2015; Просеков и др., 2018; Ганина и др., 2012). Этот метод позволяет улучшить и/или модифицировать характеристики и свойства активного материала, а также его защиту, стабилизацию и медленное высвобождение.
Цель исследования – изучение влияния иммобилизации Bifidobacterium bifidum в структуре альгинатных микрокапсул на жизнеспособность штамма в процессе воздействия смоделированных желудочно-кишечных жидкостей и хранения в кисломолочном напитке из овечьего молока.
Материалы и методы
Объектом исследования являются штамм Bifidobacterium bifidum 791 (ООО "Экополис", г. Ковров), иммобилизованный микрокапсулированием в альгинатную матрицу, и микрокапсулы, состоящие из природных биодеградируемых полимеров. Были проведены исследования, направленные на изучение возможности микрокапсулирования бифидобактерий в альгинатном геле методом экструзии. Таким образом, исследовались микрокапсулы, содержащие бифидобактерии и резистентный крахмал в структуре микрокапсулы и без него. Высушенные и увлажненные микрокапсулы оценивали для количественного определения их среднего диаметра и распределения по размерам, а также характеристики их морфологии.
Способ получения бактериального концентрата бифидобактерий не ниже 10 9 в жидкой форме предусматривал приготовление питательной среды для культивирования бифидобактерий. В приготовленную питательную среду вносили сублимированную культуру штамма Bifidobacterium bifidum 791 и культивировали при температуре 37–38 °С до получения микробной массы с содержанием бифидобактерий не менее 10 8 КОЕ/мл. Далее производили второй пассаж, который предусматривал внесение 10 % выращенной культуры штамма Bifidobacterium bifidum 791 в среду культивирования и накопления при температуре 37–38 °С. Третий пассаж предусматривал внесение 10 % выращенной культуры штамма Bifidobacterium bifidum 791 в среду культивирования и накопления при температуре 37–38 °С в течение 6 ч. Затем происходило центрифугирование при температуре 4 °С в течение 20 мин при 5000 об/мин. Полученный бактериальный концентрат содержал не менее 10 10 КОЕ/мл. Он использовался для получения микрокапсул.
Микрокапсулы были получены в соответствии с технологией экструзии. Основой для получения микрокапсул являлись растворы, один из которых содержал 1 % альгината натрия + 1 % резистентного крахмала, второй – 1 % альгината натрия. После полной дисперсии полимеров в растворы добавляли штамм Bifidobacterium bifidum 791; поликомпонентный состав распыляли в 0,1М CaCl 2 при помощи аэрографа, соединенного с воздушным компрессором. Образовавшиеся частицы перемешивали в течение 30 мин в растворе CaCl 2 для обеспечения полного гелеобразования, затем удаляли из раствора.
Определение специфической активности капсулированных пробиотиков проводили согласно МР 1.2.2566-09 "Оценка безопасности наноматериалов in vitro и в модельных системах in vivo", ОФС.1.2.1.0005.15 "Растворимость" 1 .
Общую морфологию микрокапсул определяли с помощью сканирующего электронного микроскопа (SEM) (MIRA3, TESCAN). Микрокапсулы помещались на подложку столика микроскопа с помощью двухсторонней ленты, покрытой золотым напылением. Ускоряющее напряжение микроскопа 5 кВ. Диаметры микрокапсул определяли с помощью программного обеспечения ImageJ (NIH, США). Средний диаметр определялся путем измерения 100 микрокапсул.
Исследовали сохранение жизнеспособности бифидобактерий в процессе хранения кисломолочного напитка из овечьего молока при 4 °С в течение 21 дня. Кисломолочный напиток был получен из овечьего молока, пастеризованного при 63 °C в течение 30 мин перед изготовлением с применением Streptococcus ssp. thermophilus и Lactobacillus delbrueckii ssp. Bulgaricus (ФГУП "Экспериментальная биофабрика", г. Углич).
Все опыты были выполнены не менее чем в трех повторностях. Объективность выбора количества повторностей опытов и минимальный объем выборки при получении результатов представленных исследований определялся на основании статистической обработки экспериментальных данных, обеспечивающих статистическую надежность 0,95 (или 95 %) и уровень значимости ˂ 0,05 (или 5 %). Статистическая обработка данных выполнялась при помощи многофункционального программного обеспечения Statistica 6.0.
Результаты и обсуждение

а б в
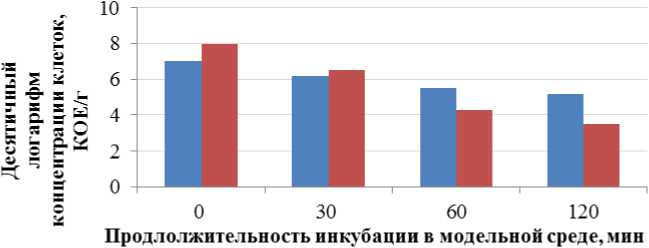
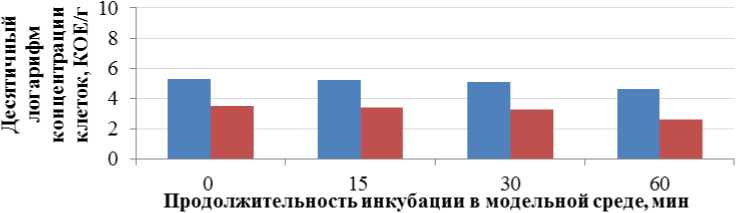
Результаты изучения выживаемости пробиотических микроорганизмов в альгинатной матрице в условиях in vitro, имитирующих процесс пищеварения у человека, представлены на рис. 2–5.
-
■Опытный образец (защищенный микрокапсулой)
-
■ Контрольный образец (не защищенный микрокапсулой)
Fig. 2. Survival rate of bifidobacteria in the stomach model, pH 1.2
-
■ Опытный образец (защищенный микрокапсулой)
-
■ Контрольный образец
(не защищенный микрокапсулой)
Рис. 3. Выживаемость бифидобактерий в модельной среде 12-перстной кишки, pH 4,5
Fig. 3. Survival rate of bifidobacteria in the duodenum environment model, pH 4.5
s
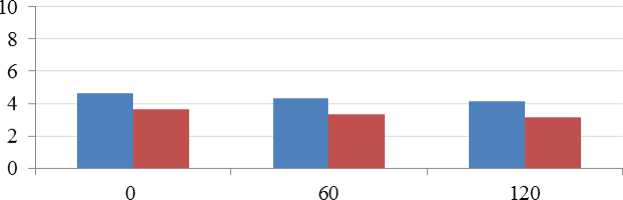
Продолжительность инкубации в модельной среде, мин
-
■ Опытный образец (защищенный микрокапсулой)
-
■ Контрольный образец
(не защищенный микрокапсулой)
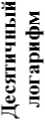
Рис. 4. Выживаемость бифидобактерий в модельной среде тощей кишки, pH 6,8
Fig. 4. Survival rate of bifidobacteria in the jejunum environment model, pH 6.8
Продолжительность инкубации в модельной среде, мин
Рис. 5. Выживаемость бифидобактерий в модельной среде подвздошной кишки, pH 7,2
Fig. 5. Survival rate of bifidobacteria in the ileum environment model, pH 7.2
Полученные экспериментальные данные согласуются с результатами некоторых исследований, свидетельствующих о том, что микрокапсулы на основе альгината могут обеспечить ограниченную защиту пробиотиков из-за его специфических свойств. Например, микрокапсулы, полученные методом экструзии с использованием альгината в качестве основного носителя и биополимера, не являются стабильными в кислой среде. Кроме того, микросферы, полученные на основе альгината, характеризуются пористой структурой, обеспечивают легкую диффузию кислоты внутрь и из микросфер. Эти недостатки могут быть эффективно устранены путем смешивания альгината с другими полимерами или применения структурной модификации альгината с использованием различных добавок (Hassan et al., 2014).
Для повышения стабильности бифидобактерий в состав биодеградируемых микрокапсул вводился резистентный крахмал. Введение резистентного крахмала в структуру микрокапсул способствовало улучшению защиты и сохранению жизнеспособности микрокапсулированных бифидобактерий до 87 % от исходной концентрации при прохождении модельных сред, имитирующих процесс пищеварения человека. Полученные данные согласуются с результатами некоторых исследователей, которые также сообщали о более высокой выживаемости бактерий в альгинатных микрокапсулах, содержащих природные полимеры (фруктоолигосахариды, галактоолигосахариды / инулин, фруктоолигосахариды, моносахариды и галактоолигосахариды соответственно), в смоделированных суровых условиях желудочно-кишечного тракта по сравнению с микрочастицами альгината без пребиотиков (Coghetto et al., 2016; Burgain et al., 2011).
Разработанный способ получения микрокапсул на основе биодеградируемых нетоксичных полимеров природного происхождения позволил получить микрокапсулы с замкнутой поверхностью. Лиофилизированные микрочастицы имели средний диаметр 150 мкм (матрица из альгината и резистентного крахмала) и 97 мкм (альгинатная матрица), микроструктура поверхности микрокапсул представлена на рис. 6.

HITACHI 2017.02.27 15:36 HL D6,0 x6,0k lOum HITACHI 2017.02.27 15:30 HL D8.1 x800 100 um
Рис. 6. Морфология и микроструктура лиофилизированных микрочастиц (альгинат + резистентный крахмал), полученная с помощью сканирующей электронной микроскопии:
а – поверхность микрочастицы; б – микрочастицы (альгинат + резистентный крахмал)
Fig. 6. Morphology and microstructure of lyophilized microparticles (alginate + Hi-Maize) obtained using scanning electron microscopy: а – the surface of the microparticles; б – the microparticles (alginate + Hi-Maize)
Исследование сохранения жизнеспособности бифидобактерий в процессе хранения кисломолочного напитка из овечьего молока проводилось при 4 °С в течение 21 дня. Кисломолочный напиток был получен из овечьего молока, пастеризованного при 63 °C в течение 30 мин перед изготовлением с применением Streptococcus ssp. thermophilus и Lactobacillus delbrueckii ssp. Bulgaricus.
Стоит отметить более высокие уровни фактического количества жизнеспособных клеток, инкапсулированных в модифицированной альгинатной матрице в процессе хранения кисломолочного напитка из овечьего молока при +4 °С (рис. 7).
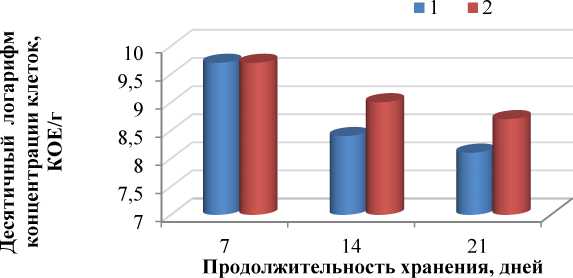
Рис. 7. Выживание культуры свободной и инкапсулированной Bifidobacterium bifidum 791 в кисломолочном напитке из овечьего молока при 4 °С в течение 21 дня: 1 – свободная;
2 – инкапсулированная
Fig. 7. Survival of culture of the free and encapsulated Bifidobacterium bifidum 791 in dairy drink from sheep milk at 4 °C within 21 days: 1 – free; 2 – encapsulated
Концентрация клеток бифидобактерий в кисломолочном напитке, содержащем инкапсулированные пробиотики, не снижалась ниже рекомендуемого уровня (10 7 КОЕ/г) в течение 21 дня хранения. Титруемая кислотность на седьмые сутки хранения кисломолочного напитка – от 75 до 88 °Т. Кисломолочный напиток отвечал требованиям Технического регламента Таможенного союза "О безопасности молока и молочных продуктов" (ТС ТР 033/2013) 5 по физико-химическим показателям.
Заключение
За помощь в подготовке статьи выражаем благодарность исполняющей обязанности руководителя лаборатории биологии бифидобактерий ФБУН МНИИЭМ им. Г. Н. Габричевского Роспотребнадзора, канд. биол. наук Ольге Геннадьевне Жиленковой.
Научно-исследовательская работа выполнена в рамках первого этапа (подэтап № 1) грантовой программы "Старт" Фонда содействия инновациям по договору № 1402/ГС1/22672 о предоставлении гранта на проведение научно-исследовательских и опытно-конструкторских работ от 20.07.2016 г. ООО "БИОМИЛКЮГ" по теме "Разработка биотехнологии кисломолочного напитка с использованием иммобилизованных пробиотических культур микроорганизмов".


