Значение адренорецепторов артерий при симпатолизисе в регуляции кровотока в работающих мышцах
Автор: Ананьев Владимир Николаевич, Ананьев Георгий Владимирович, Ананьева Ольга Васильевна
Журнал: Человек. Спорт. Медицина @hsm-susu
Рубрика: Физиология
Статья в выпуске: 2 т.23, 2023 года.
Бесплатный доступ
Цель. Изучение физиологических механизмов увеличения кровотока в работающих поперечно-полосатых мышцах при функциональной блокаде влияния симпатической нервной системы и ее медиатора норэпинефрина на адренорецепторы артерий мышц при симпатолизисе. Материалы и методы. Эксперименты провели на кроликах под наркозом. В опытах было две группы животных: контрольная (n = 20) и опытная (n = 15). В опытной группе проводили моделирование работы мышц задней конечности при сокращении мышц с помощью электростимулятора. В контрольной группе электростимулятор не применялся. В контрольной и опытной группах животных по одной методике перфузировали насосом через бедренную артерию мышцы задней конечности. На выходе насоса стоял датчик давления фирмы «Моторола» MPX5100DP, и через аналогово-цифровой преобразователь давление регистрировалось компьютером. Изменение давления в бедренной артерии на выходе насоса характеризовало прессорную активность а1-адренорецепторов артерий на введение норэпинефрина в контрольной группе и на фоне сокращения мышц электростимулятором в опытной группе. Результаты. Исследование показало, что на фоне сокращения мышц значительно снижается сосудосуживающее действие норэпинефрина при стимулировании а1-адренорецепторов артерий конечности. Наши опыты показали, что при низких дозах (0,5 мкг/кг) сосудосуживающее действие норэпинефрина на артерии конечности при сокращении мышц уменьшилось в 21,7 раза. При средних дозах норэпинефрина (5 мкг/кг) симпатолизис уменьшился и стал в 5,7 раза меньше контроля. При высоких дозах норэпинефрина (30 мкг/кг) симпатолизис при сокращении мышц уменьшил его сосудосуживающее действие в 1,9 раза. Заключение. Выявленные эффекты фармакокинетики и фармакодинамики норэпинефрина на а1-адренорецепторы артерий раскрывают новые механизмы симпатолизиса в регуляции кровотока в работающих мышцах за счет уменьшения чувствительности а1-адренорецепторов. Величина симпатолизиса уменьшается с увеличением дозы норэпинефрина.
Кролики, симпатолизис, электростимуляция мышц, фармакокинетика и фармакодинамика норэпинефрина, а1-адренорецепторы артерий
Короткий адрес: https://sciup.org/147240965
IDR: 147240965 | УДК: 612.146.4 | DOI: 10.14529/hsm230208
Текст научной статьи Значение адренорецепторов артерий при симпатолизисе в регуляции кровотока в работающих мышцах
V.N. Ananev1, , G.V. Ananev2, , O.V. Ananeva3, ,
Введение. Симпатическая вазоконстрикция обычно ослабляется при тренировке мышц, при локальном изменении содержания мышечных метаболитов и других веществ, которые снижают сосудистую реакцию на активацию α-адренергических рецепторов [8, 10, 19, 22]. Считается, что этот защитный механизм, называемый функциональным симпато-лизисом, оптимизирует распределение мышечного кровотока в соответствии с перфузией и метаболическими потребностями.
Значительная роль в нарушении механизмов симпатолизиса принадлежит сердечно- сосудистым заболеваниям, которые являются главной причиной смертности во всем мире. Только в США около 600 000 смертей каждый год связаны с сердечно-сосудистыми заболеваниями [14], что связано с нарушением в метаболическом и миогенном контроле сосудов сопротивления скелетных мышц. Роль физических нагрузок для профилактики гипертонии показана в работе [1], где эффекты физических тренировок, снижающих артериальное давление в результате симпатолизиса, оставались устойчивыми в течение 8-недельного периода после тренировок. В то же время и сама гипертония [3] сопровождается ослаблением кровотока (симпатолизиса) и усилением прессорной реакции.
Исследования ученых показало [11, 12], что с возрастом нарушается эндотелий зависимый механизм симпатолизиса при физических нагрузках, что приводит к увеличению артериального давления. Изучены и половые различия в механизмах действия симпатических вазоконстрикторов и симпатолизисе [5, 13]. Было показано, что оксид азота (NO) ингибирует симпатическую вазоконстрикцию в состоянии покоя и при сокращении скелетных мышц, а эстроген модулирует экспрессию NO-синтазы и усиливает симпатолизис [13]. В другой работе показано, что пол не влияет на симпатолизис [18]. Изучение механизмов возникновения диабета показало [16], что преддиабет связан с нарушением расширения артериол скелетных мышц при их работе, что может быть связано с повышенной симпатической активностью, сопровождающей эту раннюю стадию диабетического заболевания. Исследования блокады β-адренорецепторов артерий показало, что это не изменило функциональный симпатолизис [2].
При физической нагрузке острая симпатическая активация обычно вызывает высвобождение норэпинефрина (NE) из симпатических нервных окончаний и надпочечников, который связывается с постсинаптическими α-адренергическими рецепторами на гладких мышцах артерий для увеличения вазоконстрикции [4, 6, 20].
Симпатическая сосудосуживающая активность при работе мышц ухудшает перфузию кровью неактивных мышц, тогда как активные мышцы резко увеличивают кровоток [7, 9, 17].
Изучение вазодилатации нижней конечности показало, что даже после одного сгибания прямой ноги происходит увеличение кровотока сосудов ног примерно в 2,5 раза в течение 5–10 с, а затем возвращается к исходному уровню в течение примерно 30 с [21].
Роль оксида азота (NO) как модулятора функционального симпатолизиса обсуждалась в литературе, где говорилось, что величина NO-опосредованной дилатации сдерживается симпатической вазоконстрикцией [13, 21, 22].
Регуляция диаметра артерий осуществляется нервными импульсами симпатического отдела вегетативной нервной системы и ее медиатора норэпинефрина [6]. Анализ литера- турных источников показал, что симпатоли-зис – актуальный физиологический механизм увеличения кровотока в работающих мышцах, но нет данных о влиянии различных концентраций норэпинефрина (NE) на регуляцию симпатолизиса, нет данных о изменении динамики чувствительности а1-адренорецеп-торов при мышечной гиперемии.
Таким образом, целью нашей работы было изучение физиологических механизмов увеличения кровотока в работающих поперечнополосатых мышцах при функциональной блокаде влияния симпатической нервной системы и ее медиатора норэпинефрина на а1-адре-норецепторы артерий мышц при симпатоли-зисе (рабочей мышечной гиперемии).
Методы и организация исследования. Эксперименты проводились на кроликах (2,5– 3,5 кг) под наркозом (гексенал в/в 30 мг/кг) при в/в введении гепарина (1000 ед./кг). В опытах было две группы животных: контрольная (n = 20) и опытная (n = 15). У кроликов проводили сокращение мышц с помощью электростимулятора.
Основу метода составило искусственное кровообращение задней конечности кролика с помощью перфузионного насоса постоянной производительности через бедренную артерию, с перевязкой всех анастомозов. При введении 8 доз NE перед входом насоса, он попадал в артериальное русло бедренной артерии, действуя на а1-адренорецепторы (a1-AR) и дозозависимо сокращал артерии [6, 15], что увеличивало перфузионное давление насоса. Увеличение давления в бедренной артерии после насоса регистрировалось датчиком давления фирмы «Моторола» MPX5100DP и через аналогово-цифровой преобразователь (на базе ADS1286) вводилось и записывалось постоянно в компьютер. Одновременно проводилась аналоговая запись перфузионного давления на выходе насоса на самописец Line Recorder TZ4620.
Опыты проводились по стандартной схеме, что позволяло проводить анализ сокращения артерий конечности по величинам изменения давления после насоса на тестируемые введени NE. Препарат фирмы Sigma-Aldrich Corporation norepinephrine (селективный миметик а1-адренорецепторов) применялся в разных концентрациях (8 доз в микрограмм/кг). Норэпинефрин вводили перед входом трубки насоса в артерию конечности в 8 дозах от 0,5 до 30 мкг на 1 кг массы животного.
Изменения давления в русле бедренной артерии (после насоса) на фоне введения NE анализировалось как реакция a1-AR (a1-адре-норецепторов) артерий до и во время работы мышц. Это позволило по кривым «доза-эффект» оценить влияние симпатолизиса на a1-AR артерий.
Для моделирования рабочей симпатоли-зиса (рабочей мышечной гиперемии) вводили два игольчатых электрода в мышцы конечности и при частоте 5 Гц, напряжении 10 В и длительности импульса L = 5 мс сокращали мышцы кролика, на этом фоне вводили 8 доз норэпинефрина. Анализ реакций изменения перфузионного давления, создающегося работой насоса, в артериях мышц конечности кролика на различные дозы NE в контроле и на фоне работы мышц позволило определить реактивность a1-AR при симпатолизисе и в контроле. Полученные данные статистически обработаны по Стьюденту.
Результаты исследования. Регуляция диаметра артерий осуществляется нервными им- пульсами симпатического отдела вегетативной нервной системы и ее медиатора норэпинефрина [6]. Физиологическая регуляция мышечного кровотока [22] происходит с механизмом симпатолизиса (рабочей мышечной гиперемии), когда при сокращении мышц происходит усиление кровотока. В нашей работе проанализировано (см. таблицу) введение NE в возрастающих дозах в артериальное русло бедренной артерии (см. рисунок) перед насосом в контрольной группе животных и у кроликов при сокращении мышц электростимулятором.
В обеих группах NE всегда вызывал повышение перфузионного давления (см. таблицу) за счет возбуждения прессорных постсинаптических а1-AR [6]. Анализ действия NE на артериальное русло, через которое прокачивает насос кровь, показал (см. рисунок), что NE усиливал свое прессорное действие с увеличением дозы (см. таблицу). Величины прессорных реакций на норэпинефрин (см. таблицу) были намного меньше на фоне симпато-лизиса (см. рисунок).
Активность а1-адренорецепторов (М1 ± m1, мм рт. ст.) артерий на 8 доз норэпинефрина в контроле (N) и при симпатолизисе (Sym) (М2 ± m2), за счет изменения чувствительности а1-адренорецепторов (Sen) Activity of a1-adrenoceptors (M1 ± m1, mm Hg) of the arteries at 8 doses of norepinephrine in the control (N) and in sympatholysis (Sym) (M2 ± m2) due to changes in the sensitivity of a1-adrenergic receptors (Sen)
|
Доза мкг/кг (Y) Dose mcg/kg |
0,5 (Y) |
1,0 (Y) |
2,0 (Y) |
5,0 (Y) |
10 (Y) |
15 (Y) |
20 (Y) |
30 (Y) |
|
Контроль (N) Control (N) (М1 ± m1) mm Hg |
65 ± 2,1 |
94 ± 1,7 |
122 ± 3,5 |
148 ± 4,2 |
159 ± 4,6 |
163 ± 5,1 |
165 ± 4,2 |
167 ± 4,5 |
|
Симпатолиз (Sym) Sympatholysis (Sym) (М2 ± m2) mm Hg |
3 ± 0,12* |
6 ± 0,14* |
11 ± 0,3* |
26 ± 0,8* |
45 ± 1,2* |
60 ± 1,8* |
71 ± 1,1* |
88 ± 1,7* |
|
Чувствительность Контроль (N) Sensitivity Control (N) (М1/Y) mm Hg/Y |
130 |
94 |
61 |
29,6 |
15,9 |
10,9 |
8,3 |
5,57 |
|
Чувствительность Симпатолиз Sensitivity Sympatholysis (М2/Y) mm Hg/Y |
6** |
6** |
5,5** |
5,2** |
4,5** |
**4 |
3,6** |
2,9** |
|
Снижение чувствительности при симпатолизисе Reduced sensitivity with sympatholysis |
21,7 |
15,7 |
11 |
5,7 |
3,53 |
2,73 |
2,33 |
1,9 |
Примечание. * – p ≤ 0,01 изменения достоверны к контролю (М1); ** – p ≤ 0,01 изменения достоверны к контролю (М2).
Note. * – p ≤ 0.01 changes are significant to the control (M1), ** – p ≤ 0.01 changes are significant to the control (M2).
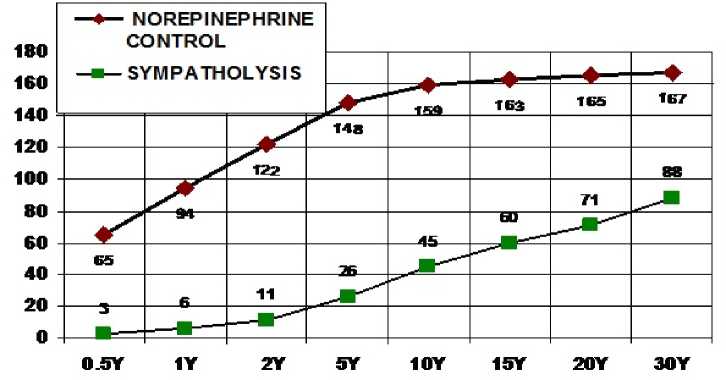
Увеличение давления в артериях конечности на выходе насоса (мм рт. ст.) при введении 8 доз норэпинефрина до и после симпатолизиса
Красные ромбы – контрольные животные (верхняя линия). Зеленые квадраты – кролики на фоне симпатолизиса. По оси ординат: увеличение давления, мм рт. ст. По оси абсцисс: дозы норэпинефрина, мкг/кг. (Y). Все реакции давления у кроликов на фоне симпатолизиса достоверно отличаются от контроля (P < 0,01)
An increase in pressure in the arteries of the limb recorded at the outlet of the pump (mm Hg) with the administration of 8 doses of norepinephrine before and after sympatholysis
Red diamonds are control animals (upper line). Green squares are rabbits with sympatholysis. The X axis: doses of norepinephrine, mcg/kg. (Y). All pressure reactions in rabbits with sympatholysis significantly differ from the control (P < 0.01)
Анализ физиологических механизмов симпатолизиса выявил совершенно новую закономерность (см. таблицу): на низкие дозы норэпинефрина симпатолизис был более выражен, чем на более высокие дозы (см. рисунок) по сравнению с реакцией на соответствующие дозы в контрольной группе.
Данные наших опытов показали (см. рисунок и таблицу), что доза NE 0,5 мкг/кг увеличила сокращение артерий конечности и повысила давление на выходе насоса в контроле на 65 мм рт. ст., а при симпатолизисе только на 3 мм рт. ст., что было в 21,7 раза меньше, чем в контрольной группе. При дозе NE 1 мкг/кг в контроле давление бедренной артерии увеличилось на 94 мм рт. ст., а при симпатолизисе увеличилось только на 6 мм рт. ст., что было в 15,7 раза меньше контроля. На все другие дозы норэпинефрина на фоне симпатолизиса прессорная реакция была меньше контроля (см. таблицу). При дозе NE 30 мкг/кг в контроле давление выросло на 167 мм рт. ст., а во время симпатолизиса увеличилось только на 88 мм рт. ст., то есть было в 1,9 раза меньше контроля (см. таблицу и рисунок).
Наши результаты исследования о снижении а1-адренореактивности при симпатолизи-се согласуются с данными многих авторов исследований [9, 14, 17, 19, 20]. Но в этих ра- ботах не исследовались различные дозы норэпинефрина (NE) и изменение чувствительности (см. таблицу) симпатолизиса при разных концентрациях NE. Наша работа позволила выявить совершенно новые механизмы сим-патолизиса, значительное уменьшение симпа-толизиса с увеличением концентрации NE. Эти механизмы позволяют нам объяснить, почему при значительных физических нагрузках, когда симпатолизис выражен и происходит расширение артерий в работающих мышцах, нет значительного уменьшения артериального давления. Это происходит за счет выявленных нами механизмов уменьшения симпатолизиса при больших концентрациях NE. Это происходит при физических нагрузках, когда значительно увеличивается в крови концентрация NE.
Полученные нами данные об увеличении кровотока и снижении а-адренореактивности артерий при симпатолизисе согласуются с результатами работ авторов [1, 5, 7, 14], которые показали, что занятие спортом способствует снижению системного давления за счет симпатолизиса. Но в этих работах нет анализа симпатолизиса при различных концентрациях норэпинефрина, что не позволило определить изменение чувствительности а1-адренореак-тивности артерий, как в нашей работе.
Данные литературных источников показывают, что изучение симпатолизиса актуально, так как он различен при разном возрасте [11, 12], есть половые различия [13, 18], а также при различной степени физической нагрузки [1, 4, 5], что требует многогранного исследования. Мы в нашей работе не изучали эти варианты проявления симпатолизиса. Применение наших методов исследования позволило бы более точно раскрыть механизмы симпа-толизиса в этих исследованиях.
Полученные данные показывают (см. таблицу), что с увеличением дозы норэпинефрина симпатолизис уменьшается, но всегда прессорная реакция артерий при симпатолизисе значительно меньше, чем в контроле (см. рисунок).
Заключение. Исследование показало, что на фоне сокращения мышц при симпатолизи-се значительно снижается сосудосуживающее действие норэпинефрина при стимулировании а1-адренорецепторов артерий конечности. Наши опыты доказали, что при низких дозах (0,5 мкг/кг) сосудосуживающее действие NE на артерии конечности при сокращении мышц уменьшилось в 21,6 раза. При средних дозах NE (5 мкг/кг) симпатолизис уменьшился и стал в 5,7 раза меньше контроля. При высоких дозах норэпинефрина (30 мкг/кг) симпатолизис при сокращении мышц уменьшил сосудосуживающее его действие только в 1,9 раза (см. таблицу). Выявленные эффекты фармакокинетики и фармакодинамики норэпинефрина на а1-адренорецепторы артерий раскрывают новые механизмы регуляции кровотока в работающих мышцах. Нами показано, что сокращение мышц при симпатолизисе приводит к перераспределению кровотока в работающие мышцы за счет функциональной частичной блокады а1-адренорецепторов, в артериях этих мышц уменьшается чувствительность а1-адренорецепторов. Величина симпатолизи-са уменьшается с увеличением дозы норэпинефрина, что не позволяет значительно уменьшить системное давление организмом при работе большой массы мышц при выраженном симпатолизисе.
Список литературы Значение адренорецепторов артерий при симпатолизисе в регуляции кровотока в работающих мышцах
- Baross A.W., Kay A.D., Baxter B.A. et al. Effects of Isometric Resistance Training and Detraining on Ambulatory Blood Pressure and Morning Blood Pressure Surge in Young Normotensives. Front Physiology, 2022, no. 13, 958135. DOI: 10.3389/fphys.2022.958135
- Cooper I.R., Just T.P., DeLorey D.S. β-Adrenoreceptors do not Oppose Sympathetic Vasoconstriction in Resting and Contracting Skeletal Muscle of Male Rats. Appl Physiology Nutr Metab., 2019, no. 44 (11), pp. 1230–1236. DOI: 10.1139/apnm-2019-0130
- Craig J.C., Broxterman R.M., La Salle D.T. et al. The Role of Endothelin A Receptors in Peripheral Vascular Control at Rest and During Exercise in Patients with Hypertension. Journal Physiology, 2020, no. 598 (1), pp. 71–84. DOI: 10.1113/JP279077
- DeLorey D.S., Clifford P.S. Does Sympathetic Vasoconstriction Contribute to Metabolism: Perfusion Matching in Exercising Skeletal Muscle? Front Physiology, 2022, no. 13, 980524. DOI: 10.3389/fphys.2022.980524
- DeLorey D.S. Sympathetic Vasoconstriction in Skeletal Muscle: Modulatory Effects of Aging, Exercise Training, and Sex. Appl Physiology Nutr Metab., 2021, no. 46 (12), pp. 1437–1447. DOI: 10.1139/apnm-2021-0399
- Docherty J.R. The Pharmacology of α1-Adrenoceptor Subtypes. European Journal Pharmacology, 2019, no. 855, pp. 305–320. DOI: 10.1016/j.ejphar.2019.04.047
- Dulaney C.S., Heidorn C.E., Singer T.J., McDaniel J. Mechanisms that Underlie Blood Flow Regulation at Rest and During Exercise. Advansed Physiology Education, 2023, no. 47 (1), pp. 26–36. DOI: 10.1152/advan.00180.2022
- Gentilin A., Tarperi C., Skroce K. et al. Effect of Acute Sympathetic Activation on Leg Vasodilation before and after Endurance Exercise. Journal Smooth Muscle Reserch, 2021, no. 57 (0), pp. 53–67. DOI: 10.1540/jsmr.57
- Gliemann L., Carter H. Sympatholysis: the More we Learn, the Less we Know. Journal Physiology, 2018, no. 596 (6), pp. 963–964. DOI: 10.1113/JP275513
- Green D.J., Hopman M.T.E., Padilla J. et al. Vascular Adaptation to Exercise in Humans: Role of Hemodynamic Stimuli. Physiology Rev., 2017, no. 97 (2), pp. 495–528. DOI: 10.1152/physrev.00014.2016
- Hearon C.M.Jr., Richards J.C., Racine M.L. et al. Augmentation of Endothelium-Dependent Vasodilatory Signalling Improves Functional Sympatholysis in Contracting Muscle of Older Adults. Journal Physiology, 2020, no. 598 (12), pp. 2323–2336. DOI: 10.1113/JP279462
- Hughes W.E., Kruse N.T., Ueda K., Casey D.P. Habitual Exercise Training in Older Adults Offsets the Age-Related Prolongation in Leg Vasodilator Kinetics During Single-Limb Lower Body Exercise. Journal Appl Physiology, 2018, no. 125 (3), pp. 746–754. DOI: 10.1152/japplphysiol.00235.2018
- Just T.P., DeLorey D.S. Sex Differences in Sympathetic Vasoconstrictor Responsiveness and Sympatholysis. Journal Appl Physiology, 2017, no. 123 (1), pp. 128–135. DOI: 10.1152/japplphysiol.00139.2017
- Limberg J.K., Casey D.P., Trinity J.D. et al. Assessment of Resistance Vessel Function in Human Skeletal Muscle: Guidelines for Experimental Design, Doppler Ultrasound, and Pharmacology. American Journal Physiology Heart Circ, 2020, no. 318 (2), pp. 301–325. DOI: 10.1152/ajpheart.00649.2019
- Manukhin B.N., Anan'ev V.N., Anan'eva O.V. Effect of Rabbit Adaptation to Cold on the Depressor Muscarinic Cholinergic Reaction of the Arterial Pressure of the Hind Limb Vessels and the Small Intestine in Situ and the Systemic Arterial Pressure. Izv Akad Nauk Ser Biol., 2010, no. 3, pp. 363–369. PMID: 20583620
- Novielli-Kuntz N.M., Lemaster K.A., Frisbee J.C., Jackson D.N. Neuropeptide Y1 and alpha-1 Adrenergic Receptor-Mediated Decreases in Functional Vasodilation in Gluteus Maximus Microvascular Networks of Prediabetic Mice. Physiology Rep., 2018, no. 6 (13), e13755. DOI: 10.14814/phy2.13755
- Remensnyder J., Mitchell J.H., Sarnoff S.J. Functional Sympatholysis During Muscular Activity. Observations on Influence of Carotid Sinus on Oxygen Uptake. Circ Res., 1962, no. 11, pp. 370–380. DOI: 10.1161/01.res.11.3.370
- Teixeira A.L., Garland M., Lee J.B. et al. Assessing Functional Sympatholysis During Rhythmic Handgrip Exercise Using Doppler Ultrasound and Near-Infrared Spectroscopy: Sex Differences and Test-Retest Reliability. American Journal Physiology Regular Integr Comp Physiology, 2022, no. 323 (5), pp. 810–821. DOI: 10.1152/ajpregu.00123.2022
- Terwoord J.D., Racine M.L., Hearon C.M. Jr. et al. ATP and Acetylcholine Interact to Modulate Vascular Tone and α1-Adrenergic Vasoconstriction in Humans. Journal Appl Physiology, 2021, no. 131 (2), pp. 566–574. DOI: 10.1152/japplphysiol.00205.2021
- Van der Horst J., Møller S., Kjeldsen S.A.S. et al. Functional Sympatholysis in Mouse Skeletal Muscle Involves Sarcoplasmic Reticulum Swelling in Arterial Smooth Muscle Cells. Physiology Rep., 2021, no. 9 (23), e15133. DOI: 10.14814/phy2.15133
- Venturelli M., Layec G., Trinity J. et al. Single Passive Leg Movement-Induced Hyperemia: a Simple Vascular Function Assessment Without a Chronotropic Response. Journal Appl Physiology, 2017, no. 122 (1), pp. 28–37.
- Venturelli M., Rossman M.J., Ives S.J. et al. Passive Leg Movement-Induced Vasodilation and Exercise-Induced Sympathetic Vasoconstriction. Auton Neuroscience, 2022, no. 239, 102969. DOI: 10.1016/j.autneu.2022.102969. Epub 2022 Mar 4. PMID: 35259576.


