Значение полиморфизмов генов факторов VII и XIII системы свертываемости крови в патогенезе нетравматического асептического некроза головки бедренной кости
Автор: Панин Михаил Александрович, Загородний Николай Васильевич, Бойко Андрей Викторович, Самоходская Лариса Михайловна, Абакиров Медетбек Джумабекович, Волков Евгений Егорович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.27, 2021 года.
Бесплатный доступ
Введение. Нетравматический асептический некроз головки бедренной кости - полиэтиологическое социально значимое заболевание, связанное с утратой трудоспособности в возрасте от 20 до 50 лет. Исследования в отношении выявления причин/предикторов некроза являются актуальными. Цель. Изучение вклада полиморфизмов генов факторов свертывания крови F7 и F13 в генез нетравматического асептического некроза головки бедренной кости. Материалы и методы. Изучены полиморфизмы генов системы свертывания крови F7 и F13; проведен сравнительный анализ частоты встречаемости значимых аллельных вариантов генов F7 (Arg353Gln) и F13 (Val134Leu) у пациентов с верифицированным диагнозом «асептический некроз» (основная группа) и у здоровых пациентов (контрольная группа). В основную группу вошел 41 больной (все - мужчины) с асептическим некрозом головки бедренной кости неясной этиологии. Результаты. Частота встречаемости аллелей гена Arg353Gln F7 в основной группе составила: GG - у 30 из 41 больного (73,2 %), GA - у 11 из 41 (26,8 %), причем полиморфный вариант АА не встретился ни у одного из 41 пациента. В контрольной группе частоты аллелей данного гена распределились следующим образом: GG - у 7 из 320 человек (2,2 %), GA - у 66 из 320 (20,6 %), AA - у 247 из 320 (77,2 %). Достоверные различия были выявлены нами в частотах встречаемости гомозиготных генотипов - АА (χ2 = 100,215, р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Нетравматический асептический некроз головки бедренной кости, полиморфизм генов факторов свертываемости крови, аваскулярный некроз, предикторы
Короткий адрес: https://sciup.org/142230151
IDR: 142230151 | УДК: 616.718.41-002.4-021.4:575.174.015.3 | DOI: 10.18019/1028-4427-2021-27-1-43-47
Текст научной статьи Значение полиморфизмов генов факторов VII и XIII системы свертываемости крови в патогенезе нетравматического асептического некроза головки бедренной кости
Нетравматический асептический некроз (НАН) головки бедренной кости – заболевание, характерное для мужчин в возрасте от 20 до 50 лет; утрата трудоспособности молодыми людьми выводит данное заболевание в разряд социально значимых [1, 2].
Среди причин НАН головки бедренной кости выделяют длительное применение кортикостероидов, злоупотребление алкоголем, системную красную волчанку, серповидноклеточную анемию, болезнь Legg-Calve-Perthes, ионизирующую радиацию, цитотоксические
агенты и др. [3, 4]. Однако известно, что некроз головки бедренной кости может наблюдаться и при отсутствии вышеупомянутых факторов - так называемый «идиопатический».
Согласно данным литературы, в основе развития НАН лежат три основных механизма: механическое препятствие току крови, тромботическая окклюзия сосудов, экстраваскулярная компрессия [5]. Правомочно придается значение взаимодействию между генетической предрасположенностью к нарушениям гемоциркуляции и внешними факторами. У многих пациентов с НАН головки бедренной кости наблюдается сочетание неблагоприятных внешних факторов риска с наследственными: гиперкоагуляция, гемоглобинопатии, нарушения ангиогенеза, оксидативный стресс [6].
Возможно предположить, что определенную роль в патогенезе НАН играют некоторые наследственные особенности (полиморфизмы) генов факторов свертываемости крови. Как известно, система гемостаза представляет собой совокупность процессов, обеспечивающих жидкое состояние крови, поддержание ее нормальной вязкости, предупреждение и остановку кровотечений. В нее входят факторы свертывающей, естественной противосвертывающей и фибринолитической систем крови. В норме все процессы находятся в определенном балансе и обеспечивают жидкое состояние крови. Смещение равновесия вследствие внутренних или внешних факторов может повышать риск кровотечений и тромбообразования.
Особое внимание при оценке риска тромбоэмболий и инфарктов уделяется генам коагуляционных (свертывающих) факторов крови VII и XIII (F7, F13), изменения в которых в большинстве случаев направлены на обеспечение защитного эффекта. Снижение активности данных факторов способствует уменьшению тром-бообразования [7, 8].
Ген F7 кодирует фактор свертывания крови VII – витамин-К-зависимый профермент, продуцирующийся в печени. Основной физиологической ролью F7 является активация фактора свертывания крови Х. После повреждения сосуда F7 связывается с тканевым фактором III и переходит в активную форму. Эта реакция является основным событием в процессе свертывания крови [9]. Изменения в гене F7 в большинстве случаев имеют протективный эффект относительно риска развития тромбоэмболии. Замена гуанина (G) на аденин (А) в позиции 10976 (генетический маркер G10976A) приводит к изменению биохимических свойств фактора VII. Снижение активности F7 в результате замены способствует уменьшению тромбообразования. Генотип АА является причиной снижения активности фермента F7 на 72 % по сравнению с диким (наиболее часто встречающимся в популяции) – генотип GG [10]. Маркер ассоциирован со снижением вероятности инфаркта миокарда, даже при наличии ангиографически задокументированного, тяжелого коронарного атеросклероза. Гетерозиготы (носители одной аллели А и одного G, генотип AG) имеют риск заболевания инфарктом миокарда в 2 раза меньший, чем носители двух аллелей G (генотип GG) [11].
Фактор XIII (F13) представляет собой плазматический гликопротеин, циркулирующий в плазме крови в комплексе с белком фибриногеном. При активации системы свертывания крови F13 подвергается расщеплению ферментом тромбином (фактором свертывания крови II). Кофактором в данной реакции являются ионы кальция. Активированный белок F13a катализирует "сшивание" мономеров фибрина, образуя связи между аминокислотами, что ведет к формированию фибрина-полимера. Фибрин – основа сгустка крови, он стабилизирует тромб, завершая процесс свертывания крови [12]. Изменения в гене F13 в большинстве случаев снижают риск развития патологий, связанных с повышенным тромбообразованием. Участок, в котором происходит замена нуклеотида гуанина (G) на тимин (Т) в позиции 103, обозначается как генетический маркер G103T. В результате замены преобразуются биохимические свойства белка F13, а именно, его способность "сшивать" фибриновые мономеры, вследствие чего фибриновые сгустки получаются более тонкими [13]. При анализе частотности аллелей (G103T) у пациентов, перенесших инфаркт миокарда, и у контрольной группы был доказан защитный эффект присутствия в генотипе аллели Т [14].
Целью настоящего исследования явилось изучение вклада полиморфизмов генов факторов свертывания крови F7 и F13 в генез нетравматического асептического некроза головки бедренной кости.
МАТЕРИАЛЫ И МЕТОДЫ
В основу исследования легло предположение о важности генетических факторов в развитии некроза головки бедренной кости. В связи с этим нами были изучены полиморфизмы генов системы свертывания крови F7 и F13, роль которых известна в генезе развития ишемических расстройств различной локализации.
В процессе исследования проведен сравнительный анализ частоты встречаемости значимых аллельных вариантов генов F7 (Arg353Gln) и F13 (Val134Leu) у пациентов с верифицированным диагнозом НАН (основная группа) и у здоровых пациентов (контрольная группа).
Нами был обследован 41 больной (все – мужчины) с НАН головки бедренной кости. В данную группу вошли пациенты с неясной причиной заболевания, которое клинически манифестировало в возрасте от 27 до 45 лет. Критериями исключения являлись алкоголизм, длительный прием кортикостероидов, системные заболевания соединительной ткани, заболевания крови и прочие известные этиологические факторы НАН [15].
Стаж заболевания варьировал от 1 до 20 лет. На момент обследования у 24 из 41 пациента основной группы 1–10 лет назад было проведено одно-, двустороннее тотальное эндопротезирование тазобедренного сустава в связи со вторичным артрозом на фоне НАН 3–4 ст. Пятнадцать пациентов с НАН головки бедренной кости 3 ст. готовятся к аналогичной операции. Два пациента (НАН 3 ст.) получают консервативное лечение в связи с отказом от хирургического вмешательства.
При анализе семейного анамнеза пациентов с НАН головки бедренной кости отмечена высокая частота сердечнососудистых заболеваний (инсульт, инфаркт, острый тромбоз) у ближайших родственников (мать/ отец) – у 61 % (25 из 41) пациентов основной группы.
Следует подчеркнуть, что у 13 больных сердечнососудистые заболевания имели место у обоих родителей, причем у 6 – с летальным исходом.
При анализе соматического статуса у 12 пациентов основной группы установлена артериальная гипертензия 1–3 ст., у 6 – варикозная болезнь вен нижних конечностей, у 3 в анамнезе – острый тромбофлебит, потребовавший хирургического вмешательства, у 3 – коагулопатии (гиперфибриногенемии), требующие перманентной медикаментозной коррекции.
В контрольную группу вошло 320 мужчин аналогичной возрастной категории (25–45 лет) – военнослужащих, обследованных при профилактических осмотрах [16]. Ни у одного из пациентов контрольной группы не было выявлено клинических проявлений заболеваний тазобедренных суставов.
В программу обследования было включено исследование полиморфизмов генов Arg353Gln F7 и Val134Leu F13 методом ПЦР. Для генетического ис- следования выполнялась экстракция геномной ДНК на сорбенте из лимфоцитов периферической цельной крови при помощи коммерческого набора «ДНК-сорб-В» («АмплиСенс», Москва).
Определение аллельных вариантов генов проводили методом ПЦР в реальном времени на амплифика-торе ДТ-96 (производитель ДНК Технология, Россия) тест-системами для ПЦР - анализа (производитель ДНК Технология, Россия) согласно рекомендациям фирмы производителя.
При статистической обработке полученных данных было проведено сравнение результатов в основной и контрольной группах. Достоверность значений определялась в программе STATISTIСА при подсчете значения р по критерию χ 2 Пирсона.
Все лица, включенные в исследование, дали письменное информированное согласие на участие в нем. Проведение исследования одобрено Этическим комитетом РУДН.
РЕЗУЛЬТАТЫ
Нами были проанализированы частоты встречаемости аллелей А и G (в гомо- и гетерозиготном состоянии) гена Arg353Gln F7 у больных НАН и у здоровых людей. Как следует из таблицы 1, наличие аллели А было выявлено у 26,8 % пациентов основной группы, что в 3,5 раза ниже, чем в контрольной (у 97,1 %), различия статистически достоверны. Присутствие в генотипе аллели G отмечено у 73,2 % пациентов с НАН и у 22,8 % человек из контрольной группы, различия также статистически достоверны (табл. 1).
Таблица 1
Наличие аллелей А и G гена Arg353Gln F7 у пациентов двух групп
|
Наличие аллели |
Основная группа (НАН, n = 41) |
Контрольная группа (n = 320) |
χ 2 |
р |
|
А (генотипы АА+GA) |
11/41 – 26,8 % |
311/320 – 97,1 % |
186,703 |
< 0,001 |
|
G (генотипы GG+GA) |
30/41 – 73,2 % |
73/320 – 22,8 % |
45,199 |
< 0,001 |
Частота встречаемости аллелей гена Arg353Gln F7 в основной группе составила: GG – у 30 из 41 больного (73,2 %), GA – у 11 из 41 (26,8 %), причем полиморфный вариант АА не встретился ни у одного из 41 пациента. В контрольной группе частоты аллелей данного гена распределились следующим образом: GG – у 7 из 320 человек (2,2) %, GA – у 66 из 320 (20,6 %, AA – у 247 из 320 (77,2 %).
Достоверные различия были выявлены нами в частотах встречаемости гомозиготных генотипов – АА ( χ 2 = 100,215, р < 0,001) и GG ( χ 2 = 205,770, р < 0,001) в основной и контрольной группах (рис. 1). В отношении гетерозиготного генотипа GA различия были не достоверны – χ 2 = 0,834, р = 0,362.
В дальнейшем нами были проанализированы частоты встречаемости различных аллельных вариантов гена Val134Leu F13.
Частота обнаружения аллели Т (генотипы TT+TG) у больных НАН составила 73,2 %, в контрольной группе – 90,0 %, различия статистически достоверны (р = 0,002). Различия в частоте встречаемости алле- ли G были еще более значимы: в основной группе – 90,2 %, в контрольной группе – 54,7 %; различия статистически достоверны – р < 0,001 (табл. 2).
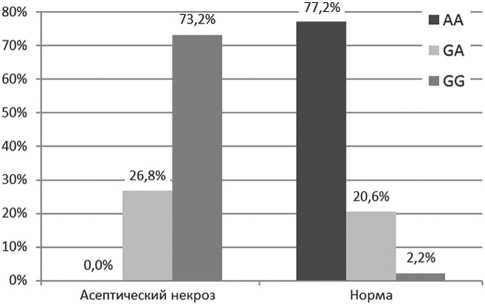
Рис. 1. Частота встречаемости аллелей гена Arg353Gln F7 у пациентов с НАН головки бедренной кости и контрольной группы
Таблица 2
Наличие аллелей Т и G гена Val134Leu F13 у пациентов двух групп
|
Наличие аллели |
Основная группа (НАН, n = 41) |
Контрольная группа (n = 320) |
χ 2 |
р |
|
Т (генотипы ТТ+ТG) |
30/41 – 73,2 % |
288/320 – 90,0 % |
9,810 |
0,002 |
|
G (генотипы GG+ТG) |
37/41 – 90,2 % |
175/320 – 54,7 % |
18,956 |
< 0,001 |
Анализ частот встречаемости различных аллельных вариантов гена Val134Leu F13 показал, что в основной группе наличие гомозиготного генотипа ТТ отмечено у 4 из 41 пациента (9,8 %), гетерозиготного генотипа GT – у 26 из 41 (63,4 %), гомозиготного генотипа GG – у 11 из 41 (26,8 %). В контрольной группе частоты встречаемости аналогичных генотипов составили соответственно: 45,3 % (у 145 из 320), 45,0 % (у 144 из 320) и 9,7 % (у 31 из 320) (рис. 2).
Генотип GG в 2,8 раза чаще отмечен у пациентов основной группы, различия статистически достоверны (26,8 % против 9,7 %, χ 2 = 10,388, р = 0,002).
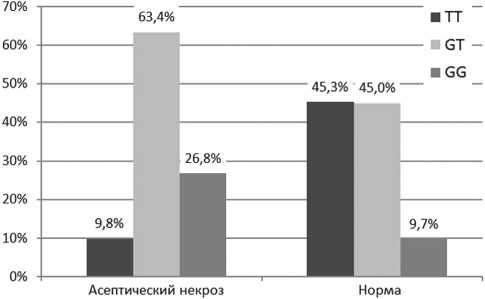
Рис. 2. Частоты встречаемости аллельных вариантов гена Val134Leu F13 у пациентов основной и контрольной групп
С учетом данных литературы о протективной роли аллели Т в развитии ишемических расстройств нами были проанализированы частоты встречаемости данной аллели в исследуемых группах.
Наличие генотипа ТТ гена Val134Leu F13 почти в 5 раз чаще ( χ 2 = 18,956, р < 0,001) выявлялось у здоровых людей (контрольная группа). Различия в частоте встречаемости аллели Т в гомо- и гетерозиготной комбинациях (ТТ и GT) в основной и контрольной группе оказались также статистически достоверными (72,7 % против 90,1 % соответственно, χ 2 = 4,946, р = 0,027). Учитывая разницу в степенях достоверности (р < 0,001 против р = 0,027), можно заключить, что ключевую про-тективную роль в развитии асептического некроза головки бедра играет только гомозиготный генотип ТТ.
ДИСКУССИЯ
В результате исследования установлены возможные причины так называемого идиопатического некроза головки бедренной кости. Показано, что риск развития НАН повышен при определенных полиморфизмах генов факторов свертываемости крови F7 и F13.
Полученные нами данные позволяют предположить, что наличие аллели G гена Arg353Gln F7 может рассматриваться как один из факторов риска развития асептического некроза головки бедренной кости. Повышенная более чем в 30 раз (по сравнению с контрольной группой) частота встречаемости гомозиготного генотипа GG гена Arg353Gln F7 у больных асептическим некрозом головки бедренной кости, вероятно, свидетельствует о высокой значимости нарушений системы свертывания крови в генезе данного заболевания.
На универсальный характер ишемических расстройств в организме человека указывают результаты исследования M. Ramzia с соавт., которые выявили двукратное повышение риска инфаркта миокарда у носителей гомозиготной аллели GG гена Arg353Gln F7 [17].
В то же время нами установлено, что наличие аллели А гена Arg353Gln F7 в 3,5 раза чаще выявлялось в контрольной группе. Это указывает на ее протективную роль в отношении развития НАН. Известно, что генотип АА является причиной снижения активности фермента F7 на 72 % и ассоциирован со снижением вероятности инфаркта миокарда даже при наличии тяжелого коронарного атеросклероза. [10]. В отношении генотипа АА гена Arg353Gln F7 важно отметить, что его наличие не выявлено нами ни у одного из пациентов основной группы. В литературе есть указания на протективную роль данной аллели в отношении инфаркта миокарда и ишемического инсульта [11], что указывает на сходные элементы патогенеза «больших сосудистых катастроф» и НАН.
При анализе полиморфизмов гена Val134Leu F13 нами установлено, что аллельный полиморфизм GG можно рассматривать в качестве одного из факторов риска НАН: частоты встречаемости данного полиморфизма были достоверно различны в основной и контрольной группах ( χ 2 = 10,388, р = 0,002). Литературных данных, указывающих на неблагоприятную прогностическую роль генотипа GG гена Val134Leu F13 в генезе ишемических расстройств, нами не обнаружено.
Генотип ТТ гена Val134Leu F13 почти в 5 раз чаще встречался у здоровых людей, чем у пациентов с НАН. Различия в частоте встречаемости аллели Т в гомо- и гетерозиготной комбинациях (ТТ и GT) в основной и контрольной группе оказались также статистически достоверными (72,7 % против 90,1 % соответственно, χ 2 = 4,946, р = 0,027). Учитывая разницу в степенях достоверности (р < 0,001 против р = 0,027), можно заключить, что ключевую протективную роль в развитии асептического некроза головки бедра играет гомозиготный генотип ТТ. На низкую частоту встречаемости аллели T гена Val134Leu F13 в группе пациентов с инфарктом миокарда по сравнению с контрольной группой указывают Kreutz R. с соавт. [18], что подтверждает “коагулопатический” генез так называемого идиопатического некроза головки бедренной кости.
Гомозиготный генотип GG гена Val134Leu F13 в 2,8 раза чаще встречался у больных с НАН (26,8 % в основной группе против 9,7 % в контрольной, р = 0,002). Возможны различные варианты трактовки полученных данных. В связи относительно низкой (менее одной трети) частотой встречаемости генотипа GG в основной группе трудно утверждать, что наличие генотипа GG – самостоятельный фактор риска НАН; возможно, имеет значение не наличие генотипа GG, а отсутствие аллели Т в генотипе.
ВЫВОДЫ
Таким образом, проведенное нами исследование показало, что полиморфизмы генов факторов свертывания крови F7 и F13 вно сят существенный вклад в генез нетравматического асептического некроза головки бедренной кости. Показано, что фак- тором риска развития НАН является гомозиготный генотип GG гена Arg353Gln F7. Низкая вероятность заболевания НАН обусловлена протективной ролью генотипа АА гена Arg353Gln F7 и генотипа ТТ гена Val134Leu F13.
При выполнении данной работы конфликта интересов не было. Финансирование из внешних источников не привлекалось.
Список литературы Значение полиморфизмов генов факторов VII и XIII системы свертываемости крови в патогенезе нетравматического асептического некроза головки бедренной кости
- Shannon B.D., Trousdale R.T. Femoral osteotomies for avascular necrosis of the femoral head // Clin. Orthop. Relat. Res. 2004. No 418. P. 34-40. DOI: 10.1097/00003086-200401000-00007.
- Expert Panel on Musculoskeletal Imaging. Avascular necrosis of the hip / A.A. DeSmet, M.K. Dalinka, N.P. Alazraki, R.H. Daffner, G.Y. El-Khoury, J.B. Kneeland et al. // American College of Radiology (ACR), Reston (VA), 2005. URL: http://www.guidelines.gov/summary/summary.aspx? doc_ id=8296&nbr=004628&string=avascular+AND+necrosis.
- Systematic analysis of classification systems for osteonecrosis of the femoral head / M.A. Mont, G.A. Marulanda, L.C. Jones, K.J. Saleh, N. Gordon, D.S. Hungerford, M.E. Steinberg // I. Bone Joint Surg. Am. 2006. Vol. 88, No 3. P. 16-26. DOI: 10.2106/JBJS.F.00457.
- Современный взгляд на патогенез нетравматического остеонекроза / М.А. Панин, Н.В. Загородний, Н.Н. Карчебный, И.А. Садков, А.С. Пе-тросян, А.Р. Закирова // Вестник травматологии и ортопедии имени Н.Н. Приорова. 2017. № 2. С. 69-75.
- Procoagulants and osteonecrosis / L.C. Jones, M.A. Mont, T.B. Le, M. Petri, D.S. Hungerford, P. Wang, C.J. Glueck // J. Rheumatol. 2003. Vol. 30, No 4. P. 783-791.
- Association between the T-786C eNOS polymorphism and idiopathic osteonecrosis of the head of the femur / C.J. Glueck, R.A. Freiberg, J. Oghene, R.N. Fontaine, P. Wang // J. Bone Joint Surg. Am. 2007. Vol. 89, No 11. P. 2460-2468. DOI: 10.2106/JBJS.F.01421.
- Di Minno G., Grandone E., Margaglione M. Clinical relevance of polymorphic markers of arterial thrombosis // Thromb. Haemost. 1997. Vol. 78, No 1. P. 462-466.
- Grant P.J. Polymorphisms of coagulation/fibrinolysis genes: gene environment interactions and vascular risk // Prostaglandins Leukot. Essent. Fatty Acids. 1997. Vol. 57, No 4-5. P. 473-477. DOI: 10.1016/s0952-3278(97)90431-2.
- Кузник Б.И. Система гемостаза // Физиология человека. 2000. № 1. С. 313-325.
- Golino P. The inhibitors of the tissue factor: factor VII pathway // Thromb. Res. 2002. Vol. 106, No 3. P. V257-V265. DOI: 10.1016/s0049-3848(02)00079-8.
- Polymorphisms of the coagulation factor VII gene and its plasma levels in relation to acute cerebral infarction differences in allelic frequencies between Chinese Han and European populations / W.Y. Kang, H.L. Wang, L.F. Xiong, X.F. Wang, H.Y. Chu, B. Qu, X.F. Liu, J. Yin, B.H. Duan, Z.Y. Wang // Chin. Med. J. (Engl). 2004. Vol. 117, No 1. P. 71-74.
- Komaromi I., Bagoly Z., Muszbek L. Factor XIII: novel structural and functional aspects // J. Thromb. Haemost. 2011. Vol. 9, No 1. P. 9-20. DOI: 10.1111/j.1538-7836.2010.04070.x.
- Muszbek L., Ariëns R.A., Ichinose A. ISTH SSC Subcommittee on Factor XIII. Factor XIII: recommended terms and abbreviation // J. Thromb. Haemost. 2007. Vol. 5, No 1. P. 181-183. DOI: 10.1111/j.1538-7836.2006.02182.x.
- Impact of FXIII-A Val34Leu polymorphism on coronary artery disease in Croatian patients / A. Bronic, G. Ferencak, R. Zadro, A. Stavljenic-Rukavina, R. Bernat // Mol. Biol. Rep. 2009. Vol. 36, No 1. P. 1-5. DOI: 10.1007/s11033-007-9144-9.
- Avascular Necrosis of Femoral Head: A Metabolomic, Biophysical, Biochemical, Electron Microscopic and Histopathological Characterization / A. Narayanan, P. Khanchandani, R.M. Borkar, C.R. Ambati, A. Roy, X. Han, R.N. Bhoskar, S. Ragampeta, F. Gannon, V. Mysorekar, B. Karanam, V. Sai Muthukumar, V. Sivaramakrishnan // Sci. Rep. 2017. Vol. 7, No 1. P. 10721. DOI: 10.1038/s41598-017-10817-w.
- Прогностическая значимость носительства аллельных вариантов генов, контролирующих систему гемостаза, и их сочетания с традиционными факторами риска в раннем развитии ишемической болезни сердца / Е.Ю. Андреенко, Л.М. Самоходская, А.В. Балацкий, П.И. Мака-ревич, С.А. Бойцов // Кардиоваскулярная терапия и профилактика. 2011. Т. 10, № 8. С. 32-39.
- Coagulation factor VII gene polymorphisms and cardiovascular diseases in Iranian population / M. Ramzi, N. Cohan, M. Yavarian, M.R. Jahromi // J. Indian College of Cardiology. 2013. Vol. 3, No 1. P. 6-8. DOI: 10.1016/j.jicc.2012.12.004.
- Factor XIII Val34Leu polymorphism and recurrent myocardial infarction in patients with coronary artery disease / R.P. Kreutz, A. Bitar, J. Owens, Z. Desta, J.A. Breall, E. von der Lohe, A. Sinha, M. Vatta, P. Nystrom, Y. Jin, D.A. Flockhart // J. Thromb. Thrombolysis. 2014. Vol. 38, No 3. P. 380-387. DOI: 10.1007/s11239-014-1059-4.


