Значение условий ограничения подвижности позвоночника при сочетанной спинномозговой травме для сохранности нервной ткани, краниально расположенной от зоны повреждения (экспериментально-морфологическое исследование)
Автор: Шевцов В.И., Сафонова Г.Д., Муштаева Ю.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2007 года.
Бесплатный доступ
На модели гемисекции спинного мозга и частичного разрушения задних опорных структур в поясничном отделе 18 взрослых беспородных собак изучено морфофункциональное состояние краниально расположенной от зоны повреждения части спинного мозга в пределах смежного сегмента. Длительность эксперимента - до 3 мес. Методы исследования: нейрогистологический, компьютерная морфометрия, статистический. Установлено, что деструктивный процесс наиболее выражен в условиях нестабильности позвоночника, особенно в области серого вещества поврежденного спинного мозга, что обусловливает невозможность восстановления функций. В условиях управляемого чрескостного остеосинтеза разрушение структур спинного мозга минимально, что определяет возможность восстановления функций после половинного поперечного рассечения. Представлена количественная оценка выраженности деструктивного процесса в обозначенных условиях
Позвоночник, спинной мозг, гемисекция, деструкция, морфометрия, остеосинтез
Короткий адрес: https://sciup.org/142121028
IDR: 142121028
Текст научной статьи Значение условий ограничения подвижности позвоночника при сочетанной спинномозговой травме для сохранности нервной ткани, краниально расположенной от зоны повреждения (экспериментально-морфологическое исследование)
В спинном мозге после его травматизации закономерно протекают процессы, приводящие большей частью к глубокой инвалидности. Проведенные исследования позволили выявить многие патогенетические аспекты, обозначить в общих чертах условия для успешной регенерации, пути коррекции, в т.ч. и значение выполнения стабилизирующих операций на позвоночнике [1-4].
Из проведенных ранее исследований известно, что разрушение ламинотомией заднего опорного комплекса позвоночного столба приводит к нарушению его стабильности, увеличению кифотической деформации, натяжению зубчатых связок и разобщению анатомических структур спинного мозга, особенно по дорсальной поверхности [11]. Условия нестабильности способствуют наруше- нию спинального кровообращения и образованию вторичных геморрагических некрозов. Нейромор-фологическим проявлением нестабильности является формирование интраспинальных полостей эллипсовидной или неправильной, вытянутой вдоль длинника спинного мозга формы, а также их более крупные, чем при ограничении подвижности позвоночника, размеры [5].
Через 14 суток после половинного поперечного рассечения спинного мозга в условиях нестабильности позвоночника мы наблюдали заполнение диастаза, сформированного вследствие расхождения краев рассеченного участка мозга, а также последующей выраженной деструкции нервной ткани, глиосоединительнотканным рубцом. При этом в течение эксперимента просле- живалось максимальное увеличение размеров сформированных вблизи рубца крупных интрас-пинальных полостей. В условиях ограничения подвижности позвоночника и изменения его формы в функционально выгодном положении формирования рубца не наблюдалось вследствие плотного смыкания краев рассеченных участков мозга, прослеживалось формирование некрупных полостей вблизи зоны повреждения [6, 7].
Цель работы – изучить выраженность деструктивного процесса в прилежащей краниально к зоне повреждения части спинного мозга в пределах смежного сегмента при нестабильности позвоночника (контроль) и в условиях применения метода управляемого чрескостного остеосинтеза.
МАТЕРИАЛ И МЕТОДЫ
В эксперименте на 18 взрослых беспородных собаках моделировали сочетанное повреждение задних опорных структур поясничного отдела позвоночного столба (частичная ляминэктомия) и спинного мозга (гемисекция L5 сегмента слева). Животные без фиксации позвоночника составили группу контроля (n=9). В опытной группе (n=9) с целью ограничения подвижности позвоночника накладывали аппарат Илизарова и создавали условия для сближения краев рассеченного участка мозга [10]. Содержание животных и эвтаназию (предельные дозы тиопентала натрия) осуществляли в соответствии с требованиями приказа № 755 МЗ СССР, 1977г. Сроки эксперимента: 14 суток, 1 и 2-3 месяца (по 3 животных в каждой группе). Эксперименты выполнены Заслуженным изобретателем РФ, к.м.н. А.М. Мархашовым и к.т.н. Ю.А. Муштаевой.
Спинной мозг фиксировали в 12 % растворе нейтрального формалина. Изготавливали поперечные парафиновые срезы смежных сегментов и продольные, выполненные во фронтальной плоскости, содержащие зону повреждения и прилежащие участки мозга. Продольные срезы получали на нескольких уровнях с целью иссле-
РЕЗУЛЬТАТЫ
Структура белого вещества краниального отдела поврежденного медуллярного сегмента на стороне гемисекции во все сроки эксперимента характеризовалась снижением плотности вследствие наличия значительного количества микрополостей характерной, вытянутой вдоль нервных волокон, формы. Они формировались в участках распада нервных проводников, большей частью вблизи диастаза и в поверхностно расположенных участках мозга. Наибольшие размеры имели микрополости, образованные вследствие аутотомии крупных миелинизированных нервных волокон, максимальная площадь которых достигала 20 000 мкм2.
Наряду с выраженным процессом деструкции нервной ткани на стороне повреждения были типичны микроциркуляторные расстройства: в прилежащих к зоне повреждения областях преимущественно в срок эксперимента 14 суток выявлялись изменения стенок сосудов и очаги кровоизлияний. Позднее в этих участках обна- дования дорсальной и вентральной поверхностей, а также промежуточной зоны. Гистологические препараты толщиной 8 мкм окрашивали по Нисслю, Массону, Ван-Гизону, Эросу-Нисслю-Бочерикову, гематоксилином-эозином; толщиной 12 мкм импрегнировали азотнокислым серебром по Рассказовой.
Количественно оценивали выраженность деструктивного процесса с использованием универсального микроскопа «Opton» (Германия) и АПК ДиаМорф (Россия). Для этого на препаратах, окрашенных гематоксилином-эозином, определяли суммарную площадь профилей интрас-пинальных микрополостей, сформированных в результате деструкции нервной ткани. Измерения проводили в пяти участках квадратной формы, стандартно расположенных в участках латерального канатика (нечетные номера участков) и промежуточной зоны (четные номера). Площадь каждого из квадратов при инструментальном увеличении 63 составила 256 976,7 мкм2.
Статистическую обработку проводили методами вариационной статистики с определением критерия Стьюдента.
ИССЛЕДОВАНИЯ руживались сформированные в той или иной степени интраспинальные полости. Образование наиболее крупных полостей отмечено в сером веществе спинного мозга, а именно в области дорсальных рогов и промежуточной зоны. Участки значительной потери нервной ткани определялись по дорсальной поверхности спинного мозга не только в сером, но и в белом веществе смежного сегмента (рис. 1, а).
В условиях нестабильности позвоночника при наличии постоянной дополнительной травматиза-ции поврежденного участка мозга процесс деструкции нервных структур носит пролонгированный характер. Процесс регенерации нервных волокон затруднен, о чем свидетельствовали следующие факты: малочисленность и нарастающая с течением времени отдаленность от зоны повреждения конусов роста, а также обилие продуктов распада и фрагментированных волокон.
Наиболее выражен процесс деструкции нервной ткани в рассеченном дорсальном канатике: в срок эксперимента 14 суток на очень значительном расстоянии от зоны травмирования он содержал только продукты распада, далее обнаруживались резко измененные нервные волокна и их фрагменты. Восстановления его структуры на протяжении изученного краниального отдела не прослеживалось, что вполне закономерно, т.к. деструкции были подвержены преимущественно дистальные участки рассеченных отростков нервных клеток спинномозговых ганглиев. Более того, выраженные изменения нервных волокон деструктивного характера наблюдались и контралате-рально во все сроки эксперимента (рис. 1, а, б).
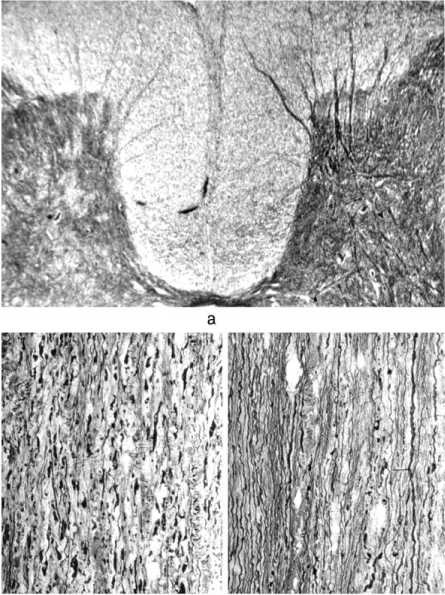
б в
Рис. 1. Структурные преобразования в смежном краниальном сегменте спинного мозга контрольных животных через 14 сут. после гемисекции. Импрегнация нитратом серебра: а – потеря части нервных структур по дорсальной поверхности спинного мозга, поперечный срез, ув. 25; б – полная деструкция нервных волокон рассеченного дорсального канатика, продольный срез, ув. 160; в – фрагментация, извитость нервных волокон и микрополости в латеральном канатике, продольный срез, ув. 160
В пределах травмированного сегмента в структуре латерального канатика наблюдались более умеренные изменения деструктивного характера, наступающие вследствие ретроградной дегенерации рассеченных аксонов мотонейронов, входящих в состав двигательных центров поясничного отдела позвоночника, а также нейроци-тов выше расположенных структур, формирующих проводящие пути. Прослеживалась тенденция к снижению количества микрополостей вне зоны повреждения в краниальном направлении наряду с уменьшением объема каждой из них и одновременным увеличением количества со- хранных нервных волокон. При этом более кра- ниально и медиально от зоны выраженных изменений располагалась зона более умеренных изменений деструктивного характера с наличием значительного количества продольно расположенных нервных волокон и сохранившихся пучков. Количество последних, по мере отдаления от вышеописанной зоны, постепенно нарастало, но полного восстановления плотности нервных во- локон в пределах поврежденного сегмента не наблюдалось. В сохранившихся нервных волок- нах прослеживались извитость и резкие изменения контуров. Как правило, среди них обнаруживались микрополости (рис. 1, в).
Необходимо отметить, что изменения контуров продольно ориентированных проводников в той или иной степени определялись на протяжении всего краниального отдела, включая вентральные канатики, тогда как контуры межсегментарных косо расположенных нервных волокон оставались достаточно ровными даже на незначительном удалении от зоны повреждения. Плот- ность последних в пределах сегмента, исключая непосредственно зону травмирования и близлежащие области, изменялась незначительно.
В участках серого вещества, приближенных к зоне повреждения и на значительном отдалении от нее, помимо выраженных полостных преобразований нервной ткани, выявлялись также и участки гибели нейроцитов, в т.ч. и в смежном сегменте (рис. 1, а). Обнаруживались нейроциты с различной степенью преобразований структуры нейро-цитов: от появления клеток-теней или значительной гиперхромии нейроплазмы до изменения формы и локализации ядра и ядрышка.
Половинное поперечное рассечение спинного мозга в условиях нестабильности позвоночника запускало пролонгированный, динамично нарастающий процесс образования микрополостей не только в зоне повреждения, но и в прилежащих краниально участках, расположенных на отдалении от зоны повреждения, выраженный как в белом, так и более значительно сером веществе (рис. 2).
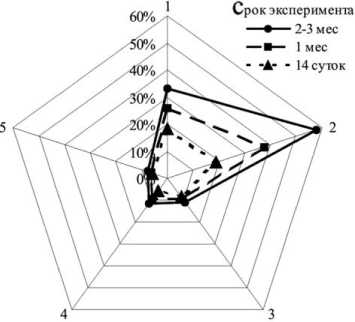
Рис. 2. Динамика деструктивных изменений после гемисекции в краниальной части спинного мозга животных с нестабильным состоянием позвоночника: 1, 3, 5 – латеральный канатик; 2, 4 – промежуточная зона
Условия ограничения подвижности поврежденного отдела позвоночника и изменения его формы в функционально выгодном положении позволили не только избежать формирования рубца и ограничить деструктивные изменения в зоне повреждения [6, 7], но и обеспечить максимальную сохранность нервной ткани. При этом наиболее выраженные изменения деструктивного характера также были характерны для дорсальных канатиков. Формирование микрополостей в срок эксперимента 14 суток наблюдалось до половины краниального отдела поврежденного сегмента, к концу происходило неполное восстановление структуры, связанное с наличием некоторого количества фрагментированных волокон. Аналогичные, но более умеренные преобразования наблюдались и в смежном краниальном сегменте: прослеживалась потеря небольшой части проводников задних канатиков как на стороне повреждения, так и контралатерально (рис. 3, а). С течением времени процесс деструкции дистальных участков рассеченных отростков чувствительных нейро-цитов нарастал.
В срок эксперимента 14 суток деструкция нервных волокон и микрополости выявлялись ограниченно вблизи зоны повреждения. На незначительном удалении от нее определялись дегенерирующие нервные волокна и микрополости максимальной площадью 2557 мкм2, сформированные в участках распада толстых миелиновых волокон. При этом большая часть выявлялась в поверхностно расположенных участках, содержащих продольно ориентированные проводники tractus spinocerebellaris и tractus spinocerebellaris ventralis. Медиально, преимущественно в области tractus rubro-reticulospinalis и vestibulo-reticulospinalis, а также собственных путей [8], наблюдалось небольшое количество микрополостей. В то же время прослеживались проявления регенераторного характера: часть нервных волокон, контуры которых были изменены умеренно, заканчивалась конусами роста на незначительном отдалении от зоны повреждения. По мере отдаления от последней деструктированные и значительно измененные нервные волокна прослеживались реже, соответственно, определялось снижение количества и размеров микрополостей. В смежном краниальном сегменте отмечались незначительные изменения структуры большинства нервных проводников, среди которых наблюдалось небольшое количество извитых и умеренно варикозных нервных волокон, без микрополостных преобразований (рис. 3, Б). Плотность нервных структур на стороне рассечения, особенно в медиальных участках смежного сегмента, мало отличалась от таковой контралатерально.
Через 1 месяц после гемисекции в условиях ограничения подвижности поврежденного отдела позвоночника и изменения его формы в функционально выгодном положении, способствующем смыканию краев рассеченного участка мозга, прослеживалось некоторое увеличение плотности латерального канатика, что было обусловлено снижением активности деструктивных и повышением репаративных процессов. В последующем, до 3 месяцев эксперимента, сохранившиеся продольно ориентированные проводники имели достаточно ровные контуры даже в непосредственной близости к зоне повреждения, значительного разрежения структуры не наблюдалось, встречались тонкие нервные волоконца, доходящие до диастаза.
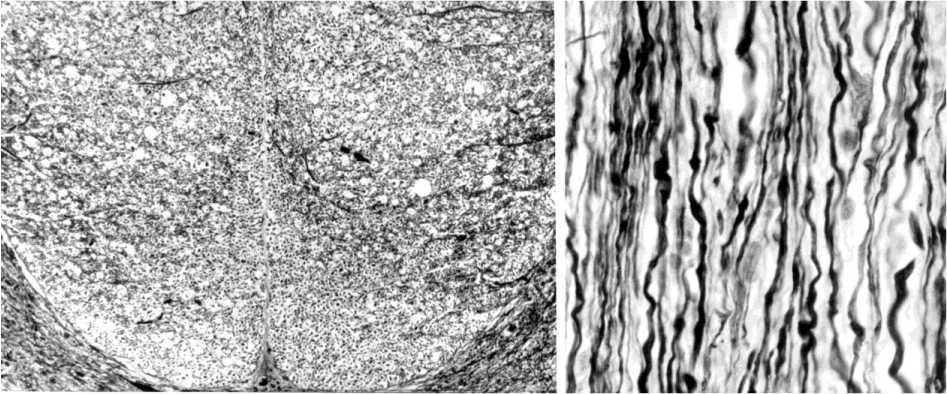
Рис. 3. Умеренная разреженность структуры дорсальных канатиков (А) и извитость нервных волокон бокового канатика (Б) в смежном краниальном сегменте спинного мозга животных опытной группы через 14 сут. после гемисекции. Импрегнация нитратом серебра: А – поперечный срез, ув. 63; Б – продольный срез, ув. 400
В нервных волокнах вентральных канатиков спинного мозга выявлены изменения, аналогичные обнаруженным в боковых канатиках: проявления ретроградной дегенерации определялись преимущественно в более ранние сроки эксперимента в ограниченных участках. Также максимально сохранными оставались внутри-сегментарные проводники.
Во всех сроках эксперимента структура серого вещества в спинном мозге животных опытной серии не претерпевала значительных преобразований и оставалась достаточно плотной, с наличием умеренно измененных сосудов. Тотальная гибель нейроцитов и изменения плотности серого вещества отмечались лишь на небольшом расстоянии от зоны повреждения, при этом в участках распада волокон и гибели нейроцитов также образовывались микрополости, величина и количество которых уменьшались по мере отдаления.
При создании оптимальных условий сближения рассеченных краев спинного мозга превалирование процесса деструкции нервной ткани ограничено во времени – нарастание прослеживалось до 14 суток эксперимента, затем на- блюдалась стабилизация в пределах первого месяца и ограничение деструктивного процесса в дальнейшем. При этом максимальная сохранность нервной ткани определялась в области серого вещества в течение всего периода эксперимента (рис. 4).
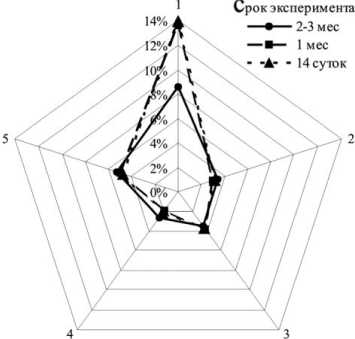
Рис. 4. Динамика деструктивных изменений после гемисекции в краниальной части спинного мозга в условиях ограничения подвижности позвоночника и изменения его формы в функционально выгодном положении: 1, 3, 5 – латеральный канатик; 2, 4 – промежуточная зона
ОБСУЖДЕНИЕ
После половинного поперечного рассечения спинного мозга в условиях нестабильности поврежденного отдела позвоночника наблюдалось большое количество микрополостей, расположенных краниально на отдалении от зоны повреждения. Данные преобразования обусловлены как распадом нервных волокон, формированием и последующим слиянием микрополостей, так и деструкцией нервной ткани вследствие нарушения внутримозгового кровообращения. Эти же факторы отрицательно влияли и на структурные преобразования нервных клеток с потерей их количества в составе двигательных ядер.
Прогрессирующему нарастанию деструктивных изменений способствовали нестабильность позвоночника и изменение его формы после частичной ламинэктомии в функционально невыгодном (кифотическом) положении, приводящие к натяжению поврежденного участка спинного мозга и пролонгированной деструкции нервной ткани не только в области белого, но и серого вещества. Выраженные расстройства кровообращения, наблюдаемые в спинном мозге собак этой группы, также являющиеся следствием постоянного дополнительного травмирования, оказывают отрицательное воздействие на сохранность нервных структур, особенно серого вещества, что объясняется особенностями кровоснабжения [9].
Формирование интраспинальных полостей максимальных размеров прослеживалось в области дорсальных рогов и в промежуточной зоне, что обусловлено, помимо особенностей кровоснабжения, наиболее значительным натяжением именно данных структур при наличии кифотической деформации [5, 11].
В спинном мозге после его половинного поперечного рассечения в условиях стабилизации и изменения формы поврежденного отдела позвоночника в функционально выгодном положении прослеживались минимальные изменения деструктивного характера, определялась максимальная сохранность структур, как белого, так и серого вещества с проявлениями компенсаторного процесса в нейроцитах и регенераторного в нервных волокнах. Исключением являются дорсальные канатики, в которых деструкции подвержены дистальные участки рассеченных отростков нервных клеток, что вполне закономерно.
Сохранность нервной ткани была обусловлена отсутствием натяжения и дополнительного травмирования прилежащих к поврежденному отделу позвоночника нервных структур, следствием чего явилось также и отсутствие выраженных расстройств интрасинального кровообращения. В спинном мозге животных данного эксперимента практически не обнаружено микродиа-педезных кровоизлияний. Большинство интрас-пинальных сосудов имели незначительные изменения стенок, наблюдалось заполнение их форменными элементами крови. Встречались единичные умеренно расширенные сосуды, в которых выявлялись участки заполнения плазмой.
При создании оптимальных условий сближения рассеченных краев спинного мозга, более значительным изменениям деструктивного характера подвержены рассеченные нервные волокна латерального канатика краниального отдела вследствие имеющего место процесса ретроградной дегенерации. Однако этот процесс выражен менее значительно, чем в условиях нестабильности позвоночника (рис. 2, 4).
Максимальная сохранность нервной ткани в условиях ограничения подвижности поврежденного отдела позвоночника и изменения его формы в функционально выгодном положении явились морфофункциональной основой для восстановления утраченных функций.
В результате проведенного исследования можно констатировать:
-
1. Биомеханическое состояние поврежденного отдела позвоночника оказывает существенное влияние на течение деструктивного процесса в прилежащих нервных структурах.
-
2. Важным пусковым моментом в развитии патологических изменений в травмированном спинном мозге является выраженность нарушений интраспинального кровообращения, которая максимальна в условиях нестабильности позвоночника.
-
3. Условия нестабильности позвоночника и формирующаяся вследствие разрушения задних опорных структур кифотическая деформация способствуют разрушению спинного мозга в значительных размерах вне зоны повреждения, особенно в области серого вещества, что отрицательно влияет на возможность восстановления функций.
-
4. В спинном мозге после его половинного поперечного рассечения в условиях стабилизации и изменения формы поврежденного отдела позвоночника в функционально выгодном положении изменения деструктивного характера минимальны, что способствует восстановлению утраченных функций.


