1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионы: синтез и особенности строения
Автор: Карманова Ольга Геннадьевна, Козьминых Владислав Олегович, Муковоз Петр Петрович, Козьминых Елена Николаевна
Журнал: Вестник Южно-Уральского государственного университета. Серия: Химия @vestnik-susu-chemistry
Рубрика: Органическая химия
Статья в выпуске: 13 (272), 2012 года.
Бесплатный доступ
Конденсацией алкилметилкетонов с диэтилоксалатом в присутствии метилата натрия получены 1,6-диалкилзамещенные 3,4-дигидрокси- 1,6-гексадиен-1,6-дионы. С помощью спектральных методов выявлены семь таутомерных форм, обсуждаются кольчато-цепные и кольчато-кольчатые интерконверсии.
Алкилметилкетоны, оксалильная конденсация, 6-диалкил- 3, 4-дигидрокси-1, 6-гексадиен-1, 6-дионы, таутомерные формы
Короткий адрес: https://sciup.org/147160224
IDR: 147160224 | УДК: 547.341+547.725
Текст научной статьи 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионы: синтез и особенности строения
Известно, что сложноэфирная конденсация Клайзена арилметилкетонов с диэтилоксалатом в присутствии оснований приводит к образованию 1,6-диарилпроизводных 1,3,4,6-тетра-оксогексанов [1-4]. Среди 1,3,4,6-тетракарбонильных систем (ТКС) до наших исследований наименее изученными оставались 1,6-диалкилпроизводные, особенности строения которых ранее не были известны. Литературные сведения по 1,6-диалкил-1,3,4,6-тетраоксогексанам ограничиваются краткими данными по соединениям, имеющим в своем составе одинаковые алкильные заместители [3].
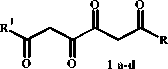
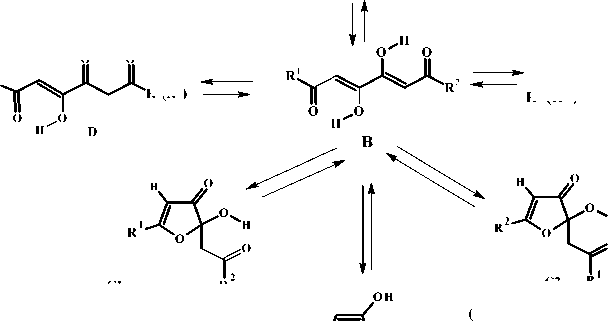
С целью получения и исследования деталей строения алкилпроизводных ТКС нами проведена реакция алкилметилкетонов с диэтилоксалатом и метилатом натрия при соотношении реагентов 2:1:2 с последующим подкислением, в результате которой с удовлетворительными выходами получены 1,6-диалкил-1,3,4,6-тетраоксогексаны 1a - d (см. рисунок, таблицу). С помощью спектральных методов у соединений 1a - d обнаружено несколько таутомерных форм A - F .
+
A
’ MeONa
2 HCl
- EtOH
-NaCl
R ’ (R 2 )
R 2 (R ’ )
O
O
H
O
O
E
H
O
HO
, 2 A,./*CHCOR ( )
R ’ (R 2 ) O
C2
R
C1
R 2 =C 3 H 7 )
R 2 =c 2 H 5 )
(R ’ =C 3 H 7 ,
HO
1 1 CHCOR 2(,)
R ’ (R 2 ) O
(R 1 =C 2 H 5 ,
F
R ’ =R2= C 2 H 5 ( 1a ); R ’ =R2= н -C 3 H 7 ( 1b ); R-C 2 H 5 , R2= н -C 3 H 7 ( 1c ); R ’ =R2= н -C 5 H 11 ( 1d )
Синтез 1,6-диалкил-1,3,4,6-тетраоксогексанов
1,6-Диалкил-1,3,4,6-тетраоксогексаны 1 в твердом состоянии и неполярных растворах (например, хлороформе) находятся полностью (твердая фаза) или преимущественно (раствор) в линейной диоксодиенольной форме В. Это хорошо согласуется с имеющимися литературными данными по 1,6-диарилпроизводным 1,3,4,6-тетракетонов [1, 2]. В полярных растворах (ацетоне, диметилсульфоксиде) у соединений 1 присутствует или количественно преобладает кольчатая оксофурановая форма С , находящаяся в подвижном кольчато-цепном таутомерном равновесии с линейной формой В . В случае 1,6-диалкил-1,3,4,6-тетраоксогексанов с различающимися алкильными заместителями в растворе ДМСО- d 6 имеются обе возможные кольчатые формы С1 и С2 (см. рисунок).
Характеристики 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионов 1a–d
|
Сое-дине-ние |
Заместители |
Т ор пл, |
Выход, % |
Брутто-формула (мол. масса) |
|
|
R1 |
R2 |
||||
|
1а |
C 2 H 5 |
C 2 H 5 |
76–78 (лит.: 75–76 [3]) |
33 |
C 10 H 14 O 4 (198,22) |
|
1b |
н -C 3 H 7 |
н -C 3 H 7 |
58–60 |
43 |
C 12 H 18 O 4 (226,27) |
|
1c |
C 2 H 5 |
н -C 3 H 7 |
103–105 |
37 |
C 11 H 16 O 4 (212,24) |
|
1d |
н- C 5 H 11 |
н- C 5 H 11 |
58–59 |
71 |
C 16 H 26 O 4 (282,38) |
По данным спектров ЯМР 1Н нами также обнаружены минорные таутомерные формы A , D , E , F в количестве 1–3 %. Установленная нами оксофурановая форма Е не может быть альтернативной на следующих основаниях. В альтернативной форме Е двухдублетный маркерный сигнал метиленовой группы С(4)Н фуранового кольца должен находится, судя по расчету, в области более сильного поля 2,79 м.д. и иметь большое значение КССВ (J 18,0 Гц). Полуацетальный гидроксил должен находится при 3,61 м.д., а находится в гораздо более слабом поле – 7,34 м.д. Это позволяет утверждать, что полуацетальный протон С(2)ОН имеет внутримолекулярную водородную связь (ВВС) с атомом кислорода ацетильного звена формы С . Наряду с основной формой соединения 1а нами обнаружена в растворе ДМСО- d 6 минорная форма В (15 %). В качестве минорной формы с общим содержанием не более 2 % нами выявлено около 1 % тетракетонной формы А (маркерный сигнал при 4,02 м.д.), а также 0,5 % формы диоксодиенольной Д (маркерный сигнал группы СН2 при 4,02–4,07 м.д.) и Е (маркерный сигнал группы СН2 при 4,05 м.д.)
В спектре ЯМР 1Н соединения 1a , записанном в растворе хлороформа, маркерными сигналами являются сигналы группы С(2,5)Н. Переход в гомологическом ряду не приводит к изменению положения метинового протона (δ 6,33–6,34 м.д.). Спектр соединения 1a характеризуется триплетным сигналом метильной группы 1,12 м.д. (J 7,8 Гц), квадруплетом метиленовой группы при 2,52 м.д. (J 7,8 Гц) и уширенным сигналом гидроксильной группы при 14,58 м.д. Данные спектра практически полностью согласуются с расчетными для соединения 1a . Протоны метиновых групп хелатных колец являются магнитно эквивалентными. Об этом свидетельствуют близкие значения химических сдвигов подвижных протонов гидроксильных групп енольного звена гомологов. Все это подтверждает равномерность перераспределения электронной плотности в устойчивых стабилизированных шестичленных ОН- хелатных кольцах, влияние алкильных заместителей на которые оказывается практически несущественным. Триплет метильной группы при 1,12 м.д. (J 7,8 Гц), квадруплет метиленовой группы при 2,52 м.д. (J 7,8 Гц), синглет протона ме-тиновой группы при С(2,5)Н и уширенный сигнал протона гидроксильной группы соответствуют диоксодиенольной форме В . Общее содержание данной формы в растворе хлороформа составляет 98 %. В спектре хлороформа соединения 1a обнаружена минорная форма D (2 %). В спектре соединения 1a , записанном в ДМСО- d 6 , преобладающей является кольчатая оксофурановая форма С (80 %). Суммарное содержание форм В и С составляет 97 %, на минорные таутомеры А и Е приходится соответственно 3 %.
В спектре ЯМР 1Н соединения 1b, снятого в растворе дейтерохлороформа, присутствует характеристический триплет метиленовой группы при 0,96 м.д. (J 7,8 Гц), квадруплетный сигнал метиленовой группы при 2,45 м.д. (J 7,8 Гц), двухдублетный сигнал метиленовой группы при 1,68 м.д. (J 7,8 Гц). Маркерным сигналом является протон С(2,5)Н со значением химического сдвига 6,33 м.д. и уширенный сигнал гидроксильной группы 14,70 м.д. Соединение 1b существует в растворе хлороформа в преобладающей диоксодиенольной форме В (96 %). Однако нами рассчитано содержание минорных форм, обнаруженных в спектре хлороформа соединения 1b. Минорными формами в данном случае являются формы А (1 %) и D (3 %).
В спектре соединения 1b , записанного в ДМСО- d 6 , общее содержание диоксодиенольной формы В и кольчатой оксофурановой формы С составляет 98 %. Нами обнаружено, что оставшиеся 2 % приходятся на минорную форму D . В отличие от раствора ДМСО- d 6, в котором количественно преобладает оксофурановая форма, в растворе d -ацетона для соединения 1c ее содержание незначительно (95 %) по сравнению с раствором ДМСО- d 6 . Это хорошо объясняется полярностью ацетона (ε 21,5 D) и диметилсульфоксида- d 6 (ε 45 D). В спектре ЯМР 1Н соединения 1b , снятого в растворе d -ацетона, наблюдается сольватация со стабилизацией бис -хелата. Это преимущественно проявляется в том, что сигнал протонов при С(2,5)Н (δ 6,42 м.д.) незначительно смещается в слабое поле по сравнению с раствором хлороформа (δ 6,33 м.д.) и вместе с тем находится в более сильном поле (δ, 6,43 м.д.) по сравнению с раствором ДМСО- d 6 , в котором имеет место специфическая сольватация.
В спектре ЯМР 1Н соединения 1c, снятого в растворе дейтерохлороформа, содержание преобладающей формы В составляет 96,5 %, а содержание обнаруженных минорных форм А , F и E составляет соответственно 2 %, 1 % и 0,5 %. В спектре присутствует сигнал метильной группы в СН 3 СН 2 СН 2 СО при 0,96 м.д. (J 7,8 Гц) и сигнал метильной группы в СН 3 СН 2 СО при 1,16 м.д. (J 7,8 Гц); квадруплет, триплет и мультиплет метиленовой группы находятся при следующих значениях химического сдвига: 2,52 м.д. (J 7,8 Гц), 2,46 м.д. (J 7,8 Гц) и 1,68 м.д. соответственно. Маркерным сигналом является протон метиновой группы при С(2,5)Н при 6,3 м.д. В спектре ЯМР 1Н соединения 1с , записанного в растворе диметилсульфоксида, преобладающей являются оксофурановая форма С (45 % С1 и 39 % С2 ), содержание дикосодиенольной формы В составляет 14,5 % и на минорую форму D приходится 1,5 %. Сигналы всех протоносодержащих групп фрагментов, расположенных по обе стороны связи С(5)–С(6), являются практически магнитноэквивалентными и не дублируются. Этот факт является неожиданным, поскольку соединение 1c не является осесимметричным по связи С(5)–С(6) даже несмотря на близость значений индуктивных эффектов этильной и н -пропильной групп. Сравнительно незначительные отличия в значениях положительных индуктивных эффектов этильной (+I, 6,30) и пропильной (+I, 6,68) групп позволяют судить о существенных отличиях структур С1 и С2 . В данном случае происходит наложение сигналов этильной и н -пропильной групп друг на друга, что косвенным образом является подтверждением аналогичного наложения сигналов в региоизомерных формах С1 и С2 . Наложение синглетов метиновых протонов С(4)Н кольчатых форм С1 и С2 друг на друга (δ 5,52 м.д.) свидетельствует об их магнитной эквивалентности и об отсутствии влияния этильного и пропильного заместителя в этих формах на положение метинового протона. Этот факт также является неожиданным и может быть интерпретирован как результат незначительной разницы в положительных индуктивных эффектах этих заместителей. Впервые нами доказано, что региоизомеры как, например, кольчатые полуацетали С1 и С2, могут быть вовлечены в прототропные равновесия с переходом друг в друга через оксоенольную форму В в равновесной системе С1 С2 Этот факт интерпретируется нами как кольчато-кольчатые интерконверсии [6]. Ранее сведения о возможности существования равновесных состояний для геометрически фиксированных региоизомеров на основе оксофурановых полуацеталей отсутствовали.
В спектре ЯМР 1Н соединения 1d, снятого в растворе дейтерохлороформа, содержание преобладающей формы В составляет 94 %, а обнаруженных минорных форм А и F соответственно 1,5 и 4,5 %. В спектре присутствуют сигналы фрагмента СН3СН2СН2СН2СН2СО: триплет группы СН3 при 0,89 м.д. (J 7,0 Гц), метиленовые сигналы (4Н, 2СН2) при 1,29–1,36 м.д. и (2Н, СН2) при 1,60–1,70 м.д.; квадруплет метиленовой группы при 2,47 м.д. (J 7,5 Гц), синглет метиновой группы С(2,5)Н при 6,33 м.д., а также уширенный сигнал протона гидроксильной группы при 14,70 м.д. В спектре соединения 1d, записанного в ДМСО-d6, содержание кольчатой оксофурановой формы С составляет 85 %, содержание минорных форм В и D составляет 13,5 и 1,5 % соответственно. Этот спектр соединения 1d характеризуется наличием группы сигналов н-пентильной группы при следующих значениях химических сдвигов: 0,86-0,93 м.д., 1,191,41 м.д., 1,46–1,56, 2,43–2,47 м.д. В составе сложной группы сигналов невозможно обнаружить отдельные разрешенные сигналы концевых протоносодержащих групп (метильной и метиленовой) вследствие наложения мультиплетов двух преобладающих форм В и С друг на друга. Присутствие характеристического двухдублетного сигнала при 2,94 м.д. с хорошо согласующейся КССВ (J 15,6 Гц), а также наличие протона гидроксильной группы С(2)ОН при 7,81 м.д. указывает на преобладание формы С. На незначительное содержание минорной формы D указывает синглет метиленовой группы при 4,03 м.д. и синглет метиленовой группы при С(2)Н со значением химического сдвига 6,32 м.д.
Заключение
Таким образом, в растворах соединений 1 нами обнаружены ранее не описанные таутомерные формы E и F . Анализ спектральных характеристик соединений 1а – d дает основание утверждать, что в растворе хлороформа количественно преобладающей является форма В (96–98 %), а в растворе диметилсульфоксида – форма С (80–83 %).
Экспериментальная химическая часть
ИК спектры полученных соединений 1 записаны на спектрофотометре «Инфралюм ФТ–02» в пасте твёрдого вещества в вазелиновом масле. Спектры ЯМР 1H соединений 1 получены на приборе «MERCURYplus-300» (300,05 МГц) в ДМСО- d 6 и СDQ3, внутренний стандарт - ТМС. Протекание реакций контролируют, а индивидуальность полученных веществ подтверждают методом ТСХ на пластинках Silufol UV–254 в системе гексан – ацетон, 3:1, хроматограммы проявляют парами иода. Исходные реактивы перед использованием очищают перегонкой.
Синтез 1,6-дизамещенных 3,4-дигидрокси-2,4-гексадиен-1,6-дионов (1a–d).Общая методика
К 100 мл метанола, предварительно перегнанного над натрием, добавляют порциями 1,15 г (50 ммоль) натрия, метанол отгоняют, к сухому метилату натрия добавляют 150 мл абсолютного диэтилового эфира, при охлаждении и перемешивании прибавляют по каплям смесь 4,4 мл (50 ммоль) бутанона (для синтеза соединения 1a ), 5,3 мл (50 ммоль) 2-пентанона (для синтеза соединения 1b ), 2,2 мл (25 ммоль) бутанона и 2,7 мл (25 ммоль) 2-пентанона (для синтеза соединения 1c ), 5,2 мл 2-гептанона (для синтеза соединения 1d ) и 3,4 мл (25 ммоль) диэтилоксалата и нагревают 1–2 часа. Осадок отфильтровывают, добавляют при перешивании и охлаждении 15 мл 15 % соляной кислоты, продукт кристаллизуют из этилацетата. Получают бесцветные кристаллы соединений 1a – d .
(4Z, 6Z)-5,6-Дигидроксидека-4,6-диен-3,8-дион (1a). Бесцветные кристаллы. Выход 1,90 г (33 %), т. пл. 76–78°С (лит.: 75–76°С [3]). Спектр ЯМР 1Н, δ, м.д., (CDCl 3 ): 1,12 т (3Н, СН 3 , форма В , 98 %), 2,52 кв (2Н, СН 2 , J 7,8 Гц, В ),6,33 с (1Н, С(2,5)Н, В ). Спектр ЯМР 1 Н, 8, м.д., (ДМСО -d 6 ): 0,91 т (3Н, СН 3 в С 2 Н 5 СО), 1,13 т (3Н, СН 3 в СН 3 СН 2 -С(5), С , 80 %), 1,10 т (3Н, СН 3 , В , 17 %), 2,64 кв (2Н СН 2 , В ), 2,93 два д (2Н, СН 2 , J 15,3 Гц, С ), 5,52 с (СН, С(4)Н, С ), 6,43 с (1Н, С(2,5)Н, В ), 7,80 с (С(2)ОН, С ), 14,58 уш.с.(С(3,4)ОН), В ). Найдено, %: С 60,87; Н 7,45. C 10 H 14 O 4 . Вычислено, %: С 60,59; Н 7,11.
( 5 Z , 7 Z)-6,7-Дигидроксидодека-5,7-диен-4,9-дион (1b). Бесцветные кристаллы. Выход 4,0 г (43%), т. пл. 58-60°С. ИК спектр, V , см-1 (форма В ): 3253 (ОН хелат ), 3097 (CH), 2962 V as (CH 3 ), 2932 V as (CH 2 ), 2896 V s (CH 3 ), 2872 V s (CH 2 ), 1556 Шир. (С(1,6)=O хела т), 1460 8 as (CH 3 ), 1397 ^ крутильные (CH 2 ), 1353 8 s (CH 3 ), 1285 З веерные (CH 2 ), 1142, 1094, 1070, 1036, 942, 903, 873 V скелетные (C-C), 793 δ маятниковые (CH 3 ), 579 ν скелетные (C–C). Спектр ЯМР 1Н, δ, м.д., (CDCl 3 ): 0,96 т (3Н, СН 3 , В , 96 %), 2,46 кв (2Н, СН), 1,68 м (2Н, СН), 6,33 (СН, С(2,5)Н). Спектр ЯМР 1 Н, 8, м.д., (ДМСО -d 6 ): 0,85 т (3Н, СН 3 в СН 3 СН 2 СН 2 С(5), С , 80 %), 0,96 т (3Н, СН 3 СН 2 СН 2 СО), 0,94 т (3Н, СН 3 , В , 18 %), 2,43– 2,59 т (2Н, СН 2 , С ), 2,43–2,59 т (2Н, СН 2 , В ), 1,46 м (2Н, СН 3 СН 2 СН 2 СО, С ), 1,64 м (2Н, СН 3 СН 2 СН 2 С(5), С ), 1,65 м (2Н, СН 2 , В ), 2,94 два д (2Н, СН 2 , J 15,6 Гц, С ), 6,43 с (1Н, С(2,5)Н, В ), 5,53 с (1Н, С(4)Н, С ), 7,79 с (С(2)ОН, С ), 14,58 уш. с. (С(3,4)ОН, В ). Спектр ЯМР 1Н, δ, м.д., ((CD 3 ) 2 CO): 0,98 т (3Н, СН 3 , В , 95 %), 0,91 т (3Н, СН 3 , С ), 2,59 т (2Н,СН 2 , J 7,5 Гц, В ), 2,48 м (2Н, СН 2 , J 7,5 Гц, С ), 1,70 м (2Н, СН 2 , В ), 1,56 м (2Н, СН 2 ), 2,97 два д (2Н, СН 2 , J 15,9 Гц, С ), 5,41 с
(1Н, С(4)Н, С ), 6,42 с (1Н, С(2,5)Н, В ). Найдено, %: С 63,92; Н 8,33. C 12 H 18 O 4 . Вычислено, %: С 63,69; Н 8,02.
4Z,6Z)-5,6-Дигидроксиундека-4,6-диен-3,8-дион ( 1c ). Бесцветные кристаллы. Выход 1,70 г (37 %), т. пл. 103-105°С. ИК спектр, V , см-1 (форма В ): 3250 (ОН хелат ), 3098 (CH), 2963 V as (CH 3 ), 2924 V as №), 2873 V s (CH 3 ), 2853 V s (CH 2 ), 1556 (С(1,6)=О хелат ), 1461 S as (CH 3 ), 1399 З крутильные №), 1375 S s (CH 3 ), 1288 З веерные №), 1137, 1092, 1047, 1000, 875, 801 V скелетные (C-C), 783 δ маятниковые (CH 3 ), 573 ν скелетные (C–C). Спектр ЯМР 1Н, δ, м.д., (CDCl 3 ): 0,96 т (3Н, СН 3 СН 2 СН 2 СО, В , 96,5 %), 1,16 т (3Н, СН 3 СН 2 СО, J 7,8 Гц), 2,52 кв (2Н, СН 2 , J 7,8 Гц, В ), 2,46 т (2Н, СН 2 , В ), 1,68 м (2Н, СН 2 ), 6,33 с (1Н, С(2,5)Н, В ). Спектр ЯМР 1Н, δ, м.д., (ДМСО -d 6 ): 1,10 т (3Н, СН 3 , В , 14,5 %), 0,83–0,99 т (3Н, СН 3 , С ), 2,43-2,60 кв (2Н, СН 2 , С ), 2,432,60 т (2Н, СН 2 , С ), 1,46 м (2Н, СН 2 , С2 , 39 %), 1,61 м (2Н, СН 2 , С1 , 45 %), 1,56 м (2Н, СН 2 , В ), 2,93 два д (2Н, СН 2 , J 15,0 Гц, С ), 5,52 с (1Н, С(4)Н, С ), 6,43 с (1Н, С(2,5)Н, В ), 7,79 с (С(2)ОН, С ), 14,59 уш.с. (С(3,4)ОН, В ). Найдено, %: С 62,44; Н 7,71. C 11 H 16 O 4 . Вычислено, %: С 62,25; Н 7,59.
(7Z,9Z)-8,9-дигидроксигексадека-7,9-диен-6,11-дион (1d). Бесцветные кристаллы. Выход 2,85 г (71 %), т. пл. 58-59°С. ИК спектр, V , см-1 (форма В ): 3200 (ОН хелат ), 3099 (CH), 2924 V as (CH 3 ), 2856 V s (CH 3 ), 1594 (С(1,6)=О хелат ), 1466 S as (CH 3 ), 1376 S s (CH 3 ), 1263 З веерные №), 1144, 1041, 1003, 946, 881, 849 ν скелетные (C–C). Спектр ЯМР 1Н, δ, м.д., (CDCl 3 ) (форма В ): 0,89 т (3Н, СН 3 , J 7,0 Гц,), 1,29–1,36 гр.с. (4Н, 2СН 2 ), 1,60–1,70 гр.с. (2Н, СН 2 ), 2,47 т (2Н, СН 2 , J 7,5 Гц), 6,33 с (С(2,5)Н), 14,70 уш.с. (С(3,4)ОН). Спектр ЯМР 1Н, δ, м.д., (ДМСО -d 6 ): 0,86–0,93, 1,19–1,41, 1,46–1,56, 2,43–2,47 гр.с. (11Н, С 5 Н 11 , В , 13,5 %), 2,91 два д (2Н, СН 2 , J 15,6 Гц, С , 85 %), 4,03 с (2Н, СН 2 , D ), 5,53 с (1Н, С(4)Н, С ), 6,32 c (1Н, С(2)Н, D ), 6,44 с (1Н, С(2,5)Н, В ), 7,81 с (С(2)ОН, С ). Найдено, %: С 68,05; Н 9,27. C 16 H 26 O 4 . Вычислено, %: С 68,31; Н 9,49.
Список литературы 1,6-диалкил-3,4-дигидрокси-2,4-гексадиен-1,6-дионы: синтез и особенности строения
- Poje, M. 3(2H)-Furanone derivatives. Ring-chain tautomerism in the 1,3,4,6-tetraketone series/M. Poje, K. Balenovic//J. Heterocycl. Chem. -1979. -Vol. 16, № 3. -Р. 417-420.
- 1,3,4,6-Тетракарбонильные соединения. Синтез, особенности строения и противомикробная активность 1,6-диарил-3,4-дигидрокси-2,4-гексадиен-1,6-дионов/Н.М. Игидов, Е.Н. Козьминых, О.А. Софьина и др.//Химия гетероцикл. соедин. -1999. -Вып. 11. -С. 1466-1475.
- Козьминых, В.О. Конденсация Клайзена метилкетонов с диалкилоксалатами в синтезе биологически активных карбонильных соединений (обзор, часть 3)/В. О. Козьминых, В.И. Гончаров, Е.Н. Козьминых//Вестник Оренбургского гос. ун-та. -2007. -Вып. 5 (69). -С. 138-148.
- Синтез, особенности строения и таутомерия 1,6-дизамещённых 3,4-дигидрокси-2,4-гексадиен-1,6-дионов/Е.А. Кириллова, П.П. Муковоз, А.Н. Виноградов и др.//Изв. вузов. Химия и хим. технология. -2011. -Т. 54. -Вып. 4. -С. 18-22.
- Молекулярный дизайн таутомерных интерконверсий гетероциклов/К.Н. Зеленин, В.В. Алексеев, К. Пихлайя, В.В. Овчаренко//Известия Академии наук. Серия «Химия». -2002. -Вып. 2. -С. 197-212.
- Zelenin, K.N. Tautomeric interconversions of heterocyclic derivatives/K.N. Zelenin, V.V. Alekseyev//Targets in Heterocyclic Systems. -1997. -Vol. 1. -P. 83-116.


