Адаптация Pseudomonas helmanticensis к додецилсульфату натрия в присутствии глицерина
Автор: Зубков Илья Николаевич, Кондратьев Вадим Дмитриевич, Шишлянников Сергей Михайлович
Рубрика: Биохимический и пищевой инжиниринг
Статья в выпуске: 2 т.10, 2022 года.
Бесплатный доступ
Культура Pseudomonas helmanticensis, устойчивая к действию додецилсульфата натрия (SDS), способна продуцировать полигидроксиалканоаты (ПГА) - биогенные полиэфиры, применяемые при производстве упаковочных материалов. Устойчивость к алкилсульфатам открывает возможность использования P. helmanticensis для разработки неаксеничных (т. е. не предполагающих предварительной стерилизации сред) процессов получения ПГА. Добавление SDS в среды для культивирования подавляет рост посторонних микроорганизмов, что позволяет избежать паровой стерилизации и снизить стоимость готового полимера. Одним из наиболее перспективных субстратов для получения ПГА является глицерин. Следовательно, целесообразно изучить адаптацию P. helmanticensis к SDS в средах, содержащих глицерин в качестве основного субстрата. Известно, что бактерии Pseudomonas обладают несколькими механизмами, обеспечивающими устойчивость к SDS: образование агрегатов, окруженных защитным матриксом, модификация мембран и синтез расщепляющих алкилсульфаты ферментов. Наличие агрегатов в культурах P. helmanticensis изучалось с помощью эпифлуоресцентной микроскопии с предварительным окрашиванием клеток Акридиновым оранжевым. Модификация клеточных мембран исследовалась путем анализа жирнокислотного состава биомассы методом газовой хроматографии - масс-спектрометрии. Наличие внутриклеточных сульфатаз оценивалось по изменению концентрации SDS в ходе культивирования. Показано, что P. helmanticensis адаптируется к присутствию SDS в средах, содержащих глицерин, путем активации всех трех указанных механизмов. Максимальная концентрация SDS, при которой P. helmanticensis демонстрирует значительный рост биомассы, составляет 0,5 г/л. Такая концентрация ингибирует рост многих других микроорганизмов, благодаря чему P. helmanticensis является перспективным продуцентом для получения ПГА в нестерильных средах, содержащих глицерин и SDS.
Pseudomonas helmanticensis, додецилсульфат натрия, агрегаты, мембранные липиды, жирнокислотный состав, полигидроксиалканоаты, глицерин, эпифлуоресцентная микроскопия, газовая хроматография - масс-спектрометрия, устойчивость к детергентам
Короткий адрес: https://sciup.org/147237387
IDR: 147237387 | УДК: 579.66
Текст научной статьи Адаптация Pseudomonas helmanticensis к додецилсульфату натрия в присутствии глицерина
Бактерии Pseudomonas продуцируют многие ценные вещества, в частности, полигид-роксиалканоаты (ПГА) – биоразлагаемые пластики, которые могут стать заменой традиционным полимерам, получаемым путем нефтехимического синтеза [1]. Основным недостатком ПГА, ограничивающим их широкое использование, является высокая стоимость их производства. Немалая часть всех затрат при получении ПГА обусловлена использованием паровой стерилизации сред, при которой расходуется большое количество энергии. Отказ от стерилизации позволил бы значительно снизить стоимость готового полимера. Неко- торые бактерии Pseudomonas, продуцирующие ПГА, обладают устойчивостью к высоким (до 5 г/л) концентрациям додецилсульфата натрия (SDS) – сильного ионного детергента, подавляющего рост большинства известных микроорганизмов [2]. Такие бактерии могут стать базой для разработки промышленных процессов синтеза ПГА, в которых культивирование проводится в присутствии SDS. Благодаря наличию в среде сильного детергента ингибируется рост посторонних микроорганизмов, но не продуцента ПГА, обладающего устойчивостью к SDS. Таким образом, использование SDS-содержащих сред позволяет отказаться от паровой стерилиза- ции. Одним из примеров устойчивых к SDS продуцентов ПГА является Pseudomonas hel-manticensis [2, 3].
Присутствие SDS в среде для культивирования вызывает у бактерий Pseudomonas значительный стресс [4]. Ответом на этот стресс служит активация трех различных механизмов. В частности, запускается процесс образования окруженных защитным матриксом агрегатов [3, 5, 6]. Кроме того, происходит снижение текучести мембранных липидов [3, 7]. Текучесть, оцениваемая как отношение содержаний ненасыщенных и насыщенных жирных кислот (ЖК), напрямую связана с проницаемостью билипидного слоя. Понижая текучесть (увеличивая долю насыщенных ЖК), клетка замедляет диффузию SDS в цитозоль [8]. Для расщепления поступающего из среды додецилсульфата бактерии Pseudomonas продуцируют ряд эндогенных сульфатаз [9, 10]. Для изучения механизмов устойчивости к алкилсульфатам применяют различные методы. Образование агрегатов можно наблюдать с помощью флуоресцентной микроскопии с предварительным окрашиванием культур универсальным красителем (например, Акридиновым оранжевым) [3]. Для изучения жирнокислотного состава липидов используют метод газовой хроматографии – масс-спектрометрии [11]. Активность эндогенных сульфатаз можно оценить по убыли концентрации SDS в среде в ходе культивирования.
Известно, что присутствие ряда легко расщепляемых субстратов (например, углеводов) ингибирует экспрессию сульфатаз, подавляя устойчивость бактерий Pseudomonas к SDS [12, 13]. Следовательно, использование сред сложного состава, содержащих помимо SDS какой-либо еще субстрат, сопряжено с рядом трудностей. Перед созданием неаксе-ничных процессов синтеза ПГА необходимо исследовать устойчивость продуцента к SDS в присутствии основного субстрата. Для получения ПГА часто используется глицерин, который образуется в процессе производства биотоплива [14]. Исследований влияния глицерина на устойчивость бактерий Pseudomonas к SDS не проводилось. Это побудило авторов статьи изучить влияние глицерина на различные механизмы устойчивости к SDS культуры P. helmanticensis – потенциального продуцента ПГА [2].
Объект исследований
Объектом исследований служила культура P. helmanticensis , выделенная из образца загрязненной почвы в Ленинградской области [3]. Культура хранится во ВНИИПД – Филиале «ФНЦ пищевых систем им. В.М. Горбатова» РАН.
Влияние концентрации SDS на накопление биомассы при культивировании на среде, содержащей глицерин
Для определения максимальной концентрации SDS, при которой происходит накопление значительного количества биомассы, была поставлена серия экспериментов с варьированием содержания детергента в среде от 0,05 г/л до 5 г/л. Культивирование проводили в колбах Эрленмейера объемом 750 мл на шейкере-инкубаторе при температуре 28 °С и скорости перемешивания 250 об/мин. Помимо SDS, среды содержали 10 г/л глицерина, 0,5 г/л NH 4 Cl, 0,5 г/л (NH 4 ) 2 SO 4 , 3 г/л Na 2 HPO 4 ·12H 2 O, 2 г/л KH 2 PO 4 ·H 2 O и 0,01 г/л MgSO4. После завершения культивирования (96 ч) массу клеток отделяли центрифугированием (10 мин при 6800 × g), высушивали и взвешивали.
Культивирование P. helmanticensis для анализа устойчивости к SDS
Для изучения устойчивости к SDS P. hel-manticensis культивировали на среде, содержащей 0,5 г/л SDS, 10 г/л глицерина, 0,5 г/л NH 4 Cl, 0,5 г/л (NH 4 ) 2 SO 4 , 3 г/л Na 2 HPO 4 ·12H 2 O, 2 г/л KH 2 PO 4 ·H 2 O и 0,01 г/л MgSO 4 . Культивирование на аналогичной среде, не содержащей SDS, использовалось в качестве контроля. Образцы биомассы для анализа морфологии культур и жирнокислотного состава липидов отбирали после 96 ч культивирования. Степень деградации SDS анализировали также по окончании культивирования (по прошествии 96 ч).
Изучение морфологии культур методом эпифлуоресцентной микроскопии
Культуры клеток подвергали окрашиванию Акридиновым оранжевым по стандартному методу [3]. Для этого образцы культур наносили на предметное стекло и высушивали на воздухе. Затем стекло с клетками помещали в 0,001 % водный раствор красителя на 2 мин. После этого образец на 15 с последовательно помещали в дистиллированную воду, 50; 70 и 90 % раствор этанола в воде, на 15 с в чистый этанол и на 30 с в лимонен. Покров- ное стекло приклеивали с помощью Витроге-ля, и образец нагревали до 42 °С в течение 10 мин. Готовый образец исследовали при длине волны возбуждения 500 нм на микроскопе Leica DM 1000 LED («Leica», Германия).
Изучение жирнокислотного состава клеток P. helmanticensis
Анализ жирнокислотного состава проводили по стандартной методике [3]. К 70 мг биомассы добавляли 800 мкл смеси Фолча (хлороформ/метанол 2:1 по объему) и проводили экстракцию липидов в течение 12 ч при 4 °С. После этого смесь центрифугировали (10 мин при 6800 × g), органическую фазу отбирали и упаривали в токе азота при комнатной температуре. К сухому остатку добавляли 200 мкл метилирующей смеси – 2 % раствора серной кислоты в метаноле. Образцы нагревали до 65 °С в течение двух часов. По окончании реакции к смеси добавляли 200 мкл 4 % водного раствора карбоната натрия и проводили экстракцию 1 мл дихлорметана. Полученный экстракт анализировали методом ГХ/МС на хроматографе Varian 450-GC, снабженном масс-спектрометрическим детектором Varian 240-MS (колонка WCOT fused silica 50 m × 0.25 mm ID Coating CP-Wax 58 (FFAP-CB Df = 0.2)) («Varian», США). Объем вводимого в колонку образца составлял 1 мкл, газ-носитель – гелий, скорость потока 1 мл/мин. Хроматографическое разделение начинали при постоянной температуре (3 мин, 50 °С), затем температуру колонки линейно повышали до 250 °С в течение 20 минут. Завершали разделение при постоянной температуре (250 °С) в течение 40 минут. Отнесение сигналов производили путем сравнения их времен удерживания с хроматограммой стандартной смеси метиловых эфиров жирных кислот. Подтверждали отнесение с помощью сравнения масс-спектров отдельных компонентов смеси с базой данных. Каждый образец анализировали три раза. Доверительные интервалы результатов анализа рассчитывали с помощью критерия Стьюдента.
Анализ содержания SDS
Анализ содержания SDS в культуральной жидкости проводили спектрофотометрическим методом в соответствии с [15]. Для этого культуру клеток центрифугировали (6800 × g, 10 мин), а супернатант отделяли. 1 мл исследуемого раствора смешивали с 500 мкл раствора Метиленового синего (50 мг/л) в фосфатном буфере (0,0007 моль/л, pH = 7,2) и
3 мл хлороформа. Проводили экстракцию в течение 3 мин, органический слой отделяли и измеряли его оптическую плотность при 655 нм (кювета толщиной 1 см) на фоне холостого раствора. Определение осуществляли с помощью градировочного графика.
Результаты и их обсуждение
Влияние концентрации SDS на накопление биомассы при культивировании на среде, содержащей глицерин
Зависимость выхода биомассы от начальной концентрации SDS при культивировании P. helmanticensis на средах, содержащих глицерин, представлена на рис. 1. Заметный рост биомассы (3,2 г/л) наблюдается при концентрации SDS 0,5 г/л и менее. В присутствии глюкозы сопоставимые количества биомассы P. helmanticensis образуются только при концентрации SDS не более 50 мг/л [3]. Таким образом, устойчивость P. helmanticensis при наличии глицерина в среде для культивирования в 10 раз выше, чем в случае глюкозы. По всей видимости, эта разница обусловлена подавлением экспрессии сульфатаз: в присутствии глюкозы это ингибирование на порядок сильнее, чем в случае глицерина. Анализ культуральной жидкости на наличие SDS также подтверждает предположение об эффективной экспрессии сульфатаз в присутствии глицерина: в конце культивирования содержание SDS в среде было ниже предела чувствительности используемого метода. Можно сделать вывод, что один из основных механизмов устойчивости к алкилсульфатам – выработка расщепляющих SDS ферментов – не подавляется глицерином.
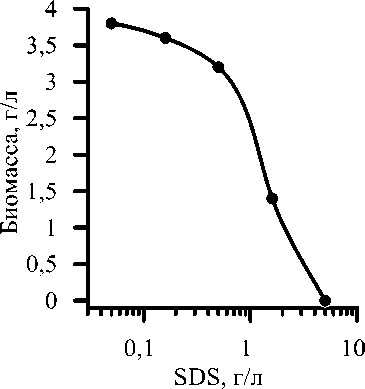
Рис. 1. Зависимость выхода биомассы
P. helmanticensis от начальной концентрации SDS. Основной источник углерода – глицерин (10 г/л)
Образование агрегатов
При культивировании в присутствии SDS P. helmanticensis образует клеточные агрегаты (рис. 2 А). Напротив, клетки P. helmanticensis в контрольном образце, не содержащем SDS, находились в планктонной форме (рис. 2 Б). Таким образом, важнейший механизм устойчивости к SDS – образование окруженных защитным матриксом агрегатов – активируется независимо от наличия глицерина в среде.
Влияние SDS на жирнокислотный состав P. helmanticensis
Содержание насыщенных ЖК (C[14: 0] и C[16: 0]) значительно выше в образцах клеток, полученных культивированием в присутствии SDS (см. таблицу). Текучесть мембранных липидов, определяемая соотношением между ненасыщенными и насыщенны- ми жирными кислотами, в 2,5 раза выше, если в среде для культивирования отсутствует детергент. Наличие SDS активирует пери-плазматические гидрогеназы ЖК [16]. В результате возрастает доля липидов, содержащих насыщенные ЖК, и имеющих меньшую текучесть, а значит и проницаемость. Таким образом клетка замедляет диффузию детергента в цитозоль, снижая его токсическое действие [3].
Выводы
ПГА-продуцирующая культура P. helman-ticensis способна адаптироваться к средам, содержащим до 0,5 г/л додецилсульфата натрия в присутствии глицерина. Показано, что адаптация обеспечивается активацией трех защитных механизмов: образование окруженных матриксом агрегатов, модификация мем-
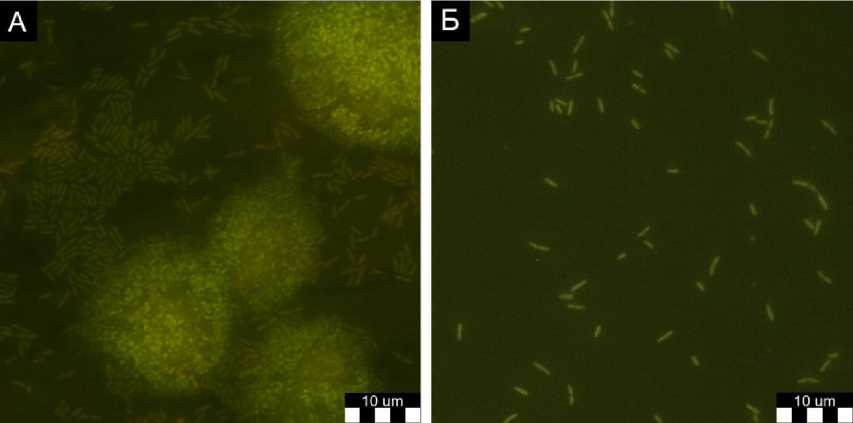
Рис. 2. Культуры клеток P. helmanticensis , выращенные в присутствии SDS (А) и на чистом глицерине (Б)
Результаты анализа жирнокислотного состава биомассы P. helmanticensis
|
Среда |
10 г/л глицерин |
10 г/л глицерин + 0,5 г/л SDS |
|
C[14: 0] (0,2) |
1,2 |
3,9 |
|
C[16: 0] (0,3) |
35,1 |
55,1 |
|
цис-9-C[16: 1] (0,2) |
31,9 |
18,7 |
|
цис-10-C[17: 1] (0,1) |
3,4 |
4,0 |
|
цис-9-C[18: 1] (0,2) |
28,4 |
18,3 |
|
Ненасыщ/насыщ (0,02) |
1,75 |
0,69 |
Примечание: Доверительные интервалы результатов анализа (p < 0,05), вычисленные с помощью критерия Стьюдента, приведены в скобках.
бранных липидов и синтез ферментов, расщепляющих алкилсульфаты. Относительно высокая предельная концентрация додецилсуль- фата (0,5 г/л) позволяет использовать P. helmanticensis для создания процессов биоконверсии глицерина в ПГА без предварительной стерилизации сред.
Список литературы Адаптация Pseudomonas helmanticensis к додецилсульфату натрия в присутствии глицерина
- Volova T.G., Boyandin A.N., Prudnikova S.V. Biodegradation of polyhydroxyalkanoates in natural soils. J. Sib. Fed. Univ. Biol, 2015, vol. 8, no. 2, pp. 152-167. DOI: 10.17516/1997-13892015-8-2-152-167
- Nepomnyashchiy A.P., Shishlyannikov S.M., Shpironok O.G., Alekseeva A.A., Zubkov I.N., Sitnov V.Yu. Soil SDS-degrading bacterium Pseudomonas helmanticensis as a potential producer of polyhydroxyalkanoates. Proc. 19th Int. Sci. Prac. Conf. "Current trends of agricultural industry in global economy ". Kemerovo, 2021, pp. 182-189. DOI: 10.32743/agri.gl.econ.2020.182-189
- Zubkov I.N., Nepomnyshchiy A.P., Kondratyev V.D., Sorokoumov P.N., Sivak K.V., Ramsay E.S., Shishlyannikov S.M. Adaptation of Pseudomonas helmanticensis to fat hydrolysates and SDS: fatty acid response and aggregate formation. J. Microbiol., 2021, vol. 59, no 11, pp. 1104-1111. DOI: 10.1007/s12275-021-1214-5
- Klebensberger J., Rui O., Fritz E., Schink B., Philipp B. Cell aggregation of Pseudomonas aeruginosa strain PAO1 as an energy-dependent stress response during growth with sodium dodecyl sulfate. Arch. Microbiol., 2006, vol. 185, no. 6, pp. 417-427. DOI: 10.1007/s00203-006-0111-y
- Klebensberger J., Birkenmaier A., Geffers R., Kjelleberg S., Philipp B. SiaA and SiaD are essential for inducing autoaggregation as a specific response to detergent stress in Pseudomonas aeruginosa. Environ. Microbiol., 2009, vol. 11, no. 12, pp. 3073-3086. DOI: 10.1111/j.1462-2920.2009.02012.x
- Flemming H.-C., Wingender J. The biofilm matrix. Nat. Rev. Microbiol., 2010, vol. 8, pp.623-633.
- Nyberg H. The influence of ionic detergents on the phospholipid fatty acid compositions of Porphyridium purpureum. Phytochemistry, 1985, vol. 24, no. 3, pp. 435-440. DOI: 10.1016/S0031-9422(00)80742-6
- Зубков И.Н., Шишлянников С.М. Толерантность бактерий Pseudomonas к додецилсуль-фату натрия // Вестник ЮУрГУ. Серия «Пищевые и биотехнологии». 2022. Т. 10, № 1. С. 5-14. [Zubkov I.N., Shishlyannikov S.M. Tolerance of Pseudomonas bacteria to sodium dodecyl sulfate. Bulletin of the South Ural State University. Ser. Food and Biotechnology, 2022, vol. 10, no. 1, pp. 514. (In Russ.)] DOI: 10.14529/food220101
- Boltes I., Czapinska H., Kahnert A., von Bulow R., Dierks T., Schmidt B., von Figura K., Kertesz M.A., Uson I. 1.3 A structure of arylsulfatase from Pseudomonas aeruginosa establishes the catalytic mechanism of sulfate ester cleavage in the sulfatase family. Structure, 2001, vol. 9, no. 6, pp. 483-491. DOI: 10.1016/s0969-2126(01)00609-8
- Muller I., Kahnert A., Pape T., Sheldrick G.M., Meyer-Klaucke W., Dierks T., Kertesz M., Uson I. Crystal structure of the alkylsulfatase AtsK: Insights into the catalytic mechanism of the Fe(II) a-ketoglutarate-dependent dioxygenase superfamily. Biochemistry, 2004, vol. 43, no. 11, pp. 3075-3088. DOI: 10.1021/bi035752v
- Guerin-Mechin L., Dubois-Brissonnet F., Heyd B., Leveau J.Y. Quaternary ammonium compound stresses induce specific variations in fatty acid composition of Pseudomonas aeruginosa. Int. J. Food Microbiol., 2000, vol. 55, no. 1-3, pp. 157-159. DOI: 10.1016/S0168-1605(00)00189-6
- Fitzgerald J.W., Kight L.C. Physiological control of alkylsulfatase synthesis in Pseudomonas aeruginosa: effects of glucose, glucose analogs, and sulfur. Can. J. Microbiol., 1977, vol. 23, pp. 1456-1464. DOI: 10.1139/m77-214
- Collier D.N., Hager P.W., Phibbs Jr. P.V. Catabolite repression control in the Pseudomonads. Res. Microbiol., 1996, vol. 147, no. 6-7, pp. 551-561. DOI: 10.1016/0923-2508(96)84011-3
- Poblete-Castro I., Wittmann C., Nikel P.I. Biochemistry, genetics and biotechnology of glycerol utilization in Pseudomonas species. Microb. Biotechnol., 2019, vol. 13, no. 1, pp. 32-53. DOI: 10.1111/1751-7915.13400
- Hayashi, K. A rapid determination of sodium dodecyl sulfate with methylene blue. Anal. Bio-chem., 1975, vol. 67, pp. 503-506. DOI: 10.1016/0003-2697(75)90324-3
- Shanklin J., Whittle E. Evidence linking the Pseudomonas oleovorans alkane ©-hydroxylase, an integral membrane diiron enzyme, and the fatty acid desaturase family. FEBSLett., 2003, vol. 545, no. 2-3, pp. 188-192. DOI: 10.1016/s0014-5793(03)00529-5


