Активность супероксиддисмутазы в спермоплазме и качество спермы жеребцов
Автор: Романова А.И., Атрощенко М.М., Фролова Н.А., Широкова О.В.
Статья в выпуске: 2 т.258, 2024 года.
Бесплатный доступ
Целью настоящего исследования стало изучение активности антиоксидантного фермента - супероксиддисмутазы (СОД) в спермоплазме у жеребцов с высокой и низкой прогрессивной подвижностью (ПП) сперматозоидов. У жеребцов с высокой прогрессивной подвижностью сперматозоидов активность супероксиддисмутазы в спермоплазме была выше и достоверно отличалась от группы жеребцов с низкой прогрессивной подвижностью сперматозоидов (P
Жеребцы, сперма, спермоплазма, антиоксиданты, супероксиддисмутаза
Короткий адрес: https://sciup.org/142241644
IDR: 142241644 | УДК: 636.1.084.453.52:612.1 | DOI: 10.31588/2413_4201_1883_2_258_171
Текст научной статьи Активность супероксиддисмутазы в спермоплазме и качество спермы жеребцов
В современном отечественном коневодстве большое значение уделяется устойчивости половых клеток к криоконсервации, так как искусственное осеменение обеспечивает высокие результаты только тогда, когда в работе используют здоровых жеребцов-производителей с высоким качеством и криоустойчивостью спермы [7].
Известно, что действие на организм неблагоприятных факторов химической и физической природы избыточно усиливает процессы свободнорадикального окисления (СРО) [2]. Антиоксидантная система организма регулирует уровень СРО и защищает клетки и ткани от накопления токсичных продуктов окисления и включает в себя: ферменты, неферментные белки и низкомолекулярные соединения [4, 5]. Активные формы кислорода (АФК) уравновешиваются антиоксидантной системой защиты, которая не допускает возникновения окислительного стресса (ОС) [1]. Антиоксиданты нейтрализуют цепную реакцию, ведущую к образованию ОС, тем самым защищая организм от негативного воздействия токсических соединений [1, 3].
Необходимо отметить, что при криоконсервации спермы жеребцов значительно возрастают показатели ОС и повреждения плазматических мембран сперматозоидов, которые в дальнейшем активируют несколько путей разрушения клеток, что в конечном итоге приводит к фрагментации их ДНК [9]. Добавление антиоксидантов в среду для криоконсервации снижает уровень структурных повреждений сперматозоидов и потерю их подвижности от перекисного окисления липидов (ПОЛ) [10, 11].
Семенная плазма, которая вырабатывается придаточными половыми железами, придатками семенников и семенниками, создает для сперматозоидов оптимальную среду и имеет большой запас антиоксидантов: ферментативных (каталаза, глутатионпероксидаза и супероксиддисмутаза) и неферментативных (множество соединений, поступающих в организм с кормом) [6, 8]. Самыми основными антиоксидантными ферментами в спермоплазме жеребцов являются: супероксиддисмутаза, каталаза и глутатионпероксидаза, способные катализировать анион супероксида, перекись водорода и перекись липидов [12, 14].
Целью настоящего исследования стало изучение активности антиоксидантного фермента – супероксиддисмутазы (СОД) в спермоплазме у жеребцов с высокой и низкой прогрессивной подвижностью (ПП) сперматозоидов.
Материал и методы исследований. Исследования проводили в 2021 году на базе АО «Терский племенной конный завод № 169» (Ставропольский край) на 16 жеребцах арабской чистокровной породы в возрасте от 5 до 15 лет (в среднем 8,5±4,5 лет). Сперму, предназначенную для исследований, получали в период случного сезона (март- апрель) согласно «Рекомендации по взятию, разбавлению и замораживанию спермы жеребцов» (2006). После получения спермы в каждом эякуляте определяли объем и концентрацию сперматозоидов (фотометр SDM1 Minitube GmbH, Tiefenbach, Германия). Далее эякулят делили на две части, одну часть разбавляли лактозо-хелато-цитратножелточной средой (ЛХЦЖ), в соотношении 1:3, определяли прогрессивную подвижность и выживаемость сперматозоидов при температуре 2-4 ˚С. Оценку прогрессивной подвижности (ПП) сперматозоидов проводили с использованием системы Argus CASA (ArgusSoft LTD., Санкт-Петербург, Россия) и микроскопа Motic BA 410 (Motic, Гонконг, Китай) в камере Маклера (Sefi-Medical Instruments Ltd., Израиль) при 37 ˚С. Для оценки выживаемости сперматозоидов (в часах) определяли их прогрессивную подвижность с интервалом 24 часа вплоть до снижения ПП до 5 %.
Другую часть эякулята сразу после получения центрифугировали при 3000 об/мин в течение 20 мин. После семенной плазмы, свободные от сперматозоидов, замораживали в пробирках типа Эппендорф (2,0 мл) и хранили при температуре -18 ˚С до проведения исследований. Исследование активности супероксиддисмутазы в спермоплазме проводили на иммунохимическом анализаторе Tecan Austria Sunrise (Bender Medsystems, Австрия).
Статистическую обработку проводили с использованием программ Statistica 13.3 (StatSoft, Россия) и Microsoft Office Exsel 2016. Достоверность различий определяли с помощью t-критерия Стьюдента. Результаты представлены в виде среднеарифметической (М) и ее стандартной ошибки (m), минимальных (Min) и максимальных (Max) значений. Отличия считали статистически значимыми при Р <0,05.
Исследования проводились при финансовой поддержке Российского научного фонда (проект № 20-16-00101-П).
Результат исследований. В таблице 1 приведены значения показателей спермы жеребцов, а также активности супероксиддисмутазы спермоплазмы.
микроскопии супернатанта аликвоты
Таблица 1 – Показатели спермы жеребцов, активность супероксиддисмутазы в спермоплазме, М±m, (Min, Max), (n=16)
|
Показатель, единицы измерения |
М±m |
Min |
Max |
|
Нативная сперма |
|||
|
Объем эякулята, мл |
30,5±5,6 |
12,0 |
41,0 |
|
Концентрация сперматозоидов в 1 мл, млн/мл |
259,9±21,9 |
177,0 |
399,0 |
|
Разбавленная сперма |
|||
|
Прогрессивная подвижность сперматозоидов, % |
56,7±5,1 |
25,0 |
80,0 |
|
Выживаемость сперматозоидов при температуре 2-4 ˚С, час |
219,6±23,5 |
48,0 |
456,0 |
|
Спермоплазма |
|||
|
Активность супероксиддисмутазы в спермоплазме, Ед/мл |
42,4±5,1 |
25,0 |
85,0 |
Наиболее точную оценку ПП сперматозоидов позволяет определить компьютерный анализ спермы (Рисунок 1). Компьютерная оценка учитывает количество сперматозоидов с прогрессивной и непрогрессивной подвижностью и количество неподвижных клеток в поле зрения.
Супероксиддисмутаза преобразует супероксидный радикал в перекись водорода, тем самым являясь ключевым фактором защиты клеток от окислительного стресса. В исследованиях Papas M. et al. (2019) установлено, что супероксиддисмутаза положительно влияет на общую и прогрессивную подвижность сперматозоидов в спермоплазме жеребцов. Сперма жеребцов с высоким содержанием супероксиддисмутазы в процессе криоконсервации выдерживает окислительный стресс благоприятнее, чем у жеребцов с низким содержанием этого фермента [12]. Partyka А. et al. (2013) установили, что при добавлении в разбавитель для спермы супероксиддисмутазы перекисное окисление липидов в плазматической мембране сперматозоидов петухов снижалось [13].
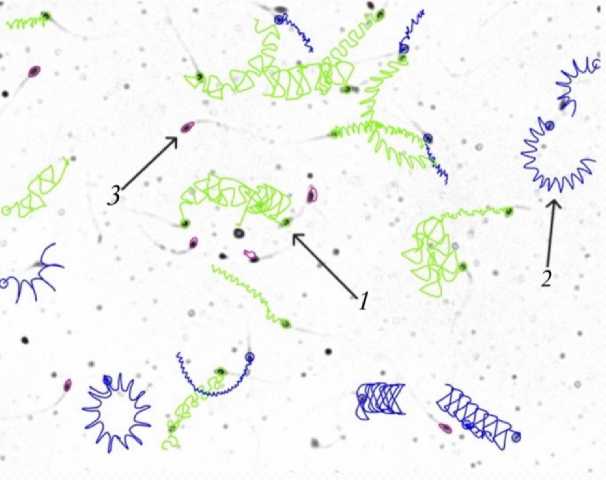
Рисунок 1 – Компьютерная оценка прогрессивной подвижности сперматозоидов с использованием системы Argus CASA, где 1 – сперматозоид с прогрессивной подвижностью, 2 – сперматозоид с непрогрессивной подвижностью, 3 – неподвижный сперматозоид
Таблица 2 – Показатели спермы и активности СОД в спермоплазме у жеребцов с высокой и низкой ПП сперматозоидов, М±m, (n=16)
|
Показатель |
Группа 1 |
Группа 2 |
|
ПП ниже 50 (n=6) |
ПП выше 50 (n=10) |
|
|
Прогрессивная подвижность сперматозоидов в нативной сперме, % |
33,2±2,7 |
62,4±6,1* |
|
Объем эякулята, мл |
23,2±4,1 |
32,4±4,4 |
|
Концентрация спермы в 1 мл, млн/мл |
307,7±40,8 |
266,1±22,1 |
|
Выживаемость сперматозоидов при температуре 2-4 °С, час |
179,3±29,5 |
254,0±28,8** |
|
Активность супероксиддисмутазы в спермоплазме, Ед/мл |
34,0±1,8 |
55,1±5,5* |
Примечание: * отмечены значения Р <0,05, ** отмечены значения Р <0,01
Для изучения взаимосвязи между активностью СОД в спермоплазме и качеством спермы жеребцов, всех исследуемых животных разделили на две группы в зависимости от показателя прогрессивной подвижности (ПП) сперматозоидов в нативной сперме (ГОСТ23681-79). В первую группу включили 6
жеребцов с ПП сперматозоидов в нативной сперме ниже 50 %. Во вторую группу включили 10 жеребцов с ПП сперматозоидов в нативной сперме выше 50 % (Таблица 2). По результатам исследования установили, что у жеребцов 2-ой группы (с высокой ПП сперматозоидов) активность СОД в спермоплазме была выше, чем у жеребцов 1-ой группы (P <0,05).
Заключение. Проведение исследования активности супероксиддисмутазы семенной плазмы позволило изучить взаимосвязь между этим антиоксидантным ферментом спермоплазмы и показателями спермы жеребцов.
Установили, что у жеребцов 2-ой группы (с высокой прогрессивной подвижностью сперматозоидов) активность супероксиддисмутазы в спермоплазме была выше и достоверно отличалась от жеребцов 1-ой группы (с низкой прогрессивной подвижностью сперматозоидов) (P <0,05).
Предполагаем, что активность супероксиддисмутазы в спермоплазме можно использовать в качестве биохимического маркера при отборе жеребцов с лучшими показателями качества спермы.
Список литературы Активность супероксиддисмутазы в спермоплазме и качество спермы жеребцов
- Никулин, В. Н. Влияние комплекса пробиотика на основе лактобактерий и селенита натрия на некоторые показатели антиоксидантной защиты макроорганизма / В. Н. Никулин, В. В. Герасименко, Т. В. Коткова [и др.] // Известия Оренбургского государственного аграрного университета. – 2013. – Т. 41. – № 3. – С. 254-257.
- Плосконос, М. В. Биохимические изменения в мембране сперматозоидов фертильных мужчин под воздействием индуктора оксидативного стресса и коррекция этих изменений / М. В. Плосконос // Проблемы репродукции. – 2015. – № 5. – С. 102-108.
- Жамсаранова, С. Д. Влияние характера питания на антиоксидантный статус организма обучающейся молодежи / С. Д. Жамсаранова, С. А. Чукаев, Л. Д. Дымшеева, С. Н. Лебедева // Science for EducationToday. – 2019. – Т. 9. – № 2. – С. 226-248.
- Чанчаева, Е. А. Современное представление об антиоксидантной системе организма человека / Е. А. Чанчаева, Р. И. Айзман, А. Д. Герасев // Экология человека. – 2013. – № 7. – С. 50-58.
- Янковский, О. Ю. Антиоксидантный статус организма человека и его коррекции / О. Ю. Янковский, С. И. Кузнецов // Вестник СПбГУ. – 2005. – № 2. – С. 40-52.
- Aitken, R. J. Use of xanthine oxidase free radical generating system to investigate the cytotoxic effects of reactive species on human spermatozoa / R. J. Aitken, D. Buckingham, D. Harkiss // Reproduction. – 1993. – Vol. 93. – P. 441-450.
- Atroshchenko, M. M. Reproductive characteristics of thawed stallion sperm / M. M. Atroshchenko, E. Arkhangelskaya, D. A. Isaev [et al.] // Animals. – 2019. – Vol. 9. – № 12. – P. 1099.
- Aurich, J. E. Effects of antioxidants on motility and membrane integrity of chilled-stored stallion semen / J. E. Aurich, U. Schönherr, H. Hoppe, C. Aurich // Theriogenology. – 1997. – Vol. 48. – P. 185-192.
- Contreras, M. J. Cryopreservation of stallion semen: Effect of adding antioxidants to the freezing medium on sperm physiology / M. J. Contreras, F. Treulen, M. E. Arias [et al.] // Reproduction in Domestic Animals. – 2020. – Vol. 55. – № 2. – P. 229-239.
- Memona, A. A. Effect of antioxidants on post thaw microscopic, oxidative stress parameter and fertility of Boer goat spermatozoa in Tris egg yolk glycerol extender / A. A. Memona, H. Wahida, Y. Rosninaa [et al.] // Animal Reproduction Science. – 2012. – Vol. 136. – № 1-2. – P. 55-60.
- Pagl, R. Anti-oxidative status and semen quality during cooled storage in stallions / R. Pagl, C. Aurich, M. Kankofer // Journal of Veterinary Internal Medicine. – 2006. – Vol. 53. – P. 486-489.
- Papas, M. Specific activity of superoxide dismutase in stallion seminal plasma is related to sperm cryotolerance / M. Papas, J. Catalán, B. Fernandez-Fuertes [et al.] // Antioxidants. – 2019. – Vol. 8. – P. 539.
- Partyka, A. The effect of cysteine and superoxide dismutase on the quality of post-thawed chicken sperm / A. Partyka, W. Niżański, J. Bajzert [et al.] // Cryobiology. – 2013. – Vol. 67. – № 2. – P. 132-136.
- Prete, C. D. Combined addition of superoxide dismutase, catalase and glutathione peroxidase improves quality of cooled stored stallion semen / C. D. Prete, T. Stout, S. Montagnaro [et al.] // Animal Reproduction Science. – 2019. – Vol. 210. – P. 106195.


