Активность воспалительного процесса при ревматоидном артрите в условиях коморбидных инфекций
Автор: Рябкова Надежда Леонидовна, Везикова Наталья Николаевна, Рябков Вадим Александрович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Медицинские науки
Статья в выпуске: 4 (125), 2012 года.
Бесплатный доступ
Изучена динамика острофазовых показателей, ряда цитокинов и неоптерина при коморбидных инфекциях на фоне ревматоидного артрита. Санация инфекционного очага сопровождалась достоверным снижением концентрации ряда острофазовых параметров и неоптерина в сыворотке крови. Коморбидные инфекции индуцируют избыточную продукцию цитокинов, острофазовых белков у больных ревматоидным артритом, влияя таким образом на активность воспаления и ускоряя развитие осложнений заболевания.
Ревматоидный артрит, коморбидные инфекции, цитокины, неоптерин
Короткий адрес: https://sciup.org/14750155
IDR: 14750155 | УДК: 616.72-002.77
Текст научной статьи Активность воспалительного процесса при ревматоидном артрите в условиях коморбидных инфекций
Ревматоидный артрит (РА) – центральная проблема современной ревматологии, что объясняется его распространенностью, поражением людей любого возраста, в том числе наиболее трудоспособного, тяжестью болезни, тенденцией к неуклонному прогрессированию и частым инвалидизированием [12].
Инфекционная патология при РА имеет особую важность как коморбидное состояние, развивающееся у больных РА в 1,5 раза чаще, чем в популяции [12], что нередко объясняют снижением иммунной защиты, обусловленным самим основным заболеванием и применением препаратов с иммуносупрессивным действием [7], [17], [20], [21]. Коморбидные инфекции (КИ) оказывают значимое влияние на продолжительность жизни у данной категории пациентов, являясь второй по частоте причиной смерти после кардиоваскулярной патологии [4], [6]. Кроме того, РА и КИ имеют ряд сходных клинико-лабораторных проявлений, что объясняется развитием неспецифических реакций организма, отражающих процесс воспаления. Так, участие фактора некроза опухоли-альфа (ФНО-α), индуцирующего синтез интерлейкина (ИЛ)-1β, ИЛ-6, неоптерина и ряда других биологически активных субстанций, доказано в развитии как РА [5], [22], так и инфекционных процессов [14], [19], [21].
Целью исследования было изучить особенности клинических проявлений, а также динамику острофазовых показателей и ряда имму-
нологических маркеров воспаления при КИ на фоне РА для уточнения возможного влияния бактериальной инфекции на скорость прогрессирования эрозивного процесса.
МАТЕРИАЛЫ И МЕТОДЫ
В исследование включено 46 пациентов ревматологического отделения ГУЗ «Республиканская больница им. В. А. Баранова» (Республика Карелия, г. Петрозаводск) с достоверным РА, установленным на основании критериев Американской коллегии ревматологов [16]. Среди них 35 (76,0 %) женщин и 11 (24,0 %) мужчин в возрасте от 23 до 86 лет (в среднем 56,96 ± 15,40 года) с длительностью болезни от 5 месяцев до 28 лет (в среднем 8,55 ± 6,93 года). Серопозитивный вариант диагностирован у 34 (74,0 %) больных. Рентгенологическая стадия I по Штейнброкеру констатирована у 3 (6,5 %) пациентов, II – у 12 (26,1 %), III – у 18 (39,1 %), IV – у 13 (28,3 %). Минимальную степень активности РА имели 7 (15,2 %) больных, умеренную – 16 (34,8 %), высокую – 23 (50,0 %). Внесуставные проявления отмечены у 20 (43,5 %) пациентов, из них ревматоидные узелки – у 5 (10,1 %), полинейропатия – у 3 (6,5 %), васкулит – у 4 (8,7 %), амилоидоз почек – у 3 (6,5 %), снижение веса – у 1 (2,0 %), сухой кератоконъюнктивит – у 2 (4,3 %), тромбоцитоз (тромбоциты более 400 г/л) – у 10 (21,7 %), анемия – у 14 (30,4 %). Установлено 3 случая особых клинических форм РА: синдром Фелти – 2 случая, болезнь Стилла взрослых – 1 случай.
На момент включения в исследование терапию нестероидными противовоспалительными препаратами (НПВП) получали 39 больных, базисными противовоспалительными средствами (БПВС) регулярно на протяжении 2 и более месяцев – 21 (45,6 %) пациент (средняя продолжительность непрерывного приема – 27,26 ± 22,10 месяца). В качестве БПВС чаще всего использовался метотрексат: у 13 больных в дозе 7,5–20 мг/нед. (в среднем 14,04 ± 4,02 мг/нед.). Сульфасалазин получали 3 пациента в дозе 2000–2500 мг/сут., лефлуномид – 2 пациента в дозе 10 мг/сут., де-лагил – 2 пациента в дозе 250 мг/сут. В исследуемой группе одной больной проводилась терапия инфликсимабом по стандартной схеме в комбинации с метотрексатом в дозе 7,5 мг/нед. на протяжении 6 месяцев. Коррекция базисной противовоспалительной терапии во время исследования не проводилась. Исключением явились 4 пациента, которым потребовалась отмена БПВС до санации очага инфекции. Кроме того, на момент диагностики бактериальной инфекции 6 (13,0 %) человек получали глюкокортикостероиды (ГКС) в дозе 5–15 мг/сут. в пересчете на преднизолон (в среднем 9,17 ± 3,80 мг/сут.). Внутрисуставное введение ГКС в течение 12 месяцев до выявления очага инфекции выполнялось 8 (17,4 %) больным.
Диагностика бактериальных инфекций и эмпирическая антибактериальная терапия осуществлялись на основании принципов, изложенных в руководствах по рациональной антимикробной терапии [13], [15]. Критериями исключения явились сопутствующая вирусная инфекция, туберкулез и онкопатология. Всем пациентам выполнялось бактериологическое исследование с определением чувствительности флоры к антибиотикам диско-диффузионным методом при диагностике очага инфекции и после курса антимикробной терапии с целью оценки ее эффективности.
У 25 (54,3 %) пациентов выявлялись инфекции мочевыводящих путей, у 13 (28,3 %) больных – инфекции респираторного тракта. У 40 (87,0 %) пациентов инфекция возникла вне стационара.
Всем больным на фоне бактериальной инфекции и после ее санации выполнялась гемограмма, определялся уровень в сыворотке крови фибриногена, ревматоидного фактора (РФ), циркулирующих иммунных комплексов (ЦИК), С-реактивного белка высокочувствительным методом (hsСРБ). У 15 пациентов в сыворотке крови определен ИЛ-1β, у 21 – ИЛ-6, у 18 – неоптерин.
Уровень РФ в сыворотке крови определялся с использованием метода латекс-агглютинации, ЦИК – метода фотометрии. Количественное измерение hsСРБ в сыворотке крови осуществлялось с помощью высокочувствительного им-мунометрического теста на анализаторе IMMU-LITE. Количество ИЛ-1β, ИЛ-6 и неоптерина оценивалось с помощью иммуноферментного анализа на сенсорном иммуноферментном анализаторе Sunrise (TECAN Austria GmbH) с использованием тест-систем фирмы «Biosourse Europe S. A.» (Бельгия) при определении ИЛ-1β и ИЛ-6 и тест-системы фирмы «IBL-Hamburg» (Германия) при определении неоптерина. Минимально определяемыми концентрациями, согласно методикам измерений, были 1,0 пг/мл (ИЛ-1 β), 2,0 пг/мл (ИЛ-6), 0,7 нмоль/л (неоптерин).
Результаты исследования обрабатывались с помощью IBM-совместимого компьютера с процессором Pentium с использованием пакета статистических программ Statistica 6.0. Перед проведением статистического анализа количественные признаки проверялись на нормальность распределения с помощью критерия Шапиро – Уилка. Для нормально распределенных признаков определялись средние величины и стандартное отклонение (M ± s, где М – среднее арифметическое, s – стандартное отклонение), для признаков, распределенных отлично от нормального, приведены медиана и интерквартильный размах (A (L-H), где A – медиана, L – нижний квартиль, H – верхний квартиль). Статистический анализ проводился непараметрическими методами: сравнение методами Манна – Уитни (для 2 независимых групп), Вилкоксона (для 2 зависимых групп), Краскела – Уоллиса (для 3 независимых групп) и анализ корреляции методом Спирмена.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Типичные клинические проявления инфекции из 46 пациентов присутствовали лишь у 28 (60,9 %), лихорадка была отмечена у 13 (28,3 %) человек, лейкоцитоз и омоложение лейкоцитарной формулы наблюдались у 12 (26,0 %) и 15 (32,6 %) больных соответственно. Характерной особенностью группы пациентов без типичных клинических проявлений явилось преобладание в ее структуре инфекций мочевыводящих путей.
При санации инфекционного очага выявлено достоверное снижение ряда лабораторных показателей, среди которых можно выделить количество тромбоцитов (на фоне инфекции – 291,0 (221,0–388,0) г/л, после лечения – 256,5 (184,0– 309,1) г/л), уровень фибриногена (5,7 (4,0–7,1) г/л и 4,6 (4,0–5,9) г/л), ЦИК (0,162 ± 0,103 и 0,138 ± 0,073) и неоптерина (21,92 (13,62–48,85) и 19,15 (12,56–24,20) нмоль/л) (см. таблицу). Выявлено также снижение hsСРБ по мере санации очага инфекции, однако достоверной динамики не отмечено, что может объясняться небольшим размером выборки, а также повышением активности РА ввиду отмены БПВС у ряда пациентов.
Полученные данные свидетельствуют об активации тромбоцитарного и коагуляционного звеньев гемостаза на фоне КИ, риске формирования эндотелиальной дисфункции [10], что может способствовать нарушению микроциркуляции у больных РА, индукции атеротромбоза и повышению вероятности развития кардиоваскулярных и цереброваскулярных расстройств [8], [18]. Особое значение данные нарушения приобретают при стертом течении инфекций в связи с затруднением своевременной диагностики и как следствие - затяжным течением.
|
Динамика лабораторных показателей |
||
|
Показатель |
На фоне инфекции |
После санации очага инфекции |
|
ИЛ-ф, пг/мл |
1,3 (1,22-1,44) |
1,32 (1,13-1,49) |
|
ИЛ-6, пг/мл |
41,3 (6,43-87,3) |
12,64 (2,67-62,95) |
|
Неоптерин, нмоль/л |
21,92 (13,62-48,85) |
19,15 (12,56-24,20)* |
|
Лейкоциты, г/л |
7,3 (5,2-9,8) |
7,22 (5,1-9,2) |
|
Тромбоциты, г/л |
291,0 (221,0-388,0) |
256,5 (184-309,1)* |
|
СОЭ, мм/час |
43 (30-58) |
39,5 (25-50) |
|
Гемоглобин, г/л |
121 (106-131) |
120 (107-133) |
|
РФ, МЕ/мл |
128 (0-512) |
64 (0-256) |
|
Фибриноген, г/л |
5,7 (4,0-7,1) |
4,6 (4,0-5,9)* |
|
ЦИК |
0,162 ± 0,103 |
0,138 ± 0,073* |
|
Hs-СРБ, мг/л |
18,2 (5,67-33,6) |
10,2 (1,96-43,7) |
Примечание. Достоверность различий по сравнению с исходными показателями отмечена * при p < 0,05.
иммунодепрессивными свойствами глюкокортикоидов (у больных на ГКС-терапии - 11,50 (6,52-13,32) нмоль/л, без ГКС-терапии - 22,18 (16,03-29,03) нмоль/л; р = 0,037).
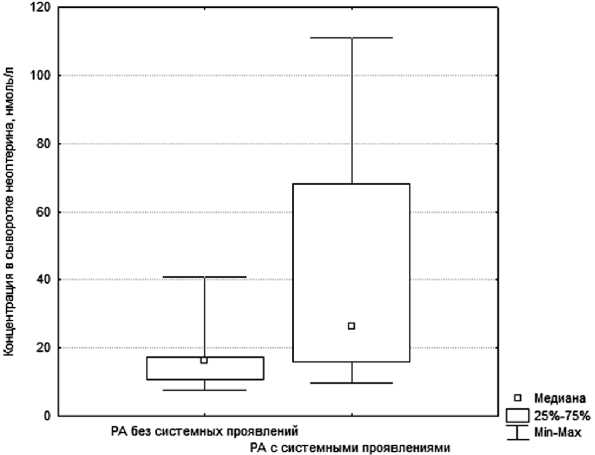
Рис. 1. Концентрация неоптерина (нмоль/л) у больных в зависимости от наличия системных проявлений РА до санации очага бактериальной инфекции
Неоптерин - это низкомолекулярная субстанция, которая образуется в моноцитах / макрофагах. Основным индуктором синтеза неоптерина является ТЫ-цитокин интерферон-гамма, а ФНО-а резко усиливает этот синтез [9]. Неоптерин считается превосходным маркером активации клеточного иммунитета [24], повышенные концентрации которого наблюдаются при вирусных, бактериальных, протозойных инфекциях, новообразованиях, а при ревматических болезнях коррелируют со степенью их активности [23], [24]. Продукция неоптерина снижается под влиянием иммуносупрессантов, в том числе ГКС [11]. Полученные нами результаты, касающиеся взаимосвязи данного показателя с активностью РА и наличием внесуставных проявлений, полностью подтверждают вышеуказанные данные. Так, при сравнении пациентов со II и III степенями активности РА выявлена достоверная разница при наличии инфекции (при II степени активности - 15,31 (10,19-16,95) нмоль/л, при III - 40,75 (20,04-90,3?) нмоль/л; р = 0,017). После санации очага инфекции концентрация неоптерина была также значимо выше при III степени активности, однако достоверных различий не получено (при II степени активности - 12,94 (11,50-17,85) нмоль/л, при III - 22,18 (16,03-59,56) нмоль/л; р = 0,063).
При сопоставлении больных РА с системными проявлениями и без них получена достоверная разница в концентрации неоптерина до антимикробной терапии (с системными проявлениями - 38,92 (20,04-90,37) нмоль/л, без них -16,51 (11,81-17,34) нмоль/л; р = 0,028) (рис. 1).
Пациенты, получавшие ГКС-терапию, имели значимо меньшую концентрацию неоптерина после лечения инфекции, что обусловлено
Показатели неоптерина были достоверно выше (p < 0,05) у серопозитивных по РФ пациентов как до, так и после эффективной антимик-
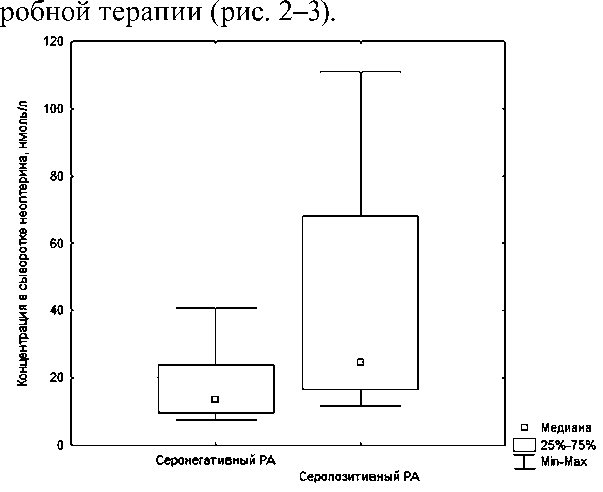
Рис. 2. Концентрация неоптерина в зависимости от наличия ревматоидного фактора при первичном обследовании пациентов
При изучении корреляции между концентрацией ИЛ-6 с лабораторными показателями активности выявлена достоверная положительная корреляция с концентрацией hsСРБ, которая регистрировалась как на фоне очага инфекции (г = 0,52; р = 0,014), так и после адекватной антимикробной терапии (г = 0,59; р = 0,006). Выявленные нами корреляции концентрации ИЛ-6 и hsСРБ отражают закономерные взаимодействия: так, СРБ считается наиболее точным параметром активности РА [2], а ИЛ-6 - один из основных цитокинов, индуцирующих его синтез в печени [3], [4]. При исследовании ИЛ-1в в сочетании
I I I I
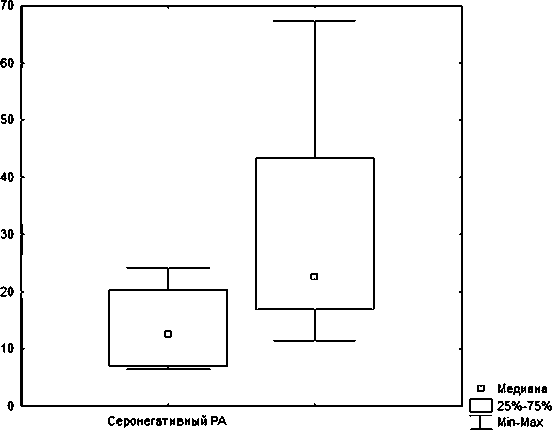
Серопозитивный PA
Рис. 3. Концентрация неоптерина в зависимости от наличия ревматоидного фактора после антибактериальной терапии
с теми же показателями достоверной корреляции не выявлено ни на фоне инфекции, ни после ее санации, что может объясняться небольшими размерами выборки.
ВЫВОДЫ
КИ, нередко протекая со стертой клинической картиной, способны индуцировать избыточную продукцию провоспалительных цитокинов и синтез острофазовых белков у больных РА, влияя на активность воспалительного процесса, что может играть роль в ускоренном прогрессировании эрозивного процесса в суставах и провоцировать развитие нежелательных кардиоваскулярных и цереброваскулярных событий. Полученные данные указывают на необходимость активного выявления и своевременной санации очагов инфекции у данной категории больных.
Список литературы Активность воспалительного процесса при ревматоидном артрите в условиях коморбидных инфекций
- Белов Б. С., Балабанова Р. М., Манукян С. Г. и др. Коморбидные инфекции при ревматических заболеваниях: современное состояние проблемы//Научно-практическая ревматология. 2006. № 3. С. 62-66.
- Гукасян Д. А., Балабанова Р. М., Смирнов А. В. и др. Изучение взаимосвязи между минеральной плотностью костной ткани и клинико-лабораторными показателями активности ревматоидного артрита//Научно-практическая ревматология. 2005. № 1. С. 18-21.
- Гусев Д. Е., Пономарь Е. Г. Роль С-реактивного белка и других маркеров острой фазы воспаления при атеросклерозе//Клиническая медицина. 2006. № 5. С. 25-30.
- Дмитриев В. А., Ощепкова Е. В., Титов В. Н. С-реактивный белок и артериальная гипертония: существует ли связь?//Терапевтический архив. 2006. № 5. С. 86-89.
- Зорина В. Н., Трофименко Н. А., Архипова С. В. и др. Альфа-2-макроглобулин, его комплексы с IgG и некоторые факторы гуморального иммунитета при ревматоидном артрите//Научно-практическая ревматология. 2006. № 1. С. 22-27.
- Лукина Г. В., Сигидин Я. А., Чичасова Н. В. и др. Применение моноклональных антител к фактору некроза опухоли (ремикейд) при ревматоидном артрите: предварительные результаты//Терапевтический архив. 2003. № 5. С. 9-12.
- Мазуров В. И., Богданов А. Н. Диагностика и лечение поражений легких у больных ревматоидным артритом//Научно-практическая ревматология. 2003. № 1. С. 52-56.
- Мазуров В. И., Столов С. В., Якушева В. А. и др. Кардиоваскулярные проблемы в ревматологии//Научнопрактическая ревматология. 2006. № 4. С. 28-34.
- Насонов Е. Л. Иммунологические маркеры атеросклероза//Терапевтический архив. 2002. № 5. С. 80-85.
- Ребров А. П., Инамова О. В. Предпосылки развития эндотелиальной дисфункции при ревматоидном артрите//Терапевтический архив. 2004. № 5. С. 79-85.
- Свиридов Е. А., Телегина Т. А. Неоптерин и его восстановленные формы: биологическая роль и участие в клеточном иммунитете//Успехи биологической химии. 2005. № 45. С. 355-390.
- Сигидин Я. А., Гусева Г. Г., Иванова М. М. Диффузные болезни соединительной ткани (Системные ревматические заболевания): Руководство для врачей. М.: Медицина, 2004. 640 с.
- Страчунский Л. С., Белоусов Ю. Б., Козлов С. Н. Практическое руководство по антиинфекционной химиотерапии. Смоленск: МАКМАХ, 2007. 464 с.
- Шилкина Н. П., Чураков О. Ю. Системные проявления ревматоидного артрита, эхоструктурные изменения в брахиоцефальных артериях//Терапевтический архив. 2005. № 12. С. 49-53.
- Яковлев В. П., Яковлев С. В. Рациональная антимикробная фармакотерапия (руководство для практических врачей). М.: Литтерра, 2003. 1008 с.
- Arnett F. С., Edworthy S. M., Bloch D. A. et al. The American Rheumatism Association 1987 revised criteria for the classification of rheumatoid arthritis//Arthr. Rheum. 1988. № 31. P. 315-324.
- Bongartz T., Sutton A. J., Sweeting M. J. Anti-TNF antibody therapy in rheumatoid arthritis and the risk of serious infections and malignancies//JAMA. 2006. № 295. P. 2275-2285.
- Gerli R., Goodson N. J. Cardiovascular involvement in rheumatoid arthritis//Lupus. 2005. Vol. 14. P 679-682.
- Hallegua D. S., Weisman M. H. Potential therapeutic uses of interleukin-1 receptor antagonists in human diseases//Ann. Rheum. Dis. 2002. Vol. 61. P. 960-967.
- Imaizumi K., Sugishita M., Usui M. et al. Pulmonary infectious complications associated with anti-TNFa therapy (Infliximab) for rheumatoid arthritis//Intern. Med. 2006. Vol. 45. № 10. P. 685-688.
- Kroesen S., Widmerl A. F., Tyndall A. et al. Serious bacterial infections in patients with rheumatoid arthritis under anti-TNF-a therapy//Rheumatology. 2003. № 42. P. 617-621.
- Popa C., Netea M. G., van Riel P. L. et al. The role of TNF-a in chronic inflammatory conditions, intermediary metabolism, and cardiovascular risk//J. Lipid. Res. 2007. Vol. 48. P. 751-762.
- Rider L. G., Schiffenbauer A. S., Zito M. et al. Neopterin and quinolinic acid are surrogate measures of disease activity in the juvenile idiopathic inflammatory myopathies//Clin. Chem. 2002. № 10. Р 1681-1688.
- Sghiri R., Feinberg J., Thabet F. et al. Gamma interferon is dispensable for neopterin production in vivo//Clin. Diagn. Lab. Immunol. 2005. № 12. Р 1437-1441.


