Алгоритм клинико-лабораторного мониторинга и курации пациентов с множественной миеломой при проведении аутологичной трансплантации гемопоэтических стволовых клеток
Автор: Жернякова А.А., Крысюк О.Б., Глазанова Т.В., Кузьмич Е.В., Михалева М.А., Мартынкевич И.С., Кулешова А.В., Чебыкина Д.А., Бессмельцев С.С.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 4 т.21, 2025 года.
Бесплатный доступ
Значительные успехи в лечении множественной миеломы (ММ), отмеченные в последние годы, являются результатом влияния ряда факторов. Среди них можно выделить: использование в широкой клинической практике многокомпонентных схем терапии, с включением препаратов таргетного действия; проведение аутологичной трансплантации гемопоэтических стволовых клеток (аутоТГСК), в качестве стандартной консолидирующей терапевтической опции для кандидатов на высокодозную химиотерапию; назначение поддерживающей терапии, интенсивность и длительность которой варьируют в зависимости от биологического фенотипа заболевания и объема остаточной болезни. Вместе с тем, ММ остается неизлечимым заболеванием. При выборе терапевтической опции клиницисты руководствуются необходимостью достижения целей: 1) устойчивый негативный статус минимальной остаточной болезни (МОБ), обуславливающий бо́льшую вероятность устойчивого ответа, более длительные выживаемость без прогрессии (ВБП) и общая выживаемость (ОВ); 2) оптимальное для конкретного пациента качество жизни (КЖ) с последующим сохранением его в течение максимально возможного периода времени. Эффективность каждого этапа терапии ММ является существенным условием достижения приемлемого ответа на лечение. Так, эффективность аутоТГСК является интегральным показателем, который учитывает следующие факторы: вариант ответа на предшествующую терапию; интенсивность режима кондиционирования и оптимальное количество перелитых CD34+ гемопоэтических стволовых клеток (ГСК), осложнения аутоТГСК. На эффективность аутоТГСК может оказывать влияние ряд дополнительных факторов: характеристики продукта афереза ГСК (трансплантата), влияние микробиоты кишечника и динамики ее изменений на фоне лечения, генетический профиль ММ. Успешное проведение аутоТГСК способствует своевременному переходу к следующему этапу комплексной терапии ММ. Целью работы явилась разработка алгоритма клинико-лабораторного мониторинга пациентов с ММ при проведении аутоТГСК, с изучением факторов, оказывающих влияние на эффективность данного этапа терапии.
Множественная миелома, аутологичная трансплантация гемопоэтических стволовых клеток, качество жизни, минимальная остаточная болезнь, статус микробиоты кишечника, генетический фенотип
Короткий адрес: https://sciup.org/170211143
IDR: 170211143
Текст научной статьи Алгоритм клинико-лабораторного мониторинга и курации пациентов с множественной миеломой при проведении аутологичной трансплантации гемопоэтических стволовых клеток
Введение . Значительные успехи в лечении ММ, отмеченные за последние годы, являются результатом взаимодействия нескольких факторов. Среди них, прежде всего, использование в широкой клинической практике многокомпонентных схем с включением ингибиторов протеасом, иммуномодуляторов и моноклональных антител как в индукционном периоде, так и при развитии рецидива и/или резистентности заболевания. Кроме того, проведение аутоТГСК, выполнение которой в настоящее время рассматривают в качестве стандартной консолидирующей терапевтической опции для пациентов, кандидатов на высокодозную химиотерапию. И, наконец, назначение поддерживающей терапии, интенсивность и длительность которой варьируют в зависимости от биологического фенотипа заболевания и объема остаточной болезни. Как ожидается, дальнейшее повышение эффективности терапии ММ будет обусловлено внедрением новых медицинских технологий, в частности иммунотерапии, а также использованием новых препаратов целенаправленного (таргетного) действия.
Вместе с тем, ММ остается неизлечимым заболеванием. Отражением данного факта является, с одной стороны, чередование периодов стабилизации с эпизодами «обострения» заболевания, что требует регулярного проведения противоопухолевого лечения. С другой стороны, вполне обоснована необходимость проведения сдерживающей терапии, которую назначают на период до прогрессии заболевания или развития непереносимости, т.е. нередко на многолетний промежуток времени. Совокупность указанных факторов обуславливает длительную персистенцию жалоб и снижение физической активности, вызванных как течением ММ, в частности анемией, оссалгией и гипоальбуминемией, так и проводимым лечением, например, периферической нейропатией, кожными высыпаниями и цитопенией [1, 2]. Вполне ожидаемо, что у пациентов с ММ имеет место значимое снижение КЖ, низкий уровень которого фиксируют уже при верификации диагноза и в первые 6 месяцев лечения. Максимальное ухудшение КЖ от-
(HSC), complications of HSCT. A number of additional factors also may affect the efficacy of autologous HSCT. These factors include the characteristics of the amount of HSC (graft), the effect of the intestinal microbiota with the dynamics of its changes during treatment, and the genetic profile of MM. Successful HSCT facilitates the timely transition to the next stage of MM therapy.
The aim of the study was to develop an algorithm for the clinical and laboratory monitoring of patients with MM during HSCT.
мечают при переводе с активного лечения на сдерживающую, паллиативную терапию [3–5]. Таким образом, динамика параметров КЖ является критерием, который отражает активность (т.е. «агрессивность») клонального процесса при ММ, что требует оценки с целью прогнозирования рецидива заболевания и отсутствия ожидаемой эффективности терапии.
В качестве приоритетных целей терапии ММ рассматривают достижение устойчивой ремиссии заболевания в сочетании с устойчивым негативным статусом МОБ. Вместе с тем, динамика показателей КЖ при оценке эффективности проводимой терапии приобретает принципиальное значение, так как при выборе терапевтической опции клиницисты руководствуются необходимостью достижения двух целей: 1) достижение МОБ-негативного статуса, обеспечивающего бо́льшую вероятность устойчивого ответа, а также более длительную ВБП и, как ожидается, ОВ; 2) обеспечение поддержания оптимального для конкретного пациента КЖ с последующим сохранением его в течение максимально возможного периода времени [6, 7].
Таким образом, сохранение стабильных показателей КЖ в сочетании с клинико-лабораторными параметрами пациентов большинство экспертов рассматривают в качестве косвенного критерия устойчивости достигнутого ответа на терапию и более высокой вероятности длительного безрецидив-ного периода [8, 9].
В настоящее время, несмотря на регистрацию новых лекарственных препаратов и внедрение новых медицинских технологий, аутоТГСК остается базовой составляющей алгоритма лечения пациентов с ММ [10, 11]. АутоТГСК включает несколько блоков, каждый из которых сопровождается риском развития осложнений, отличающихся по своему характеру и степени тяжести/выраженности. Тем самым, следует признать, что транзиторное ухудшение состояния пациентов, включая КЖ, на этапе проведения им аутоТГСК является также вполне прогнозируемым событием.
Стратификацию больных ММ на кандидатов и не кандидатов на аутоТГСК осуществляют на этапе диагностики ММ. Основным критерием при распределении больных в группу с проведением высокодо-зной химиотерапии является, прежде всего, возраст. В отличие от пожилых пациентов, практически всех молодых пациентов рассматривают как вероятных кандидатов на аутоТГСК.
В большинстве случаев после выполнения ау-тоТГСК отмечают улучшение качества ответа, а при оценке объема резидуальных миеломных клеток фиксируют отрицательный результат (их отсутствие) [12, 13]. Следствием указанных изменений является значительное улучшение показателей ВБП. В случае своевременно назначенной и адекватно проводимой поддерживающей терапии нередко улучшаются и показатели ОВ, что в настоящее время рассматривают в качестве одной из основных целей лечения пациентов с ММ [14]. Следует отметить, что столь оптимистичные результаты удается достичь преимущественно у пациентов моложе 60 лет. При разграничении пациентов на кандидатов и не кандидатов на проведение аутоТГСК принято принимать в расчет прежде всего возраст, числовая граница для которого составляет главным образом 65 лет [10]. В результате подавляющая часть пациентов с ММ, медиана возраста которых приравнивается к 70 годам, не получает высокодозной химиотерапии. Отказ от проведения аутоТГСК пациентам с ММ пожилого возраста нередко мотивирован неудовлетворительным общим состоянием и наличием сопутствующих заболеваний, которые присущи пациентам старшей возрастной группы.
Эффективность аутоТГСК – интегральный показатель. Он аккумулирует лечебный потенциал индукционных курсов, мелфалана в высоких дозах как режима кондиционирования и посттрансплантационной терапии. Немаловажной составляющей является биологический фенотип заболевания, который определяет чувствительность миеломных клеток к лекарственным препаратам, а также риск прогрессирования заболевания. Таким образом, обязательной представляется исходная стратификация пациентов на группы риска.
Как известно, стандартными факторами эффективности аутоТГСК являются: вариант ответа на предшествующую терапию, что отражает объем персистирующего опухолевого клона; оптимальное количество заготовленных и перелитых CD34+ ГСК и интенсивность проведенного режима кондиционирования, а также осложнения аутоТГСК. Среди осложнений аутоТГСК наиболее существенными являются длительная цитопения, которая сопровождается развитием инфекционных и геморрагических осложнений. На эффективность аутоТГСК может оказывать влияние ряд дополнительных факторов. Среди таких факторов, рассматриваемых в совокупности с получением клеточной взвеси (CD34+)
оптимальной клеточности, можно выделить следующие характеристики самого трансплантата (продукта афереза ГСК): достаточное количество жизнеспособных ГСК; количественный и качественный состав лимфоцитов в продукте афереза, а также иные характеристики продукта афереза, изучение которых представляет интерес.
Вместе с тем, микробиоту кишечника пациента и динамику ее изменений на фоне проведенного и проводимого лечения также принято рассматривать в качестве потенциально значимого фактора прогноза развития, прежде всего, инфекционных осложнений в посттрансплантационном периоде. Следует отметить, что состояние микробиоты у пациентов с различными гемобластозами привлекает внимание исследователей с 80-х годов прошлого века. Исследованиями последнего десятилетия продемонстрирована значительная роль микробиоты при аллогенной трансплантации ГСК (аллоТГСК) у пациентов с онкогематологическими заболеваниями. Однако ее значение при отдельных видах гемобластозов, в частности, при ММ, имеет свои особенности и требует дальнейшего изучения. Таким образом, исследование микробиома при аутоТГСК также требует дальнейшего изучения.
Успешное проведение аутоТГСК способствует своевременному переходу к следующему этапу комплексной терапии ММ, а именно консолидирующим режимам или терапии поддержки достигнутого ответа. В настоящее время использование комплексного подхода в лечении ММ, с включением аутоТГСК, новых классов препаратов и их комбинаций привело к увеличению медианы ОВ у пациентов моложе 70 лет, и составляет не менее 6-7 лет [14].
Проведение аллоТГСК пациентам с ММ в настоящее время является спорным, в виду того, что у данной категории пациентов оно сопряжено с высоким риском летальных осложнений вследствие токсичности терапии при проведении миелоаблативных режимов кондиционирования (РК). Вместе с тем, использование немиелоаблативных РК привело к увеличению частоты рецидивов ММ [15-17]. Также при длительном наблюдении в ряде исследований было продемонстрировано преимущество выполнения аутоТГСК с последующей аллоТГСК перед проведением тандемной аутоТГСК [18, 19]. По результатам метаанализа, проведенного K.E. Armeson и соавт., высокая частота летальности, связанной с терапией, нивелирует преимущества последовательных ау-тоТГСК и аллоТГСК перед тандемной аутоТГСК [20]. Таким образом, единого понимания места аллоТГСК для пациентов с ММ не сформировано, и аллоТГСК может быть рассмотрена в качестве альтернативного варианта терапии только у пациентов с агрессивным течением ММ, а также у молодых соматически сохранных пациентов группы высокого риска при рефрактерно-рецидивирующем течении ММ [15].
Для данной категории пациентов наиболее целе- сообразным представляется проведение аллоТГСК от полностью совместимого/идентичного по системе лейкоцитарных антигенов человека (HLA, Human Leukocyte Antigens) родственного донора [15, 21]. Тем не менее, вариант родственной гаплоидентич-ной (частично совместимой) по антигенам системы HLA аллоТГСК для данной категории пациентов при отсутствии полностью совместимого донора также следует рассматривать в качестве резервной опции терапии для пациентов, которым показано проведение аллоТГСК.
Целью работы явилась разработка алгоритма клинико-лабораторного мониторинга и курации пациентов с ММ при проведении аутоТГСК, с изучением факторов, оказывающих влияние на эффективность данного этапа терапии.
Материалы и методы. Объектом исследования стали пациенты (n = 180) с диагнозом ММ, получавшие лечение в Клиническом отделении химиотерапии и трансплантации костного мозга клиники и в Клиническом отделении гематологии, химиотерапии и трансплантации костного мозга с блоком интенсивной терапии и дневным стационаром клиники ФГБУ РосНИИГТ ФМБА России в период с 2011 г по 2021 год (ретроспективно, n = 107) и с 2023 г по 2025 г (проспективно, n = 73).
Диагностику ММ осуществляли согласно общепринятым стандартам, включая сбор анамнестических данных, изучение морфологических и гистологических препаратов костного мозга в совокупности с иммунологическими, биохимическими, молекулярно-генетическими и рентгенологическими методами исследования. Оценку эффективности терапии проводили в соответствии с критериями Международной группы по изучению ММ (IMWG) [22].
Лечение пациентов проводили согласно зарегистрированным схемам с соблюдением дозировок и длительности межкурсовых интервалов. Основанием для модификации доз и удлинении длительности периода между курсами были снижение клиренса креатинина, развитие глубокой и длительной цитопении. В качестве предтрансплантационной подготовки были использованы следующие режимы: мелфалан в монорежиме в дозе 200 мг/м2 (Mel 200), мелфалан в монорежиме в дозе 140 мг/м2 (Mel 140) а также мелфалан в комбинации с тиотепой (Mel + Thiotepa) и мелфалан в комбинации с карфилзоми-бом (Mel + Karfil). Критериями при выборе РК были возраст больного, функциональное состояние почек (клиренс креатинина), прогностический вариант заболевания и эффективность ранее проведенного лечения.
Методы исследования включали: клинические (опрос жалоб, сбор анамнеза жизни и заболевания с уточнением сопутствующей патологии, времени и вариантов первоначальных проявлений ММ, проведенного противоопухолевого лечения перед выполнением аутоТГСК; определение КЖ с оценкой изменений как общего статуса, так и различных аспектов КЖ (с использованием опросников КЖ в качестве универсального инструмента); гематологические (оценка показателей клинического анализа крови с подсчетом лейкоцитарной формулы и количества тромбоцитов с применением микроскопии препаратов крови); оценка стандартных биохимических параметров, включавших оценку функции печени, поджелудочной железы, почек, электролитный состав крови, маркеры воспаления; коагулологические параметры (коагулограмма); цитогенетические и молекулярно-генетические (кариотипирование аспирата костного мозга, FISH-исследование, флуоресцентная гибридизация in situ) костного мозга и периферической крови с определением основных прогностических молекулярно-генетических маркеров ММ, секвенирование следующего поколения (next-generation sequencing, NGS), метилирование генов); иммунологические (оценка МОБ методом многоцветной проточной цитометрии, оценка клеточного профиля клеток афереза ГСК с определением их иммунологического фенотипа методом проточной цитометрии); оценка статуса микробиоты; методы лучевой диагностики (позитронно-эмиссионная томография всего тела (ПЭТ-КТ); статистические (с использованием программ Microsoft Excel 2010, IBM SPSS Statistics Version 26, в среде программирования для статистической обработки данных R).
Для оценки КЖ и выраженности симптомов у части пациентов (n = 30) применяли комбинацию опросников КЖ: Европейский опросник оценки качества жизни (EuroQoL, EQ-5D) и опросник «Эдмонтонская система оценки симптомов» (Edmonton Symptom Assessment Scale-Revised, ESAS-R). Во другой группе пациентов (n = 73) применяли иной набор опросников КЖ: общий опросник оценки здоровья (SF-36), шкалу беспокойства и депрессии (Госпитальная шкала тревоги и депрессии – Hospital Anxiety and Depression Scale, HADS), также Европейский опросник оценки качества жизни (EuroQoL, EQ-5D), опросник оценки функций в онкологии при трансплантации костного мозга (Functional Assessment of Cancer Therapy-Bone Marrow Transplantation, FACT-BMT). Обследование пациентов, проводимое в рамках данного исследования, включало два компонента: заполнение опросников пациентами и регистрация клинической информации врачом-исследователем. Информация, которую фиксирует врач-исследователь, должна соответствовать срокам заполнения опросников пациентом; не должно быть пропущенных данных. На динамических точках исследования врачом-исследователем регистрируются показатели клинического и биохимического анализов крови, коагулограмма. В период цитопении (на день +7 аутоТГСК) пациенты заполняли опросники HADS, EuroQoL EQ-5D-5L, а также повторно SF-36 и FACT-BMT. Перед выпиской (на день +14-
18 после аутоТГСК) пациенты заполняли все опросники повторно.
В качестве материала для оценки аутотрансплантата использовали пробы афереза ГСК (аутотрансплантата) и венозной крови, полученные от пациентов с ММ, которым проводилась аутоТГСК. Забор проб проводили непосредственно в день выполнения процедуры афереза ГСК. Оценивали содержание клеток CD34+ в продукте афереза ГСК и субпопуляционный состав лимфоцитов в день проведения афереза ГСК. Забор проб венозной крови проводили при поступлении – перед проведением мобилизации ГСК и перед выпиской – после приживления трансплантата. Для оценки иммунологических показателей, а именно, клеточных характеристик аутотрансплантата и состояния клеточного иммунитета реципиента, использовали моноклональные антитела (Beckman Coulter, США) для выявления следующих антигенов на поверхности лимфоцитов: CD3, CD4, CD8, CD16, CD19, CD25, CD27, CD28, CD45RA, CD160, CD279. Определяли относительное содержание следующих субпопуляций лимфоцитов: CD3+ (общая популяция Т-клеток), CD3+ CD4+ (Т-хелперы), CD3+ CD8+ (Т-цитотоксические), CD4+CD25+ (Т-регуляторные клетки), CD16+ (NK-клетки), CD19+ (В-клетки) и иммунорегуляторных субпопуляций Т-клеток: CD3+CD16+, CD4+CD27+, CD4+CD28+, CD3+CD45RA+, CD3+CD160+, CD3+CD279+. Окрашивание клеток моноклональными антителами выполняли согласно рекомендациям производителя, приложенным к каждому из реагентов. Содержание клеток CD34+ в аферезе ГСК и субпопуляционный состав лимфоцитов оценивали методом проточной цитометрии на лазерном проточном цитофлуориметре «Navios» (Beckman Coulter, США) в десятицветном анализе, определяя параметры прямого и бокового светорассеяния и интенсивность флуоресцентного сигнала. Анализ и интерпретация полученных данных производили посредством программного обеспечения Kaluza Analysis (Beckman Coulter, США). Обработку данных осуществляли в режиме реального времени анализа многоцветных файлов.
Материалами для исследования микробиоты кишечника служили биологические образцы кала в подгруппе пациентов (n=30) с ММ на разных этапах проведения аутоТГСК. Протокол определения состава микробиоты кишечника включал сбор и низкотемпературное замораживание образцов кала, полученных от пациентов, экстракцию и очищение ДНК в каждом из биологических образцов, а также полногеномное секвенирование на платформе MiSeq Illumina (США) для количественной оценки видового состава микробиоты толстого кишечника и выявления доминирования отдельных типов микроорганизмов.
Для оценки генетического профиля пациентов проводили NGS. Секвенирование выполнялось с использованием таргетной NGS панели со средней глубиной прочтения 1000х методом парно-концевого прочтения. Панель, разработанная в ФГБУ РосНИ-ИГТ ФМБА России, включает в себя ключевые 118 генов, задействованных в патогенезе онкогемато-логических неоплазий (рисунок 1).
|
АВЫ |
AKT3 |
ALK |
APC |
AR1DIA |
ASXLl |
ATM |
ATRX |
B2M |
|
BCL2 |
BCOR |
BC0RL1 |
BCR |
BIRC3 |
BRAF |
BRCA1 |
BRCA2 |
ВТК |
|
CALR |
CARD11 |
CBL |
CCND1 |
CD58 |
CD79B |
CDKN2A |
CDX2 |
СЕВРА |
|
CIITA |
CREBBP |
CSF3R |
CUX1 |
DDX3X |
DEK |
DIS3 |
DNMT3A |
EP300 |
|
ETV6 |
EZH2 |
FAT1 |
FBXW7 |
FLT3 |
GA TAI |
GATA2 |
GJB2 |
GNA13 |
|
GNAS |
Hl-1 |
HRAS |
ID3 |
IDH1 |
IDH2 |
1KZF1 |
1KZF3 |
1RF4 |
|
ITPKB |
JAK2 |
JAK3 |
KDM6A |
KDR |
KIT |
KLF2 |
KMT2A |
KMT2C |
|
KMT2D |
KRAS |
MAP2K1 |
MEF2B |
MGA |
MPL |
MSN |
MYC |
MYD88 |
|
NF1 |
NOTCH1 |
NOTCH2 |
NPM1 |
NRAS |
NSD2 |
PDGFRA |
PHF6 |
PIK3CB |
|
PIM1 |
PKHD1 |
PLCG2 |
POTI |
PRDM1 |
PTCHI |
PTEN |
PTPN11 |
PTPRD |
|
RAD21 |
RBI |
RHOA |
RPS15 |
RUNX1 |
RYR1 |
SAMHD1 |
SETBP1 |
SF3B1 |
|
SH2B3 |
SMARCA4 |
SMC1A |
SMC3 |
SOCS1 |
SRSF2 |
STAG2 |
STAT3 |
STAT6 |
|
SUZI2 |
SYK |
TENT5C |
TET2 |
TNFAIP3 |
TP53 |
U2AF1 |
WT1 |
XPO1 |
|
ZRSR2 |
Рисунок 1. Гены таргетной NGS панели
В качестве средства просмотра анализов секвенирования использовали программное обеспечение Illumina Sequence Analysis Viewer. Качество исходных данных NGS оценивали с помощью программного обеспечения FastQC в Illumina BaseSpace Sequence Hub.
Статистический анализ данных проводили в программе SPSS (IBM SPSS Statistics Version 26, Chicago, USA), в среде программирования для статистической обработки данных R. Диаграммы размаха построены с помощью пакета ggpubr. Сравнение независимых групп осуществляли с помощью непараметрических критериев Краскела-Уоллиса (с последующим попарным сравнением) и Манна-Уитни. Сравнение связанных групп проводили с помощью критериев Фридмана (с последующим апостериорным попарным сравнением) и Уилкоксона.
Средние показатели и медиану определяли с помощью программы Excel Microsoft. Выживаемость рассчитывали с помощью кривых Каплан-Майера. Точкой отсчета была дата проведения АутоТГСК.
Была использована статистическая программа GraphPad Prism, версия 6.0. Достоверность различий принимали при значении р <0,05.
При оценке КЖ и симптомов для непрерывных данных использовали показатели количества наблюдений в группе, средние арифметические значения и стандартные отклонения; для категориальных переменных – частоты, процентные доли и 95 % доверительный интервал. Симптомы с выраженностью 1–3 балла расценивали как незначительно выраженные и 4–10 баллов как существенно выраженные. При сравнении двух групп использовали непараметрический метод сравнения для двух выборок –критерий знаковых рангов Уилкоксона. При сравнении четырех связанных групп применен непараметрический метод дисперсионного анализа (ANOVA) Фридмана.
Результаты и обсуждение. Клинико-гематологическая характеристика пациентов с ММ в разных возрастных группах при выполнении аутоТГСК представлена в Таблице 1.
Таблица 1
Сравнительная характеристика пациентов
|
Показатели |
≤60 лет |
≥61 года |
р |
|
Число пациентов |
78 |
29 |
- |
|
Ме возраста (диапазон), лет |
54 (26–60) |
63 (61–70) |
- |
|
Ранее назначаемые препараты, n (%) |
|||
|
- бортезомиб |
77 (98,7) |
29 (100) |
0,540 |
|
- леналидомид |
33 (42,3) |
12 (41,4) |
0,931 |
|
- антрациклины |
15 (19,2) |
2 (6,9) |
0,120 |
|
- карфилзомиб |
14 (17,9) |
5 (17,2) |
0,932 |
|
- даратумумаб |
9 (11,5) |
3 (10,3) |
0,952 |
|
Режим мобилизации, n (%) |
|||
|
- циклофосфан + Г-КСФ |
23 (29,5) |
2 (6,9) |
0,014 |
|
- винорелбин + Г-КСФ |
30 (38,5) |
15 (51,7) |
0,216 |
|
- Г-КСФ, монорежим |
21 (26,9) |
8 (27,6) |
0,945 |
|
- Г-КСФ + плериксафор |
4 (5,1) |
4 (13,8) |
0,129 |
|
Число CD34+ клеток, 106/кг веса (диапазон) |
5,02 (1,76–10,2) |
4,66 (1,16–23,29) |
0,226 |
|
Варианты ответа перед аутоТГСК, n (%) |
|||
|
- ПО |
26 (33,4) |
12 (41,4) |
0,439 |
|
- ОХЧО |
18 (23,1) |
5 (17,2) |
0,513 |
|
- ПО + ОХЧО |
44 (56,5) |
17 (58,6) |
0,837 |
|
- ЧО |
33 (42,3) |
11 (37,9) |
0,682 |
|
- стабилизация |
1 (1,2) |
1 (3,5) |
0,462 |
|
Статус МОБ, n (%) |
n = 30 |
n = 13 |
|
|
- негативный |
14 (46,7) |
5 (38,5) |
0,618 |
|
- позитивный |
16 (53,3) |
8 (61,5) |
|
|
Режим кондиционирования, n (%) |
|||
|
- Mel 200 |
52 (66,7) |
13 (44,8) |
0,039 |
|
- Mel 140 |
8 (10,3) |
9 (31,1) |
0,009 |
|
- Mel200 + Mel140 |
60 (77,0) |
22 (75,9) |
0,908 |
|
- Mel + Karfil |
14 (17,9) |
4 (13,8) |
0,609 |
|
- Mel + Thiothepa |
4 (5,1) |
3 (10,3) |
0,332 |
|
Назначение гранулоцитарного колониестимулирующего фактора (Г-КСФ) после аутоТГСК, n (%) |
|||
|
- да |
67 (85,9) |
27 (93,1) |
0,310 |
|
- нет |
11 (14,1) |
2 (6,9) |
|
|
Лихорадка после аутоТГСК |
|||
|
- да |
55 (70,5) |
19 (65,5) |
0,619 |
|
- нет |
23 (29,5) |
10 (34,5) |
|
|
День максимального снижения лейкоцитов |
6 (3–10) |
6 (3–8) |
0,171 |
|
Трансфузии эритроцитсодержащих сред |
|||
|
- число пациентов, n (%) |
26 (33,3) |
9 (31,0) |
0,821 |
|
- Ме числа доз (диапазон) |
1 (1–3) |
2 (1–4) |
0,138 |
|
Трансфузии тромбоконцентрата |
|||
|
- число пациентов, n (%) |
77 (98,7) |
28 (96,6) |
0,462 |
|
- Ме числа доз (диапазон) |
2 (1–7) |
3 (1–16) |
0,386 |
|
Сроки приживления аутотрансплантата |
|||
|
- Ме абсолютн. числа нейтрофилов,109/л (диапазон) |
11 (9–19) |
11 (9–26) |
0,686 |
|
- Ме тромбоцитов, 109/л (диапазон) |
15 (9–20) |
15 (11–28) |
0,987 |
|
Ме госпитализации от дня проведения аутоТГСК (диапазон) |
16 (12–27) |
16 (3–28) |
0,171 |
Учитывая ранее выявленное отсутствие клинического приоритета тандемной трансплантации в аспекте увеличения ОВ, а также факт небольшого числа таких пациентов в исследовании и их преимущественно молодой возраст, при анализе ОВ результаты долгосрочного наблюдения за 15 пациентами с тандемной аутоТГСК были исключены. Дополнительно были изъяты результаты еще 12 пациентов, из которых 8 – из-за отсутствия информации и 4 – по причине ранней смерти. Таким образом, показатели выживаемости были проанализированы у 80 пациентов: 59 из группы 1 (60 лет и моложе) и 21 пациент из группы 2 (61 год и старше). Для исключения влияния осложнений, связанных с проведением ау-тоТГСК, был проведен дополнительный анализ выживаемости с точкой отсчета 3 месяца после трансплантации (land-mark анализ), в связи с чем число пациентов в группах 1 и 2 было снижено до 48 и 19 соответственно.
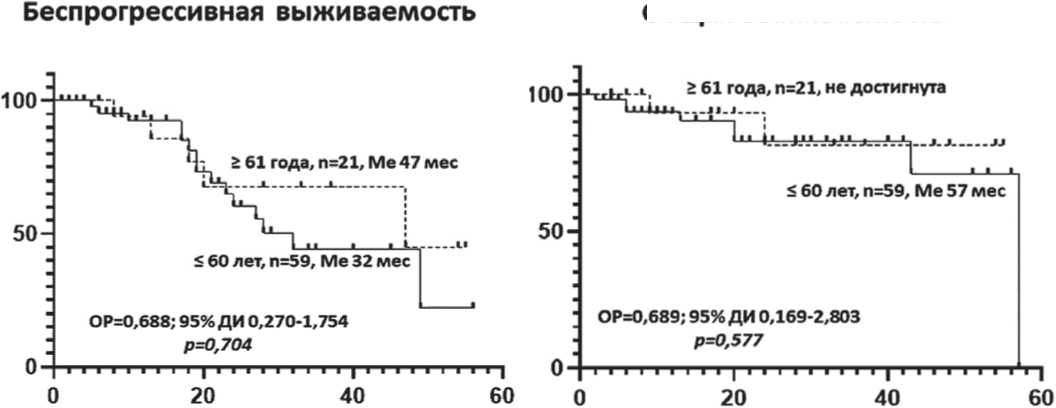
Медиана времени наблюдения составила 11 (1– 57) месяцев в группе 1 и 18 (1–55) месяцев в группе 2. Медиана БПВ в группах 1 и 2 составила 32 и 47 месяцев соответственно; р = 0,704. Медиана ОВ – 57 месяцев и не достигнута соответственно; р = 0,577. Различие между показателями было не значимо (рисунок 2).
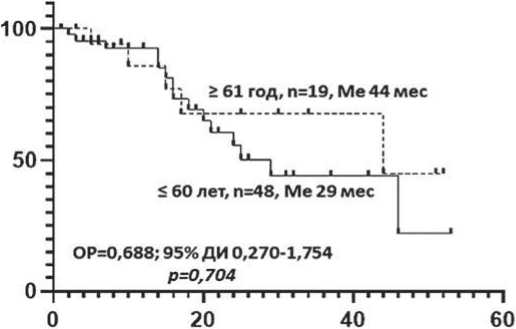
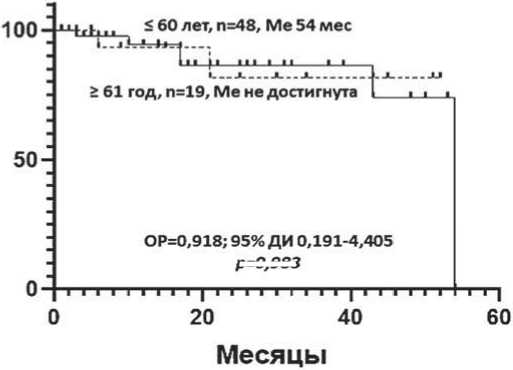
При проведении land-mark анализа также не выявлено значимой разницы. Медиана БПВ в группах 1 и 2 была 29 и 44 месяцев соответственно; р = 0,704.
Медиана ОВ составила 57 месяцев и не была достигнута соответственно; р = 0,577 (рисунок 3).
Данные проведенного исследования дают основание рекомендовать гематологам рассматривать всех пациентов впервые диагностированной ММ в возрасте до 70 лет включительно как потенциальных кандидатов на аутоТГСК. Проведение трансплантации больным старше 60 лет может обеспечить им выживаемость, сопоставимую с показателями молодых пациентов.
Выполнен ретроспективный анализ выживаемости 86 пациентов с впервые диагностированной ММ, которым аутоТГСК была выполнена в период с 2011 по 2022 годы в ФГБУ РосНИИГТ ФМБА России. В зависимости от характера лекарственных препаратов, назначаемых в предтрансплантационном периоде, были сформированы 3 группы пациентов.
В группу 1 вошли 17 пациентов с медианой возраста 56 (24–63) лет, которым трансплантация была выполнена в период с 2019 по 2022 годы. В индукционном периоде помимо бортезомиба, который получали все без исключения пациенты, назначали карфилзомиб (n = 13; 76,5 %), леналидомид (n = 8; 47,1 %), моноклональные анти-CD38 антитела (n = 7; 41,2 %) и помалидомид (n = 1; 5,9 %). Только один из названных препаратов получили 7 (41,2 %) пациентов: 6 – карфилзомиб в составе схемы Kd и 1 – да-ратумумаб в монорежиме. Два препарата получили 8 (47,1 %) пациентов и три препарата – 2 (11,7 %)
Общая выживаемость
Месяцы
Месяцы
Рисунок 2. Беспрогрессивная и общая выживаемость больных ММ в зависимости от возраста: ≤ 60 лет и ≥ 61 года
Беспрогрессивная выживаемость
Общая выживаемость
Месяцы
Р=О,983
Рисунок 3. Беспрогрессивная и общая выживаемость больных ММ в зависимости от возраста: ≤ 60 лет и ≥ 61 года (land-mark анализ)
пациента. Наряду с уже указанными схемами применялись следующие комбинации препаратов: Rd, RVd, KRd, DKd, DRd и IsaPd. Основаниями для перевода на новые схемы лечения была неэффективность первой, стандартно назначаемой бортезомиб-содер-жащей, схемы, что проявлялось в виде стабилизации заболевания или минимального ответа. Выбор схемы в большинстве случаев был мотивирован возможностями лечебного учреждения.
Группа 2 была составлена из 29 пациентов с медианой возраста 55,5 (42–69) года, которым аутоТГСК была выполнена с 2016 по 2022 годы. Все пациенты в период, предшествующий выполнению аутоТГСК, получали бортезомиб и леналидомид. Последний назначался преимущественно в составе схемы VRd и реже – Rd.
В третью, самую многочисленную группу, были включены 40 пациентов, медиана возраста которых была 40 (34–68) лет и которым аутоТГСК была проведена с 2011 по 2022 годы. Пациентам проводили только бортезомибсодержащие схемы: преимущественно VCD и реже PAD. В посттрансплантационном периоде всем пациентам была рекомендована поддерживающая терапия. Медиана периода наблюдения за пациентами после аутоТГСК была 6 (3–15), 30 (4–77) и 17 (4–105) месяцев соответственно.
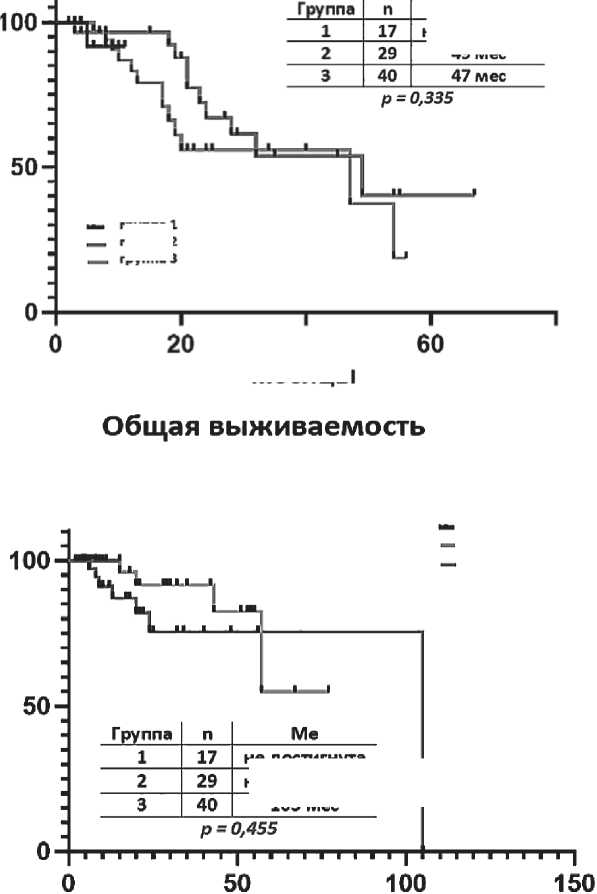
Расчетные показатели медианы БПВ были следующими: не достигнута в первой группе, 49 месяцев во второй и 47 месяцев в третьей группе. Различия как в целом (р = 0,335), так и между отдельными
Беспрогрессивная выживаемость
Me не достигнута мес
группа 1 группа 2 группа 3
группа 1 группа 2
группа 3
40 Месяцы
достигнута не достигнута 105 мес
Месяцы
Рисунок 4. Беспрогрессивная и общая выживаемость больных ММ в группах с разным составом индукционных курсов группами не достигали значимых величин. Между 1 и 2 группами: ОР = 0,64, 95 % ДИ 0,05–7,7; р = 0,612. Между 1 и 3 группами ОР = 0,94, 95 % ДИ 0,12–7,6; р = 0,944. Между 2 и 3 группами ОР = 1,7, 95 % ДИ 0,73–3,8; р = 0,124 (рис. 3).
Расчетные показатели медианы ОВ были следующими: не достигнута в первой и второй группах и 105 месяцев в третьей группе. Так же, как и в случае с БПВ, различия по ОВ в целом (р = 0,455) и между отдельными группами были незначимы. Между 1 и 2 группами р = 0,845. Между 1 и 3 группами р = 0,412. Между 2 и 3 группами; р = 0,138 (рисунок 4).
Полученные данные дают основание рекомендовать ранний перевод на новые 3- и 4-компонентные схемы при неэффективности первой индукционной схемы, что будет способствовать быстрейшему купированию симптомов заболевания с улучшением КЖ, раннему достижению ПО и ОХЧО и увеличению кандидатов на аутоТГСК.
Показатели КЖ до мобилизации представлены на рисунке 5: представлено распределение пациентов согласно уровню нарушений для каждого из доменов опросника EQ-5D до мобилизации. У подавляющего большинства пациентов наблюдали
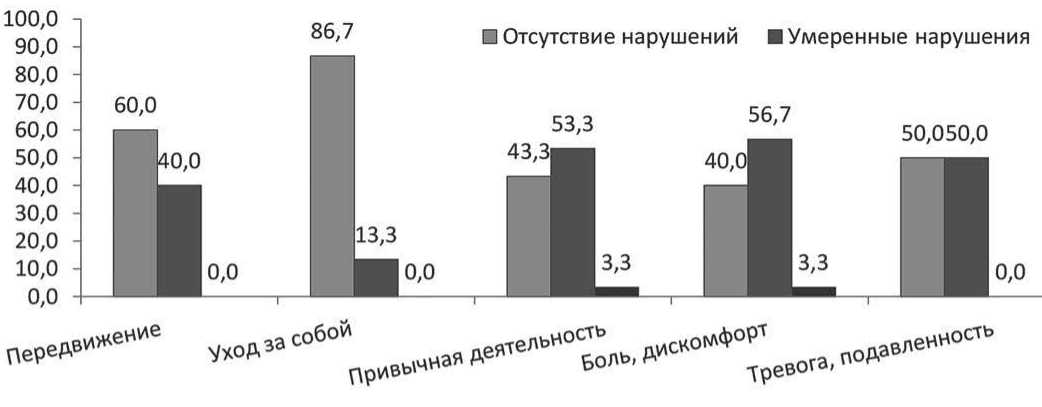
Рисунок 5. Распределение пациентов с ММ согласно уровню нарушений по доменам EQ-5D до мобилизации
Другая проблема Плохое самочувствие Тревога Депрессия Одышка Снижение аппетита Тошнота
Сонливость Усталость Боль
-
■ Нет симптомов
-
□ Незначительная выраженность
-
■ Существенная выраженность
Рисунок 6. Распределение пациентов с ММ согласно наличию и выраженности симптомов до мобилизации (по опроснику ESAS-R)
умеренные нарушения по доменам опросника или их отсутствие. Средний балл самооценки состояния здоровья составил (72,4 ± 20) балла.
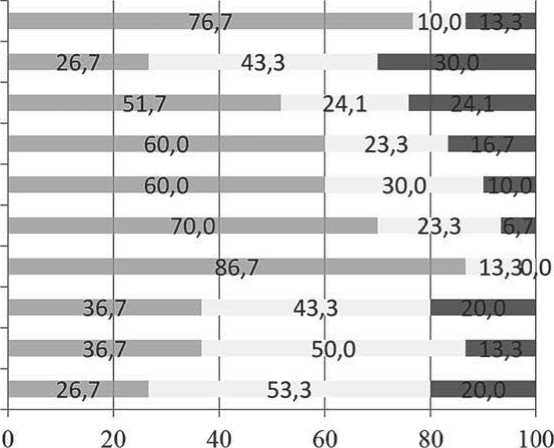
На рисунке 6 представлено распределение пациентов согласно наличию и выраженности симптомов (по опроснику ESAS-R) до мобилизации. До начала мобилизации у 96,7 % пациентов имелись симптомы. Причем, у половины пациентов (50 %, n = 15) встречались 5 и более из 9 анализируемых симптомов. У 53,3 % (n = 16) пациентов имелись симптомы с выраженностью 4 и более баллов (существенно выраженные симптомы). Все симптомы (9/9) встречались у 2 пациентов (6,7 %). Наиболее часто встречающимися симптомами были следующие: плохое самочувствие (75,9 %), боль (73,3 %), усталость и сонливость (по 63,3 % каждый), тревога (48,3 %), одышка и депрессия (по 40,0 % каждый).
Наиболее выраженными являлись следующие симптомы: плохое самочувствие (2,5 ± 2,2), боль (2,1 ± 2,1), тревога (2,0 ± 2,8), усталость (1,9 ± 2,1 балла).
Показатели КЖ в день лейкоцитафереза: на рисунке 7 представлено распределение пациентов с ММ согласно уровню нарушений для каждого из доменов опросника EQ-5D в день лейкоцитафереза. Анализ выполнен в группе из 30 пациентов.
Как видно из данных рисунка 7, в день лейкоци-тафереза доля пациентов с умеренными нарушениями по домену боли/дискомфорта больше по сравнению с показателями до мобилизации. Средний балл самооценки состояния здоровья снизился по
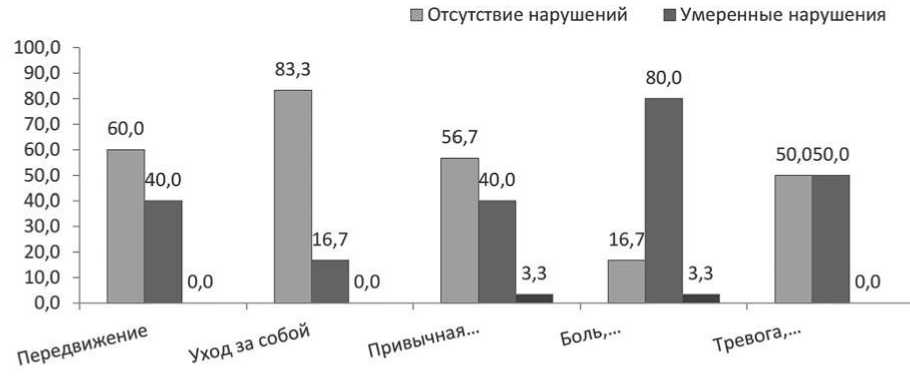
Рисунок 7. Распределение больных ММ согласно динамике симптомов в день лейкоцитафереза
сравнению с уровнем до мобилизации и составил (69,7 ± 18,3) балла.
На рисунке 8 представлено распределение пациентов согласно изменению выраженности симптомов в день лейкоцитафереза по сравнению с их выраженностью до начала РМ. Как видно, у большей части пациентов происходило нарастание выраженности симптомов. Согласно полученным данным, по сравнению с исходными показателями у 80 % пациентов в 1 день лейкоцитафереза имело место снижение аппетита, у 63 % – нарастание боли и сонливости, у 43 % – нарастание усталости и у 33 % – усиление тревоги. У 70 % пациентов ухудшилось самочувствие.
Были проанализированы данные КЖ 43 паци- ентов с ММ, 23 мужчин (53 %) и 20 женщин (47 %), медиана возраста составила 62 года (38-71 год) и 32 здоровых донора, 12 мужчин (37 %), 20 женщин (63 %), медиана возраста 58 лет (44-66 лет).
Перед инициированием РМ все пациенты с диагнозом ММ были проанкетированы по опроснику SF-36, результаты которого сравнили с группой контроля – группой здоровых доноров костного мозга (рисунок 9).
До проведения аутоТГСК показатели КЖ у пациентов с ММ были значительно снижены по сравнению с контрольной группой условно здоровых респондентов (n = 32). Статистически значимые различия получены для шкал опросника SF-36 физическое функционирование (ФФ) (p < 0,001), ролевое
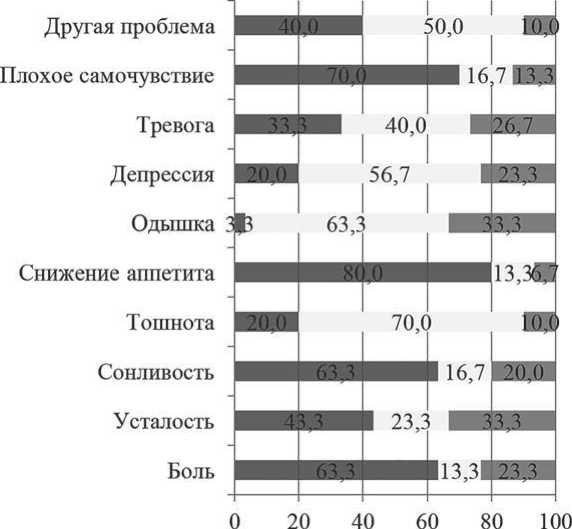
■ Ухудшение z Нет динамики ■ Улучшение
Рисунок 8. Распределение больных ММ согласно динамике симптомов в 1 день лейкоцитафереза
Оценка КЖ у больных ММ перед проведением аутоТГСК в сравнении с контрольной группой по опроснику SF-36
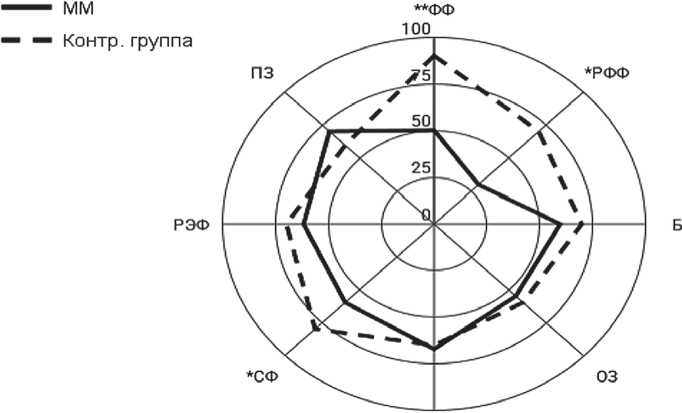
ж
Рисунок 9. КЖ пациентов с ММ перед аутоТГСК физическое функционирование (РФФ) (p < 0,05) и социальное функционирование (СФ) (p < 0,05). Физическая активность пациентов с ММ значительно ограничена в связи с наличием остеодеструктивно-го синдрома, который влияет на выполнение физических нагрузок. Наличие диагноза ММ в значительной степени влияет на самооценку и эмоциональное состояние пациентов.
В дальнейшем, пациенты с ММ были проанкетированы по опроснику SF-36 на 7-й день (Д+7) после аутоТГСК и на 14-й день (Д+14) после аутоТГСК (рисунок 10).
На Д+7 аутоТГСК отмечено достоверное снижение всех показателей КЖ, что наиболее вероятно обусловлено развитием нейтропении в посттрансплантационном периоде. Значительно ухудшились
Оценка КЖ у больных ММ при аутоТГСК по опроснику SF-36
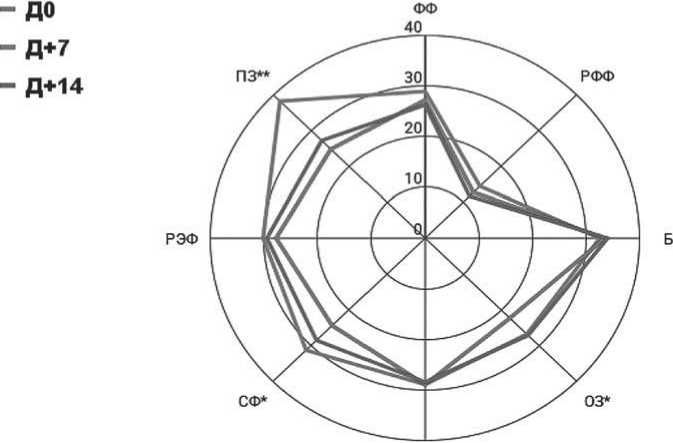
ж
Рисунок 10. КЖ пациентов с ММ при аутоТГСК (день аутоТГСК (Д0), Д+7 и Д+14)
Оценка состояния здоровья у больных ММ при аутоТГСК по опроснику FACT-BMT
-
■ Тошнота* ■ Слабость** Нарушение аппетита**
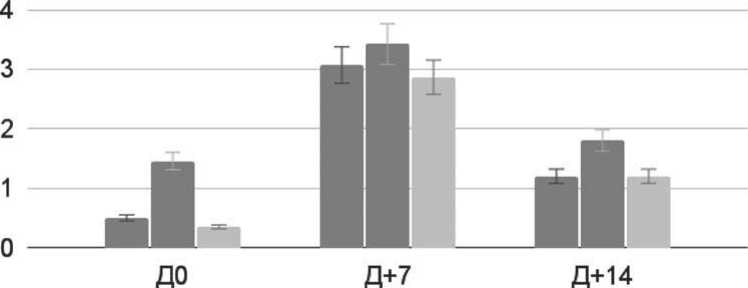
Рисунок 11. КЖ при аутоТГСК по опроснику FACT-BMT
показатели шкал общее здоровье (ОЗ), СФ и психическое здоровье (ПЗ) на Д+7 аутоТГСК. Также пациенты отмечали нарастание тошноты (ES = 1,22), слабости (ES = 0,76) и нарушение аппетита (ES = 0,74). К Д+14 аутоТГСК (показатели крови возвращаются к нормальным значениям), при отсутствии осложнений пациент готовится к выписке из стационара. На Д+14 показатели, характеризующие физическое здоровье пациента (ФФ, РФФ), оставались на том же уровне, что и на Д+7. Тем не менее, остальные шкалы, характеризующие эмоциональное состояние, интенсивность боли и другие продемонстрировали положительную динамику (p = 0,021).
Используя данные опросника FACT-BMT, можно дать характеристику изменений состояния пациентов в процессе лечения после проведения аутоТГСК. Пациенты с ММ заполняли опросник FACT-BMT в день аутоТГСК (Д0), затем на Д+7 и на Д+14 ау- тоТГСК (рисунок 11).
В день проведения аутоТГСК пациенты отмечали значительно выраженную слабость (Д0). На Д+7 ау-тоТГСК пациентов в значительной степени беспокоили тошнота (p = 0,02), слабость (p = 0,01) и нарушение аппетита (p = 0,012), с наибольшим ухудшением КЖ на Д+7 и нормализацией показателей к выписке (Д+14).
При заполнении опросников HADS Д+7 и Д+14 ау-тоТГСК (рисунок 12) пациенты отмечали снижение общего эмоционального фона. Так, на Д+7 аутоТГСК у пациентов имела место субклинически выраженная депрессия (p =0,02), а симптомы тревоги были наиболее интенсивными Д+7. К Д+14 зафиксирована субклинически выраженная тревога (p = 0,011), которая наиболее часто была обусловлена как общей усталостью от длительного нахождения в стационаре, так и неопределенностью дальнейшего статуса
Оценка состояния здоровья у больных ММ при аутоТГСК по опроснику HADS
-
■ Тревога** ■ Депрессия*
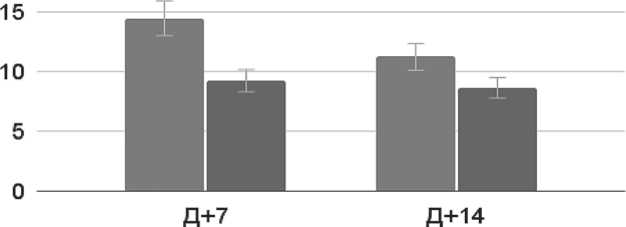
Рисунок 12 . Оценка выраженности депрессии и тревоги у пациентов (HADS)
заболевания. На Д+7 пациенты отмечали, что испытывают внутреннее напряжение, внезапно возникающее чувство паники и страх того, что трансплантация может быть неуспешной. Данные показатели непосредственно связаны со шкалой тревоги. На Д+7 и на Д+14 пациенты отмечали, что не испытывают чувство бодрости, не способны рассмеяться и не следят за своей внешностью. По данным показателям был произведен расчет выраженности субклинической депрессии.
Характеристики аутотрансплантата. Принципиальным условием для успешного выполнения аутоТГСК и оптимального по срокам приживления трансплантата является объем заготовленных и перелитых пациенту ГСК. Оптимальным минимальным количеством CD34+ ГСК для аутоТГСК является 2× 106 /кг веса реципиента, а субоптимальным – менее 2× 106 /кг веса [23-25].
У всех пациентов (n=38) объем полученных CD34+ × 106 /кг был оптимальным после одной процедуры афереза, лишь у одного пациента процедура афе-реза ГСК была проведена повторно на следующий день после первой, так как в результате первой процедуры было получено 1,3× 106 /кг CD34+. Неудач мобилизации ГСК зафиксировано не было. Анализ данных по собранным CD34+ клеткам у пациентов со схемой мобилизации Г-КСФ в монорежиме (n = 21) и Г-КСФ+химиопрепарат (n = 17) продемонстрировал отсутствие достоверных различий по группам: 4,36+0,70× 106 /кг в группе Г-КСФ моно и 4,61+1,15× 106 / кг в группе Г-КСФ+химиопрепарат, p=0,68.
Особенности иммунного статуса пациентов с ММ (день афереза). У всех пациентов (n=38) проводили оценку качественного и количественного содержания лимфоцитов и их субпопуляций. Среднее содержание лимфоцитов – 43. 109 /л (19,6-85,2. 109 /л) составило 23,8 % (10,4-34,6 %) от общего количества лейкоцитов. Из них Т-лимфоциты (CD3+) составили 80,8 % (59,3-94,7 %) в следующих субпопуляциях: Т-хелперы (CD3+CD4+) – 51,5 % (42,7-55,0 %), Т-цитотоксические (CD3+CD8+) – 29,5 % (19,034,6 %), Т-активированные (CD3+CD25+) – 2,7 % (0,8-6,5 %), Т-регуляторные (CD3+CD4+CD25+) – 1,9 % (1,5-2,7 %), NK-клетки (CD3-CD16+) – 8,3 % (1,120,3 %), В-лимфоциты (CD19+) – 7,8 % (0,7-20,3 %). Обращает внимание сохранение соотношения Т-хелперы/Т-цитотоксические в пределах нормальных значений, а также достоверное снижение относительного содержания Т-регуляторных клеток (CD3+CD4+CD25+), p=0,03.
Негативный статус МОБ при ММ на фоне проведенной терапии, достигнутый после аутоТГСК, является важным прогностическим параметром, позволяющими косвенно судить о длительности возможного безрецидивного периода, и является суррогатным маркером общей выживаемости. Проведение аутоТГСК позволяет значительно улучшить отдаленные результаты лечения ММ за счет более полной эрадикации опухолевого клона. Статус МОБ после проведенной терапии также является прогностическим параметром, который, возможно, позволит использовать его при стратификации
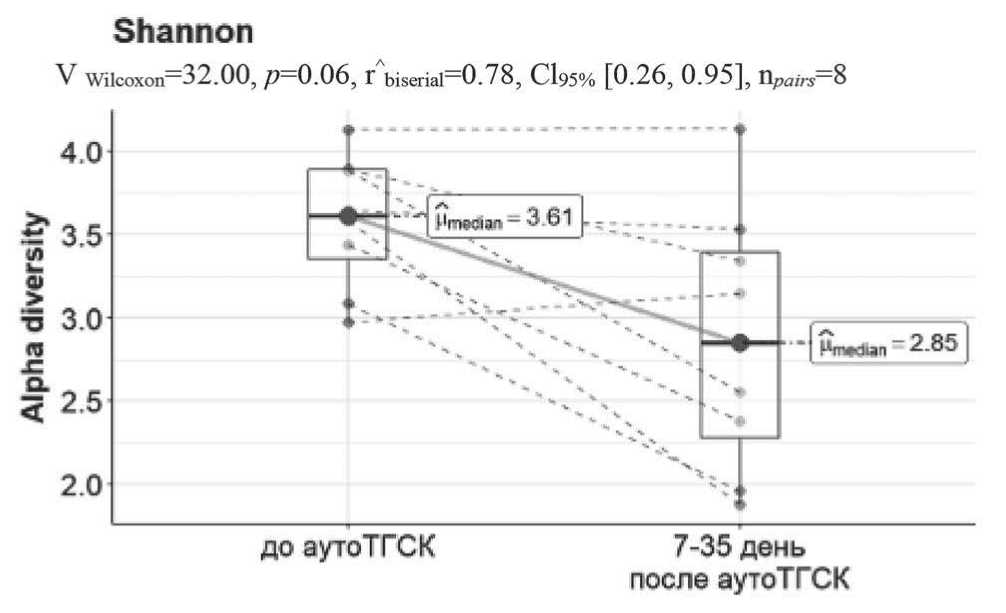
Рисунок 13. Индекс разнообразия у пациентов до (срок 1) и после (срок 2) аутоТГСК
Оптимальная клеточность трансплантата (CD 34+ ГСК)
Улучшение клинического ответа и достижение МОБ-статуса
Отсутствие инфекционных и иных осложнений
Сохранение оптимального КЖ
Некандидат на аутоТГСК (старше 65 лет)
(65-70 лет)
Стандартная терапия ММ до прогрессии
Оптимальные сроки восстановления кроветворения и выписки пациента
Терапия поддержки до прогрессии ММ
Терапия консолидации ремиссии, с переходом на терапию поддержки
Тандемная аутоТГСК
Прогрессия -клональная эволюция -терапия спасения
Прогрессирование заболевания
Смена терапии при каждом последующем рецидиве
Терапия спасения
Повторная аутоТГСК
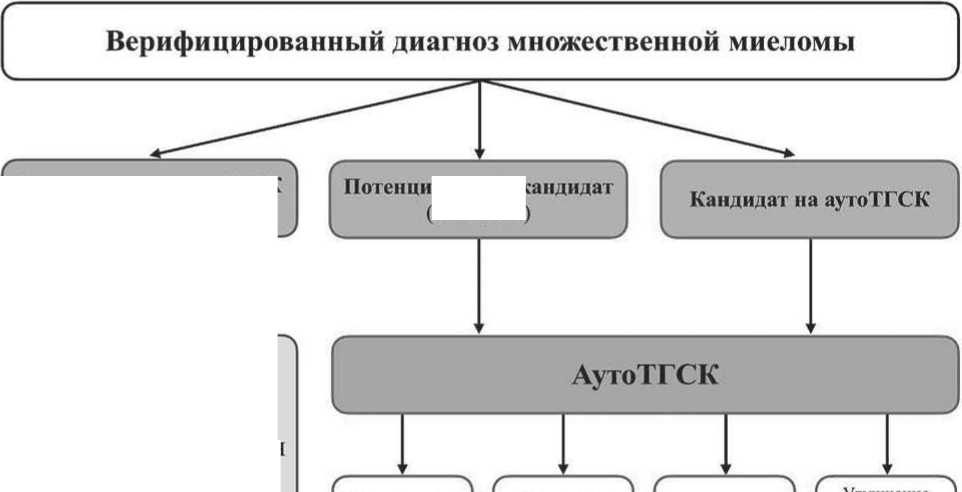
Рисунок 14. Алгоритм клинико-лабораторного мониторинга и курации пациентов с ММ при проведении аутоТГСК
МОБ-адаптированной терапии.
Для оценки характера изменения МОБ, с определением ее воздействия на эффективность трансплантации, было проведено комплексное обследование 48 пациентов с ММ. Все пациенты получали бортезомиб-содержащие программы в первой линии противоми-еломной терапии. По данным проточной цитометрии МОБ-негативный статус (МОБ–) был достигнут у 31 пациента (64,6 %). Медиана общей выживаемости в подгруппе МОБ– не была достигнута, в подгруппе МОБ+ составила 114 мес. (р = 0,002). Медиана выживаемости без прогрессирования составила 68 мес. для МОБ– и 34 мес. для МОБ+ (р = 0,047). Оценка остаточной опухолевой массы методом позитронной эмиссионной томографии с компьютерной томографией (ПЭТ-КТ) с 18-фтордезоксиглюкозой (18-ФДГ) была проведена у всех пациентов. ПЭТ-КТ-негативный полный ответ (ПЭТ-КТ–) достигнут у 27 пациентов (56,3 %). Медиана выживаемости без прогрессирования в подгруппе ПЭТ-КТ– составила 50 мес., в подгруппе ПЭТ-КТ+ – 29 мес. (р = 0,013). В подгруппе ПЭТ-КТ– было отмечено достоверное снижение медианы выживаемости без прогрессирования при наличии МОБ+ результата в костном мозге. При анализе всех подгрупп было выявлено, что наилучшие показатели выживаемости без прогрессирования имеют пациенты с достижением полной элиминации опухолевого клона по данным обоих исследований – проточной цитометрии и ПЭТ-КТ (р=0,006).
Характер изменений микробиоты кишечника. Важным показателем для оценки микробиоты кишечника является индекс ее разнообразия (индекс Шеннона). Результаты оценки изменения индекса разнообразия Шеннона у обследованных нами больных ММ в разные периоды до и после аутоТГСК представлены на рисунке 13. Было выявлено снижение альфа-разнообразия после аутоТГСК (p = 0,06), вне зависимости от стадии ММ или наличия/отсутствия почечной недостаточности. Также был установлен негативный эффект антибактериальных и химиотерапевтических препаратов на многообразие микробиоты. Тем не менее, степень снижения альфа-разнообразия была различной. Как видно из рисунка 13, у одного пациента разнообразие микробиоты было высоким и оставалось таким и после аутоТГСК. У двух пациентов при исходном низком уровне разнообразия установлено его значительное понижение в посттрансплантационном периоде.
Полученные результаты подтверждают, что снижение индекса биологического разнообразия микробиоты присутствует при аутоТГСК.
Исследование таксонов микробиома до и после аутоТГСК показало, что превалирующими типами были Bacteroides и Firmicutes. Они оставались ведущими и после аутоТГСК. Однако важно отметить, что их относительная представленность несколько снизилась с 44,92 % и 40,71 % до 38,23 % и 33,38 % после ее проведения. У 30 из 43 пациентов проведе- ны исследования микробиоты кишечника с помощью ПЦР-РВ, подтвердившие нарушения микробиоты, которые характеризовались разной степенью угнетения симбиотических микроорганизмов. Так, снижение содержания Lactobacillus spp. выявлено у 75 % больных, у 100 % пациентов – снижение титра Bifidobacterium spp. Наряду со снижением симбиотических микроорганизмов у 50 % пациентов при исследовании после проведения аутоТГСК выявлены условно патогенные микроорганизмы – Proteus spp. (n = 1), Klebsiella pneumoniae (n = 2), Staphylococcus aureus (n = 1). Наиболее весомые нарушения микробиоты были получены при оценке соотношения Bacteroides fragilis group/Faecalibacterium prausnitzii, которые верифицировали у 87 % пациентов. Повышение этого соотношения свидетельствует о наличии анаэробного дисбиоза в кишечнике и представляет собой важный маркер нарушения микробиоты у пациентов исследуемой группы.
Проведено исследование возможной связи изменения микробиоты кишечника и развития желудочно-кишечной токсичности. Предполагается, что воздействие высоких доз мелфалана и противоми-кробных препаратов у пациентов, подвергающихся аутоТГСК для лечения ММ, приводит к микробному дисбактериозу желудочно-кишечного тракта, который, в свою очередь, связан с токсичностью, зависящей в наибольшей степени от режима аутоТГСК. Было показано, что при 2 степени токсичности в микробиоте наблюдается достоверное снижение Bacteroides (M-тест Манна-Уитни: p = 0,04) по сравнению с группой пациентов, у которых наблюдали только первую степень токсичности.
Результаты исследования генетического фенотипа и метилирования генов. Для определения прогностической значимости всех найденных мутаций у каждого пациента была рассчитана опухолевая мутационная нагрузка (ТМВ), которую определяли как количество мутаций на 1 мегабазу (Mb) последовательности. При проведении NGS было выявлено 484 аллельных варианта, мутировано 57 из 118 исследуемых генов. Медиана VAF составила 46,91 % (10,0–50,38), медиана TMB – 5,0 мутаций/Мb.
Проведенный анализ в отношении 2-летней бес-событийной выживаемости (БСВ) в зависимости от величины ТМВ (≤5 мутаций/Mb и >5 мутаций/Mb) продемонстрировал достоверные различия в группах: у пациентов с высокой ТМВ (>5) 2-летняя БСВ составила 69,6 % (95 % ДИ 50,3–96,5), с низкой ТМВ (≤ 5) – 95,0 % (95 % ДИ 85,9–100), p = 0,046.
С другой стороны, при проведении анализа БСВ для количественных переменных (в нашем случае значение ТМВ для каждого пациента) точка отсечения составила 6,63 мутации/Mb, которая также продемонстрировала прогностическую значимость ТМВ у пациентов с ММ. Трехлетняя БСВ в группе с высокой TMB (≥6,63) составила 42,8 % (95 % ДИ 22,6–81,0), у пациентов с низкой ТМВ (<6,63) – 76,7 % (95 % ДИ
22,6–81,0), р = 0,041. Наличие патогенных мутаций является неблагоприятным прогностическим параметром: 1-летняя (медиана наблюдения 12,9 месяца) БСВ у пациентов с патогенными мутациями составила 66,7 % (95 % ДИ 42,0–100,0), 2-летняя БСВ у пациентов без патогенных мутаций – 88,2 % (95 % ДИ 76,3–100,0), p = 0,078. Наибольшая частота мутаций отмечена в генах: KMT2C (31 %), KMT2D (18 %), APC (15 %), RYR1 (15 %), DNMT3A (13 %), BCR (13 %), MGA (13 %), ARID1A (13 %), FAT1 (10 %), ATM (8 %). Среди всех выявленных мутаций неблагоприятное влияние на течение ММ оказывали мутации в генах FAT1, NRAS и ATM. При анализе выживаемости 3-летняя ОВ у пациентов с мутацией FAT1 составила 37,5 % (95% ДИ 8,4–100,0), в группе дикого типа – 77,6 % (61,6– 97,7), р = 0,0039. У пациентов с мутацией гена NRAS 3-летняя ОВ составила 50,0 % (95 % ДИ 12,5–100), в группе дикого типа – 74,8 %, р = 0,0043. Для пациентов с мутацией гена ATM 5-летняя ОВ составила 33,6 % (95 % ДИ 6,7–100,0) и была значимо ниже, чем в группе дикого типа – 76,9 %, р <0,0001.
Таким образом, высокая мутационная нагрузка опухолевого клона являлась негативным фактором молекулярного риска ММ, а наличие хотя бы одной патогенной мутации ухудшало прогноз у пациентов с ММ. Мутации в генах FAT1, NRAS и ATM оказали неблагоприятное влияние на выживаемость пациентов с ММ.
На основании проведенного анализа собственных результатов исследований и данных современной научной литературы [26] был разработан и предложен алгоритм оптимизации аутоТГСК (рисунок 14).
Заключение. Принципиальным условием эффективности лечения пациентов с ММ является непрерывность лечения. Неизлечимость заболевания, проявляющаяся сменой эпизодов благополучия активацией патологического процесса, требует постоянного терапевтического воздействия. Присоединение к симптомам заболевания осложнений проводимого лечения, несомненно, приводит к персистенции жалоб и значимому снижению КЖ пациентов. Эффективная коррекция отдельных показателей КЖ и симптомов возможна в случае адекватной оценки субъективного статуса пациентов с ММ.
Отличительной особенностью аутоТГСК является то, что она включает в себя несколько этапов. Ухудшение состояния пациентов на начальных этапах заболевания может трансформироваться в дальнейшее снижение соматического статуса, что негативно сказывается на результативности аутоТГСК в целом.
Использование представленного алгоритма клинико-лабораторного мониторинга и курации пациентов с ММ при проведении аутоТГСК, основанного на комплексном анализе клинического статуса пациента, включающего КЖ, а также результатах лабораторных и инструментальных исследований, призвано повысить эффективность лечения больных ММ.


