Амбулаторный посев мочи перед эндоурологическими вмешательствами по поводу мочекаменной болезни: есть ли смысл повторять исследование в стационаре?
Автор: Петров А.Д., Алоян А.А., Горгоцкий И.А., Семенякин И.В., Шкарупа А.А., Гаджиев Н.К.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Инфекционно-воспалительные заболевания
Статья в выпуске: 3 т.18, 2025 года.
Бесплатный доступ
Введение. Предоперационная профилактика инфекций мочевыводящих путей имеет важное значение для снижения осложнений при эндоурологических вмешательствах по поводу мочекаменной болезни. В нашем исследовании оценивается диагностическая сопоставимость результатов амбулаторных и стационарных анализов мочи и их влияние на антибактериальную стратегию. Материалы и методы. Мы проанализировали данные 100 пациентов, которым были выполнены эндоурологические операции по поводу мочекаменной болезни в период с ноября 2022 года по июнь 2023 года. Амбулаторные посевы мочи, выполненные в течение двух недель до госпитализации, сравнивались со стационарными посевами мочи, проведенными в предоперационный период. Патогены идентифицировались с использованием стандартных протоколов, а расхождения оценивались на предмет их влияния на антибактериальную терапию. Результаты. Среди 100 пациентов полное соответствие между амбулаторными и стационарными посевами было зафиксировано лишь в 41 случае (41%): в 23 случаях рост микрофлоры не определялся, и в 18 случаях выявлен один и тот же патоген. Грамотрицательные бактерии, в частности Escherichia coli, были наиболее часто выявляемыми патогенами. Стационарные посевы выявили уникальные роды возбудителей инфекций, включая Klebsiella spp. и Candida spp., что подчеркивает диагностические ограничения амбулаторных исследований. Заключение. Значительные расхождения между амбулаторными и стационарными анализами мочи указывают на необходимость двухэтапного контроля посева мочи для повышения точности диагностики и оптимизации предоперационной антибактериальной подготовки. Стационарные посевы могут предоставить важные данные для коррекции антибактериальной терапии. Необходимы дальнейшие проспективные исследования, сравнивающие результаты амбулаторного и стационарного посевов мочи.
Инфекции мочевыводящих путей, мочекаменная болезнь, посев мочи
Короткий адрес: https://sciup.org/142246112
IDR: 142246112 | DOI: 10.29188/2222-8543-2025-18-3-80-87
Текст научной статьи Амбулаторный посев мочи перед эндоурологическими вмешательствами по поводу мочекаменной болезни: есть ли смысл повторять исследование в стационаре?
экспериментальная и клиническая урология № 3 2025
Перкутанная нефролитотрипсия и гибкая уретеро-реноскопия являются первой линией минимально-инвазивного хирургического лечения больных с камнями почек [1, 2]. Однако несмотря на их малую инвазивность, данные виды вмешательств не лишены инфекционных осложнений, к которым относятся: синдром системной воспалительной реакции (ССВР) и уросепсис, встречаются в 10,0–35,0% и 0,3–4,7% случаев соответственно [3, 4]. К основным факторам риска развития инфекции, после таких операций относятся: положительный результат бакпосева мочи, инфицированные камни, продолжительность операции более 60 минут, а также сопутствующие заболевания, такие как сахарный диабет и хронические болезни почек [5 – 7]. Несмотря на то, что положительный посев мочи является значимым фактором риска развития инфекционных осложнений, порядка 16% пациентов с подтвержденной бактериурией подвергаются хирургическому лечению мочекаменной болезни [8].
Важность наличия стерильного посева мочи и адекватного выбора антибактериальной терапии в предоперационном периоде подчеркивается как отечественными, так и международными клиническими рекомендациями, согласно которым перед началом хирургического лечения обязательно проведение посева мочи с целью определения бактериальной культуры [1, 2, 8]. Однако зачастую пациенты приезжают на госпитализацию уже с готовыми посевами мочи, выполненными амбулаторно по месту жительства,на основании которых назначается предоперационная антибактериальная профи-лактика/терапия. Тем не менее, даже при отрицательных результатах предоперационного посева и адекватной ан-тибиотикопрофилактики у части пациентов может развиться уросепсис [9]. Также ряд исследований не подтверждает связи между результатами предоперационного посева мочи и риском послеоперационных ин- фекций [10, 11]. В качестве альтернативы некоторые работы указывают на большую прогностическую ценность интраоперационных культур (образцов камней и лоханочной мочи) по сравнению с предоперационным посевом пузырной мочи [12 – 14].
Возникает вопрос о диагностической сопоставимости амбулаторных и стационарных посевов пузырной мочи, особенно в случаях, когда их результаты могут расходиться. На сегодняшний день нет рекомендаций, где именно (амбулаторно или стационарно) и в какие сроки перед планируемым оперативным лечением должен производиться бактериологический анализ мочи Изучение данной проблемы явилось целью нашего исследования, заключающегося в сравнении результатов амбулаторного посева мочи, сданного по месту жительства, и стационарного посева мочи, выполняемого по современным стандартам.
МАТЕРИАЛЫ И МЕТОДЫ
В Клинике высоких медицинских технологий им Н.И. Пирогова Санкт-Петербургского государственного университета проведен ретроспективный анализ 100 историй болезни пациентов урологического профиля. В исследование включены больные, госпитализированные для выполнения чрескожной или трансуретральной нефролитотрипсии в период с ноября 2022 по июнь 2023 год. У всех пациентов, имевших результаты амбулаторного посева мочи, нами при поступлении в стационар был повторно выполнен бактериологический анализ мочи.
Техника выполнения посева мочи в стационаре
В нашем стационаре посев пузырной мочи выполняется в первый день госпитализации пациента по следующей методике: микроскопия с окраской по Граму, посев на плотные и жидкие питательные среды,

определение остаточной антимикробной активности, идентификация микроорганизмов методом время-пролетной масс-спектрометрии (MALDI-TOF), выявление генов основных классов карбапенемаз и металло-b-лактамаз методом полимеразной цепной реакции (ПЦР), определение антибиотикочувстви-тельности диско-диффузионным методом с интерпретацией согласно критериям Европейского комитета по тестированию устойчивости (EUCAST). Положительная культура мочи определяется, как рост одного микроорганизма или преобладающего вида,превышаю-щий 103 КОЕ/мл [15]. Данная методика является на сегодняшний день «золотым стандартом» бактериологического анализа и позволяет получить готовый клинический результат в течение 48 часов [16-17]. Антибактериальная терапия назначается на основании результатов бактериологического исследования и чувствительности к антибиотикам совместно с клиническим фармакологом за 2 дня до оперативного вмеша-тельства.Выбор антибиотика и его дозировка зависит от клинической ситуации,согласно локальному клиническому протоколу клиники.
Анализ результатов
Результаты амбулаторного и стационарного посева мочи была разделена на пять категорий:ложно положительный результат, ложно отрицательный результат, не идентичные патогены в исследовании в стационаре,идентичные патогены в обоих вариантах исследования и стерильные посевы мочи в обоих исследованиях. Ложно положительный результат отме-чался,когда в посеве мочи в стационаре был выявлен патоген,при этом амбулаторный посев был стерильный. Ложно отрицательный результат, когда на амбулаторном этапе был выявлен патоген,а посев мочи в стационаре был стерильным.
Статистический анализ
Сбор и анализ данных осуществлялись с использованием программного обеспечения MS Excel 2016 и JASP версии 0.16.3. Количественные переменные были представлены в виде таблиц, включающих средние значения и стандартные отклонения или медианы и интерквартильный размах (ИКР), в зависимости от типа распределения данных.Для проверки гипотезы о нормальности распределения применялся критерий согласия Шапиро-Уилка, при этом нулевая гипотеза отвергалась при уровне значимости р<0,05. Данные категориальных переменных отображались в виде частотных таблиц, указывающих абсолютное количество пациентов в каждой категории. Для анализа использовался χ²-критерий с поправкой Йейтса, и приводилось точное значение p-value. Для оценки ди- агностической точности исследуемого метода относительно референтного рассчитывались показатели чувствительности и специфичности,выполнялось построение матрицы ошибок (таблицы сопряженности 2×2) для исследуемого метода. Чувствительность рассчитывалась как отношение истинно положительных результатов (ИП) к сумме истинно положительных и ложно-отрицательных (ЛО) результатов: Чувствительность = ИП/(ИП+ЛО) × 100%. Специфичность определялась как отношение истинно отрицательных результатов к сумме истинно отрицательных (ИО) и ложноположительных (ЛП) результатов: Специфичность = ИО/(ИО+ЛП) × 100%. Дополнительно, для каждого показателя выполнялась оценка 95% доверительного интервала с использованием биномиального распределения.
РЕЗУЛЬТАТЫ
В исследование включено 100 пациентов с мочекаменной болезнью, у которых проводились бактериологические посевы мочи в амбулаторных и стационарных условиях. Медианный возраст пациентов составил 60 лет (IQR: 43–67), медианный индекс массы тела – 29,38 кг/м² (IQR: 25,01–34,25), медианный размер камня – 20 мм (IQR: 11–35). Мужчины составили 42% выборки.
Сравнительный анализ посевов мочи,выполнен-ных в амбулаторных и стационарных условиях, выявил значительные расхождения. Для бинарной классификации (наличие/отс., патоген обнаружен/не обнаружен), принимая амбулаторные результаты за фактические,а стационарные за предсказанные,мат-рица ошибок представлена в таблице 1. Истинно положительные результаты составили 40 случаев (идентичные патогены: 18, неидентичные: 22), истинно отрицательные – 23, ложно положительные – 18, ложно отрицательные – 19.
Детализированный анализ, учитывающий совпадение конкретных патогенов, представлен в таблице 2. Полное соответствие результатов наблюдалось в 41% случаев (n=41): 23% (n=23) – стерильные посевы в обоих тестах, 18% (n=18) – идентичные патогены. Расхождения составили 5 9% случаев (n=59), включая ложно положительные результаты (18%, n=18), ложно отрицательные (19%, n=19) и неидентичные патогены в стационарных посевах (22%, n=22).
На основании анализа результатов посева мочи в амбулаторных и стационарных условиях общая точность стационарного посева по сравнению с амбулаторным составила 63% (95% доверительный интервал (ДИ): 53,0–72,3%). Чувствительность метода, достигла 67,8% (95% ДИ: 54,4–79,4%). Специфичность метода составила 56,1% (95% ДИ: 39,7–71,5%). Коэффициент согласия Каппа равен 0,238 (p=0,02), что указывает на слабое согласие между амбулаторным и стационар- ным посевами, свидетельствуя о ограниченной кон-кордантности методов.
Результаты бактериологического посева мочи, проведенного в амбулаторных и стационарных условиях, представлены в таблице 2. В амбулаторном посеве рост патогенной флоры был выявлен в 59 случаях (59% от общего числа образцов), тогда как в 41 случае (41%) рост флоры не обнаружен. В стационарном посеве рост флоры зафиксирован в 58 случаях (58%), а в 42 случаях (42%) патогенная флора не выявлена.
В амбулаторных условиях рост бактерий наблюдался в 59% случаев, при этом идентифицировано 10 различных штаммов. Наиболее часто встречались Escherichia spp. (24%), преимущественно Escherichia coli (34% от всех патогенов), Enterococcus spp. (14%) и Proteus spp. (6%). Реже выявлялись Enterobacter spp., Providencia spp., Serratia spp. и Stenotrophomonas spp. (по 1% каждый). В 41% случаев патогены не были обнаружены.
В стационарных посевах рост микроорганизмов также зафиксирован в 58% случаев с идентификацией 12 родов патогенов. Лидировали Escherichia spp. (10%), Enterococcus spp. (7%), Pseudomonas spp. и Staphylococcus spp. (по 6 случаев, 6% каждый), а также Klebsiella spp. Enterobacter spp., Proteus spp. и Streptococcus spp. (по 5 случаев, 5% каждый). Редкие патогены, такие как Mor-ganella spp. и Myroides spp. , встречались в единичных случаях (по 1%). Патогены Providencia spp., Serratia spp. и Stenotrophomonas spp., обнаруженные в амбулаторных посевах, в стационаре отсутствовали. В 42% случаев рост патогенной флоры не наблюдался.
Сравнение показало, что в амбулаторных условиях чаще выявлялись Escherichia spp. (25 положительных культур против 10 в стационаре) и Enterococcus spp. (15 против 10), что указывает на их связь с инфек-циями,приобретенными в сообществе.В стационаре преобладали Pseudomonas spp. (10 против 5) и Candida spp. (5 против 1), а также патогены, обнаруженные исключительно в стационарных условиях: Klebsiella spp. (5 случаев), Corynebacterium spp. (3 случая), Morganella spp. (1 случай) и Myroides spp. (1 случай), что подчеркивает риск нозокомиальных инфекций.
В стационаре выявлено пять новых родов патогенов, отсутствовавших в амбулаторных посевах: Klebsiella spp. (5 пациентов, 80% из них имели другие патогены в амбулаторных посевах, 20% – отрицательные посевы), Candida spp. (4 пациента, 50% с другими патогенами амбулаторно, 50% – с отрицательными посевами), Corynebacterium spp. (3 пациента, 33% с другими патогенами амбулаторно, 67% – с отрицательными посевами), Morganella spp. (1 пациент с другим патогеном амбулаторно) и Myroides spp. (1 пациент с отрицательным амбулаторным посевом) (рис. 1).
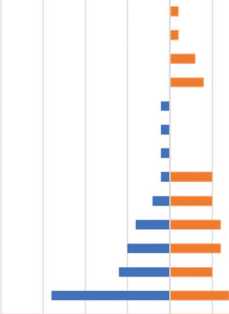
Myroides Morganella Corynebacterium Candida Stenotrorophomonas Serratia Providencia
Entero barter Streptococcus Pseudomonas Staphylococcus Proteus Enteroccoccus Escherichia
30 25 20 15 10 5 0 5 10 15
■ Амбулаторный посев ■ Госпитальный посев
Рис. 1. Распределение патогенов в выявленных группах результатов амбулаторного и стационарного посева мочи.
Fig. 1. Concordance between outpatient and inpatient urine culture results
Таблица 1. Матрица ошибок для результатов посевов мочи (амбулаторные vs. стационарные)
Table 1. Error matrix for urine culture results (outpatient vs. inpatient)
|
Фактический результат (Посев мочи в стационаре) Actual result (Urine culture in hospital) |
Патоген обнаружен (Амбулаторный) Pathogen detected (Outpatient) |
Патоген не обнаружен (Амбулаторный) Pathogen not detected (Outpatient) |
|
Патоген обнаружен Pathogen detected |
40 (67,7 %) |
18 (43,9%) |
|
Патоген не обнаружен Pathogen not detected |
19 (32,3%) |
23 (56,1%) |
|
Итого Total |
59 (100%) |
41 (100%) |
Таблица 2. Результаты посева мочи в амбулатории и посева мочи в стационаре
Table 2. The results of urine culture in the outpatient clinic and urine culture in the hospital
|
Результаты бактериологического посева Results of bacteriological culture |
Амбулаторный посев мочи Outpatient urine culture |
Посев мочи в стационаре Urine culture in hospital |
|
Рост флоры не выявлен, n No flora growth detected, n |
41 |
42 |
|
Рост флоры выявлен, n Flora growth detected, n |
59 |
58 |
|
Итого, n Total, n |
100 |
100 |
Наибольшая воспроизводимость результатов между амбулаторными и стационарными посевами отмечена для Escherichia spp. : из 24 амбулаторных случаев 8 (33%) подтверждены в стационаре, но дополнительно выявлено 16 новых случаев. Для Proteus spp. воспроизводимость составила 100% (3 из 3 случаев подтверждены),но в стационаре зафиксировано еще 3 новых случая (50% от общего числа). Наибольшие показатели ложноотрицательных результатов наблюдались для Pseudomonas spp. (3 случая, 50% от 6 стационарных выявлений) и Candida spp. (2 случая, 50%).
ОБСУЖДЕНИЕ
Инфекционные осложнения, включая послеоперационную атаку пиелонефрита и сепсис,являются одними из наиболее частых осложнений эндоурологичес-ких вмешательств.Частота послеоперационного сепсиса у пациентов,перенесших хирургическое вмешательство по поводу мочекаменной болезни, по данным литературы колеблется в пределах 0,3–7,6% [18 – 20]. При этом основным фактором,способствующим развитию инфекционных осложнений после литотрипсии, является высвобождение бактерий, колонизирующих камни, а также повышение интрареналь-ного давления,что приводит к транслокации бактерий и эндотоксинов в системный кровоток [21].
На сегодняшний день перед плановым оперативным вмешательством по поводу мочекаменной болезни выбор антибактериального препарата основывается на результатах амбулаторного посева мочи [22, 23]. Однако данные, полученные за 1 – 4 недели до операции могут быть недостаточно информативными, что может привести к высокой частоте послеоперационных инфекционно-воспалительных осложнений [12, 24, 25]. В исследовании R. Korets и соавт. показано, что амбулаторные посевы мочи обладают ограниченной прогностической ценностью для выбора антибио-тикопрофилактики перед перкутанной нефролито-трипсией [12]. В частности, у 33% пациентов выявлялись положительные посевы из верхних мочевых путей при отрицательных амбулаторных результатах пузырной мочи,что повышает риск послеоперационных осложнений.Несмотря на значительный объем исследований в области лечения инфекции мочевыводящих путей,сравнительный анализ диагностической ценности амбулаторных и стационарных посевов мочи остается недостаточно изученным. Стоит отметить, что развитие инфекционных осложнений в послеоперационном периоде даже при отрицательных результатах амбулаторно бактериологического исследования мочи,может потребовать смены антибактериальной терапии. В нашем исследовании была проведена оценка сопоставимости результатов амбулаторных и госпитальных посевов мочи у пациентов, проходящих плановые эндоурологические вмешательства по поводу мочекаменной болезни.Полученные данные выявили значительные расхождения между результатами посевов, выполненных до госпитализации и в стационаре,что подчеркивает сложность диагностики и лечения инфекций мочевыводящих путей в данной группе пациентов.Наш анализ показал,что только у 41% пациентов результаты амбулаторных и госпитальных посевов мочи совпадали (стерильные посевы мочи в обоих исследованиях и индентичные патогены), отрицательные результаты амбулаторных посевов были подтверждены в 23% случаев, а положительные – только в 18%. Эти расхождения подчеркивают ограниченность использования только амбулаторного посева для предоперационного планирования и акцентируют важность проведения дополнительного стационарного посева для более точной идентификации патогенов. Этот аспект имеет важное клиническое значение,так как напрямую влияет на тактику ведения пациентов в плане антибиотикопро-филактики и антибактериальной терапии.Антибио-тикопрофилактика, основной целью которой является предотвращение развития инфекции, назначается всем пациентам перед оперативным лечением [26]. Антибактериальная терапия – это применение антибиотиков при уже имеющейся развившейся инфек-ции.Цель терапии – устранение патогенных микроорганизмов, вызывающих инфекцию [27]. По данным нашего исследования, у 18% пациентов амбулаторный посев мочи не выявил наличие бактериального агента, тогда как посев в стационаре позволил его определить. У 22% пациентов амбулаторные и стационарные штаммы микроорганизмов отличались друг от друга. При развитии атаки пиелонефрита пациенту назначалась антибактериальная терапия с учетом антибиоти-кограммы стационарного посева мочи.Изменения в терапии включали либо сужение спектра антибиотиков (замена комбинированной терапии на монотерапию при подтверждении чувствительности патогена к одному препарату), либо расширение спектра (добавление дополнительных антибиотиков для покрытия полимикробной флоры). Послеоперационные инфекции остаются одной из наиболее значимых проблем в клинической практике, они характеризуются тяжелым течением,ухудшением качества жизни пациентов и значительной экономической нагрузкой на систему здравоохранения. Это подчеркивает важность разработки и внедрения эффективных профилактических мероприятий, направленных на снижение частоты подобных осложнений [23]. Возможно, одним из таких моментов, может послужить бактериологическое исследование конкрементов, после литоэкстракции. Ряд исследований указывает на то,что бактериологическое исследование камней, а не предоперационный посев мочи,может являться более точным предикто- ром развития послеоперационных инфекционных осложнений [28, 29]. Поскольку микробный состав мочи не всегда коррелирует с результатами посева кон-крементов,предоперационный анализ мочи перед перкутанной нефролитотрипсией нередко рассматривается как недостаточно надежный метод прогнозирования инфекционных рисков [28].
Проведение подтверждающего посева мочи на разных этапах обследования может помочь улучшить диагностические и лечебные стратегии при инфекциях мочевыводящих путей. Мы ожидаем, что полученные результаты не только дополнят существующие знания о диагностике урологических инфекций,но и привлекут внимание к необходимости более тщательного и стандартизированного подхода к сбору и анализу мочи в различных клинических ситуациях. Более того, в условиях стационара диагностические возможности для выявления различных спектров патогенов в исследованиях мочи могут быть значительно выше,чем в амбулаторных условиях [30].
Согласно национальным клиническим рекомендациям, плановое хирургическое удаление камней почек не рекомендуется при положительном бактериологическом исследовании мочи из-за риска развития инфекционно-воспалительных осложнений [1, 2, 8]. Систематический обзор и метаанализ,выполненный C.W. Lo и соавт., показал, что профилактическое лечение антибиотиками может снизить частоту пиурии и бактериурии после эндоурологических вмешательств, но не частоту клинически значимых инфекционных осложнений [31]. Как правило, при положительном посеве мочи первым этапом перед оперативным лечением проводится курс антибактериальной терапии, после завершения которого проводится контрольное бактериологическое исследование [1, 8, 32]. На фоне длительного приема антибиотиков предоперационный посев мочи может привести к некорректным результатам, включая ложноотрицательный или смешанный бактериальный рост, что может привести к неправильной антибактериальной терапии [33 – 35]. В данной группе пациентов особую значимость приобретает двухэтапный микробиологический контроль, позволяющий более точно подобрать антибактериальную терапию и минимизировать риск послеоперационных инфекционных осложнений.
В ходе исследования было идентифицировано 15 различных родов патогенов,при этом были выявлены значительные различия в их обнаружении между амбулаторными и госпитальными посевами. Escherichia coli оказалась наиболее часто выявляемым патогеном в обоих посевах мочи,что соответствует ее известной распространенности при ирнфекции мочевых путей [36]. Однако некоторые патогены, такие как Providencia spp., Serratias spp. и Stenotrophomonas spp, были обнаружены исключительно в госпитальных посевах, что может свидетельствовать о возможной нозокомиальной природе этих инфекций или ограничениях амбулаторной диагностики.
Один их наиболее важных параметров на догоспитальном этапе – это «плюс-посев», когда на амбулаторном этапе посев отрицательный, а в клинике высевается патоген. Таких случаев было зарегистрировано 18 (18%). Кроме того, у 40 пациента первый посев показал наличие одних патогенов, а второй – отличных от первых. Как правило, подобные несоответствия происходят по причине ограничения возможностей бактериологического исследования в лабораториях [37]. Дополнительными факторами некорректного результата посева мочи может служить неправильный сбор исследуемого материала, время транспортировки до лаборатории [37]. К сожалению, данных о среднем времени нахождения материала в транспортном контейнере от момента сбора до начала исследования в открытых литературных источниках не удалось обнаружить, но, согласно клиническим рекомендациям, образец мочи необходимо доставить в лабораторию в течение 2 часов после взятия [38]. Также необходимо отметить,что не во всех стационарных медицинских учреждения есть своя бактериологическая лаборатория [37, 39]. Проведение подтверждающего анализа результатов посевов мочи на различных этапах обследования может помочь улучшить стратегии диагностики и лечения инфекций мочевыводящих путей.
Идентификация бактерий в анализе мочи и определение их концентрации позволяет предсказать вероятность послеоперационных инфекционных осложнений [9, 40]. Это дает возможность реализовать соответствующую терапию или профилактические меры, что улучшает результаты лечения и сокращает продолжительность пребывания пациента в стационаре [20]. Согласно широко признанным представлениям, необходимым условием для проведения эндоурологиче-ских вмешательств является стерильный посев мочи до операции.При обструкции верхних мочевыводящих путей требуется предварительное дренирование и последующее поэтапное лечение [1, 8, 40].
Выявленные нами расхождения в результатах посева мочи имеют существенное клиническое значение.
Следует отметить несколько ограничений исследования. Во-первых, анализ данных проводился ретроспективно, из-за чего полученные данные могли быть искажены. Для более точной оценки необходимо провести рандомизированное проспективное исследование. Кроме того, нельзя исключить самостоятельный прием антибиотиков пациентами с момента сдачи амбулаторного анализа мочи до госпитализации, что также могло отразиться на результатах госпитальных посевов. Во-вторых, различия в протоколах сбора, обработки и лабораторного анализа образцов в амбулаторных и стационарных условиях могли быть причиной разных результатов.
ЗАКЛЮЧЕНИЕ
Значительные расхождения между результатами амбулаторных и стационарных посевов мочи указывают на необходимость двухэтапного контроля посева мочи для повышения точности распознавания возбу- дителя инфекции и оптимизации предоперационной антибактериальной подготовки. Результаты стационарных посевов мочи могут предоставить важные данные для коррекции антибактериальной терапии. Необходимы дальнейшие проспективные исследования, сравнивающие результаты амбулаторного и стационарного посевов мочи, особенно у пациентов с высоким риском инфекционных послеоперационных осложнений.


