Анализ работы женской консультации ГБУЗ "Городская поликлиника № 1" за 2020 год
Автор: Ботоева Елена Аполлоновна, Занданов Александр Октябрьевич
Журнал: Вестник Бурятского государственного университета. Медицина и фармация @vestnik-bsu-medicine-pharmacy
Статья в выпуске: 2, 2022 года.
Бесплатный доступ
Одним из существующих вариантов негормональной менопаузальной терапии является применение фитоэстрогенов. Однако следует отметить, что фитоэстрогены в низких дозах практически не оказывают влияния на климактерические симптомы, а в больших дозах имитируют действие эстрогенов, а это может иметь нежелательные эффекты, свойственные гормональной терапии, что особенно опасно для женщин с РМЖ в анамнезе. Особое место среди средств негормональной терапии занимают препараты на основе экстрактов растения цимицифуга кистевидная (Cimicifuga racemosa) . Растительные вещества, содержащиеся в экстракте корневища цимицифуги кистевидной, не связываются с рецепторами эстрогена и лишены эстрогенных эффектов на раковые клетки молочной железы и матки. Вместе с тем они уменьшают частоту приливов и способны противодействовать развитию остеопороза. Клиническое влияние Cimicifuga racemosa реализуется за счет дофаминергического, норадренергического, серотонинергического и ГАМК-ергического эффектов.
Фитоэстрогены, фитотерапия, менопауза, здоровье, женщина
Короткий адрес: https://sciup.org/148326722
IDR: 148326722 | УДК: 618.4 | DOI: 10.18101/2306-1995-2022-2-29-41
Текст научной статьи Анализ работы женской консультации ГБУЗ "Городская поликлиника № 1" за 2020 год
Ботоева Е. А., Занданов А. О. Анализ работы женской консультации ГБУЗ «Городская поликлиника № 1» за 2020 год // Вестник Бурятского государственного университета. Медицина и фармация. 2022. № 2. С. 29‒41.
В женской консультации ГБУЗ «Городская поликлиника № 1» имеется 15 акушерско-гинекологических участков. Среднее количество женщин на 1 участке — 2 624. В 2020 г. были расширены площади до 789,6 м2 (полезная — 621,0). Работают филиалы в пос. Заречный (5 участков — 4 врача) и пос. Стеклозавод (2 участка — 1 врач). Имеются 2 дневных стационара (1 в пос. Заречный), кабинет медико-социальной помощи, УЗД, доврачебного приема, процедурные кабинеты, работали два фильтра для выявления ОРВИ.
Численность женщин (всего) — 38 749, женщин фертильного возраста (ЖФВ) — 24 532.
Удельный вес ЖФВ в структуре (от всех жителей 90 023) — 27,2%.
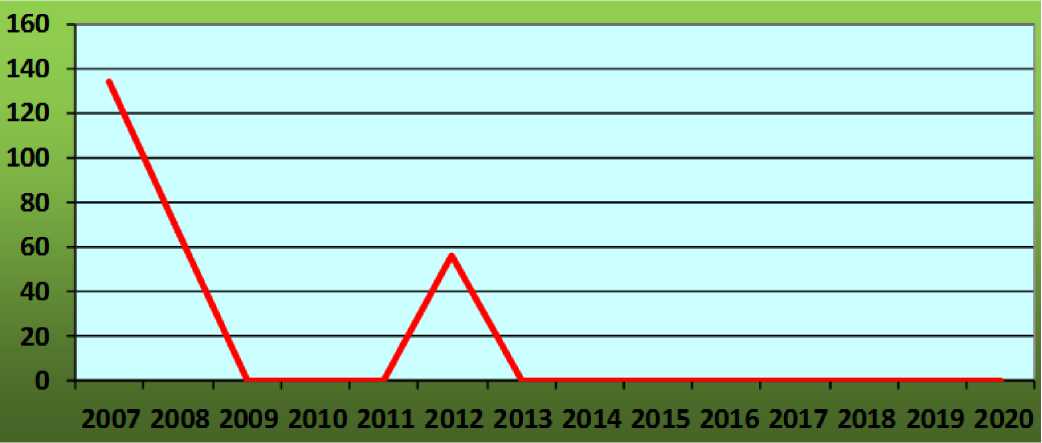
Материнской смертности не было с 2012 г.
Всего взято под наблюдение беременных в 2020 г. 1 430 чел., что меньше по сравнению с 2018 г. на 7,1%. Ранняя явка беременных в женскую консультацию повысилась в динамике за 3 года и составила 86,4% всех вставших на учет беременных.
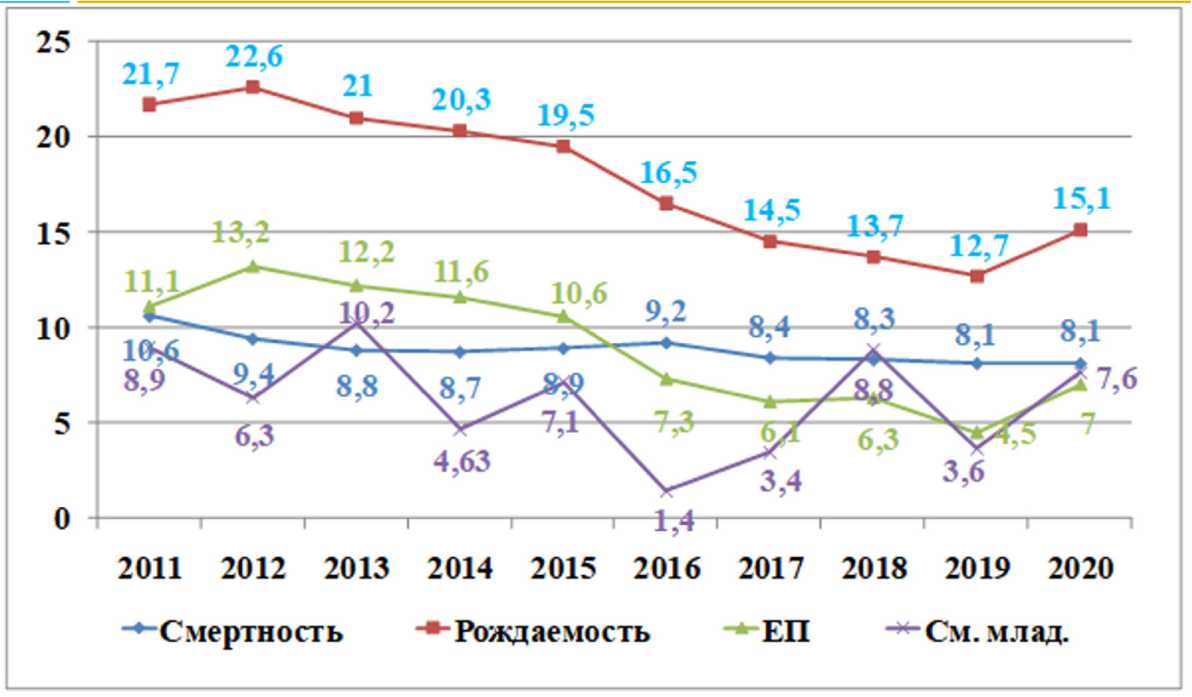
Демографические показатели
Динамика материнской смертности в ЖК
Распределение беременных женщин по группам перинатального риска: 51,1% — группа низкого риска
30,0 — среднего
18,9% — высокого.
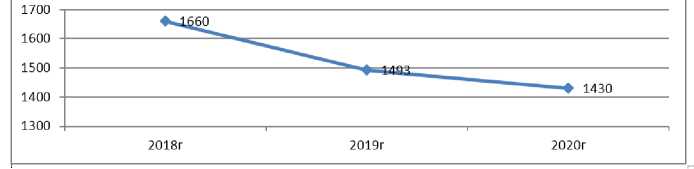
Отмечается снижение количества родов с 1 660 в 2018 г. до 1 430 в 2020 г. — на 13,8%.
Количество родов
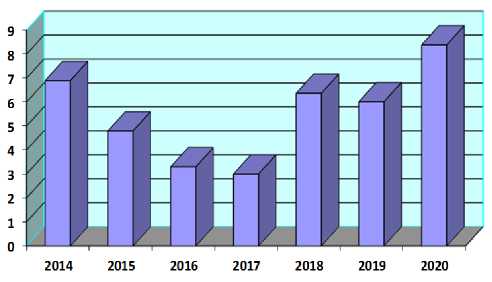
Динамика перинатальной смертности
В соответствии с порядком оказания медицинской помощи критерием работы женской консультации является показатель антенатальной смертности. Число случаев антенатальной смертности в динамике за 3 года снизилось с 6 до 4, т. е. на 33%, показатель антенатальной смертности снизился с 4,8 до 2,8 (на 41%), а в динамике за 10 лет — с 13 случаев до 4, т. е. на 69% (показатель антенатальной смертности — на 65,8%). Из 4 случаев два из двойни (монохориальная двойня). Антенатальная в стационаре — 1, в женской консультации — 3. Стационарный случай: на прерывание беременности в ГПЦ госпитализирована с опозданием в 22 недели, категорически отказывалась от госпитализации и лечения, указывая, что плод нежизнеспособен.
|
2020 г. |
2021 г. |
10 мес. 2022 г. |
||||
|
Абс. число |
%о |
Абс. число |
%о |
Абс число |
%о |
|
|
Перинатальная смертность, всего % и абс. число |
12 |
8,39 |
6 |
4,4 |
9 |
8,9 |
|
РНС |
8 |
2 |
0 |
0 |
||
|
Мертворождаемость, в т. ч.: |
4 |
4 |
9 |
8,9 |
||
|
- интранатальная |
0 |
0 |
3 |
2,9 |
||
|
- антенатальная в стационаре |
1 |
1 |
2 |
1,9 |
||
|
- антенатальная амбулаторно |
3 |
3 |
4 |
3,9 |
||
|
Антенатальная вся |
4 |
4 |
6 |
5,9 |
Удельный вес доношенных детей среди перинатальных потерь в 2018 г. — 50%, а в 2021 г. — 16%, 2022 г. — 11,1%.
Динамика перинатальной смертности
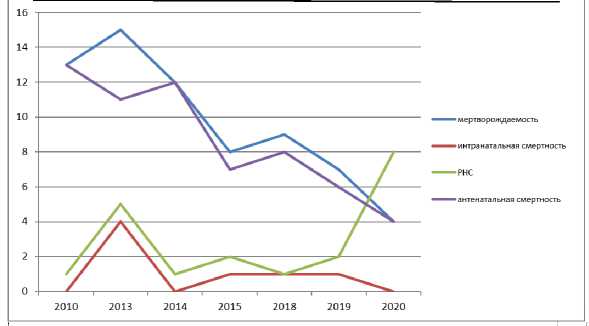
При этом показатель мертворождаемости снизился в динамике за последние 3 года с 5,38 до 2,8 в 2020 г., т. е. на 47,9%. Снижение мертворождаемости произошло не только за счет антенатальной смертности, в 2020 г. не было ни одного случая интранатальной смертности. Ранняя неонатальная смертность и интрана-тальная смертность являются критерием работы акушерского стационара. Показатель ранней неонатальной смертности в динамике за последние 3 года повысился с 0,59 до 5,6 в 2020 г. Перинатальная смертность повысилась с 10 до 12 случаев, т. е. на 20%, повышение произошло за счет ранней неонатальной смертности.
Причины перинатальной смертности
Установлено, что 100% случаев неуправляемы — первичная плацентарная недостаточность, ВПР невыявляемые и нежизнеспособные, преждевременная отслойка плаценты у монохориальной диамниотической двойни. Исчезли по сравнению с предыдущими годами причины смертности: ИЦН, АФС, гемолитическая болезнь новорожденных и тяжелая преэклампсия.
Удельный вес доношенных детей среди перинатальных потерь в 2018 г. — 50%, а в 2020 г. — 33%.
В динамике с 2019 г. отмечается снижение числа преждевременных родов с 67 до 50 в этом году. Показатель преждевременных родов в ЖК 1 низкий — 3,9%, за три года остается на одном уровне. Средний возраст женщин с ПР — 31±4 года.
Большинство преждевременных родов приходится на наиболее активный репродуктивный возраст — 19‒38 лет (91,8%).
Наибольший процент преждевременных родов отмечен у тех, кто рожал в третий раз, это составляет 29% родов.
Факторами риска преждевременных родов следует считать наличие 1 и более преждевременных родов в анамнезе, 1 и более поздних выкидышей, инфекции половых путей, экстрагенитальную патологию.
При анализе невынашивания беременности выявлено, что в 17,4% случаев имелась патология репродуктивной системы: нарушения менструального цикла, истмикоцервикальная недостаточность, миома матки, вагиниты, резекция яичника.
Отмечается увеличение процента экстрагенитальной патологии у беременных с 51,3 до 63,6% всех родов.
Среди причин преждевременных родов — плацентарная недостаточность, ИЦН, инфекции. Отмечается рост в 2020 г. ПОНРП, предлежаний плаценты, рубцов на матке.
Осложнениями беременности при ПР являются: преэклампсия — 10,5%, диабетическая фетопатия — 3,5%, многоводие — 2,3%, маловодие — 2,3%, задержка развития плода — 7%.
Риски менопаузы и менопаузальная гормональная терапия (МГТ)
Путь от менархе до менопаузы в целом расценивается как процесс предсказуемого и постепенного старения женской репродуктивной системы. В настоящее время более 1/3 жизни женщины приходится на период постменопаузы. Начиная с шестого десятилетия происходят возникновение и манифестация многих хронических заболеваний, которые могут влиять как на качество, так и на продолжительность жизни женщины. Ожирение, метаболический синдром и диабет, сердечно-сосудистые заболевания, остеопороз и остеоартроз, снижение когнитивных функций, расстройство интеллекта, депрессия, рак являются основными заболеваниями, сопровождающими зрелый возраст.
Начало менопаузы обусловливает возможности для проведения профилактики многих заболеваний, сопровождающих зрелый возраст, для улучшения качества жизни и повышения ее продолжительности. Профилактика отмеченных заболеваний включает модификацию образа жизни: отказ от курения и чрезмерного употребления алкоголя, здоровое и сбалансированное питание, регулярная физическая активность.
Особое место в стратегии профилактики заболеваний, сопровождающих женщин постменопаузального возраста, и повышения качества их жизни занимает менопаузальная терапия. Профилактика заболеваний менопаузального возраста должна начаться со скрининга и тщательной оценки факторов риска возникновения и прогрессирования определенных заболеваний [1].
Согласно критериям STRAW+10, разработанным Рабочей группой по изучению этапов старения репродуктивной системы (Stages of Reproductive Aging Workshop — STRAW), у женщин различают три основных периода: репродуктивный, переходный (менопаузальный переход) и постменопауза.
Период менопаузального перехода в целом характеризуется высоким уровнем фолликулостимулирующего гормона (ФСГ) (но с различными индивидуальными значениями), снижением числа антральных фолликулов, показателей ан-тимюллерова гормона (АМГ) и ингибина В. Различают ранний и поздний этапы менопаузального перехода. Ранний этап (стадия — 2) менопаузального перехода характеризуется ростом изменчивости продолжительности менструального цикла с колебаниями в 7 дней или более, поздний этап (стадия — 1) — возникновением аменореи длительностью 60 и более дней. Для менструальных циклов в конце менопаузального перехода характерны повышенная изменчивость продолжительности цикла, резкие колебания гормональных уровней, а также увеличение ановуляторных циклов. Уровень ФСГ на этом этапе переходного периода — более 25 МЕ/л. Возможно появление вазомоторных симптомов. Средняя продолжительность позднего этапa менопаузального перехода — от 1 до 3 лет [10].
Постменопауза в целом характеризуется высоким уровнем ФСГ, низкими уровнями АМГ и ингибина В, очень низким количеством антральных фолликулов, высокой вероятностью вазомоторных симптомов, а также явлениями урогенитальной атрофии. Различают раннюю и позднюю постменопаузу. Ранняя постменопауза в среднем длится 2 года (1+1) и подразделяется на следующие стадии: +1a, +1b и +1c. Примерно 2 года после последней менструации продолжаются увеличение уровня ФСГ и уменьшение уровня эстрадиола. Этапы +1a и +1b заканчиваются стабилизацией уровней ФСГ и эстрадиола. Стадия +1a соответствует завершению 12-месячного периода аменореи, необходимого для подтверждения того факта, что последний менструальный цикл действительно является завершающим. Это соответствует концу перименопаузы. Перименопауза — период до и после менопаузы, начинается на стадии — 2 менопаузального перехода и заканчивается через 12 мес. после последней менструации. Стадия +1с, по оценкам, длится от 3 до 6 лет и характеризуется периодом стабилизации высоких уровней ФСГ и низких значений эстрадиола. Таким образом, весь ранний период постменопаузы длится приблизительно от 5 до 8 лет. В поздней постменопаузе (стадия +2) на первое место выходят процессы соматического старения. Симптомы сухости влагалища и урогенитальной атрофии становятся все более распространенными в это время [27].
Важно отметить, что периоды менопаузального перехода и постменопаузы характеризуются целым рядом других особенностей, в частности, тенденцией к увеличению частоты:
-
• избыточной массы тела и ожирения;
-
• недержания мочи, урогенитальной атрофии;
-
• остеопороза и повышенного риска развития переломов;
-
• сердечно-сосудистых заболеваний;
-
• венозных тромбоэмболий и повышенной коагуляции;
-
• нарушений функционирования центральной нервной системы;
-
• рака молочной железы.
Ожирение
Существуют различные точки зрения относительно связи менопаузы и формирования избыточной массы тела и ожирения. Более убедительны данные о том, что образ жизни и другие внешние факторы являются основной причиной формирования избыточной массы тела и ожирения у женщин зрелого возраста, а дефицит эстрогенов способствует увеличению висцеральной жировой ткани.
По данным двухэнергетической рентгеновской абсорбциометрии, у женщин в процессе менопаузального перехода происходит увеличение висцеральной жировой ткани [2]. Экспериментальные данные свидетельствуют о том, что после овариэктомии у мышей уменьшается расход энергии без изменения энергии по- требления, отмечаются гипертрофия адипоцитов и жировая дистрофия печени [4].
Трехлетнее наблюдение за 3 064 женщинами в возрасте от 42 до 52 лет позволило установить, что средняя масса тела увеличивалась на 2,1 кг, а средняя окружность талии (ОТ) — на 2,2 см. Однако увеличение физической активности, даже незначительное, было связано с уменьшением массы тела и ОТ [5]. Анализ в общей сложности 65 381 женщины в возрасте от 50 до 75 лет свидетельствовал, что у больных с депрессией выше риск развития сахарного диабета (СД) 2-го типа и избыточной массы тела, с другой стороны, также отмечено, что у женщин с СД 2-го типа выше риск развития депрессии [6].
Концепция профилактики и лечения ожирения в постменопаузе в теоретическом аспекте очень проста и логична — меньше есть и больше заниматься физическими упражнениями. К сожалению, данная концепция невероятно трудно реализуется [11].
Венозные тромбозы
Вместе с тем важно отметить, что риск развития венозного тромбоза увеличивается как с возрастом, так и с наличием ожирения, особенно у категории женщин, принимающих МГТ. Тромбоз и ожирение (или избыточная масса тела) тесно взаимосвязаны между собой и отчасти имеют общую генетическую природу [8]. Вышеуказанный факт обусловливает поиск негормональных методов лекарственной терапии женщин в период менопаузального перехода и постменопаузы с ожирением и менопаузальными симптомами.
Дефицит эстрогенов после менопаузы, как известно, приводит к атрофическим изменениям и может быть связан с такими проявлениями нарушения функции нижних мочевых путей, как частое и ургентное мочеиспускание, никтурия, недержание мочи и рецидивирующие инфекции. Указанные симптомы могут быть сопряжены с явлениями диспареунии, зуда, жжения и вагинальной сухости, урогенитальной атрофии [19].
Однако в настоящее время не признается роль системной терапии эстрогенами у женщин с частым стрессовым недержанием мочи [3].
Тренировка мышц тазового дна предлагается в качестве первой линии консервативной терапии женщинам со стрессовым, ургентным или смешанным вариантами недержания мочи (степень рекомендации А).
При стрессовом недержании мочи рассматривается также вариант присоединения дулоксетина (степень рекомендации C) [13].
Остеопороз
Остеопороз определяется как системное скелетное заболевание, характеризующееся снижением прочности костной ткани, приводящее к повышенному риску переломов. Трещины и переломы могут возникать в результате минимальной травмы, например, падения с высоты собственного тела. Наиболее распространенные переломы, связанные с остеопорозом, — переломы позвонков. Среди других переломов, ассоциированных с остеопорозом, отмечаются переломы бедра, запястья, таза, крестца, ребер, грудины, ключицы и плечевой кости. Все указанные виды переломов сопровождаются болевым синдромом, могут приводить к инвалидности, а также повышают показатели заболеваемости и смертности [12].
Прочность костной ткани зависит от особенностей ремоделирования и взаимодействия между остеокластами и остеобластами. Ремоделирование костной ткани в том числе регулируется системными гормонами: эстрогенами, андрогенами, паратиреоидным гормоном, фолликулостимулирующим гормоном, тиреотропным гормоном с участием цитокинов и факторов роста [18].
Применение фармакологических средств для лечения и профилактики остеопороза должно основываться на индивидуальной оценке 10-летней вероятности перелома, которая проводится с использованием интегрированной модели факторов риска ФРАКС (FRAX®) [5].
В целом МГТ является эффективным средством профилактики переломов в ранней постменопаузе [10]. Однако влияние МГТ на минеральную плотность костной ткани снижается после прекращения терапии с непредсказуемой скоростью [14].
Рекомендуемое потребление с пищей кальция у женщин постменопаузального возраста составляет 1000–1500 мг, а витамина D–800–1000 МЕ. Следует отметить, что рутинное применение препаратов кальция необходимо ограничить вследствие того, что повышенное поступление кальция может привести к возникновению сердечно-сосудистых заболеваний (ССЗ). В частности, согласно данным метаанализа, 11 рандомизированных контролируемых исследований (РКИ), в которое вошли 12 000 женщин, повышенное поступление кальция (без витамина D) повышало риск развития инфаркта миокарда (на 30%), инсульта и/или внезапной смерти, что, по-видимому, может быть следствием кальциноза сосудов, приводящего к развитию или прогрессированию ССЗ [19].
Сердечно-сосудистые заболевания
У женщин постменопаузального возраста основной причиной инвалидизации и смертности являются ССЗ [5].
С целью оценки роли МГТ во вторичной профилактике ишемической болезни сердца (ИБС) было проведено плацебо-контролируемое РКИ, в котором приняли участие 276 женщин моложе 80 лет (средний возраст составил 66,7 года) в менопаузе с интактной маткой и ИБС. Средний период наблюдения продолжался 0,8 года. Было установлено, что МГТ не снижает частоту коронарных событий у женщин постменопаузального возраста. Кроме того, отмечено увеличение частоты тромбоэмболии и заболеваний желчного пузыря. В связи с этим авторы не рекомендуют начинать МГТ с целью вторичной профилактики ИБС у определенной возрастной категории женщин [9].
Инсульт
Инсульт остается главной причиной длительной инвалидизации у взрослых и третьей ведущей причиной смерти среди женщин [15]. Во многих развивающихся странах инвалидность и смертность от инсульта превышают аналогичные показатели по ИБС [2].
Факторы риска развития инсульта включают артериальную гипертензию, курение, повышенное соотношение талия — бедро, нездоровое питание, отсутствие регулярной физической активности, СД, высокий уровень потребления алкоголя, психосоциальный стресс или депрессию, фибрилляцию предсердий и другие болезни сердца, а также повышенный коэффициент соотношения аполипопротеина B к аполипопротеину A1 [7]. Частота инсульта неуклонно возрастает с возрастом [9].
С целью оценки влияния орального и трансдермального пути введения эстрогенов на риск развития инсульта был проведен анализ наблюдений за 883 женщинами в возрасте 50–79 лет (ранее перенесенный инсульт являлся диагнозом исключения из исследования). Было выявлено, что пероральный прием эстрогенов как в низкой, так и в высокой дозе сопровождался повышением частоты инсульта [22].
Венозная тромбоэмболия
Риск венозной тромбоэмболии является наиболее значимым риском МГТ. Оральные эстрогены дозозависимо повышают риск венозной тромбоэмболии путем увеличения выработки тромбина и формирования резистентности к активированному протеину С. Трансдермальные эстрогены оказывают меньшее влияние на гемостаз. Применение оральных эстрогенов еще более повышает риск венозных тромбоэмболий у женщин с ожирением или тромбогенными мутациями. Риск венозных тромбоэмболий при МГТ также зависит от прогестагенного компонента, в частности, риск выше у женщин, использующих МПА, по сравнению с применением других прогестинов, например, микронизированного прогестерона [15].
Риск венозных тромбозов, связанных с оральной гормональной терапией, может отличаться в зависимости от типа эстрогенов. В частности, результаты сравнительного анализа 92 женщин, принимавших эстрадиол, и 48 женщин, принимающих КЛЭ (средний возраст — 64,1 года, средний ИМТ — 29,1), показали, что у женщин, принимавших КЛЭ, были бóльшие пиковые значения генерации тромбина и эндогенного тромбинового потенциала, а также снижение общего протеина S [20].
Снижение когнитивных функций
Данные систематического обзора и метаанализа исследований о влиянии возраста на когнитивные функции свидетельствуют о том, что снижение уровня эстрогена связано со снижением когнитивных функций, а также с повышенным риском депрессивных расстройств, более выраженных у женщин в пери- и постменопаузе, чем у женщин в пременопаузе [23].
Хирургическая менопауза может сопровождаться когнитивными нарушениями, которые в первую очередь влияют на вербальную эпизодическую память. Применение эстрогенов может оказывать краткосрочное положительное влияние на когнитивные функции, если терапия проведена вовремя или вскоре после ова-риэктомии [16].
Симптомы менопаузы и фитотерапия
Таким образом, с учетом выявленных отрицательных аспектов МГТ у категории женщин с менопаузальными симптомами и факторами онкологического или тромботического риска следует отдавать предпочтение негормональной лекарственной менопаузальной терапии.
Одним из существующих вариантов негормональной менопаузальной терапии является применение фитоэстрогенов. Однако следует отметить, что фитоэстрогены в низких дозах практически не оказывают влияния на климактерические симптомы, а в больших дозах имитируют действие эстрогенов, а это может иметь нежелательные эффекты, свойственные гормональной терапии, что особенно опасно у женщин с РМЖ в анамнезе.
Особое место среди средств негормональной терапии занимают препараты на основе экстрактов растения цимицифуга кистевидная (Cimicifuga racemosa) . Растительные вещества, содержащиеся в экстракте корневища цимицифуги кистевидной, не связываются с рецепторами эстрогена и лишены эстрогенных эффектов на раковые клетки молочной железы и матки. Вместе с тем они уменьшают частоту приливов и способны противодействовать развитию остеопороза. Клиническое влияние Cimicifuga racemosa реализуется за счет дофаминергического, норадренергического, серотонинергического и ГАМК-ергического эффектов [21].
Данные систематического обзора свидетельствуют о том, что негормональные методы лечения вазомоторных симптомов у женщин в пери- и постменопаузе, в том числе применение Cimicifuga racemosa , характеризуются не только положительным соотношением риска и пользы, но и высокой клинической эффективностью, особенно у категории пациенток с РМЖ в анамнезе [24].
Результаты применения Cimicifuga racemosa при вазомоторных симптомах у женщин в постменопаузе показали значительное снижение менопаузального индекса Куппермана. Особенно эффективно применение Cimicifuga racemosa оказалось против приливов, ночной бессонницы и тревоги [25]. Отмечено увеличение уровня липопротеинов высокой плотности (р<0,04), обладающих антиатероген-ными свойствами, у женщин, получавших Сimicifuga racemosa . Уровни триглицеридов не менялись в обеих группах женщин. Показатели ФСГ, ЛГ и кортизола существенно не изменились после трехмесячного лечения, в то время как уровни пролактина (р<0,005) и 17-бета-эстрадиола (E2) (р<0,001) были немного увеличены у женщин, принимающих трансдермальный эстрадиол. Толщина эндометрия существенно не отличалась у женщин, принимающих Сimicifuga racemosa или низкие дозы трансдермального эстрадиола. В заключение авторы утверждают, что Сimicifuga racemosa (40 мг/сут) может быть реальной альтернативой низкой дозы трансдермального эстрадиола в лечении женщин с климактерическими жалобами, у которых оказалось неэффективным применение трансдермального эстрадиола или имеет место отказ принимать гормональное средство [1; 27].
Было выявлено, что Сimicifuga racemosa значительно более эффективна, чем плацебо (p<0,001). Авторы особо отмечают, что лечебная эффективность приема Сimicifuga racemosa значительно зависит от времени появления климактерических симптомов (p=0,014) и уровня ФСГ (p=0,011): в частности, у женщин в периоде менопаузального перехода в ранней фазе климактерического периода более выражен положительный эффект применения Сimicifuga racemosa , чем в постменопаузальном периоде [26].
Результаты двойного слепого плацебоконтролируемого РКИ свидетельствуют, что применение Cimicifuga racemosa в течение 4–8 нед. способствует значительно большему улучшению вазомоторных, психических, физических и сексуальных климактерических симптомов у женщин в период ранней менопаузы, чем плацебо [17; 26].
Недавно проведенное рандомизированное двойное слепое плацебоконтро-лируемое исследование у женщин с нарушением сна позволило зарегистрировать значительные положительные полисомнографические изменения и снижение частоты пробуждения после начала сна (WASO), а также повышение индекса качества сна (Pittsburg Sleep Quality Index (PSQI)) у пациенток в постменопаузе (45–60 лет), принимающих Cimicifuga racemosa [16].
У женщин с климактерическим синдромом и РМЖ в анамнезе Cimicifuga racemosa может быть альтернативой МГТ [57]. Экспериментальные исследования свидетельствуют о том, что Cimicifuga racemosa снижает риск развития остеопороза, возможно, путем влияния на функциональную активность структур костного мозга и уменьшения секреции провоспалительных цитокинов [21, 24].
Важно отметить, что недавно проведенный тщательный анализ и пересмотр всех плацебоконтролируемых клинических исследований относительно применения Cimicifuga racemosa свидетельствуют об однозначной эффективности ее применения при климактерическом синдроме (стандартизированное среднее различие 0,385 в пользу Cimicifuga racemosa , р<0,0001) [25].
Таким образом, применение лекарственной негормональной менопаузальной терапии с препаратами, содержащими Cimicifuga racemosa , имеет ряд неоспоримых преимуществ в подавлении менопаузальных симптомов, при этом лишено каких-либо значимых побочных эффектов.
Список литературы Анализ работы женской консультации ГБУЗ "Городская поликлиника № 1" за 2020 год
- Prevention of diseases after menopause / R. A. Lobo, S. R. Davis, de Villiers T. J. et al. // Climacteric. 2014. Vol. 17. P. 540-556.
- STRAW + 10 Collaborative Group. Executive summary of the Stages of Reproductive Aging Workshop + 10: addressing the unfinished agenda of staging reproductive aging / S. D. Harlow, M. Gass, J. E. Hall et al. // J Clin Endocrinol Metab. 2012. Vol. 97(4). P. 11591168.
- The effect of the menopausal transition on body composition and cardiometabolic risk factors: a Montreal-Ottawa New Emerging Team group study / J. Abdulnour, E. Doucet, M. Brochu et al. // Menopause. 2012. Vol. 19(7). P. 760-767.
- Reduced energy expenditure and increased inflammation are early events in the development of ovariectomy-induced obesity / N. Rogers, J. W. Perfield, K. J. Strissel et al. // Endocrinology. 2009. Vol. 150(5). P. 2161-2168.
- Physical activity and changes in weight and waist circumference in midlife women: findings from the Study of Women's Health Across the Nation / B. Sternfeld, H. Wang, C. P. Quesenberry et al. // Am J Epidemiol. 2004. Vol. 160(9). P. 912-922.
- Bidirectional association between depression and type 2 diabetes mellitus in women / A. Pan, M. Lucas, Q. Sun et al. // Arch Intern Med. 2010. Vol. 170. P. 1884-1891.
- Dubnov-Raz G., Pines A., Berry E. M. Diet and lifestyle in managing postmenopausal obesity // Climacteric. 2007. Vol. 10 (Suppl 2). P. 38-41.
- A genomewide study of body mass index and its genetic correlation with thromboembolic risk. Results from the GAIT project / J. C. Souto, G. Pena, A. Ziyatdinov et al. // Thromb Haemost. 2014. Vol. 112(5). P. 1036-1043.
- Robinson D., Toozs-Hobson P., Cardozo L. The effect of hormones on the lower urinary tract // Menopause Int. 2013. Vol. 19(4). P. 155-162.
- Baber J., Panay N., Fenton А. The IMS Writing Group 2016 IMS Recommendations on women's midlife health and menopause hormone therapy // Climacteric. 2016. Vol. 19(2). P. 109-150.
- Adult conservative management. In Abrams P, Cardozo L, Khoury S, Wein A, eds. Incontinence / K. Moore, C. Dumoulin, C. Bradley et al. Paris: Health Publications Ltd. 2013. P. 1101-1228.
- De Villiers T. J. Bone health and osteoporosis in postmenopausal women // Best Pract Res Clin Obstet Gynaecol. 2009. Vol. 23. P. 73-85.
- URL: https://www.sheffield.ac.uk/FRAX.
- Two to three years of hormone replacement therapy in healthy women have long-term prevention effects on bone mass and osteoporotic fractures: the PERF study / Y. Z. Bagger, L. B. Tanko, P. Alexandersen et al. // Bone. 2004. Vol. 34. P. 728-731.
- Effect of calcium supplements on risk of myocardial infarction and cardiovascular events: meta-analysis / M. J. Bolland, A. Avenell, J. A. Baron et al. // BMJ. 2010. Vol. 341. P. 3691.
- Maruthur N. M., Wang N.-Y., Appel L. J. Lifestyle interventions reduce coronary artery disease risk. Results from the PREMIER trial // Circulation. 2009. Vol. 119. P. 2026-2031.
- Randomized trial of estrogen plus progestin for secondary prevention of coronary heart disease in postmenopausal women. Heart and Estrogen/progestin Replacement Study (HERS) Research Group / S. Hulley, D. Grady, T. Bush et al. // JAMA. 1998. Vol. 280. P. 605-613.
- Lethbridge-Cejku M., Vickerie J. Summary Health Statistics for U.S. Adults: National Health Interview Survey, 2003 // Vital and Health Statistics. 2005. Vol. 10. P. 225.
- Kim A. S., Johnston S. C. Global variation in the relative burden of stroke and ischemic heart disease // Circulation. 2011. Vol. 124. P. 314-323.
- Risk factors for ischaemic and intracerebral haemorrhagic stroke in 22 countries (the INTERSTROKE study): a case-control study / M. J. O'Donnell, D. Xavier, L. Liu et al. // Lancet. 2010. Vol. 376. P. 112-123.
- Stroke epidemiology: a review of population-based studies of incidence, prevalence, and case-fatality in the late 20th century / V. L. Feigin, C. M. Lawes, D. A. Bennett, C. S. Anderson // Lancet Neurol. 2003. Vol. 2. P. 43-53.
- Transdermal and oral hormone replacement therapy and the risk of stroke: a nested case-control study / C. Renoux, S. Dell'aniello, E. Garbe et al. // BMJ. 2010. Vol. 340. P. 2519.
- Scarabin P. Y. Hormone therapy and venous thromboembolism among postmenopausal women // Front Horm Res. 2014. Vol. 43. P. 21-32.
- Women's Health Initiative Investigators. Estrogen plus progestin and risk of venous thrombosis / M. Cushman, L. H. Kuller, R. Prentice et al. // JAMA. 2004. Vol. 292. P. 15731580.
- Venous thrombosis and conjugated equine estrogen in women without a uterus / J. D. Curb, R. L. Prentice, P. F. Bray et al. // Arch Intern Med. 2006. Vol. 166. P. 772-780.
- Menopausal hormone therapy and health outcomes during the intervention and extended poststopping phases of the Women's Health Initiative randomized trials / J. E. Manson, R. T. Chlebowski, M. L. Stefanick et al. // JAMA. 2013. Vol. 310. P. 1353-1368.
- Lower risk of cardiovascular events in postmenopausal women taking oral estradiol compared with oral conjugated equine estrogens / N. L. Smith, M. Blondon, K. L. Wiggins et al. // JAMA Intern Med. 2014. Vol. 174. P. 25-31.


