Анализ возможности подбора доноров тромбоцитов для пациентов с рефрактерностью
Автор: Гавровская C.В., Кробинец И.И., Бодрова Н.Н., Бессмельцев С.С., Сидоркевич С.В.
Журнал: Вестник гематологии @bulletin-of-hematology
Рубрика: Оригинальные статьи
Статья в выпуске: 2 т.21, 2025 года.
Бесплатный доступ
Развитие иммунной рефрактерности к трансфузиям концентрата тромбоцитов связано с присутствием у реципиента аллоантител к представленным на мембране тромбоцитов донора антигенам систем АВO, Левис, I, i, P, HLA (Human Leukocyte Antigen) класса I и, непосредственно, к тромбоцит-специфичным антигенам HPA (Human Platelet Antigens). Основной причиной отсутствия прироста тромбоцитов в крови и снижения гемостатического эффекта у пациентов с множественными трансфузиями считается наличие HLA-А и/или HLA-В-антител, однако у рефрактерных пациентов встречаются и НРА-антитела. В настоящее время подбор донорских тромбоцитов осуществляется по системе ABO и Rhпринадлежности, антигенный состав тромбоцитов донора и реципиента не учитывается. Вероятность совместимости пары донор/реципиент, выбранных без учета антигенного состава тромбоцитов, невелика, так как частота аллелей большинства генов системы НРА отклоняется в сторону «а» аллеля, а гомозиготы по «b» составляют от 0 до 15%. Возможность подбора пары донор/реципиент с учетом генотипа позволит достичь лечебного эффекта при трансфузиях донорских тромбоцитов и повысит результативность терапии у пациентов с редко встречающимися аллельными вариантами гена HPA.
Тромбоцитопения, рефрактерность, трансфузии тромбоконцентрата, антитромбоцитарные антитела, генотип
Короткий адрес: https://sciup.org/170209409
IDR: 170209409
Текст научной статьи Анализ возможности подбора доноров тромбоцитов для пациентов с рефрактерностью
трансплантации костного мозга предусматривают обязательное использование переливаний концентрата тромбоцитов для коррекции длительной ги-попролиферативной тромбоцитопении, что значительно снижает частоту серьезных геморрагических осложнений [3]. Из-за продолжительности периода недостаточности кроветворения таким пациентам необходимы серийные, множественные трансфузии
[4]. Однако при многократных трансфузиях концентрата тромбоцитов у некоторых пациентов после трансфузии может наблюдаться отсутствие прироста количества циркулирующих тромбоцитов в крови, что ведет к снижению гемостатического эффекта, развитию посттрансфузионных реакций и т. д. Это может оказать неблагоприятное влияние на результат комплексной терапии, так как высок риск развития тяжелого геморрагического синдрома [3, 5].
Состояние, при котором регистрируется отсутствие адекватного прироста уровня тромбоцитов после 2-х или более трансфузий тромбоконцентра-та, называется рефрактерностью. Различают иммунную и неиммунную рефрактерность. Причиной неиммунной рефрактерности может быть спленомегалия, высокая лихорадка, сепсис, ДВС-синдром, кровотечение, веноокклюзивная болезнь печени, РТПХ, применение некоторых фармпрепаратов и т. д. Иммунная рефрактерность развивается вследствие аллоиммунизации. Считается, что главной причиной иммунной рефрактерности у пациентов с множественными трансфузиями тромбоцитов является сенсибилизация антигенами присутствующих в тромбоконцентрате лейкоцитов системы HLA (Human Leukocyte Antigens) донора, отсутствующими у реципиента, и появление иммунных HLA-А и/ или HLA-В-антител. В результате снижается посттрансфузионный прирост числа тромбоцитов и их выживаемость, уменьшается эффективность трансфузий, вплоть до полного отсутствия гемостатического эффекта, что ведет к возникновению угрозы для жизни пациента [6, 7]. Однако, кроме лейкоцитарных антигенов HLA (класса I), эритроцитарных антигенов систем АВO, Левис, I, i, P, на тромбоцитах присутствуют и собственные тромбоцит-специфич-ные антигены HPA (Human Platelet Antigens). На сегодняшний день 35 HPA были идентифицированы и официально утверждены Международным комитетом по номенклатуре иммунологии тромбоцитов Международного общества переливания крови ISBT [8]. Все HPA расположены на гликопротеиновых комплексах GPIIb/IIIa, GPIb/V/IX, GPIa/IIa и CD109 на мембране тромбоцитов [9, 10].
В настоящее время при подборе донорских тромбоцитов антигенный состав тромбоцитов донора и реципиента не учитывается. При многократных трансфузиях выработка аллоантител возможна сразу к нескольким антигенам донора, при этом в процессе гемокомпонентной терапии образование аллоантител происходит не у всех пациентов и зависит от HLA- и HPA- генотипа пациента, иммуногенности антигенов, присутствующих на тромбоцитах донора, наличия в концентрате тромбоцитов мононуклеарных клеток [11, 12]. Также, кроме множественных трансфузий компонентов донорской крови, причиной выработки антитромбоцитарных аллоантител у пациентов могут быть предыдущие беременности (женщина иммунизируется тромбоцитарным антигеном плода, не представленным на ее собственных тромбоцитах), наличие аутоиммунного процесса, онкологические и инфекционные заболевания, генетические факторы [13-15].
Антитела против специфических антигенов тромбоцитов, вызывающие в дальнейшем трансфузионную рефрактерность, встречаются у 20-25% пациентов даже при трансфузиях тромбоцитов, совместимых по антигенам системы HLA [15, 16]. Наиболее клинически значимыми являются анти-HPA-1a, анти-HPA-5b, анти-HPA-3а и анти-HPA-3b антитела. Известно, что частота встречаемости разных аллельных вариантов НРА антигенов в России не отличается от других европейских популяций и отклоняется в сторону «а» аллеля, а гомозиготы по «b» составляют от 0 до 15% [17]. Поэтому вероятность совместимости пациента и донора, выбранного без учета антигенного состава тромбоцитов, невелика. Если в рефрактерности задействованы иммунные механизмы, одним из путей преодоления проблемы и достижения лечебного эффекта является возможность подбора пары донор/реципиент, совместимых по антигенному составу тромбоцитов. Предпочтительным является донор, имеющий наименьшее количество различий с реципиентом по локусам генов HPA.
Цель . Изучить встречаемость редких аллелей генов НРА у доноров ФГБУ РосНИИГТ ФМБА России. Оценить возможность подбора пары донор/реципи-ент, совместимых по тромбоцитарным антигенам.
Материалы и методы. Обследован 471 донор крови ФГБУ РосНИИГТ ФМБА России. В составе группы 139 женщин и 332 мужчины. Медиана возраста составила 43 года. Обследованы 4 пациента (3 женщины и 1 мужчина) с подозрением на рефрактер-ность к трансфузиям тромбоконцентрата. Доноры и пациенты типированы по аллелям локусов HPA1, HPA2, HPA3, HPA4, HPA5, HPA6, HPA9, HPA15 методом полимеразной цепной реакции в реальном времени на анализаторе FluoVista (Inno-Train, Германия), используя набор реактивов HPA-FluoGene (Inno-Train, Германия). Геномную ДНК выделяли с помощью комплекта реагентов «ДНК-сорб-В» (AmpliSens, Россия) из цельной крови, взятой в пробирку с 5% К2ЭДТА. Генотипы пациентов сравнивали с генотипами 471 донора из базы доноров крови, типированных по аллелям локусов HPA, созданной в ФГБУ РосНИИГТ ФМБА России за 2018-2023 г.г. Частота аллелей HPA была подсчитана методом прямого подсчета.
Результаты и обсуждение . Распределение аллелей генов HPA, обнаруженных у обследованных доноров, показано в таблице 1.
Таблица 1
Частота встречаемости аллелей генов HPA у доноров крови ФГБУ РосНИИГТ ФМБА России
|
Локусы HPA |
Частота генотипов, % |
Встречаемость аллеля b, % |
||
|
aa |
ab |
bb |
||
|
HPA1 |
68,4 |
28,7 |
2,9 |
31,6 |
|
HPA2 |
84,9 |
14,9 |
0,2 |
15,1 |
|
HPA3 |
30,1 |
50,7 |
19,2 |
69,9 |
|
HPA4 |
100,0 |
0 |
0 |
0 |
|
HPA5 |
82,6 |
15,5 |
1,9 |
17,4 |
|
HPA6 |
98,9 |
1,1 |
0 |
1,1 |
|
HPA9 |
99,6 |
0,4 |
0 |
0,4 |
|
HPA15 |
28,0 |
52,9 |
19,1 |
71,9 |
По аллелю «а» локуса HPA-4 все обследованные доноры были гомозиготны, аллель «b» не встречался. В локусах HPA-6 и HPA-9 аллель «b» встречался реже всего и обнаружен только у 1,1% и 0,4% соответственно. Полученные данные согласуются с результатами российских и зарубежных авторов, из- учающих частоту встречаемости аллелей генов HPA среди белых европейцев.
Распределение аллелей генов HPA, обнаруженных у обследованных пациентов с подозрением на рефрактерность, показано в таблице 2.
Таблица 2
Распределение аллелей генов HPA у обследованных пациентов
|
Обследуемые |
Обнаруженные аллели генов HPA |
|||||||
|
HPA1 |
HPA2 |
HPA3 |
HPA4 |
HPA5 |
HPA6 |
HPA9 |
HPA15 |
|
|
Пациентка Б. |
аb |
аа |
bb |
аа |
аb |
аа |
аа |
аb |
|
Пациентка С. |
аb |
аа |
аа |
аа |
аа |
аа |
аа |
bb |
|
Пациент Б. |
аa |
аа |
aa |
аа |
аа |
аа |
аа |
aa |
|
Пациентка Л. |
аb |
аа |
bb |
аа |
аа |
аа |
аа |
ab |
В результате сравнительного анализа генотипов доноров базы и генотипов обследованных пациентов с учетом групповой принадлежности по АВО и Rh были выбраны доноры, совместимые с реципиентами по антигенному составу тромбоцитов.
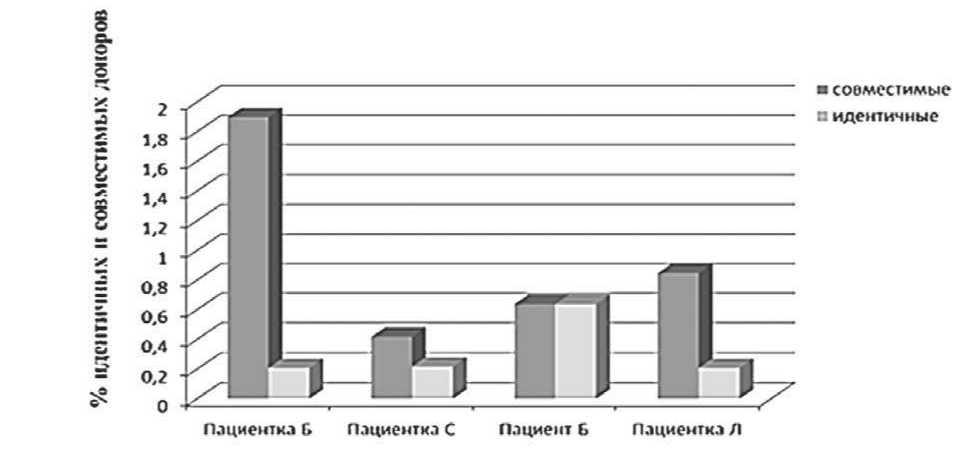
На рисунке 1 в процентном соотношении показано количество подходящих по генотипу доноров из базы ФГБУ РосНИИГТ ФМБА России.
Как видно из рисунка 1, % совместимых доноров весьма невысок. Количество идентичных по исследуемым антигенам доноров составило 0,21 – 0,64 %, совместимых – от 0,42 до 1,9 %.
Клинический случай
Пациентка Б. (диагноз: идиопатическая тромбоцитопеническая пурпура), 68 лет, группа крови A(II) Rh+, фенотип ссееК-, рефрактерная к трансфузиям тромбоконцентрата. У пациентки были обнаружены аллели HPA-1а/b, HPA-2а/а, HPA-3b/b, HPA-4 а/а,
HPA-5а/b, HPA-6а/а, HPA-9а/а, HPA-15а/в. Пациентка гомозиготна по аллелю «b» локуса HPA-3, что значительно сокращает возможность подбора, так как встречаемость генотипа HPA-3b/b у белой расы составляет около 19% [18, 19]. В имеющейся базе доноров встречаемость такого генотипа – 19,2%. В результате сравнения обнаруженных у пациентки локусов генов HPA с данными доноров базы с учетом АВО и резусной принадлежности совместимость по антигенному составу тромбоцитов в паре донор/ре-ципиент обнаружена в 8 случаях (1,7%), а полное совпадение определяемых локусов обнаружено только у 1 донора (0,2%). Результаты генотипирования пациентки и совместимых доноров представлены в таблице 3.
Паиисшы
Рисунок 1. Количество доноров (%), идентичных (светло-серый цвет, вторые столбики) и совместимых (темно-серый цвет, первые столбики) с реципиентами по исследованным антигенам HPA.
Таблица 3
Генотипы пациентки и доноров тромбоцитов , совместимых по обнаруженным аллелям локусов HPA1, 2, 3, 4, 5, 6, 9, 15.
|
Обследуемые |
Обнаруженные аллели генов HPA |
|||||||
|
HPA 1 |
HPA 2 |
HPA 3 |
HPA 4 |
HPA 5 |
HPA 6 |
HPA 9 |
HPA 15 |
|
|
Пациентка |
ab |
аа |
bb |
аа |
ab |
аа |
аа |
ab |
|
Донор 1 (идентичный) |
ab |
аа |
bb |
аа |
аb |
аа |
аа |
ab |
|
Донор 2 |
ab |
аа |
bb |
аа |
аа |
аа |
аа |
ab |
|
Донор 3 |
аа |
аа |
bb |
аа |
аа |
аа |
аа |
аа |
|
Донор 4 |
аа |
аа |
bb |
аа |
bb |
аа |
аа |
ab |
|
Донор 5 |
аа |
аа |
bb |
аа |
аа |
аа |
аа |
ab |
|
Донор 6 |
аа |
аа |
bb |
аа |
аа |
аа |
аа |
bb |
|
Донор 7 |
ab |
аа |
bb |
аа |
аа |
аа |
аа |
аа |
|
Донор 8 |
аа |
аа |
bb |
аа |
аа |
аа |
аа |
ab |
|
Донор 9 |
ab |
аа |
bb |
аа |
ab |
аа |
аа |
ab |
В данном случае удалось подобрать самое большое количество подходящих для пациентки доноров тромбоцитов – 9 (1,9%). Для остальных 3-х пациентов подходящих доноров оказалось меньше: 2, 3 и 4 соответственно.
В настоящее время в отделениях переливания крови (ОПК) медицинских учреждений тромбоциты заготавливаются строго по заявке, так как срок их хранения составляет не более 5 суток. Для приготовления терапевтической дозы концентрата тромбоцитов (для взрослого реципиента) методом цитафереза требуется 1 человек (донор), из дозы крови – 4. В вышеприведенном примере для получения у пациентки клинического эффекта от транс- фузионной терапии необходимо организовать до-нацию хотя бы от одного из 9 доноров. Вероятность этого может быть стремительно снижена в первую очередь несовместимостью пары донор/реципиент по антигенам системы HLA, а также объективными обстоятельствами: недоступностью донора в связи с местонахождением в данный момент, заболеванием или беременностью (если донор – женщина), необходимостью соблюсти интервал между дона-циями, временным или постоянным отводом от донорства по медицинским показаниям и т.д. Решением проблемы может быть внедрение типирования доноров тромбоцитов в ОПК лечебных учреждений и на станциях переливания крови и внесение ре- зультатов в имеющиеся донорские базы, регистры и т.д. К сожалению, возможности ограничиваются немалой стоимостью реактивов и оборудования для молекулярно-генетических исследований, однако значимость таких мероприятий для охраны здоровья населения не вызывает сомнений и заслуживает внимания.
Выводы
-
1. Проанализирована встречаемость редких аллелей генов НРА у доноров ФГБУ РосНИИГТ ФМБА России.
-
2. Проанализирована возможность подбора пары донор/реципиент с учетом антигенного состава тромбоцитов, используя имеющуюся базу доноров. Для 4 пациентов с гематологическими заболеваниями совместимыми оказались всего от 0,42 до 1,9 % доноров. Учитывая естественную убыль доноров базы (переехал, заболел и т.д.), подходящих доноров тромбоцитов может оказаться еще меньше.
-
3. Необходима дальнейшая работа по расширению базы типированных доноров, что позволит подбирать донорские тромбоциты для реципиентов с рефрактерностью.


