Анапластические эпендимомы детей: есть ли прогресс в результатах лечения? Обзор литературы и собственные данные
Автор: Шевцов А.И., Пархоменко Р.А., Харченко Н.В., Щербенко О.И., Антоненко Ф.Ф., Регентова О.С., Зелинская Н.И., Крянев А.М., Сорокин А.С.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Лучевая терапия
Статья в выпуске: 4 т.21, 2021 года.
Бесплатный доступ
Вопрос о влиянии методики облучения на эффективность лечения при анапластических эпендимомах у детей и подростков остается мало изученным. Нами проанализирована общая выживаемость 150 таких пациентов, из них 25 получили исходную лучевую терапию (ЛТ) по конвенциональной методике, 94 - по конформной методике, у остальных ЛТ была отсрочена по различным причинам до возникновения рецидивов. Проведены однофакторный и многофакторный анализ различных причин успеха и неудач противоопухолевого лечения. На риск развития рецидивов анапластических эпендимом существенное влияние оказывали два фактора первичного лечения: радикальность операции и методика ЛТ. По данным многофакторного анализа у пациентов, получавших конвенциональную ЛТ, либо исходно не получавших лучевую терапию, риск рецидива был в 1,7 раз выше, чем у больных после конформного лечения на линейном ускорителе ( Р = 0,003). Нами построена модель статистического предсказания рецидивов на основании ряда факторов, с чувствительностью 75% и специфичностью 70%.
Анапластическая эпендимома, дети, подростки, лучевая терапия, конформная, конвенциональная, общая выживаемость
Короткий адрес: https://sciup.org/149139205
IDR: 149139205
Текст научной статьи Анапластические эпендимомы детей: есть ли прогресс в результатах лечения? Обзор литературы и собственные данные
Опухоли центральной нервной системы – самые частые солидные новообразования у детей в возрасте от 0 до 14 лет. Примерно 6%–12% из них - это эпендимомы, они занимают третье место по частоте после астроцитом и медуллобластом. У детей до 3 лет около 30% всех опухолей ЦНС – это эпендимомы [1 – 4].
Общая 5-летняя выживаемость у детей с эпендимомами зависит от возраста: у детей до 1 года она близка к 42%, в возрасте 1–4 года повышается до 55%, у старших детей и подростков этот показатель уже находится на уровне 75%. Независимо от степени злокачественности, при всех эпендимомах не исключается риск метастазирования и рецидива [4, 5].
Анапластические эпендимомы (АЭ) – это эпендимарные опухоли III степени злокачественности, характеризующиеся признаками активного роста, клеточной анаплазией, повышенной склонностью к метастазированию. Частота АЭ является самой высокой среди детей младшего возраста (от 0 до 4 лет) – 4,3 случая на 1000000. Среди всех эпендимом в этой возрастной группе АЭ составляют примерно ½ (48%), в старших возрастных группах их доля ниже: 40% у 5–9-летних, 30% в возрасте 10–14 лет и 25% у 15–19-летних. В общей популяции больных (взрослых и детей) риск смерти при АЭ в 2 раза выше, чем при других типах эпендимом [6]. При АЭ наблюдается высокая частота рецидивов (до 50–65%), которые являются основной причиной смертности у данного контингента больных [1, 7 – 9]. Поэтому актуальным остается вопрос об оптимизации программ терапии, как первичной (после постановки диагноза АЭ), направленной на максимально возможное снижение риска прогрессирования или рецидива, так и повторной, при наступлении этих событий. Сложность данной проблемы усугубляется недостаточно изученной эффективностью различных методик лучевой терапии (ЛТ) при данной патологии.
Установлено, что достоверными неблагоприятными факторами при эпендимомах являются: возраст (младше 7 лет на момент постановки диагноза), локализация (прогноз при интракраниальной локализации хуже, чем при спинальной), высокая степень анаплазии, субтотальная резекция опухоли (объем остаточной опухоли более 1,5 см3), нерадикальные суммарные дозы лучевой терапии, экспрессия белка p53, высокий индекс пролиферативной активности Ki67, увеличение копийности участка хромосомы 1q25, наличие мутации RELA fusion и YAP1 . Безусловно, радикальность хирургического удаления опухоли – важнейший фактор, влияющий на результат лечения эпендимом, однако без адъювантной ЛТ при АЭ пока обойтись не представляется возможным [1, 7, 10 –14].
За последние десятилетия произошел ряд существенных усовершенствований ЛТ: гамма-аппараты в значительной степени уступили место линейным ускорителям и, в некоторых клиниках, протонным установкам; плоскостное планирование сменилось 3D планированием; появилась возможность перед каждой лечебной укладкой выполнять визуализацию (для проверки правильности положения пациента); широкое распространение получили фиксирующие устройства; внедрено анестезиологическое пособие для облучения детей младше 3-х лет. Все эти изменения послужили основой для разработки и широкого применения конформной лучевой терапии, которая предусматривает более точное облучение, чем более простые, так называемые конвенциональные методики. Сам термин «конформная ЛТ» означает, что используются все современные возможности визуализации и формирования пучка излучения, чтобы максимально учесть индивидуальную для каждого больного конфигурацию опухоли. Конформная ЛТ не только обеспечивает более прецизионное облучение самой опухоли, но и позволяет снижать дозы на окружающие здоровые ткани, что особенно важно для детей. Достижение этих целей при конвенциональных методиках значительно ограничено. Однако недостатком аппаратуры для конформного облучения является ее высокая стоимость, многократно превышающая стоимость гамма-аппаратов 20-го века, сложность эксплуатации и необходимость наличия высококвалифицированных техников и дозиметристов. В настоящее время использование современной лучевой терапии относится к категории наиболее затратных методов лечения рака. В то же время принципы, механизмы и биологическая эффективность действия излучения как гамма-аппаратов, так и тормозного излучения ускорителей, одинаковы и остаются такими же, как и на заре появления метода лечения рака ионизирующим излучением. В условиях ограниченных материальных ресурсов здравоохранения правомочно поставить вопрос: имеется ли существенная разница в окончательном результате лечения больного на гамма-аппарате или простейшем ускорителе по сравнению с современными ускорительными комплексами, и оправдывается ли все более растущая стоимость лечения при помощи все более дорогостоящей аппаратуры [15-19]?
Как уже было отмечено выше, конформное облучение в настоящее время проводится главным образом на линейных ускорителях и протонных установках, но оно возможно также и на аппаратах для дистанционной лучевой терапии с источниками Со-60 [20, 21].
Вместе с тем, по нашим данным, пока недостаточно публикаций в отечественной и мировой литературе, которые бы отражали, насколько реально, а не гипотетически, повышается эффективность при АЭ у детей при переходе от конвенциональных к конформным методикам ЛТ (в отношении как контроля опухоли, так и ближайших и отдаленных осложнений). Изучение роли этого фактора и явилось задачей настоящего исследования.
Материалы и методы
В детском онкологическом отделении радиотерапии РНЦРР проходили лечение и наблюдались 150 пациентов с диагнозом АЭ головного мозга в период с 1993 по 2018 год. У всех больных диагноз АЭ основывался на данных жалоб, анамнеза, клиникоинструментального обследования (включая данные КТ и/или МРТ) и морфологического изучения материала, полученного при удалении опухоли. Средний возраст в группе составлял 5,7 лет (стандартная ошибка ± 5,4).
Лучевая терапия проводилась на двух видах аппаратов: гамма- излучением на гамма-аппаратах “Агат”, “Рокус АМ” и “Алтай” и фотонами на линейных ускорителях “Philips SL-75-5” одноименного производителя, а также Clinac 2100, Unique и True Beam фирмы Varian. Всем пациентам перед началом ЛТ на линейном ускорителе для повышения точности укладок проводилось изготовление индивидуального фиксирующего устройства (маски из термопластического материала – Рис. 1), а при проведении ЛТ на гамма-аппарате таких фиксирующих устройств не применяли.
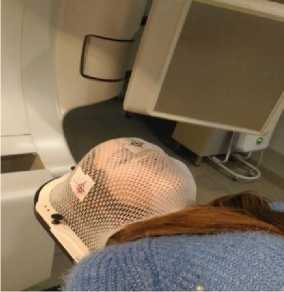
Рис. 1 Расположение пациента на лечебном столе линейного ускорителя в индивидуальной фиксирующей маске.
При осуществлении конформной ЛТ проводилась трехмерная КТ-топометрия на аппарате Toshiba, Asteion 4, либо Siemens, при этом пациент находился в фиксирующем устройстве. Для планирования конвенциональной ЛТ применялись рентген-топометрия на симуляторе "Legends" и КТ-скан по центру предполагаемого поля облучения. Физико-дозиметрический расчет проводился с помощью планирующих систем совместно с медицинскими физиками. Планирование осуществлялось по программам “Тонкий Луч” и “Поле” – для гамма-аппаратов и “Oncentra”, “MasterPlan” и “Eclipse” – для линейных ускорителей. В случае объемного планирования суммарная очаговая доза подсчитывалась в среднем по PTV (100% изодоза). При плоскостном планировании доза задавалась на центр облучаемого объема.
При конформном облучении для контроля положения тела пациента на лечебном столе проводилась визуализация мишени. Она осуществлялась перед первым сеансом ЛТ, а также в процессе лечения не реже чем 1 раз в неделю, при КСО – не реже 2 раз в неделю. Для этих целей использовались двухмерные изображения типа гаммаграмм с использованием киловольтного пучка, либо трехмерное изображение, получаемое при обороте вокруг больного конического пучка фотонов лечебной установки (по типу конусно-лучевой компьютерной томографии), при этом изображение выводилось на экран в пультовую комнату для возможной коррекции положения пациента относительно данных первичной КТ-топометрии. Расположение поля облучения при конвенциональном облучении осуществлялось по анатомическим ориентирам и по меткам, нанесенным на кожу при рентгеновской топометрии.
С 2017 года пациентам младшего возраста изготовление индивидуального фиксирующего устройства, КТ-топометрия и в дальнейшем ЛТ проводились под анестезиологическим пособием. Применялся общий ингаляционный масочный наркоз севофлураном. Дозировка рассчитывалась индивидуально в зависимости от возраста, антропометрических данных ребенка и также длительности лечебной укладки. Всего наркоз проводился 5 пациентам – все они были младше 3-х лет.
При первичном (исходном) лечении конвенциональное облучение прошли 25 пациентов, конформную лучевую терапию получили 94 больных. Оставшиеся пациенты (n=31) в качестве первичного лечения ЛТ не получали, большинство – из-за возраста (младше 3 лет); решение о проведении ЛТ в этой возрастной категории принималось индивидуально детским онкологом совместно с радиотерапевтом; у 8 из них исходно операция была дополнена химиотерапией по протоколу HIT. Следует отметить, что у больных, первично не получавших лучевую терапию, впоследствии при рецидивах проводилось облучение, причем у 16 из них – конформное. Данные лечения в этой группе (n=31) были использованы в дальнейшем при многофакторном анализе и построении прогностической модели.
Статистические методы
Для сравнения групп по частоте различных явлений, а также выявления взаимосвязи между факторами риска и исходом выводились таблицы сопряжённости, наличие связи оценивалось с помощью теста независимости «хи-квадрат» Пирсона и точного критерия Фишера, а также z-критерия равенства долей. Результаты описательной статистики представлены в виде M±σ, где M – средняя арифметическая величина, σ – стандартное отклонение. Данные с распределением, отличным от нормального, представлены в формате
Me (Q1, Q3) и Me (RQ), где Ме - медиана, Q1, Q3 - верхний и нижний квартили, RQ -межквартильный размах. Критический уровень значимости для принятия достоверных различий был принят P < 0,05. Критерием сравнения эффективности указанных методик ЛТ служила общая выживаемость.
Результаты
По данным однофакторного анализа, при проведении конвенционального облучения (25 пациентов) общая выживаемость составила 32%, при конформной лучевой терапии (94 пациента) этот показатель оказался существенно выше - 78,7%, Р = 0,02.
Для проверки указанного выявленного различия в эффективности этих двух методик облучения проведен многофакторный анализ. По его результатам, у пациентов, получавших конвенциональную ЛТ, либо не получавших лучевую терапию при первичном лечении, риск рецидива оказался в 1,7 раз выше, чем у больных, проходивших конформную ЛТ ( Р = 0,003), значимость коэффициента 4,4 (доверительный 95% интервал от 1,9 до 10,3).
Кроме методики лучевой терапии важным прогностическим фактором оказалась степень радикальности хирургического лечения ( Р = 0,001). При этом не явились значимыми факторами прогноза: пол ( Р = 0,35), принадлежность к определенной возрастной группе ( Р > 0,171), локализация первичной опухоли ( Р = 0,160), проведение химиотерапии ( Р = 0,144).
В результате была построена модель с пошаговым алгоритмом исключения на основе критерия изменения функции правдоподобия; одним из факторов в данной модели явилась методика лучевой терапии. Оказалось, что разработанная нами модель предсказывает верно 73,3% случаев рецидивов, что отражено в таблице №1. При этом чувствительность модели равнялась 75%, а ее специфичность 70%.
Согласно графику на Рис. 2, площадь под кривой составила 0,73 (доверительный интервал от 0,64 до 0,817), что соответствует хорошему качеству, индекс Джинин - 0,460, статистика Колмогорова-Смирнова равняется 0,45, максимальное значение статистики Колмогорова-Смирнова в точке 0,64, что показано на рисунке 3.
Таблица №1. Процентная доля предсказаний по многофакторной модели.
|
Предсказанные рецидивы |
Процент правильных предсказаний |
|||
|
нет |
да |
|||
|
Наблюдавшиеся рецидивы |
нет |
35 |
15 |
70,0 |
|
да |
25 |
75 |
75,0 |
|
|
Общая процентная доля |
73,3 |
|||
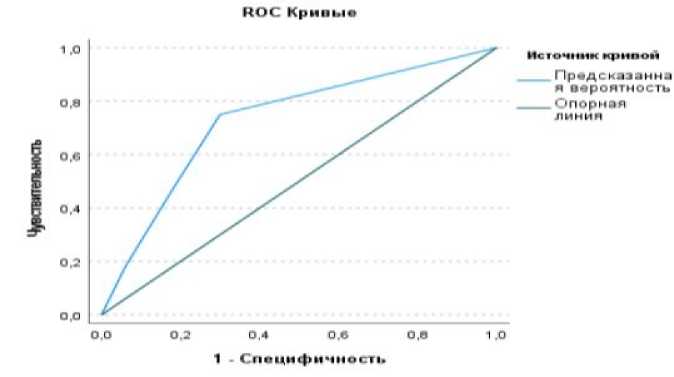
Рис. 2. ROC кривые предсказанной вероятности рецидива.
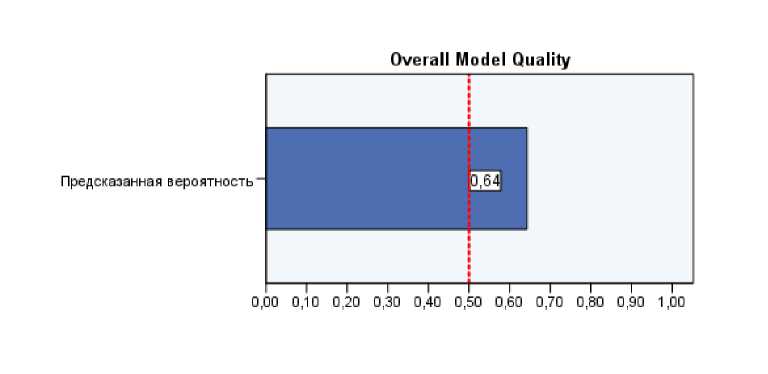
Рис. 3. Статистка Колмогорова-Смирнова для предсказания вероятности рецидива.
Статистка Колмогорова-Смирнова для нашей модели считается хорошей, так как имеет значение больше 0.5. Согласно нашей прогностической модели, значение более 0,64 означает, что рецидив будет.
Обсуждение
Вопрос о результативности технического перевооружения ЛТ остается до сих пор несколько «на заднем плане» по сравнению с другими задачами онкологии. Тем не менее, на наш взгляд, этот вопрос далеко не праздный. Высока ли вероятность, что и старые, конвенциональные методики обеспечивали вполне высокий уровень эффективности лечения, при этом являясь существенно более дешевыми, чем конформная ЛТ? Мы полагаем, что данные нашего исследования могут служить еще одним аргументом в пользу применения конформных методик.
В настоящей работе мы изучили лишь один показатель как критерий эффективности лечения – общую выживаемость. Что касается влияния методики ЛТ на частоту осложнений, нам пока не удалось выявить существенных отличий в их частоте по результатам применения различных методик ЛТ, очевидно эта проблема требует дальнейших исследований. К методическим ограничениям нашей работы можно отнести ее ретроспективный характер, однако этот недостаток, как нам представляется, удалось сгладить применением многофакторного анализа.
Аналогичных исследований в отношении ЛТ при АЭ у детей в доступной нам литературе мы не нашли. Однако есть работы по сравнению эффективности конформных и конвенциональных методик ЛТ при других опухолях. В области детской онкологии их немного.
В рандомизированном исследовании 200 детей и взрослых в возрасте до 25 лет с опухолями головного мозга (доброкачественными или низкой степени злокачественности, включая 12 случаев эпендимом) была показана меньшая частота эндокринных и нейрокогнитивных осложнений после конформной, по сравнению с конвенциональной, ЛТ, без снижения противоопухолевой эффективности [22, 23].
При обследовании 15 детей с опухолями ствола головного мозга не было выявлено влияния методики облучения (конвенционального, либо конформного) на их общую выживаемость [24]. К результатам этой работы все же следует отнестись с осторожностью из-за малого числа исследованных больных, а также в связи с крайне неблагоприятным прогнозом при данной локализации опухоли.
На примере глиом головного мозга у взрослых продемонстрировано, что конформная ЛТ, в сравнении с конвенциональной ЛТ, увеличивала медиану общей выживаемости на 2 месяца, 1-летнюю и 2-х летнюю общую выживаемость – на 13% и 9%, соответственно ( Р < 0,05) [25].
По литературным данным конформная ЛТ, по сравнению с конвенциональными методиками, дает преимущества (в отношении повышения выживаемости и/или снижения частоты осложнений) при раке простаты, злокачественных опухолях печени, раке шейки матки, легкого, глотки [26]. Имеются данные о снижении частоты острых лучевых реакций при применении новых технологий ЛТ (включая IMRT) и при лимфоме Ходжкина [27].
Таким образом, в нашем ретроспективном исследовании показана несколько более высокая эффективность конформной ЛТ по сравнению с конвенциональным облучением при АЭ головного мозга у детей, что согласуется с данными исследований по лечению других опухолей. Дальнейший прогресс в этой области нам видится в совершенствовании конформной ЛТ, с особым вниманием к снижению частоты осложнений ЛТ.
Список литературы Анапластические эпендимомы детей: есть ли прогресс в результатах лечения? Обзор литературы и собственные данные
- Полушкина О.Б., Желудкова О.Г. Современное представление об эпендимомах у детей: эпидемиология, диагностика, лечение. Педиатрия. 2007. Т. 86. № 3. C. 132-135.
- Kilday J.P., Rahman R., Dyer S., et al. Pediatric ependymoma: biological perspectives. Mol Cancer Res. 2009. V. 7. No. 6. P. 765-786. DOI: 10.1158/1541-7786.MCR-08-0584.
- Ostrom Q.T., Gittleman H., Liao P., et al. CBTRUS statistical report: primary brain and central nervous system tumors diagnosed in the United States in 2007-2011. Neuro Oncol. 2014. V. 16. Suppl. 4. P. iv1-iv63. DOI: 10.1093/neuonc/nou223.
- Папуша Л.И., Кумирова Э.В., Озеров С.С. и др. Клинические рекомендации. Злокачественные новообразования головного мозга. Возрастная группа: дети. 2020. 63 с.
- Godfraind C., Kaczmarska J.M., Kocak M., et al. Distinct disease-risk groups in pediatric supratentorial and posterior fossa ependymomas. Acta Neuropathol. 2012. V. 124. No. 2. P. 247-257. DOI: 10.1007/s00401-012-0981-9.
- Achey R.L., Vo S., Cioffi G., et al. Ependymoma, NOS and anaplastic ependymoma incidence and survival in the United States varies widely by patient and clinical characteristics. 2000-2016. Neurooncol Pract. 2020. V. 7. No. 5. P. 549-558. DOI: 10.1093/nop/npaa023.
- Трунин Ю.Ю. Эпендимомы головного мозга у детей (результаты лечения и факторы, влияющие на прогноз). Дисс. ... канд. мед. наук: 14.00.28. Нейрохирургия, 14.00.19. Лучевая диагностика, лучевая терапия. Научно-исследовательский институт нейрохирургии им. академика Н.Н. Бурденко. М. 2008. 165 с.
- Hübner J.M., Kool M., Pfister S.M., Pajtler K.W. Epidemiology, molecular classification and WHO grading of ependymoma. J Neurosurg Sci. 2018. V. 62. No. 1. P. 46-50. DOI: 10.23736/S0390-5616.17.04152-2.
- De B., Khakoo Y., Souweidane M.M., et al. Patterns of relapse for children with localized intracranial ependymoma. J Neurooncol. 2018. V. 138. No. 2. P. 435-445. DOI: 10.1007/s11060-018-2815-7.
- Wani K., Armstrong T.S., Vera-Bolanos E., et al. A prognostic gene expression signature in infratentorial ependymoma. Acta Neuropathol. 2012. V. 123. No. 5. P. 727-738. DOI: 10.1007/s00401-012-0941-4.
- Massimino M., Barretta F., Modena P. Pediatric intracranial ependymoma: correlating signs and symptoms at recurrence with outcome in the second prospective AIEOP protocol follow-up. J Neurooncol. 2018. V. 140. No. 2. P. 457-465. DOI: 10.1007/s11060-018-2974-6.
- Vaidya K., Smee R., Williams J.R. Prognostic factors and treatment options for paediatricependymomas. J Clin Neurosci. 2012. V. 19. No. 9. P 1228-1235. DOI: 10.1016/j.jocn.2012.02.006.
- Щербенко О.И. Эпендимомы головного мозга у детей. Современное состояние вопроса. Вестник РНЦРР. 2012. Т. 12. Адрес доступа http://vestnik.rncrr.ru/vestnik/v12/papers/sherb_v12.htm (дата доступа 15.12.2021).
- Ким А.В. Рецидив нейроэпителиальных опухолей головного мозга у детей. Автореф. дисс. ... д.м.н.: 14.01.18. Нейрохирургия. «Российский научно-исследовательский нейрохирургический институт им. проф. А.Л. Поленова» – филиал ФГБУ «Национальный медицинский исследовательский центр им. В.А. Алмазова» Министерства здравоохранения Российской Федерации. СПб. 2021. 42 с.
- Виноградов В.М. Перспективные методики лучевой терапии. Практическая онкология. 2007. Т. 8. № 4. C. 194-203.
- Михайлов A.B., Смирнова Е.В., Воробьев H.A. Дистанционная лучевая терапия: современные возможности. ONCOLOGY.RU. 2007. Адрес доступа http://www.oncology.ru/specialist/treatment/high_technology/nuclear_medicine/001/ (дата доступа 15.12.2021).
- Трофимова О.П., Ткачев С.И., Юрьева Т.В. Прошлое и настоящее лучевой терапии в онкологии. Клиническая онкогематология. 2013. Т. 6. № 4. C. 355-364.
- Белова В.П., Глеков И.В., Григоренко В.А. и др. Конформная лучевая терапия в детской онкологии. Онкопедиатрия. 2015. Т. 2. № 1. С. 54-60.
- Трунин Ю.Ю. Стереотаксическое облучение в комплексном лечении пациентов с пилоиднымиастроцитомами. Автореф. дисс.…. д.м.н.: 14.01.18. Нейрохирургия. Научно-исследовательский институт нейрохирургии им. академика Н.Н. Бурденко. М. 2021. 42 с.
- Xu L., Romesberg M., Bhat S. SU-GG-T-602: Cobalt-60 Based 3-D Conformal Radiotherapy Using an MLC and Corvus Treatment Planning System. Medical Physics. 2010. V. 37. No. 6. Article ID 3326. DOI:10.1118/1.3469003. DOI:10.1118/1.3469003.
- Langhans M., Echner G., Runz A., et al. Development, physical properties and clinical applicability of a mechanical Multileaf Collimator for the use in Cobalt-60 radiotherapy. Phys. Med. Biol. 2015. V. 60. P. 3375-3387. DOI: 10.1088/0031-9155/60/8/3375.
- Jalali R., Gupta T., Goda J.S., et al. Efficacy of Stereotactic Conformal Radiotherapy vs Conventional Radiotherapy on Benign and Low-Grade Brain Tumors: A Randomized Clinical Trial. JAMA Oncol. 2017. V. 3. No. 10. P. 1368-1376. DOI: 10.1001/jamaoncol.2017.0997.
- Chatterjee A., Goda J.S., Gupta T., et al. A randomized trial of stereotactic versus conventional radiotherapy in young patients with low-grade brain tumors: occupational therapy-based neurocognitive data. Neurooncol Adv. 2020. V. 2. No. 1. Article ID vdaa130. DOI: 10.1093/noajnl/vdaa130.
- Rasool M.T., Dar I.A., Banday S.Z., et al. Modality of Radiotherapy and Overall Survival in Pediatric Diffuse Brainstem Gliomas: Implications for Resource-Constrained Settings. Journal of Tropical Pediatrics. 2021. V. 67. No. 1. Article ID fmaa105. DOI: 10.1093/tropej/fmaa105.
- Пименова М.М. Оптимизация варианта лучевой терапии в комплексном лечении злокачественных глиом головного мозга с учетом лучевых повреждений. Автореф. дисс…. к.м.н.: 14.01.13. Лучевая диагностика, лучевая терапия. ФГБОУ ВО «Южно-Уральский государственный медицинский университет». М. 2017. 24.
- Сарсенбаева Г.Е. Конформная терапия в онкологии: возможности и перспективы. Вестник АГИУВ. 2015. №3-4. С. 56-58.
- Виноградова Ю.Н., Иванова Е.И., Чумаченко А.И. и др. Конвенциональная и конформная лучевая терапия с модуляцией пучка по интенсивности и без таковой при лимфоме Ходжкина II стадии с поражениями выше диафрагмы. Клиническая онкогематология. 2018. Т. 11. № 1. C. 70-77.


