Антиагрегантная терапия парвовирусного энтерита у собак в возрасте от 2 до 6 месяцев
Автор: Баруздина Елена Сергеевна
Журнал: Молочнохозяйственный вестник @vestnik-molochnoe
Рубрика: Сельскохозяйственные и ветеринарные науки
Статья в выпуске: 4 (40), 2020 года.
Бесплатный доступ
В работе представлены результаты применения антиагрегантной терапии при парвовирусном энтерите у собак в возрасте от 2 до 6 месяцев. Включение пентоксифиллина и реополиглюкина в схему лечения парвовирусного энтерита у собак позволяет сохранить уровень лимфоцитов на 3-й (39,21±5,08%) и 5-й дни болезни (32,91±1,39%), количество гемоглобина (137,62±13,17г/л), тромбоцитов (352,7±25,41 х109/л) и тромбокрит (0,38±0,03%) на 5-й день болезни на уровне контрольных цифр; приводит к снижению агрегационных свойств тромбоцитов, которое проявляется уменьшением СИАТ со всеми индукторами (50,12±8,3 % с АДФ, 66,71±12,37 % с коллагеном и 71±11,5 % с ристомицином на 3-й день и 45,35±15,83 % с АДФ, 58,29±16,32 % с коллагеном и 53,12±9,35 % с ристомицином на 5-й день) и замедлением СА с ристомицином до 0,025±0,006 мин на 5-й день болезни. Все вышеперечисленное позволяет снизить смертность на 20% относительно группы с базовой схемой лечения.
Собаки, тромбоциты, гемостаз, парвовирусный энтерит, антиагрегантная терапия
Короткий адрес: https://sciup.org/149126895
IDR: 149126895 | УДК: 619:616-07:636.7
Текст научной статьи Антиагрегантная терапия парвовирусного энтерита у собак в возрасте от 2 до 6 месяцев
Актуальность
Парвовирусная инфекция плотоядных вызывается ДНК-содержащим вирусом, широко распространена и вызывает тяжелое, угрожающее жизни состояние [1, 2, 3, 4]. Наиболее восприимчивы собаки в возрасте от 2 месяцев до 1 года [2, 4, 5] Летальность зависит от возраста животного и тяжести течения болезни. У молодых животных она колеблется от 5 до 100%, а у взрослых собак не превышает 1% [5].
Парвовирусная инфекция собак у щенков в возрасте от 2 до 6 месяцев клинически проявляется наиболее тяжело, при этом на третий день болезни уменьшается количество тромбоцитов и индекс дезагрегации тромбоцитов под действием ристо-мицина, что говорит о высокой активности сосудистого компонента и образовании более прочных агрегатов. На пятый день болезни происходит прогрессирующее уменьшение количества тромбоцитов вместе с понижением тромбокрита и повышением объема тромбоцита, уменьшается дезагрегация тромбоцитов под действием коллагена и ристомицина, что является признаком повышения функциональной активности тромбоцитов, а в частности, ее сосудистого компонента. Возможно это связано с тем, что клетки – предшественники тромбоцитов в костном мозге у собак в возрасте младше 6 месяцев более уязвимы для парвовируса. [6, 7].
Медицинские исследования показывают, что в период вирусемии выделяются биологически активные вещества, которые способствуют повышению проницаемости сосудов микроциркуляторного русла и приводят к расширению микрососудов. Среди патологических изменений в системе микроциркуляции особого внимания заслуживают внутрисосудистые расстройства, так как именно они приводят к ухудшению кровоснабжения жизненно важных органов, развитию ишемических и некротических процессов. Если в физиологических условиях тромбоциты могут играть защитную роль в отношении эндотелия, то во время вирусных инфекций они способствуют еще большему повреждению сосудистой стенки. В экспериментах на животных показано, что тромбоцитарные агрегаты, появляясь в микроцир-куляторном русле, способны повреждать нормальную сосудистую стенку, вызывая тем самым развитие васкулита [7, 8, 9].
Такие патоморфологические признаки, как обширные участки некроза в кишечнике, серозно-геморрагический лимфаденит с мелкоточечными кровоизлияниями, геморрагические инфаркты в селезенке у 3 щенков, серозно-геморрагический перикардит с участком некроза миокарда около 2 см в диаметре у 1 щенка, отек легких с крупноточечными кровоизлияниями под плеврой у 12 щенков, выявленные В.И. Балабановой при вскрытии 25 щенков, погибших от парвовирусной инфекции, ярко иллюстрируют наличие гемореологических нарушений [5, 7].
При инфекционных заболеваниях внутрисосудистое свертывание возникает под воздействием эндотоксинов, комплексов антиген-антитело, а также в результате непосредственного повреждения эндотелия сосудов инфекционными агентами [8, 9], однако исследований по фармакологической коррекции нарушений гемостаза при парвовирусном энтерите плотоядных мы не обнаружили ни в одном из доступных источников информации.
Поэтому целью нашей работы стало исследование возможности применения антиагрегантной терапии при парвовирусном энтерите у собак в возрасте от 2 до 6 месяцев.
Антиагреганты – вещества, действующие на сосудисто-тромбоцитарное звено системы гемостаза, но некоторые препараты этой группы (ацетилсалициловая кислота, клопидогрел) негативно действуют на слизистую оболочку желудочно- кишечного тракта [10], поэтому препаратом выбора стал пентоксифиллин. Он ингибирует фосфодиэстеразу, стабилизирует цАМФ и снижает концентрацию внутриклеточного кальция, блокирует АДФ рецепторы, за счет чего тормозит агрегацию тромбоцитов, повышает их устойчивость к деформации, подавляет тромбообра-зование и нормализует микроциркуляцию, при этом вызывает вазодилятацию сосудов сердца и легких. Пентоксифиллин широко используется при нарушениях микроциркуляции крови, сопровожающих самые разнообразные заболевания у животных [11, 12, 13]. В комплексе с пентоксифиллином было решено использовать реополиглюкин – это декстран, биологическим свойством которого является связывание воды и увеличение длительности пребывания коллоидных частиц в сосудистом русле, что полезно при нарастающих признаках дегидратации и, как следствие, повышения вязкости крови. Кроме того, декстраны обладают свойствами дезагрегации тромбоцитов и эритроцитов, что препятствует агглютинации и образованию сладжей [7, 14].
Материалы и методы
Исследования, положенные в основу работы, выполнены в 2013–2018 гг. на собаках в возрасте от 2 до 6 месяцев, принадлежащих Вологодскому обществу защиты животных «Велес». Лабораторные исследования проведены на базе кафедры внутренних незаразных болезней, хирургии и акушерства Вологодской ГМХА [7].
Исследовали 30 собак в возрасте от 2 до 6 месяцев, которым был поставлен диагноз «парвовирусная инфекция плотоядных», диагноз ставили с помощью клинического осмотра и выявления антигена парвовируса в фекалиях собак хроматографическим иммунохимическим методом с использованием одношагового экспресс-теста VetExpert CPV Ag. Из этих животных случайным образом были сформированы 2 группы.
Собакам 1 группы (Опыт 1, n=15 собак) применялась стандартизированная терапия, включающая введение раствора Рингера-Локка 30‒60 мл/кг в сутки с целью регидратации, дезинтоксикации и восполнения электролитов, ампициллин 20‒40 мг/кг/каждые 8 часов внутривенно для профилактики бактериальной инфекции. Рвоту купировали с помощью подкожного введения маропитанта цитрата (Серения) в дозе 1 мг/10 кг каждые 24 часа первые 3‒5 дней болезни [7, 15]. После купирования рвоты применяли Энтеросгель по 2‒5 г 6 раз в сутки перорально и диетический рацион Роял Канин Рекавери (примерно по 1 ст. ложке 6 раз в сутки). В качестве специфической терапии применяли сыворотку Гискан-5 в дозе 1-2 мл на животное подкожно, трехкратно с интервалом 24 часа [7].
Собакам 2 группы (Опыт 2, n =15 собак), помимо приведенной выше базисной терапии, с момента появления первых клинических симптомов применялась антиагрегантная терапия, включающая реополиглюкин (10 мл/кг, внутривенно, медленно, через день 3 инъекции) и пентоксифиллин (0,1 г (5 мл раствора) разводится в 250‒500 мл изотонического раствора натрия хлорида, вводится из расчета 20 мг/кг, длительность введения – 90‒180 минут внутривенно капельно, ежедневно в течение 5 дней). Полученные результаты сравнивали с первой группой щенков (Опыт 1, n = 15 собак). Погибло 5 собак – 4 щенка в 1-й опытной группе и 1 щенок во 2-й опытной группе. В качестве контрольных цифр использовались данные более ранних исследований здоровых собак этой же возрастной группы, проведенные в этой же лаборатории, на том же оборудовании [7, 15].
У животных опытных групп определяли морфологические и гемостатические показатели на 3-й и 5-й дни болезни с момента появления клинических признаков.
Для морфологического исследования крови использовали вакуумные пластиковые пробирки с ЭДТА. Подсчет форменных элементов крови, определение уровня тром-бокрита (PCT) и среднего объема тромбоцита (MPV), количество гемоглобина (HGB, Hb) и гематокрита (HCT) производили с помощью автоматического гематологического анализатора Exigo 17 (Boule Medical A.B., Швеция). Однако при подсчете тромбоцитов с наличием атипичных форм и тромбоцитарных агрегатов, а также у кошек, автоматические счетчики могут давать искаженную информацию [17, 18], поэтому количество тромбоцитов и лейкоцитарную формулу подсчитывали вручную в мазке крови, окрашенной по Романовскому – Гимзе. Кровь для гемостазио-логического исследования брали в вакуумные пластиковые пробирки, содержащие 3,8% раствор цитрата натрия. С помощью центрифугирования получали обогащенную тромбоцитами плазму (ОТП) и бедную тромбоцитами плазму (БТП) [7].
Адгезивно-агрегационную активность тромбоцитов определяли количественным методом с применением фотоэлектроколориметра (ФЭК) КФК-2 по Howard M. A [19]. Определяли суммирующий индекс агрегации тромбоцитов (СИАТ), скорость агрегации (СА) и индекс дезагрегации тромбоцитов (ИДТ) с индукторами агрегации – АДФ (концентрация 0,1 мг/мл), коллагеном (концентрация 20 мг/мл) и ристо-мицином (концентрация 15 мг/мл) [7].
Параметры плазменно-коагуляционного гемостаза определяли на коагуломе-тре Thrombostat производства Behnk Elektronik (Германия) с использованием цитратной бестромбоцитной плазмы после добавления различных реактивов производства фирмы «Технология-Стандарт» и НПО «РЕНАМ». Для оценки состояния плазменно-коагуляционного гемостаза выбрали следующие показатели: АЧТВ (активированное частичное тромбопластиновое время); ПВ (протромбиновое время); ТВ (тромбиновое время); количественный анализ фибриногена. Количество растворимых фибрин-мономерных комплексов (РФМК) определяли с помощью планшетного варианта ортофенантролинового теста. Активность антитромбина определяли с помощью «Тех-Антитромбин-теста» (принцип U. Abildgaard в модификации А.П. Момота и А.Н. Мамаева) [7, 20].
Полученные в ходе исследования результаты обрабатывались с помощью программного пакета Statistica 6.1. Значения полученных результатов в работе представлены в виде средней величины и стандартной ошибки средней (M ± m). Результаты исследования со значением вероятности допущения альфа-ошибки, равные либо менее 5% (р ≤ 0,05) расценивались как статистически значимые. Сравнение независимых выборок проводили с помощью критерия Манна – Уитни, зависимых ‒ с помощью критерия Вилкоксона [7].
Результаты исследования
Морфологические параметры крови претерпели изменения у собак в обеих опытных группах, однако различий между группами выявлено немного (табл. 1). Количество лейкоцитов в первой группе уменьшилось немного сильнее, чем во второй, но достоверной разницы эти различия не имели. Уровень палочкоядерных нейтрофилов, относительно контрольных цифр, повысился в обеих группах, но во второй незначительно больше [7].
Единственное, что достоверно различало исследуемые группы ‒ это уровень лимфоцитов, который во второй группе уже на третий день был выше, чем в первой (р=0,0035) и сохранился на этом уровне до 5-го дня болезни (р=0,04), тогда как у собак первой группы на 5-й день уровень лимфоцитов понизился ниже контрольных значений [7].
Таблица 1 ‒ Лейкоцитарные показатели у собак опытных групп, M ± m.
|
ПпкЛЭДТРПк |
Контроль, |
Опыт 1, n = 1 |
5 |
Опыт 2, n = |
5 |
|
|
Ед. |
, измерения |
n = 10 |
3 день |
5 день |
3 день |
5 день |
|
Количество лейкоцитов, х109/л |
12,51±0,65 |
7,91±1,38 |
9,32±2,15 |
9,44±1,72 |
12,12±2,33 |
|
|
ч0 о4 ? Z Q. О е о у Ф с; |
Сегментоядерные нейтрофилы |
57,0±1,04 |
46,8±2,75 |
49,9±2,32 |
47,83±1,05 |
50,5±3,51 |
|
Палочкоядерные нейтрофилы |
2,20±0,46 |
9,1±2,39 |
10,5±1,84 |
10,11±1,51 |
11,72±1,5 |
|
|
Моноциты |
8,60±0,60 |
7,4±0,87 |
9,4±0,49 |
8,55±1,61 |
9,64±1,8 |
|
|
Лимфоциты |
27,00±1,4 |
29,4±1,68 |
24,6±2,53 |
39,21±5,08 |
32,91±1,39 |
|
|
Эозинофилы |
5,10±0,70 |
4,5±1,27 |
5,6±1,27 |
4,5±1,72 |
5,18±1,75 |
|
|
Базофилы |
0,50±0,16 |
1,4±0,75 |
0,3±0,2 |
0,42±0,17 |
0,53±0,16 |
|
Количество эритроцитов во второй группе осталось на уровне контроля, тогда как в первой группе щенков незначительно уменьшилось (табл. 2) . Количество гемоглобина у собак второй группы на 5-й день болезни немного повышается (р=0,021) в отличие их от собак первой группы, где количество гемоглобина снижается. Изменения уровня гематокрита при этом у собак обеих групп существенной разницы не имеют [7].
Изменения тромбоцитарных параметров у собак опытных групп существенно отличаются. У собак второй группы, которым применяли антиагрегационную терапию, не происходит существенного понижения количества тромбоцитов, тогда как в первой группе количество тромбоцитов на 5-й день достоверно понижается, что приводит к различиям между группами (р=0,015) [7].
Таблица 2 ‒ Эритроцитарные и тромбоцитарные показатели у собак опытных групп, M ± m.
|
Показатель, Ед. измерения |
Контроль, n = 10 |
Опыт 1, n = 15 |
Опыт 2, n = 15 |
||
|
3 день |
5 день |
3 день |
5 день |
||
|
Эритроциты, х10 12/л |
6,39±0,29 |
5,26±0,5 |
5,14±0,55 |
6,23±1,5 |
6,91±1,35 |
|
Гемоглобин, г/л |
131,31±6,13 |
137,72±7,31 |
117,62±3,47 |
129,3±8,13 |
137,62±13,17 |
|
Гематокрит, % |
0,41±0,02 |
0,4±0,05 |
0,36±0,07 |
0,43±0,05 |
0,37±0,07 |
|
СОЭ, мм/ч |
3,55±0,48 |
6,4±1,02 |
5,6±0,5 |
5,23±0,29 |
4,45±1,32 |
|
Тромбоциты, х10 9/л |
405,77±3,11 |
349,62±25,69 |
306,2±40,38 |
361,32±37,16 |
352,7±25,41 |
|
Тромбокрит,% |
0,35±0,03 |
0,47±0,06 |
0,28±0,06 |
0,37±0,05 |
0,38±0,03 |
|
Ср. объем тромбоцита, fl |
7,5±0,9 |
6,9±1,2 |
8,3±1,5 |
6,9±0,8 |
7,2±1,1 |
Уровень тромбокрита изменяется похожим образом, и на 5-й день у собак первой группы, в отличие от второй, наблюдают его понижение (р=0,017). При этом у собак первой группы слегка увеличивается средний объем тромбоцита, но к существенным различиям со второй группой и контролем это не приводит [7].
Антиагреганты – вещества, действующие на сосудисто-тромбоцитарное звено системы гемостаза, поэтому большая часть различий между группами была в параметрах тромбоцитарных функций (табл. 3) .
Таблица 3 ‒ Сосудисто-тромбоцитарный гемостаз у собак опытных групп
|
Показатель Ед. изм. |
Контроль, n = 10 |
Опыт 1, n = 15, M ± m |
Опыт 2, n = 15, M ± m |
||
|
3 день |
5 день |
3 день |
5 день |
||
|
Агрегация с АДФ |
|||||
|
СИАТ,% |
92,96±10,23 |
108,32±13,90 |
110,92±12,91 |
50,12±8,3 |
45,35±15,83 |
|
СА, мин |
0,01±0,0026 |
0,0097±0,004 |
0,0151±0,0037 |
0,016±0,004 |
0,016±0,0029 |
|
ИДТ,% |
5,3 ±1,19 |
4,82±2,1 |
7,06±3,22 |
5,75±0,3 |
7,12±1,3 |
|
Агрегация с коллагеном |
|||||
|
СИАТ,% |
114,01±12,05 |
126,64±15,64 |
105,32±13,62 |
66,71±12,37 |
58,29±16,32 |
|
СА, мин |
0,01 ± 0,0036 |
0,015±0,005 |
0,0139±0,0066 |
0,017±0,006 |
0,019±0,007 |
|
ИДТ,% |
7,15 ± 1,52 |
5,85±1,67 |
4,2±1,78 |
5,35±0,71 |
5,3±0,03 |
|
Агрегация с ристомицином |
|||||
|
СИАТ,% |
110,69±12,36 |
110,66±14,01 |
123,52±17,21 |
71±11,5 |
53,12±9,35 |
|
СА, мин |
0,01±0,0028 |
0,0094±0,003 |
0,0094±0,003 |
0,01±0,009 |
0,025±0,006 |
|
ИДТ,% |
5,75±1,26 |
2,18±0,95 |
0,9±0,5 |
5,27±0,15 |
3,8±0,6 |
У собак второй группы суммирующий индекс агрегации со всеми индукторами был достоверно ниже, чем в контрольной группе (р=0,012 с АДФ, р=0,013 с коллагеном и р=0,032 с ристомицином на 3-й день и р=0,001 с АДФ, р=0,0015 с коллагеном и р=0,001 с ристомицином на 5-й день) и второй группе (р=0,002 с АДФ, р=0,0014 с коллагеном и р=0,012 с ристомицином на 3-й день и р=0,0001 с АДФ, р=0,0013 с коллагеном и ристомицином на 5-й день). При этом параметры дезагрегации тромбоцитов практически не различались, за исключением ИДТ с ристомицином, которое значительно понизилось в первой группе и практически не изменилось во второй, что обусловило разницу между группами (р=0,0005 на 3-й день и р=0,0001 на 5-й день) и ИДТ с коллагеном, которое снизилось у собак первой группы на 5-й день болезни, а у собак второй группы статистически не отличалось от контрольных параметров. Скорость агрегации замедлилась только при индукции ристомицином во второй группе на 5-й день болезни (р=0,027) [7].
Для формирования наглядной картины изменений сосудисто-тромбоцитарного звена гемостаза у собак опытных групп, мы провели анализ полученных результатов в динамике. При сравнении изменений показателей гемостаза мы использовали относительные величины, при этом за 100% принимали значение показателей гемостаза у контрольной группы щенков в возрасте от 2 до 6 месяцев. В результате (рис. 1) мы видим, что во второй группе на третий день болезни произошло снижение суммирующих индексов агрегации с АДФ на 47%, с коллагеном на 42% и ристомицином на 36%, тогда как в первой группе эти параметры не изменились (СИАТ с ристомицином) или слегка повысились (СИАТ с АДФ на 16%, с коллагеном на 11%). При этом индексы дезагрегации тромбоцитов собак в обеих группах существенных изменений не претерпели, за исключением понизившегося на 63% ИДТ с ристомицином в первой группе. На пятый день болезни общая тенденция изменений сохранилась, за исключением индекса дезагрегации с АДФ, который вырос на 33% в первой и на 34% во второй группе относительно контрольных цифр [7].
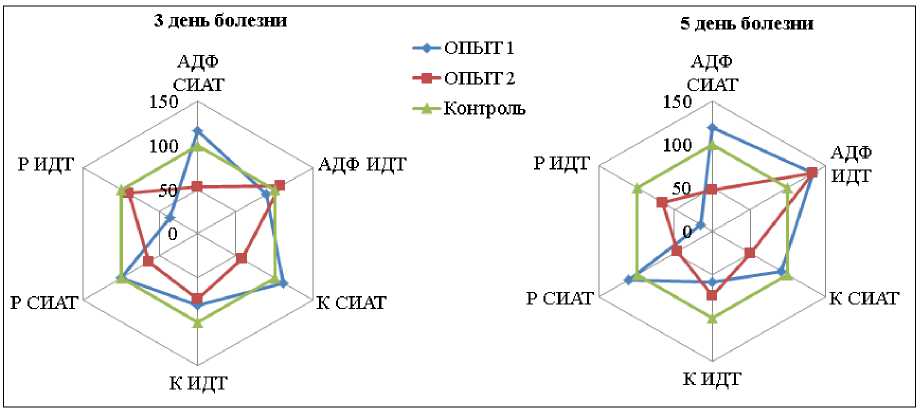
Рис. 1. Сосудисто-тромбоцитарный гемостаз у собак опытных групп на 3 и 5 день болезни (показатели контрольной группы приняты за 100%).
Клинические проявления у животных опытных групп были разнообразны, но не отличались от результатов других исследователей (табл. 4). Наиболее распространенными клиническими симптомами у наблюдаемых собак были апатия, диарея, рвота и дегидратация. Смертность приходилась на 5-й, реже 6-й день болезни. В 1 группе погибло 4 собаки, во второй группе – 1 собака.
Таблица 4 ‒ Клинические симптомы у животных опытных групп, %
|
Клинический симптом |
Опыт 1, n = 15 |
Опыт 2, n = 15 |
||||||
|
Выжившие, n = 11 |
Погибшие, n = 4 |
Выжившие, n = 14 |
Погибшие, n = 1 |
|||||
|
3 день |
5 день |
3 день |
5 день |
3 день |
5 день |
3 день |
5 день |
|
|
Апатия |
100 |
18 |
100 |
100 |
92 |
7 |
100 |
100 |
|
Диарея катаральная |
18 |
100 |
- |
- |
57 |
92 |
- |
|
|
Диарея геморрагическая |
81 |
- |
100 |
100 |
42 |
- |
100 |
100 |
|
Рвота |
100 |
- |
50 |
- |
100 |
|||
|
Рвота с примесью крови |
- |
- |
50 |
- |
- |
- |
100 |
- |
|
Дегидратация |
27 |
9 |
100 |
100 |
14 |
100 |
100 |
|
|
Анемичность слизистых |
45 |
9 |
100 |
100 |
35 |
100 |
100 |
|
|
Одышка, носовые гнойные истечения |
- |
- |
- |
- |
- |
- |
- |
100 |
|
Удлиненное время наполнения капилляров |
27 |
- |
75 |
100 |
- |
- |
100 |
100 |
|
Лихорадка |
72 |
- |
50 |
- |
64 |
100 |
100 |
|
|
Гипотермия |
- |
- |
- |
100 |
- |
|||
|
Абдоминальная боль |
81 |
- |
100 |
75 |
35 |
100 |
||
|
Тромбоз венозных катетеров |
27 |
- |
100 |
100 |
- |
- |
100 |
- |
|
Петехиальные кровоизлияния |
- |
- |
- |
- |
- |
- |
- |
100 |
Смертность в первой группе собак составила 26,6%, тогда как во второй группе, где применяли антиагрегантную терапию, составила 6,6% (рис. 2).
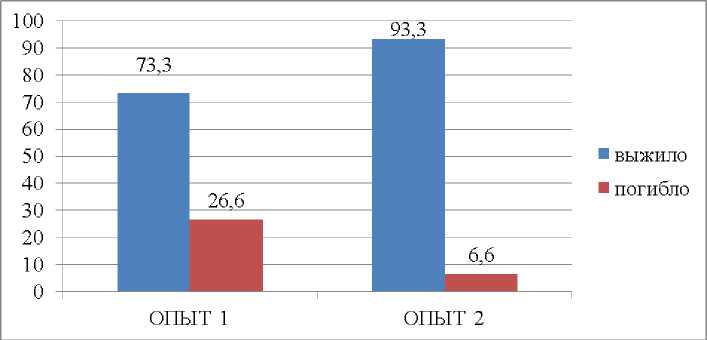
Рис. 2. Смертность в опытных группах, %
Заключение
Включение пентоксифиллина и реополиглюкина в схему лечения 2-й опытной группы щенков в возрасте от 2 до 6 месяцев позволяет сохранить уровень лимфоцитов на 3-й (39,21±5,08%) и 5-й день болезни (32,91±1,39%), количество гемоглобина (137,62±13,17г/л), тромбоцитов (352,7±25,41 х109/л) и тромбо-крит (0,38±0,03%) на 5-й день болезни на уровне контрольных цифр; приводит к снижению агрегационных свойств тромбоцитов, которое проявляется уменьшением суммирующего индекса агрегации со всеми индукторами (50,12±8,3 % с АДФ, 66,71±12,37 % с коллагеном и 71±11,5 % с ристомицином на 3-й день и 45,35±15,83 % с АДФ, 58,29±16,32 % с коллагеном и 53,12±9,35 % с ристомици-ном на 5-й день) и замедлением скорости агрегации с ристомицином до 0,025±0,006 мин на 5-й день болезни.
Резюмируя результаты клинической оценки, можно отметить, что включение антиагрегантной терапии в схему лечения второй опытной группы позволяет уменьшить проявления таких клинических симптомов, как геморрагическая диарея (на 39% на 3-й день и 100% на 5-й день болезни); дегидратация (на 14% на 3-й день и 9% на 5-й день болезни); анемия на 10% и удлинение СНК на 27%; абдоминальная боль на 46% и тромбозы венозных катетеров на 27% на 3-й день болезни, что позволяет снизить смертность на 20% относительно группы с базовой схемой лечения.
Основываясь на полученных результатах, можно заключить, что введение в схему лечения парвовирусной инфекции антиагрегантных препаратов – пентоксифиллина и реополиглюкина – позволяет добиться положительной динамики агрегационных параметров тромбоцитов, предупредить тяжелые осложнения, связанные с нарушением гемодинамики, за счет чего снизить смертность у собак, больных парвовирусной инфекцией.
Список литературы Антиагрегантная терапия парвовирусного энтерита у собак в возрасте от 2 до 6 месяцев
- Goddard, A., Leisewitz A. L. (2010) Canine parvovirus. Vet Clin North Am Small Anim Pract., 40(6), рр. 1041–1053.
- Ling, M., Norris, J. M., Kelman, M., Ward, M. P. (2012) Risk factors for death from canine parvoviral-related disease in Australia. Vet Microbiol., 158 (3–4), рр. 280– 290
- Парвовирусы плотоядных и вызываемые ими болезни / Н. А. Власов [и др.]. – Ульяновск, 2000. – 35 с.
- Сулимов, А. А. Парвовирусные инфекции плотоядных/ А. А. Сулимов, В. И. Уласов // РВЖ. МДЖ. – 2008. ‒ № 2. ‒ С. 40–45.
- Балабанова, В. И. Патоморфология парвовирусного энтерита собак: дисс. … канд. вет. наук: 16.00.02 / Балабанова Виктория Игоревна. – СПб., 2005. – 129 с.
- Баруздина, Е. С. Морфофункциональная характеристика системы гемостаза у собак при парвовирусной инфекции: дисс. … канд. вет. наук: 06.02.01 / Баруз- дина Елена Сергеевна. – М., 2019. – 105 с.
- Баруздина, Е. С. Морфофункциональные параметры тромбоцитов у собак разного возраста при парвовирусной инфекции / Е. С. Баруздина // Молочнохозяй- ственный вестник. – 2018. ‒ № 4 (32). – С. 18‒27.
- Девяткин, А. В. Клиническое значение нарушений микроциркуляции и гемореологии при гриппе и других острых респираторных вирусных инфекциях у больных с осложнениями и сопутствующими заболеваниями: дисс. … доктора мед. наук: 14.00.10 / Девяткин Андрей Викторович. – М., 2003. ‒ 272 с.
- Schoeman, J.P., Goddard, A., Leisewitz, A.L. (2013) Biomarkers in canine parvovirus enteritis. N. Z. Vet. J., 61 (4), рр. 217‒222.
- Thames, B.E. The effects of clopidogrel and omeprazole on platelet function in normal dogs/ B.E. Thames, J. Lovvorn, M.G. Papich, R. Wills, T. Archer, A. Mackin, J. Thomason // J Vet Pharmacol Ther. – 2017. ‒ 40 (2). – Р. 130‒139.
- Соболева, Е. Н. Морфофункциональная характеристика системы гемостаза у коров в лактационный период: дисс. … канд. вет. наук: 06.02.01 / Соболева Елена Николаевна. – М., 2016. ‒ 142 с.
- Hoeffner, U. Pharmacology of pentoxifylline in isolated canine arteries and veins/ U. Hoeffner, L.L. Aarhus, Z.S. Katusic, P.M. Vanhoutte// J Cardiovasc. Pharmacol. – 1989. - 14(6). – Р. 899-907.
- Marsella, R. Pharmacokinetics of pentoxifylline in dogs after oral and intravenous administration/ R. Marsella, C.F. Nicklin, J.W. Munson, S.M. Roberts// Am. J. Vet. Res. – 2000. ‒ 61(6). – Р. 631‒637.
- Пульняшенко, П.Р. Инфузионная терапия у животных/ П.Р. Пульняшенко, Р.С. Козий, В.Н.Федоров// Ветеринария Кубани. ‒ 2006. ‒ №2. – С. 5‒9.
- Mathios E. Mylonakis, Iris Kalli, Timoleon S. Rallis (2016) Canine parvoviral enteritis: an update on the clinical diagnosis, treatment, and prevention. Veterinary Medicine: Research and Reports, рр. 91‒100.
- Баруздина Е.С., Ошуркова Ю. Л. Особенности функционирования системы гемостаза у здоровых собак в возрасте от двух до шести месяцев // Актуальные вопросы ветеринарной биологии. ‒ 2016. ‒ №3 (31). ‒ С. 8‒12.
- Мейер, Д. Ветеринарная лабораторная медицина. Интерпретация и диагностика: пер. с англ. / Д. Мейер, Дж. Харви. ‒ М.: Софион, 2007. – 456 с.
- Hackner, S.G. (1995) Approach to the diagnosis of bleeding disorders. Comp. Cont. Educ. Pract. Vet., 17, рр. 331‒349.
- Балуда, В. П. Лабораторные методы исследования системы гемостаза / В. П. Балуда, З. С. Баркаган, Е. Д. Гольдберг. – Томск, 1980. – 304 с.
- Долгов, В. В. Лабораторная диагностика нарушений гемостаза / В. В. Долгов, П. В Свирин. – М.: Триада, 2005. – 223 с.


