Антибиотикорезистентность - новый вызов современной урологии
Автор: Котов С.В., Пульбере Сергей Александрович, Беломытцев С.В., Перов Р.А., Алесина Н.В., Желтикова Е.А.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Организация урологической помощи
Статья в выпуске: 5, 2020 года.
Бесплатный доступ
Введение. Проведен анализ встречаемости и резистентности микроорганизмов к антибактериальным препаратам, выделенных в культурах мочи пациентов с инфекциями мочевыводящих путей (ИМП) с 2012 по 2019 год. Материалы и методы. В клинике урологии на базах ГКБ № 1 им. Н. И. Пирогова и ГКБ № 29 им. Н. Э. Баумана были проанализированы результаты 6083 посевов мочи у 5027 больных. Лабораторный этап включал стандартизированный посев, который выполнялся петлей 10 мкл на следующие питательные среды: агар с добавлением 5% овечьей крови (Пронадиса, Испания), Левин-агар (Пронадиса, Испания), Бигги-агар (БД, США) с последующей инкубацией при 37°С в течение 18-24 часов. Затем проводился визуальный подсчет колоний. Чувствительность выделенных микроорганизмов к антибиотикам оценивалась с помощью бактериологического анализатора Phoenix (BD, США) и диско-диффузионного метода (производитель дисков BD, США). Оценка продуцентов ф-лактамаз расширенного спектра (БЛРС) и карбапенемаз проводилась на бактериологическом анализаторе Phoenix (BD, США), методом «двойных дисков» и методом «инактивации карбапенемов». Результаты. Отмечен высокий уровень резистентности штаммов Enterococcus faecalis к фторхинолонам (>20%) и аминогликозидам (>35%). Среди штаммов Escherichia coli прослеживается повышение резистентности к антибактериальным препаратам группы пенициллинов (>80%), в то же время наблюдается повышение резистентности к препаратам группы цефалоспоринов (>60%), фторхинолонов (>50%). Отмечается появление устойчивых к карбапенемам штаммов. Среди штаммов Klebsiella pneumonia обнаружена высокая устойчивость к фторхинолонам (>50%) и цефалоспоринам (>45%). Выявлено значительное повышение резистентности ко всем применяемым антибактериальным препаратам. Отдельно выделяется повышение резистентности к карбапенемам (27,1%). Обсуждение. По результатам нашего исследования можно утверждать, что наиболее частыми возбудителями осложненных ИМП в 2019 году явились представители семейств Enterococcaceae и Enterobacteriaceae, прослеживается увеличение числа штаммов, резистентных к определенным группам антибактериальных препаратов. При сопоставлении полученных результатов с данными интернет-платформы «Карта антибиотикорезистентности. AMR map» отмечаются сопоставимые данные о встречаемости и резистентности микроорганизмов. Особую настороженность вызывают высокая частота резистентности бактерий к препаратам группы фторхинолонов и, следовательно, эти препараты не могут применяться в качестве эмпирической терапии больных с осложненными ИМП. Выводы. Необходим постоянный контроль за спектром резистентности штаммов в каждом стационаре и на этапе амбулаторного звена в конкретном регионе - это поможет более точно подобрать антибактериальную терапию, а также ввести в практику ускоренной лабораторной диагностики маркеры резистентности бактерий.
Инфекция, антибактериальная терапия, антибиотикорезистентность, чувствительность к антибиотикам
Короткий адрес: https://sciup.org/142225728
IDR: 142225728 | DOI: 10.29188/2222-8543-2020-13-5-113-119
Текст научной статьи Антибиотикорезистентность - новый вызов современной урологии
Открытие Александром Флемигном в 1928 году пенициллина и последующее его выделение Говардом Флори и Эрнестом Чейном в 1945 году послужили развитию новой эры лечения инфекционных заболеваний – антибактериальной терапии. В результате применения антибактериальных препаратов, главенствующие места в структуре летальности заняли заболевания сердечнососудистой системы и злокачественные новообразования. Однако на сегодняшний день более 20-40% антибактериальных препаратов назначаются без соблюдения принципов рациональной антибиотикотерапии в лечении инфекционных заболеваний различной локализации, таких как строгие показания к назначению препаратов, адекватное дозирование и длительность применения, учет совместимости различных групп препаратов и др. [1-3]. Современное здравоохранение столкнулось с таким защитным феноменом микроорганизмов, как появление госпитальных штаммов, устойчивых к неблагоприятным условиям внешней среды, дезинфицирующим средствам и антибактериальным препаратам [4, 5]. Обсуждая проблему антибиотикорезистентности, приходится констатировать, что она находится в фокусе внимания врачей и ученых разных специальностей и интерес к этой проблеме продолжает расти.
Ежегодно в мире регистрируется более 700 тысяч смертей от инфекционных заболеваний различной локализации, преимущественно вызванными резистентными к антибактериальным препаратам штаммами. К настоящему времени инфекции мочевыводящих путей (ИМП) стали одними из наиболее часто встречаемых заболеваний, в том числе в структуре госпитальных инфекций (до 40%) [6, 7].
Лечение ИМП должно быть целенаправленным и учитывать все результаты доступных микробиологических исследований [8, 9]. Анализ чувствительности микроорганизмов к антибактериальным препаратам, наряду с изучением изменения встречаемости отдельных возбудителей, необходим в выборе рациональной терапии и позволяет прогнозировать успешность назначаемой терапии [10, 11].
Цель настоящего исследования – изучить встречаемость и резистентность к антибактериальным препаратам наиболее распространенных штаммов микроорганизмов, выделенных в посевах мочи пациентов с осложненными инфекциями мочевыводящих путей, находившихся на стационарном лечении с 2012 по 2019 гг.
МАТЕРИАЛЫ И МЕТОДЫ
В ГКБ № 1 им. Н.И. Пирогова и ГКБ № 29 им. Н.Э. Баумана – клинических базах кафедры урологии ФГАОУ ВО РНИМУ им. Н.И. Пирогова, проведено исследование 6083 посевов мочи у 5027 пациентов с осложненными инфекциями мочевыводящих путей. Осложненными счита- лись ИМП у пациентов с наличием постоянного катетера или дренажа (стента) в мочевых путях, интермиттирующей катетеризацией мочевого пузыря, обструктивной уропатией любой этиологии (инфравезикальной обструкцией, нейрогенным мочевым пузырем, камнями, опухолями), пузырно-мочеточниковом рефлюксом или другими функциональными нарушениями. К ним также относили ИМП после пластики мочевых путей (например с использованием сегмента подвздошной кишки)или в послеоперационном периоде, у пациентов с почечной недостаточностью, сахарным диабетом, иммуносупрессивными состояниями, продолжительностью симптомов на момент осмотра более 7 суток, неэффективностью эмпирической антибактериальной терапии на амбулаторном этапе более 72 часов [12].
Проведенный анализ включал в себя: выделение идентификацию, оценку чувствительности микроорганизмов к антибактериальным препаратам [13].
Лабораторный этап включал стандартизированный посев, который выполнялся петлей 10 мкл на следующие питательные среды:
-
- агар с добавлением 5% бараньей крови (Pronadisa Испания);
-
- агар Левина (Pronadisa, Испания);
-
- агар Бигги (BD, США).
Последующая инкубация при 37°C проводилась в течение 18-24 часов.
Затем производился визуальный подсчет колоний. Анализ проведен согласно клиническим рекомендациям «Бактериологический анализ мочи» [14].
Положительным считали результат при выявлении:
-
• первичных патогенных микроорганизмов ( Escherichia coli, Enterococcus spp.) ;
-
• вторичных патогенных микроорганизмов ( Enteobac-ter spp., Klebsiella spp., Proteus mirabilis, Pseudomonas aeruginosa, Staphylococcus aureus, Acinetobacter spp.) 1х103 КОЕ/мл в моче, полученной от мужчин и 1х104 КОЕ/мл в моче полученной от женщин;
-
• нетипичных возбудителей (коагулазо-негативные стафилококки, Streptococcuss spp. и др.) 1х105 и более КОЕ/мл.
На бактериологическом анализаторе Phoenix (BD США) и диско-диффузионным методом (диски производства BD, США) произведена оценка чувствительности выделенных микроорганизмов к исследуемым антибактериальным препаратам. Оценка продуцентов β-лактамаз расширенного спектра (БЛРС) и карбапенемаз проводилась на бактериологическом анализаторе Phoenix (BD США), методом «двойных дисков» и методом «инактивации карбапенемов».
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Из 6083 посевов мочи пациентов осложненными ИМП количество положительных посевов с выделенными культурами микроорганизмов составило 2640 (43,3%). После возможного устранения функциональных или обструктивных нарушений, смены длительно функционирующих дренажей антибактериальная терапия является основным методом лечения осложненных ИМП. Эффективность антимикробного лечения напрямую зависит от чувствительности к применяемым препаратам микроорганизмов в очаге воспаления.
Наиболее частыми возбудителями осложненных ИМП были Enterococcus faecalis (2012/2019 +6,3%), Escherichia coli (2012/2019 +7,1%), Klebsiella pneumonia (2012/2019 +10,3%), Proteus mirabilis (2012/2019 +1,4%). Частота встречаемости Pseudomonas aeruginosa в динамике уменьшилась на 2,6% (с 8,1% до 5,5%), Staphylococcus aureus на 2,6% (с 4,1% до 1,5%), Proteus mirabilis увеличилась на 5,1% (с 2,5% до 7,6%) (рис. 1). Значительно снизилась частота встречаемости Enterobacter cloacae на 7,9% (с 8,3% до 0,4%). Однако отмечается увеличение роста Acinetobacter baumannii у пациентов реанимационного профиля на 3,5% (с 0,9% до 4,4%) и Staphylococcus haemolyticus на 0,4% (с 1,2% до 1,6%).
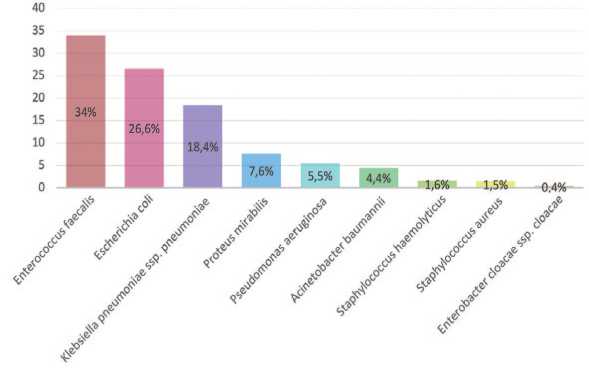
Рис. 1. Частота встречаемости микроорганизмов в посевах мочи в 2019 г. (%) Fig. 1. Frequency of occurrence of microorganisms in urine crops in 2019 (%)
Таким образом, среди микроорганизмов, вызывающих осложненные ИМП, преимущественно встречаются представители семейств Enterococcaceae и Enterobacteri-aceae . У пациентов с коралловидными камнями в 74% случаев на момент установления диагноза имеет место ИМП, из них в 72% случаев встречаются уреазо-проду-цирующие возбудители. У 87% пациентов с постоянными катетерами или дренажами в мочевыделительных путях обнаружены полирезистентные ко многим антибактериальным препаратам штаммы микроорганизмов.
Кроме того, прослеживается увеличение частоты штаммов различных микроорганизмов, резистентных к определенным исследуемым группам антибактериальных препаратов.
Так, метициллин резистентные стафилококки – Methicillin (Oxacillin) Resistant Staphylococcus аureus (MRSA) которые устойчивы ко всем β-лактамным препаратам обладают ассоциированной устойчивостью к антибактериальным препаратам групп фторхинолонов, макроли- дов, аминогликозидов, линкозаминов, тетрациклинов. На метициллин-резистентность исследованы 432 штамма Staphylococcus аureus. Доля MRSA в 2012 и 2019 гг. составила соответственно 35,0% и 41,0% (+6,0%).
Согласно полученным данным штаммы,выра-батывающие БЛРС или Еxtended-Spectrum-βLactamases (ESBL) стали на 21,3% встречаться чаще у Escherichia coli (с 3,2% до 24,5%) и на 35,6% среди Klebsiella pneumoniae (с 5,2% до 40,8%) (рис. 2). По данным исследования «ДАРМИС, 2018г», частота продукции БРЛС среди штаммов Escherichia coli составила в 2011 и 2018 гг. соответс-венно 2,3% и 19,5% [15]. Однако отмечается снижение частоты встречаемости данных штаммов среди Pseudomonas aeruginosa на 15,9% (с 56% до 40,1%).
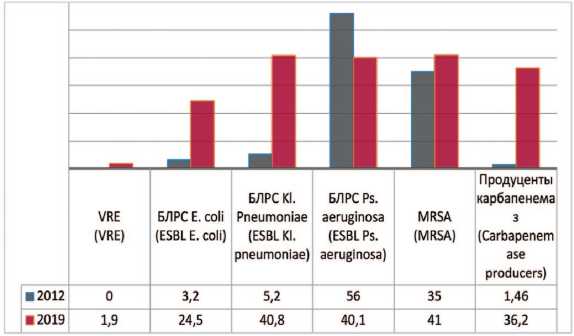
Рис. 2. Количество штаммов с факторами патогенности в 2012, 2019 гг., по оси ординат - количество штаммов
Fig. 2. Frequency of stains with pathogen factors: 2012-2019,the ordinate - stains frequency
Первый в России штамм ванкомицин-резистентного энтерококка (VRE) обнаружен еще в 2002 г. В 2019 г. в ГКБ №1 им. Н.И. Пирогова было исследовано 264 штамма энтерококка, среди которых выявлены 5 (1,9%) штаммов VRE.
Зафиксирована динамика существенного роста числа микроорганизмов, которые продуцируют карбапе-немазы. В 2012 г. исследованы 342 штамма микроорганизмов, из которых карбапенемазы продуцировали только 5 (1,46%). В 2018 году исследованы 533 штамма, из которых 44 (8,25%) явились продуцентами карбапенемаз, а в 2019 году из 432 исследованных штаммов выявлены 157 (36,2%) штаммов, продуцирующих карбапенемазы.
Enterococcus — род бактерий семейства Enterococ-caceae являются основными симбиотическими организмами кишечника человека. У пациентов с осложненными ИМП, при изучении выделенных штаммов Enterococcus faecalis с 2012 по 2019 гг. прослеживается несущественное увеличение резистентности к ванкомицину (до 2,0%), тигециклину (до 0,9%), нитрофурантоину на 4,9% (с 4,1% до 9,0%), имипенему (до 4,5%), гентамицину на 6,1% (с 32,6% до 38,7%), ампициллину на 0,4% (с 12,2% до 12,6%) (рис. 3). Одновременно отмечается снижение резистентности к препаратам группы фторхинолонов – ципрофлоксацину на 29,4% (с 53,3% до 23,9 %) и левофлоксацину на 27,3% (с 48% до 20,7%).
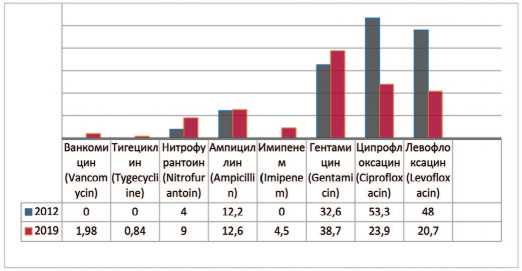
Рис. 3. Резистентность Enterococcus faecalis к антибиотикам в 2012, 2019 гг., по оси ординат - количество штаммов
Fig. 3. Antibiotic resistance of Enterococcus faecalis: 2012-2019, the ordinate -stains frequency
|
Амика (Arnica |
Имипе (Imipin |
Мерой (Мегор enem) |
Цефтаз идим (Ceftazi |
Ко-тримок сазол( бисепт (Со- |
Цефота ксим/К лавула новая кислот (Cefo... |
Тигеци (Tygecy |
Ципро флокса ЦИН (Ciprofl oxacin) |
Левоф локсац (Levofl oxacin) |
Амоке ицилл ин/Кла вулано кислот |
Ампиц иллин (Ampici Ilin) |
|
|
■ 2012 |
18,6 |
0 |
1,4 |
12,8 |
45,4 |
16,3 |
0 |
76,5 |
33,8 |
41,8 |
85,7 |
|
■ 2019 |
30,6 |
24,6 |
28,7 |
48,1 |
45,2 |
36 |
100 |
58 |
53 |
62,8 |
74,2 |
Рис. 5. Резистентность Klebsiella pneumoniae к антибиотикам в 2012, 2019 гг., по оси ординат - количество штаммов
Fig. 5. Antibiotic resistance of Klebsiella pneumoniae : 2012-2019, the ordinate -stains frequency
Escherichia coli — грамотрицательная бактерия, факультативный анаэроб, не образующая эндоспор. Проводя анализ динамики чувствительности Escherichia coli к антибактериальным препаратам выявлено повышение резистентности микроорганизма к карбапенемам (меропенему) – до 4,5%, к амоксициллину/клавулоновой кислоте – на 4,1% (с 21,4 % до 25,5%), амикацину – на 4,8% (c 7,3% до 12,1 %), цефтазидиму – на 43,8% (с 23,2% до 67,0%) (рис. 4). Кроме того, отмечается значительный рост резистентности к фторхинолонам – левофлоксацину на 18,5% (с 34,9% до 53,4%), ципрофлоксацину – на 8,3% (с 46,5% до 54,8%), а также к нитрофурантоину – на 33,6% (с 8,5% до 42,1%) и ко-тримоксазолу (бисептолу) – на 63,3% (до 100%).
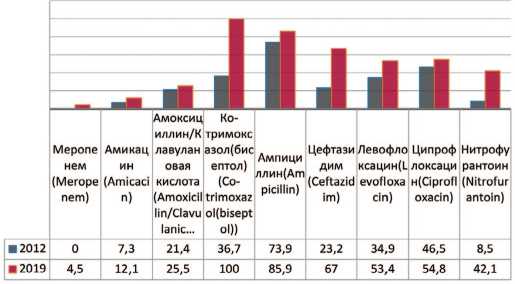
Рис. 4. Резистентность Escherichia coli к антибиотикам в 2012, 2019 гг., по оси ординат - количество штаммов
Fig. 4. Antibiotic resistance of Escherichia coli: 2012-2019, the ordinate - stains frequency
В когорте пациентов отделений реанимации и интенсивной терапии с генерализацией инфекционного процесса и развитием сепсиса прослеживается увеличение резистентности выделенных штаммов Klebsiellapneumonia к амикацину на 39,3% (с 25% до 64,3%), меропенему – до 59,7% цефтазидиму – до 100%, амоксициллину/клавулановой кислоте – на 4,0% (с 79,0% до 83,0%), имипенему – до 50,3%, це-фотаксиму/клавулановой кислоте – на 3,5% (с 30,8% до 34,3%), левофлоксацину – на 2,0% (c 73,7% до 75,7%). Таким образом, при выявлении у данной когорты пациентов штаммов Klebsiella pneumonia показано проведение длительной комбинированной антибактериальной терапии, преимущественно с использованием оригинальных препаратов, согласно полученным результатам посевов мочи и крови.
Proteus mirabilis — вид грамотрицательных, споронеобразующих, факультативно анаэробных уреазо-про-дуцирующих бактерий, представитель условно-патогенной микрофлоры кишечника человека. У пациентов с выделенным Proteus mirabilis демонстрируется увеличение резистентности возбудителя к амикацину на 16,8% (с 6,7% до 23,5%), меропенему – до 2,7%, имипенему – до 1,5%, амоксициллину/клавулановой кислоте – на 20,6% (с 17,1% до 37,7%), левофлоксацину – на 4,6 % (с 23,4% до 28%), ципрофлоксацину – на 39,6% (с 27,3% до 66,9%), ампициллину – на 15,2% (с 60,9% до 76,1%), цефтазидиму – на 12,8% (с 0,2% до 13%), бисептолу – на 10,0% (с 59,9% до 69,9%) (рис. 6).
Klebsiella pneumonia , выделенная в 1882 г. Карлом Фридлендером, вид грамотрицательных факультативноанаэробных палочковидных бактерий, которые не образуют спор, неподвижны, способны к образованию капсулы. Анализируя чувствительность Klebsiella pneumoniae к антибактериальным препаратам выявлено увеличение резистентности к амикацину на 12% (с 18,6% до 30,6%), ме-ропенему – на 27,3% (с 1,4% до 28,7%), имипенему – до 24,6%, цефтазидиму – на 35,3% (с 12,8% до 48,1%), амокси-циллину/клавулановой кислоте – на 21% (с 41,8% до 62,8%) тигециклину – до 100%, левофлоксацину – на 19,2% (с 33,8% до 53%) (рис. 5). Одновременно отмечается снижение резистентности к ампициллину – на 11,5% (с 85,7% до 74,2%), незначительно к бисептолу – на 0,2% (с 45,4% до 45,2%) и ципрофлоксацину на 18,5% (с 76,5% до 58%).
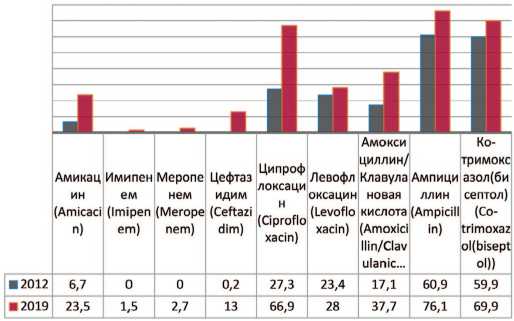
Рис. 6. Резистентность Proteus mirabilis к антибиотикам в 2012, 2019 гг., по оси ординат - количество штаммов
Fig. 6. Antibiotic resistance of Proteus mirabilis : 2012-2019, the ordinate - stains frequency
экспериментальная и клиническая урология № 5 20 20
Staphylococcus aureus — группа положительных, неподвижных, анаэробных, условно-патогенных для организма человека микроорганизмов, не образующих спор и капсул. При анализе выделенных штаммов Staphylococcus aureus прослеживается увеличение их резистентности к амикацину на 29,1% (с 14% до 43,1%), цефурок-симу – на 35,0% (с 7,1% до 43,1%), левофлоксацину – на 17,5% (с 14,3% до 31,8%), оксациллину – на 27,8% (с 35,7% до 63,5%), эритромицину – на 6,4% (с 38,8% до 44,4%) (рис. 7). Снижение резистентности отмечается к амокси-циллину/клавулановой кислоте – на 6,9% (с 21,4% до 14,5%), бисептолу – на 12,2% (с 24,7% до 12,5%).
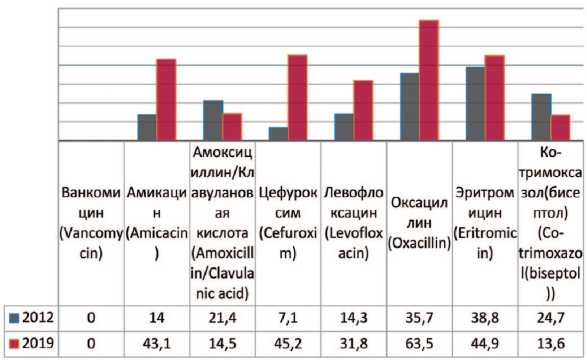
Рис. 7. Резистентность Staphylococcus aureus к антибиотикам в 2012, 2019 гг., по оси ординат – количество штаммов
Fig. 7. Antibiotic resistance of Staphylococcus aureus : 2012-2019, the ordinate – stains frequency
Pseudomonas aeruginosa — вид грамотрицательных подвижных палочковидных бактерий, условно патогенных для человека, возбудитель нозокомиальных инфекций у человека. Pseudomonas aeruginosa устойчива к действию многих беталактамов, аминогликозидов, фторированных хинолонов. В 2019 г. прослеживается увеличение резистентности к амикацину на 12,0% (с 34,9% до 46,9%), левофлоксацину – на 6,4% (с 65,8% до 72,2%) ципрофлоксацину – на 6,7% (с 60,0% до 66,7%), меропе-нему – на 38,4% (с 11,6% до 50,0%), эртапенему – на 38,6% (с 10,9% до 49,5%) (рис. 8). Одним из препаратов выбора при лечении пациентов с выделенными штаммами Pseudomonas aeruginosa остается полимиксин Е.
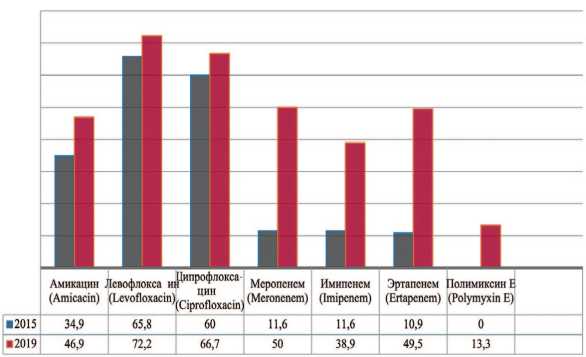
Рис. 8. Резистентность Pseudomonas aeruginosa к антибиотикам в 2015, 2020 гг., по оси ординат - количество штаммов
Fig. 8. Antibiotic resistance of Pseudomonas aeruginosa: 2015-2020, the ordinate - stains frequency
Acinetobacter — род грамотрицательных бактерий из семейства Moraxellaceae , строгие аэробы, резистентные к многим антибактериальным препаратам. Предшествующие госпитализации в ОРИТ и хирургическое вмешательство в разы повышают риск инфицирования. Анализируя полученные данные выявлено увеличение резистентности данных штаммов к амикацину на 52,5% (с 43,1% до 95,6%) имипенему – на 82,6% (с 9,7% до 92,3%), амоксициллину/ клавулоновой кислоте – до 100%, меропенему – на 71,5% (с 23,6% до 95,1%), эртапенему – до 100%, цефотаксиму – на 76,4% (с 13,6 до 90,2%) (рис. 9). В случаях выявления в посевах крови и мочи пациентов штаммов Acinetobacter baumannii препаратами выбора остаются полимиксин Е и
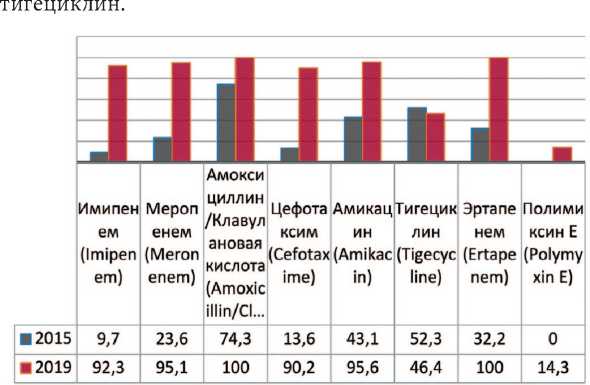
Рис. 9. Резистентность Acinetobacter baumannii к антибиотикам в 2015, 2020 гг. в отделении ОРИТ, по оси ординат - количество штаммов
Fig. 9. Antibiotic resistance of Acinetobacter baumannii: 2015-2020 in intensive care units, the ordinate - stains frequency
ОБСУЖДЕНИЕ
Резюмируя полученные данные можно утверждать что в возникновении осложненных ИМП наиболее частыми возбудителями в 2019 году явились представители семейств Enterococcaceae и Enterobacteriaceae. В отношении Enterococcus faecalis ( выявлена у 34% случаев) наибольшую активность продемонстрировали препараты: ванкомицин (98,1%), тигециклин (99,0%), из фтор-хинолонов – левофоксацин (79,3%); максимальная чувствительность Escherichia coli (выявлена у 26,6% случаев) отмечена к меропенему (95,5%), амикацину (87,9%), амоксицллину/клавулановой кислоте (74,5%). В отношении Klebsiella pneumonia (выявлена у 18,4% пациентов) лучшую активность демонстрируют препараты: амикацин (69,4%), имипенем (75,4%), цефотаксим/ клавулановая кислота (64,5%). Частота встречаемости Proteus mirabilis составила 7,6%. Данный микроорганизм чувствителен к имипенему (98,5%), амикацину (76,5%) левофлоксацину (72%).
Также прослеживается увеличение числа штаммов резистентных к определенным группам антибактериальных препаратов: мецитиллин-резистентных стафилококков (на +6%), продуцентов β-лактамаз (на +21,3% для E. coli и на + 35,6% для Klebsiella рneumoniae), ванкомицин-резистентных энтерококков (на 1,9%) и продуцентов карбапенемаз (на 34,7%).
У пациентов реанимационного профиля встречаются такие возбудители, как Pseudomonas aeruginosa (5,5%) и Acinetobacter baumannii (4,4%), демонстрируя панрезистентность.Отдельно можно отметить резкий прирост резистентности к карбапенемам (на 24,6%).
При сопоставлении полученных результатов с данными интернет-платформы «Карта антибиотикорезистент-ности. AMR map» за 2012-2019 гг. отмечаются сопоставимые данные о встречаемости и резистентности микроорганизмов [16, 17]. Согласно данным «Карты антибиоти-корезистентности. AMR map», наиболее частыми видами микроорганизмов у пациентов с осложненными ИМП являются Escherichia coli (30,6%) и Klebsiella pneumoniae (25,1%). Доля штаммов Enterococcus faecalis составила 9,1%. Из парентеральных препаратов наибольшей активностью в отношении Escherichia coli обладают имипенем и амикацин (98,1% и 88,1%), чувствительность к ципрофлоксацину составила 36,3%. Встречаемость Pseudomonas aeruginosa составляет 12,3%, максимальную чувствительность демонстрируют амикацин (49,4%) и меропенем (из карбапенемов (47,0%)). Частота продукции БЛРС среди штаммов Escherichia coli в субпопуляции пациентов с осложненными ИМП составила 42,6%.
Особую настороженность вызывают высокая частота резистентности бактерий к препаратам группы фторхинолонов и относительно высокий процент встречаемости штаммов БЛРС у энтеробактерий. Следовательно, препараты группы фторхинолонов не могут применяться в качестве эмпирической терапии больных с осложненными ИМП,исключение могут составлять безальтернативные случаи аллергических реакций у пациентов на другие группы антибактериальных препаратов. Широкое применение таких препаратов резерва как карбапенемы, полимиксин Е, тигециклин, линезолид, в том числе и дженериков, у пациентов с осложненными ИМП привело к появлению панрезистентных штаммов таких как Klebsiella pneumoniae и Acinetobacter baumannii
[18, 19]. Схемы терапии пациентов, с выделенными панрезистентными штаммами, сопряжены с высокой частотой неблагоприятных результатов лечения.
Учитывая столь широкое распространение резистентных к этиотропным препаратам штаммов микроорганизмов, большое количество пациентов с иммуносупрессивными состояниями, рост рецидивирующих инфекций, современное здравоохранение возлагает надежды на эффективность «новых» антибактериальных препаратов, таких как имипенем/релебактам (карбапенем/инги-битор бета-лактамаз); эравациклин (синтетический тетрациклин); плазомицин (группа аминогликозидов), де-лафлоксацин (группа фторхинолонов); омадациклин (по-лусинтетический тетрациклин), цефтолозан/тазобактам обладающий антисинегнойной активностью и др. [20].
ВЫВОДЫ
С целью замедления темпа резистентности микроорганизмов к антибактериальным препаратам необходим постоянный контроль спектра резистентности штаммов в каждом стационаре и на этапе амбулаторного звена. С целью повышения эффективности лечения больных осложненных ИМП необходимо избавление пациентов от дренажей и катетеров в короткие сроки, коррекция сопутствующих заболеваний, осложняющих течение инфекционных процессов. Важно и строгое соблюдение правил асептики и антисептики на этапах хирургического лечения пациентов, с целью профилактики послеоперационных осложнений. Следуя современным стратегиям рациональной антибиотикотерапии, необходимо продолжать мониторить антибиотикорезистентность микроорганизмов выявлять резистентные штаммы, широко вводить в практику ускоренной лабораторной диагностики маркеры резистентности бактерий. Кроме того, в комплексной терапии больных ИМП, с целью повышения эффективности лечения, необходимо широко применять альтернативные схемы, такие как физиотерапия, фитотерапия, иммуно-активная профилактика, бактериофаготерапия.
ЛИТЕ РАТУPA/REFEREN CE S
ЛИТЕ РАТУPA/REFEREN CE S
Сведения об авторах:
Вклад авторов:
Котов С.В. – дизайн исследования, анализ полученных данных, сбор и обработка информации, 20%
Пульбере С.А. – концепция, дизайн исследования, 50%
Желтикова Е.А. – статистическая обработка, написание текста, 15%
Беломытцев С.В., Перов Р.А., Алесина Н.В. – получение данных для анализа, обзор публикаций по теме статьи, по 5%
Конфликт интересов: Авторы заявляют об отсутствии конфликта интересов.
Финансирование: Исследование проведено без спонсорской поддержки.
Список литературы Антибиотикорезистентность - новый вызов современной урологии
- Choe HS, Lee SJ, Cho YH, Qek M, Tandogdu Z, Wagenlehner F, et al. Aspects of urinary tract infections and antimicrobial resistance in hospitalise urology patient in Asia: 10-year's results of the global prevalence study of infections in urology (GPIU). J Infect Chemother 2018;24(4):278-283. 10.1016/ j.jiac.2017.11.013. DOI: 10.1016/j.jiac.2017.11.013
- Малхасян В.А., Иванов В.Ю., Ходырева Л.А., Дударева А.А., Куприянов Ю.А., Редькович В.И., и др. Анализ оказания специализированной медицинской помощи пациентам с острым обструктивным пиелонефритом в урологических стационарах г. Москвы. Экспериментальная и клиническая урология 2016;(4):6-31.
- McLellan LK, Hunstad DA. Urinary tract infection: pathogenesis and outlook. Trends Mol Med 2016;22(11):946-957. 10.1016/ j.molmed.2016.09.003. DOI: 10.1016/j.molmed.2016.09.003
- Яковлев С.В., Суворова М.П. Обоснование антибактериальной терапии нозокомиальных инфекций, вызванных полирезистентными микроорганизмами. Клиническая фармакология и терапия 2011;20(2):1-10.
- Агеевец В.А., Партина И.В., Лисицына Е.С. и др. Чувствительность грамотрицательных бактерий, продуцентов карбапенемаз, к антибиотикам различных групп. Антибиотики и химиотерапия 2013;58(3-4):3-6
- Аляев Ю.Г., Глыбочко П.В., Пушкарь Д.Ю. Урология. Российские клинические рекомендации. М.: ГЭОТАР-Медиа, 2016. 496 с
- Masajtis-Zagajewska A, Nowicki M. New markers of urinary tract infection. Clin Chim Acta 2017;471:286-291.
- DOI: 10.1016/jxca.2017.06.003
- Кулмагамбетов И.Р., Сарсенбаева С.С., Рамазанова Ш.Х., Есимова Н.К. Современные подходы к контролю и сдерживанию антибиотикорезистентности в мире. Международный журнал прикладных и фундаментальных исследований 2015;(9-1):54-59.
- Каприн А.Д., Аполихин О.И., Сивков А.В., Солцева Е.В., Комарова В.А. Анализ уронефрологической заболеваемости и смертности в Российской Федерации за период 2002-2014 гг. по данным официальной статистики. Экспериментальная и клиническая урология 2016;(3):4-13
- Caskurlu H, Culpan M, Erol B, Turan T, Vahaboglu H, Caskurlu T. Changes in antimicrobial resistance of urinary tract infections in adult patients over a 5-year period. Urol Int 2020;104(3-4):287-292.
- DOI: 10.1159/000504415
- Глыбочко П.В., Коган М.И., Набока Ю.Л. (под ред.) Инфекции и воспаления в урологии. М.: Медфорум, 2019. 888 с.
- Котов С.В., Хачатрян А.Л., Гуспанов Р.И., Пульбере С.А., Беломытцев С.В., Юсуфов А.Г, Котова Д.П. Оценка частоты послеоперационных хирургических осложнений у пациентов, подвергшихся радикальной цистэктомии. Онкоурология 2018;14(4):95-102.
- DOI: 10.17650/1726-9776-2018-14-4-95-102
- Определение чувствительности микроорганизмов к антимикробным препаратам. Клинические рекомендации. Версия 2018-03. 206 с.
- EUCAST Guidelines for the identification of resistance and resistance mechanisms of particular clinical and/or epidemiological significance Version 2.01. July 2017.
- Палагин И.С., Сухорукова М.В., Дехнич А.В., Эйдельштейн М.В., Перепанова Т.С., Козлов Р.С. Антибиотикорезистентность возбудителей внебольничных инфекций мочевых путей в России: результаты многоцентрового исследования "Дармис-2018" Клиническая микробиология и антимикробная химиотерапия 2019;21(2):134-146.
- Кузьменков А.Ю., Трушин И.В., Авраменко А.А., Эйдельштейн М.В., Дехнич А.В., Козлов Р.С. AMRmap: интернет-платформа мониторинга антибиотикоре-зистентности. Клиническая микробиология и антимикробная химиотерапия 2017;19(2):84-90
- Виноградова А.Г., Кузьменков А.Ю. Практическое применение AMRmap: элементы подхода "от общего к частному" на примере Klebsiella pneumoniae. Клиническая микробиология и антимикробная химиотерапия 2019;21(2):181-186.
- Lenhard JR, Bulitta JB, Connell TD, King-Lyons N, Landersdorfer CB, Cheah SE, et al: High-intensity meropenem combinations with polymyxin B: new strategies to overcome carbapenem resistance in Acinetobacter baumannii. J Antimicrob Chemother 2017;72(1):153-65.
- DOI: 10.1093/jac/dkw355
- Ni W, Han Y, Zhao J, Wei C, Cui J, Wang R, Liu Y. Tigecycline treatment experience against multidrug-resistant Acinetobacter baumannii infections: a systematic review and meta-analysis. Int J Antimicrob Agents 2016;47(2):107-16.
- DOI: 10.1016/j.ijantimicag.2015.11.011
- Перепанова Т.С., Шадеркина В.А. Отчет о XII Всероссийской научно-практической конференции с международным участием "Рациональная фармакотерапия в урологии". Экспериментальная и клиническая урология 2018;(1):124-127.


