Антитела к бензо[a]пирену в сыворотке крови больных плоскоклеточным раком легких
Автор: Поленок Елена Геннадьевна, Аносова Татьяна Петровна, Аносов Михаил Петрович, Красильникова Ксения Сергеевна, Гуров Евгений Александрович, Титов Виктор Александрович, Вержбицкая Наталья Евгеньевна, Вафин Илгиз Ахметович, Рагожина Светлана Егоровна, Глушков Андрей Николаевич
Рубрика: Влияние экологии на внутренние болезни
Статья в выпуске: 1-7 т.13, 2011 года.
Бесплатный доступ
Изучены особенности иммунного ответа на химический канцероген бензо[a]пирен (БП) у мужчин, больных плоскоклеточным раком легких (ПРЛ). Выявлены изотипические различия в образовании антител (АТ) к БП у мужчин, больных ПРЛ, по сравнению со здоровыми. У больных ПРЛ чаще наблюдается высокий уровень IgA и IgG АТ-БП. У курящих больных ПРЛ чаще встречаются высокие уровни IgG АТ-БП. Для больных на II стадии ПРЛ характерны высокие уровни АТ-БП классов А и G. Риск возникновения ПРЛ при высоком уровне IgG АТ-БП возрастает более чем в 3 раза.
Антитела, бензо[a]пирен, плоскоклеточный рак легких
Короткий адрес: https://sciup.org/148100719
IDR: 148100719 | УДК: [616.24-006:616.15]-07
Текст научной статьи Антитела к бензо[a]пирену в сыворотке крови больных плоскоклеточным раком легких
Аносова Татьяна Петровна, научный сотрудник лаборатории иммунохимии
Аносов Михаил Петрович, научный сотрудник лаборатории иммунохимии
Красильникова Ксения Сергеевна, младший научный сотрудник лаборатории иммунохимии
Гуров Евгений Александрович, ведущий инженер-технолог лаборатории иммунохимии
Титов Виктор Александрович, заведующий торакальным отделением
Вержбицкая Наталья Евгеньевна, заведующая патологоанатомическим отделением
Вафин Илгиз Ахметович, главный врач
Рагожина Светлана Егоровна, заместитель главного врача по медицинской части
бензо[a]пирена (БП) [1, 12]. Известны механизмы его биохимической трансформации в организме, однако роль иммунной системы в адаптации к БП изучена недостаточно [14]. В экспериментах in vivo и in vitro авторами ряда работ [10, 11, 15] показано, что антитела (АТ) к химическим канцерогенам способны тормозить или стимулировать возникновение злокачественных опухолей в зависимости от изотипа и количества. Имеются данные о том, что АТ к аддуктам БП с макромолекулами организма обнаруживаются как у людей с высокой экспозицией к БП [3, 13], так и у больных раком молочной железы и органов желудочнокишечного тракта [2, 9]. Поэтому изучение роли и функции антител к БП, которые могут иметь диагностическое и прогностическое значение при других онкологических заболеваниях, по-прежнему остается актуальной задачей.
Цель работы : исследование особенностей образования АТ к БП у мужчин, больных плоскоклеточным раком легкого.
Материалы и методы. Обследованы 318 мужчин с плоскоклеточным раком легкого (ПРЛ), которые поступали на лечение в Областной клинический онкологический диспансер г. Кемерово. Диагноз ПРЛ в каждом случае был установлен морфологически. У основной части больных (62%) была диагностирована II стадия РЛ, I, III и IV стадии заболевания были выявлены в 12%, 19% и 7% соответственно. Средний возраст мужчин, больных ПРЛ, составил 59,8±0,4 лет. В группу сравнения вошли условно здоровые мужчины (71 человек), не болеющие РЛ. Средний возраст мужчин в группе сравнения – 46,6±1,1 года. Забор периферической крови проводился с информированного согласия обследуемых и в соответствии с этическими нормами Хельсинской декларации (2000). Исследование АТ к БП проводили с помощью неконкурентного иммуно-ферментного анализа в собственной модификации [5]. Уровень АТ к БП определяли по соотношению связывания АТ с конъюгатом БП – бычий сывороточный альбумин (за вычетом фонового связывания) к бычьему сывороточному альбумину. Величина уровня АТ-БП показывала, во сколько раз связывание с канцерогеном превышает связывание с белком-носителем. Статистическую обработку данных проводили с помощью ППК Statistica 6.0. Ненормальный характер распределения показателей определяли с помощью критерия Шапиро-Уилка и в дальнейшем статистически значимые различия между группами выявляли с помощью непараметрического критерия χ2 с поправкой Йетса на непрерывность вариации и U-критерия Манн-Уитни. Относительные риски (RR) возникновения ПРЛ рассчитывали по методу [6] с доверительным интервалом (CI) при 95% уровне значимости.
Результаты и обсуждения. В результате исследования были выявлены АТ к БП классов A, G и M как у больных ПРЛ, так и у здоровых мужчин. Однако медиана уровня IgG АТ-БП была в 1,6 раз выше у мужчин, больных ПРЛ, по сравнению со здоровыми (3,9 против 2,5 соответственно, р=0,0007). По медианам уровней АТ-БП классов A и М сравниваемые группы не отличались. Далее была исследована частота встречаемости низких и высоких уровней АТ-БП в исследуемых группах (рис. 1).
52% соответственно, χ2=5,2; р=0,02). При этом риск возникновения онкологического заболевания увеличивается почти в 2 раза (RR=1,9; CI 0,9-4,0). Такая же закономерность прослеживается и для АТ-БП класса G: у больных ПРЛ чаще встречался высокий уровень IgG АТ-БП (>2), чем в группе сравнения (81% против 56% соответственно, χ2=17,9; р = 0,00001). При этом риск возникновения ПРЛ значительно выше (RR=3,3; CI 1,5-6,9). По частоте встречаемости высоких и низких уровней АТ-БП класса М больные ПРЛ не отличались от здоровых мужчин.
Далее исследовали характер образования АТ-БП в зависимости от курения (рис. 2). Между курящими и некурящими мужчинами выявлены следующие различия. В группе сравнения у курящих уровень IgA АТ-БП был в 2 раза выше по сравнению с некурящими (2,9 против 1,4 соответственно, р=0,02), а у курящих больных ПРЛ в 2 раза выше уровень IgМ АТ-БП в отличие от некурящих (2,8 против 1,4 соответственно, р=0,04). Наибольшая разница между больными ПРЛ и группой сравнения была выявлена среди некурящих: медиана уровня IgG АТ-БП у больных ПРЛ была в 2,1 раз выше, чем в группе сравнения (4,5 против 2,1 соответственно, р=0,01), а медиана уровня IgМ АТ-БП – в 1,6 раз ниже (1,4 против 2,3 соответственно, р=0,04). Между курящими больными ПРЛ и здоровыми мужчинами различий по медианам уровней АТ-БП трех классов выявлено не было. Однако у курящих больных ПРЛ чаще встречались повышенные уровни IgG АТ-БП (>2), чем у здоровых курильщиков (80% против 56% соответственно, χ2=7,7; р=0,006). При этом риск возникновения ПРЛ возрастает почти в 3 раза (RR=2,9; CI 1,6-5,3).
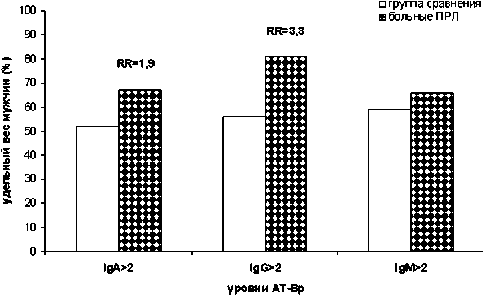
Рис. 1. Частота встречаемости повышенных (>2) уровней антител к бензо[a]пирену у мужчин
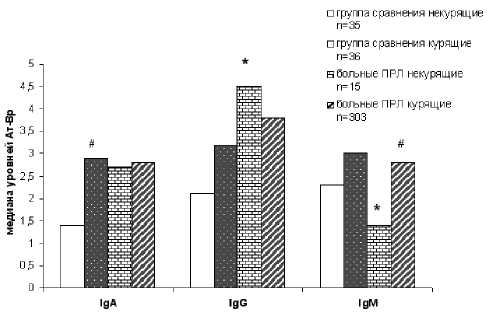
Примечание: * р<0,05 разница между больными и здоровыми; #р<0,05 разница между курящими и некурящими внутри группы
Рис. 2. Медианы уровней антител к бензо[a]пирену у больных ПРЛ и здоровых мужчин в зависимости от курения
Выяснилось, что у больных ПРЛ чаще встречался высокий уровень IgA АТ-БП (>2) в отличие от группы сравнения (67% против
При анализе уровней АТ-БП разных классов у больных ПРЛ в зависимости от стадии заболевания обнаружено следующее (рис. 3). Значимые отличия от группы сравнения были выявлены у больных ПРЛ I и II стадии: медиана уровня IgG АТ-БП была 1,6 раз выше у больных ПРЛ II стадии, чем в группе сравнения (3,9 против 2,5 соответственно, р=0,001), а медиана уровня IgМ АТ-БП была в 1,5 раз ниже у больных ПРЛ I стадии (2,0 против 2,9 соответственно, р=0,02). При этом у больных ПРЛ II стадии чаще встречались высокие уровни АТ-БП классов А и G по сравнению со здоровыми мужчинами (69% против 52% соответственно, χ2=4,9; р=0,03; 82% против 56% соответственно, χ2=14,7; р=0,0001). Были выявлены значимые различия по уровню АТ-БП у больных ПРЛ на разных стадиях следующие: у больных ПРЛ II стадии медиана уровня IgA АТ-БП была 1,4 раз выше, чем у больных ПРЛ III стадии (2,8 против 2,0 соответственно, р=0,04), а медиана уровня IgМ АТ-БП была в 1,5 раз выше, чем у больных ПРЛ I стадии (2,9 против 2,0 соответственно, р=0,03). При этом у больных ПРЛ II стадии чаще встречались высокие уровни IgA АТ-БП в отличие от больных ПРЛ III стадии (69% против 50% соответственно, χ2=4,4; р=0,03) и высокие уровни IgG АТ-БП по сравнению с больными ПРЛ I стадии (82% против 61% соответственно, χ2=5,1; р=0,02).
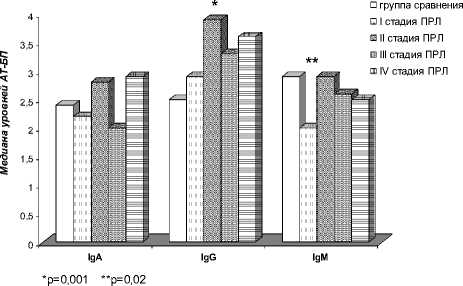
Рис. 3. Медианы уровней антител к бензо[a]пирену у больных ПРЛ в зависимости от стадии заболевания
Выводы: выявлены изотипические различия в образовании АТ-БП у мужчин, больных ПРЛ, по сравнению со здоровыми. У больных ПРЛ чаще наблюдался высокий уровень IgA и IgG АТ-БП, при этом риск возникновения ПРЛ возрастает почти в 3 раза при высоких уровнях IgG АТ-БП (>2). Фактор курения по разному оказывает влияние на уровень АТ-БП: у курящих больных ПРЛ уровень АТ-БП класса М в 2 раза выше, чем у некурящих, а у здоровых курильщиков в 2 раза выше уровень АТ-БП класса A. Между курящими больными ПРЛ и здоровыми мужчинами различий по средним показателям уровней АТ-БП трех классов выявлено не было. Однако у курящих больных ПРЛ чаще встречались высокие уровни IgG АТ-БП (>2), чем у здоровых курильщиков. У некурящих больных ПРЛ обнаружены высокий уровень IgG и низкий уровень IgM АТ-БП. Также обнаружено, что изотипический состав АТ-БП варьирует в зависимости от стадии ПРЛ. У больных ПРЛ II стадии чаще наблюдаются высокие уровни АТ-БП классов А и G (>2) в отличие от здоровых мужчин. У больных ПРЛ II стадии уровень IgA АТ-БП выше, чем у больных ПРЛ III стадии, а уровень IgM АТ-БП выше, чем у больных ПРЛ I стадии. Таким образом, очевидна необходимость дальнейшего изучения функций АТ-БП в иммунологической защите от химических канцерогенов, а также определение диагностической значимости иммуноанализа АТ-БП при раке легкого.
Список литературы Антитела к бензо[a]пирену в сыворотке крови больных плоскоклеточным раком легких
- Бахлаев, И.Е. Рак легкого (учебное пособие)/И.Е. Бахлаев, А.П. Толпинский. -Петрозаводск: изд-во ПГУ, 2000. 74 с.
- Глушков, А.Н. Изотипические особенности антител к полициклическим ароматическим углеводородам у больных раком молочной железы, желудка, толстой и прямой кишки/А.Н. Глушков, Т.П. Аносова, Н.Г. Небесная, Л.Я. Железнова//Эксперимент. онкология. 1996. № 18. С. 426-428.
- Глушков, А.Н. Антитела к бензо[a]пирену как маркер канцерогенной нагрузки у рабочих углеперерабатывающей промышленности/А.Н. Глушков, Е.Г. Поленок, С.А. Мун и др.//Гигиена и санитария. 2010. № 2. С. 53-56.
- Глушков, А.Н. Взаимосвязи заболеваемости раком легкого с промышленным загрязнением атмосферного воздуха в угледобывающих регионах России и Украины/А.Н. Глушков, Г.В. Бондарь, С.А. Мун и др.//Environment and Health: Довкiлля та здоров’я: науковий журнал з проблем медичної екологiї, гiгiєни, охорони здоров’я та екологiчної безпеки. 2010. № 3. С. 45-50.
- Глушков, А.Н. Сывороточные антитела к бензо[a]пирену и хромосомные аберрации в лимфоцитах периферической крови у рабочих углеперерабатывающего предприятия/А.Н. Глушков, Е.Г. Поленок, Т.П. Аносова и др.//Российский иммунологический журнал. 2011. Т. 5(14), № 1. С. 39-44.
- Двойрин, В.В. Методы эпидемиологических исследований при злокачественных опухолях. -М.: Медицина, 1975. 100 с.
- Мерабишвили, В.М. Статистика рака легкого (заболеваемость, смертность, выживаемость)/В.М. Мерабишвили, О.Т. Дятченко//Практическая онкология. 2000. № 3. С. 3-7.
- Мун, С.А. Влияние атмосферных выбросов коксохимического производства на заболеваемость злокачественными новообразованиями/С.А. Мун, С.А. Ларин, А.Н. Глушков и др.//Гигиена и санитария. 2008. № 3. С. 11-13.
- Chagnaud, J.L. Identification and immunochemical characterization of IgA in sera of patients with mammary tumors/J.L. Chagnaud, S. Faiderbe, M. Geffard//Int. J. Cancer. 1992. V. 50. P. 395-401.
- Creech, H. Compounds synthesized from protein and carcinogenic hydrocarbons/H. Creech, W. Franks//Amer. J. Cancer. 1937. V. 30. P. 555-562.
- Curtis, G. Antibody stimulation of benzo[a]pyrene cancinogenesis/G. Curtis, W. Ryan, F. Stenback//Cancer Lett. 1978. V. 4. P. 223-228.
- Fucic, A. Lung cancer and environmental chemical exposure: a review of our current state of knowledge with reference to the role of hormones and hormone receptors as an increased risk factor for developing lung cancer in man/A. Fucic, M. Gamulin, Z. Ferencic et al.//Toxicologic Pathology. 2010. № 000. P. 1-7.
- Galati, R. Detection of antibodies to the benzo[a]pyrene diol epoxide-DNA adducts in sera from individuals exposed to low doses of polycyclic aromatic hydrocarbons/R. Galati, A. Zijno, R. Crebelli et al.//J. Exp. Clin. Cancer Res. 2001. V. 20, № 3. Р. 359-364.
- Glushkov, A.N. Immunostimulation of the chemical-induced carcinogenesis in the phase of initiation//Medical Hypotheses. 2002. V. 59, № 5. P. 501-503.
- Moolten, F. Protection of mice against 7,12-dimethylbenz[a]antracene-induced skin tumors by immunization with a fluorinated analog of carcinogen/F. Moolten, B. Schreiber, A. Rizzone//Cancer Res. 1981. V. 41. P. 452-464.

![Антитела к бензо[a]пирену в сыворотке крови больных плоскоклеточным раком легких Антитела к бензо[a]пирену в сыворотке крови больных плоскоклеточным раком легких](/file/cover/148100719/antitela-k-benzo-a-pirenu-v-syvorotke-krovi-bolnyh-ploskokletochnym-rakom-legkih.png)
