Антитела к низкомолекулярным ксено- и эндобиотикам и риски возникновения рака легкого
Автор: Глушков Андрей Николаевич, Поленок Елена Геннадьевна, Мун Стелла Андреевна, Титов Виктор Александрович, Вафин Илгиз Ахметович, Рагожина Светлана Егоровна, Костянко М.В.
Рубрика: Внутренние, профессиональные и экологически обусловленные заболевания
Статья в выпуске: 5-2 т.16, 2014 года.
Бесплатный доступ
Исследовали особенности образования антител к ксенобиотику бензо[a]пирену и эндобиотикам (стероидным гормонам) в зависимости от полиморфных вариантов гена GSTM1 у мужчин, больных раком легкого. Было установлено, что риски возникновения рака легкого значительно выше у мужчин носителей GSTM1«+» с высоким уровнем IgA- и IgG-антител к бензо[a]пирену и эстрадиолу и носителей делеционного генотипа GSTM1 с низким уровнем IgG-антител к прогестерону. Таким образом, нами подтверждено ранее высказанное предположение о взаимосвязи образования антител к низкомолекулярным ксено- и эндобиотикам с активностью ферментов их метаболизма.
Рак легкого, антитела, бензо[a]пирен, эстрадиол, прогестерон, полиморфизм генов
Короткий адрес: https://sciup.org/148101850
IDR: 148101850 | УДК: 616.24-006.6:616-097.3
Текст научной статьи Антитела к низкомолекулярным ксено- и эндобиотикам и риски возникновения рака легкого
Титов Виктор Александрович, заведующий торакальным отделением
Вафин Илгиз Ахметович, главный врач
Рагожина Светлана Егоровна, заместитель главного врача по медицинской части циации образования АТ к БП, ЭС и ПГ с полиморфными вариантами гена глутатион-S-транс-феразы М1 (GSTM1) у здоровых мужчин и больных РЛ.
Материалы и методы. Нами было обследовано 389 мужчин. Из них 164 мужчины с диагнозом: немелкоклеточный РЛ, которые поступили на лечение в Областной клинический онкологический диспансер г. Кемерово. Диагноз РЛ в каждом случае был подтвержден морфологически, рентгенологически и эндоскопически. Средний возраст мужчин больных РЛ составил 59,1±7,3 лет. В группу сравнения вошли условно здоровые мужчины (225 человек) с Кемеровского центра крови, не болеющие РЛ и другими заболеваниями дыхательных путей. Средний возраст здоровых мужчин составил 50,2±7,8 лет.
Забор периферической крови осуществлялся согласно этическим стандартам в соответствии с Хельсинской декларацией 2000 г. и «Правилами клинической практики в Российской Федерации», утвержденными Приказом Минздрава РФ № 266 от 19.06.2003 г. Все лица, участвовавшие в исследовании, дали информированное письменное согласие на участие в нем. Исследование АТ к БП, ЭС и ПГ проводили с помощью модифицированного нами неконкурентного иммуноферментного анализа [6, 7]. Уровни АТ к гаптенам выражали в относительных единицах и вычисляли по формуле:
АТ-Х=(ODХ-БСА-ODБСА)/ODБСА где Х= БП, ЭС, ПГ; ODХ-БСА – связывание АТ с конъюгатом гаптен-БСА, ODБСА – связывание с БСА.
Для анализа генетического полиморфизма ферментов биотрансформации выделяли геномную ДНК методом фенольно-хлороформной экстракции с последующим осаждением этанолом. Образцы ДНК хранили при -20ºС. Типиро-вание гена GSTM1(del) проводили методом мультиплексной ПЦР с флуоресцентной детекцией продуктов в режиме Real-Time с помощью тест-систем, разработанных в ИХБФМ СО РАН (г. Новосибирск). Подробно методика описана в работе [11]. Статистическую обработку результатов проводили с использованием ППП STATISTICA 6.0 (StatSoft, Inc., USA). Ненормальный характер распределения показателей определили с помощью критерия Шапиро-Уилка и в дальнейшем статистически значимые различия между группами выявляли с помощью непараметрического критерия χ2 с поправкой Йетса на непрерывность вариации и U-критерия Манна-Уитни. Риск возникновения РЛ оценивали с помощью величины ОR с доверительным интервалом (CI) при 95% уровне значимости. Для оценки пороговых значений уровней АТ был проведен ROC-анализ [12] и рассчитаны величины AUC, характеризующие прогностическую значимость показателей.
Результаты и обсуждение. В результате молекулярно-генетического анализа не удалось выявить разницы между сравниваемыми группами по полиморфизму GSTM1. Делеция гена обнаружена в 101 случае из 223 (45%) у здоровых мужчин и в 55 случаях из 127 (43%) у больных РЛ. Уровни IgA и IgG-АТ к БП, ЭС были повышены у больных РЛ (рис. 1). Уровни IgA-ПГ не отличались значимо, а IgG-ПГ оказались ниже у больных по сравнению со здоровыми. Таким образом, при анализе более широких выборок больных и здоровых мужчин в настоящем исследовании подтверждены ранее полученные результаты [7-9].
Кроме того, выяснилось, что повышенные уровни АТ к БП и ЭС значимо чаще встречаются при РЛ (табл. 1). При этом рассчитанные риски РЛ (OR) возрастают в 1,8-3,5 раза. Низкие значения уровней указанных АТ свидетельствуют о невысоких рисках РЛ (0,3-0,5). Расчет показателей AUC показал хорошую (0,6-0,65) и отличную (0,84-0,85) диагностическую значимость анализа IgG и IgA-АТ, соответственно, для определения рисков РЛ.
Для достижения цели работы рассчитали медианы уровней АТ у носителей нормального и делеционного генотипов GSTM1 (табл. 2). Не обнаружили разницы между ними по IgA-АТ ни у больных РЛ, ни в группе сравнения. В то же время у здоровых мужчин уровни IgG-АТ при делеции GSTM1 оказались выше, чем при GSTM1«+» (IgG-ЭС и IgG-ПГ статистически значимо, р=0,003 и 0,015 соответственно). У больных РЛ наблюдалась противоположная тенденция – при делеции GSTM1 уровни АТ были ниже, хотя и статистически недостоверно.
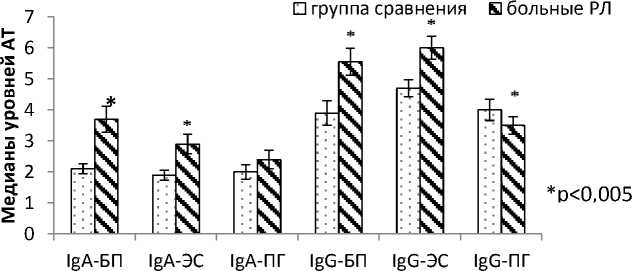
Рис. 1. Медианы уровней антител классов A и G (IgA, IgG) к БП, ПГ и ЭС у здоровых мужчин и больных РЛ
При сравнении исследуемых групп отдельно для GSTM1«0» и GSTM1«+» выяснилось следующее. Максимально выраженное статистически более значимое превышение уровней АТ у больных РЛ зафиксировано у носителей GSTM1«+» для АТ-БП и АТ-ЭС. Например, значение р при сравнении групп по IgA-БП у носителей GSTM1«+» составило 0,000001, а при де-леции гена – 0,0005 (менее достоверно). При сравнении групп по IgG-БП значение р у носителей GSTM1«+» составило 0,000001, а при деле-ции гена – 0,91 (статистически недостоверно). Противоположная ситуация обнаружена при анализе АТ-ПГ. У больных РЛ с делецией GSTM1 уровни IgG-ПГ были значительно ниже, чем у здоровых (медианы 2,7 и 4,8 соответственно) при р=0,000001. Разница между группами при GSTM1«0» была менее выражена (р=0,05).
Таблица 1. Частота встречаемости низких и высоких уровней IgA- и IgG-антител к БП, ЭС и ПГ у здоровых мужчин и больных РЛ
|
АТ |
Группа сравнения (n=225) n / % |
Больные РЛ (n=164) n / % |
Χ2, р |
OR (95% CI) |
AUC |
|
IgА-БП > 3 ≤ 3 |
69/31 156/69 |
100/61 64/39 |
34,2 0,0005 |
3,5 (2,3-5,5) 0,3 (0,2-0,4) |
0,87 |
|
IgА-ЭС > 2 ≤ 2 |
105/47 120/53 |
114/70 50/30 |
19,2 0,0005 |
2,6 (1,7-4,1) 0,4 (0,2-0,6) |
0,84 |
|
IgА-ПГ > 2 ≤ 2 |
112/50 113/50 |
97/59 67/41 |
2,9 0,08 |
1,5 (0,9-2,2) 0,7 (0,4-1,1) |
0,64 |
|
IgG-БП > 4 ≤ 4 |
110/49 115/51 |
111/68 53/32 |
12,9 0,001 |
2,2 (1,4-3,4) 0,5 (0,3-0,7) |
0,65 |
|
IgG-ЭС > 6 ≤ 6 |
77/34 148/66 |
80/49 84/51 |
7,8 0,006 |
1,8 (1,2-2,8) 0,5 (0,4-0,8) |
0,60 |
|
IgG-ПГ > 4 ≤ 4 |
112/50 113/50 |
65/40 99/60 |
3,5 0,06 |
0,7 (0,4-1,0) 1,5 (0,9-2,3) |
0,46 |
Таблица 2. Медианы уровней антител (IgA, IgG) к БП, ЭС и ПГ у здоровых мужчин и больных РЛ в зависимости от полиморфных вариантов гена GSTM1
|
АТ |
Группа сравнения (N=223) |
Больные РЛ (N=127) |
GSTM1"0 " |
GSTM1"+ " |
||||
|
GSTM1"0 " |
GSTM1"+ " |
p |
GSTM1"0 " |
GSTM1"+ " |
p |
|||
|
Me±m |
Me±m |
Me±m |
Me±m |
p |
p |
|||
|
IgA-БП |
2,1±0,2 |
2,1±0,2 |
0,50 |
3,3±0,6 |
3,55±0,8 |
0,33 |
0,0005 |
0,000001 |
|
IgA-ЭС |
2±0,2 |
1,75±0,2 |
0,08 |
2,7±0,4 |
2,8±0,6 |
0,73 |
0,04 |
0,0003 |
|
IgA-ПГ |
1,9±0,3 |
1,95±0,3 |
0,25 |
2,2±0,3 |
2,2±0,5 |
0,99 |
0,53 |
0,75 |
|
IgG-БП |
4,5±0,6 |
3,4±0,5 |
0,10 |
4,7±0,7 |
5,95±0,7 |
0,07 |
0,91 |
0,000001 |
|
IgG-ЭС |
5,2±0,4 |
4,2±0,3 |
0,003 |
5,2±0,6 |
6,1±0,6 |
0,62 |
0,70 |
0,007 |
|
IgG-ПГ |
4,8±0,5 |
3,4±0,5 |
0,015 |
2,7±0,4 |
2,65±0,4 |
0,78 |
0,000001 |
0,05 |
Далее сравнили группы по частоте встречаемости низких и высоких уровней АТ отдельно для носителей GSTM1«+» и при делеции этого гена (табл. 3). Обнаружили, что значения χ2 и OR при GSTM1«+» значительно выше, чем при GSTM1«0» для АТ-БП и АТ-ЭС. Например, у носителей GSTM1«+» при высоких уровнях IgA-БП χ2=22,9 (р=0,0005) и OR=4,6 (2,4-9,1). А при делеции этого гена χ2=3,9 (р=0,046) и OR=2,1 (1,01-4,3). При анализе IgG-ПГ наблюдалась противоположная ситуация. При делеции GSTM1 χ2=11,8 (р=0,001) и OR=3,6 (1,7-7,8) для низких уровней этих АТ. А у носителей GSTM1«+» разница между больными и здоровыми вообще отсутствовала.
Сравнение результатов, представленных в табл. 2 и 3 показало, что анализ исследуемых АТ с учетом генотипа GSTM1 более информативен. Обнаружение высоких уровней АТ-БП и АТ-ЭС у носителей GSTM1«+» (табл. 3) сопряжено с более высокими значениями OR по сравнению с одним только анализом АТ (табл. 2). Например, в первом случае при анализе IgA-БП OR=4,6 (2,4-9,1), а во втором OR=3,5 (2,3-5,5). Обнаружение низких значений IgG-ПГ при делеции в GSTM1 (табл. 3) сопряжено с более высокими значениями OR=3,6 (1,7-7,8) при высоком уровне статистической значимости (χ2=11,8, р=0,001). Без учета генотипа частота обнаружения низких значений IgG-ПГ у больных РЛ статистически не отличалась от здоровых (χ2=3,5, р=0,06), а показатель AUC был ниже среднего (0,46).
Выводы: ранее высказанное предположение о взаимосвязи образования АТ к низкомолекулярным ксено- и эндобиотикам с активностью ферментов их метаболизма получило подтверждение. Одна из основных задач клинической иммунохимии канцерогенеза, а именно, создание комплекса иммунологических и молекулярно-генетических методов определения риска онкологических заболеваний [10], представляется решаемой и полезной с практической точки зрения. Анализ АТ к химическим канцерогенам окружающей среды и стероидным гормонам в сочетании с генетическим полиморфизмом ферментов биотрансформации рекоменду- ется для дальнейших клинических испытаний в разработке методов профилактики РЛ и других злокачественных опухолей.
Таблица 3. Частота встречаемости низких и высоких уровней антител (IgA, IgG) к БП, ЭС и ПГ у мужчин в зависимости от полиморфных вариантов гена GSTM1
|
АТ |
Группа сравнения n / % |
Больные РЛ n / % |
χ2, р |
OR (95% CI) |
|
GSTM1 «+» |
||||
|
IgА-БП > 3 ≤ 3 |
31/25 91/75 |
44/61 28/39 |
22,9 0,0005 |
4,6 (2,4-9,1) 0,2 (0,1-0,4) |
|
IgА-ЭС > 2 ≤ 2 |
52/43 70/57 |
47/65 25/35 |
8,4 0,005 |
2,5 (1,3-4,0) 0,4 (0,2-0,8) |
|
IgА-ПГ > 2 ≤ 2 |
60/49 62/51 |
37/51 35/49 |
0,02 0,9 |
|
|
IgG-БП > 4 ≤ 4 |
54/44 68/56 |
50/69 22/31 |
10,6 0,002 |
2,9 (1,5-5,6) 0,3 (0,2-0,7) |
|
IgG-ЭС > 6 ≤ 6 |
32/26 90/74 |
38/53 34/47 |
12,7 0,001 |
3,1 (1,6-6,1) 0,3 (0,2-0,6) |
|
IgG-ПГ > 4 ≤ 4 |
53/43 69/57 |
23/32 49/68 |
2,1 0,2 |
|
|
GSTM1 «0» |
||||
|
IgА-БП > 3 ≤ 3 |
37/37 64/63 |
30/55 25/45 |
3,9 0,046 |
2,1 (1,01-4,3) 0,5 (0,2-0,9) |
|
IgА-ЭС > 2 ≤ 2 |
51/50 50/50 |
37/67 18/33 |
3,4 0,06 |
|
|
IgА-ПГ > 2 ≤ 2 |
50/50 51/50 |
32/58 23/42 |
0,8 0,4 |
|
|
IgG-БП > 4 ≤ 4 |
55/54 46/46 |
32/58 23/42 |
0,08 0,8 |
|
|
IgG-ЭС > 6 ≤ 6 |
44/44 57/56 |
22/40 33/60 |
0,06 0,8 |
|
|
IgG-ПГ > 4 ≤ 4 |
58/57 43/43 |
15/27 40/73 |
11,8 0,001 |
0,3 (0,1-0,6) 3,6 (1,7-7,8) |
Работа выполнена в рамках проекта № 59.1.1. Программы фундаментальных научных исследований СО РАН.
Список литературы Антитела к низкомолекулярным ксено- и эндобиотикам и риски возникновения рака легкого
- Гуляева, Л.Ф. Ферменты биотрансформации ксенобиотиков в химическом канцерогенезе/Л.Ф. Гуляева, В.А. Вавилин, В.В. Ляхович -Новосибирск, 2000. 83 с.
- Землянова, М.А. Современные подходы к оценке метаболизма ксенобиотиков при поступлении в организм из внешней среды/М.А. Землянова, Ю.Л. Кольдибекова//Экология человека. 2012. № 8. С. 8-13.
- Суханов, В.А. Роль физиологических факторов в прогнозировании риска развития онкологических заболеваний на основе полиморфизма системы ферментов метаболизма ксенобиотиков/В.А. Суханов, Л.А. Пирузян//Физиология человека. 2010. Т. 36, № 6. С. 122-137.
- Аткарская, Н.В. Полиморфизм генов биотрансформации ксенобиотиков и контроль клеточной пролиферации в ассоциации с риском развития рака дыхательных путей/Н.В. Аткарская, Т.М. Заварыкина, Г.П. Жижина, Е.Б. Бурлакова//Молекулярная медицина. 2012. № 6. С. 52-56.
- Минина, В.И. Хромосомные аберрации у жителей Кемеровской области, проживающих на территориях с различным уровнем загрязнения атмосферного воздуха//Известия Самарского научного центра РАН. 2012. Т. 14, № 5(2). С. 483-485.
- Глушков, А.Н. Сывороточные антитела к бензопирену и хромосомные аберрации в лимфоцитах периферической крови у рабочих углеперерабатывающего предприятия/А.Н. Глушков, Е.Г. Поленок, Т.П. Аносова и др.//Российский иммунологический журнал. 2011. Т. 5(14), № 1. С. 39-44.
- Глушков, А.Н. Влияние курения на образование антител к химическим канцерогенам и стероидным гормонам у здоровых мужчин и больных раком легкого/А.Н. Глушков, Е.Г. Поленок, В.А. Титов м др.//Известия Самарского научного центра РАН. 2013. Т. 15, № 3(6). С. 1765-1768.
- Глушков, А.Н. Антитела к химическим канцерогенам и стероидным гормонам у больных раком легкого/А.Н. Глушков, Е.Г. Поленок, Н.Е. Вержбицкая и др.//Российский иммунологический журнал. 2014. №2. (в печати).
- Поленок, Е.Г. Антитела к бензопирену в сыворотке крови больных немелкоклеточным раком лёгкого/Е.Г. Поленок, Т.П. Аносова, М.П. Аносов и др.//Бюллетень ВСНЦ СО РАМН. 2012. №3(85). Часть 2. С. 151-154.
- Глушков, А.Н. Клиническая иммунохимия канцерогенеза: новые задачи и перспективы//Российский иммунологический журнал. 2013. Т. 7(16), № 1. С. 27-34.
- Гордеева, Л.А. Сочетание материнских полиморфизмов CYP1A2*1F и GST при врождённых пороках развития у плода и новорожденных/Л.А. Гордеева, О.А. Глушкова, Н.А. Ермоленко и др.//Медицинская генетика. 2011. № 11. С.9-15.
- Zweig, M.H. ROC plots: a fundamental evaluation in clinical medicine/M.H. Zweig, G. Campbell//Clinical Chemistry. 1993. 39, № 4. P. 561-577.


