Ассоциация генов TNF и LTA с осложнениями атеросклероза у больных, перенесших обострение ишемической болезни сердца
Автор: Затейщиков Дмитрий Александрович, Пушков Александр Алексеевич, Никитин Алексей Георгиевич, Бровкин Алексей Николаевич, Евдокимова Марина Андреевна, Бакланова Татьяна Николаевна, Терещенко Сергей Николаевич, Джаиани Нино Амирановна, Акатова Евгения Владимировна, Глезер Мария Генриховна, Галявич Альберт Сарварович, Козиолова Наталья Андреевна, Ягода Александр Валентинович, Боева Ольга Игоревна, Хоролец Екатерина Викторовна, Шлык Сергей Владимирович, Волкова Эмилия Григорьевна, Константинов Владимир Олегович, Носиков Валерий Вячеславович, Благодатских Константин Александрович
Журнал: Клиническая практика @clinpractice
Рубрика: Передовая статья
Статья в выпуске: 1 (13), 2013 года.
Бесплатный доступ
Цель представленного исследования – изучение ассоциации полиморфных маркеров G (-308)A гена TNF и Thr26Asn гена LTA с частотой развития неблагоприятных исходов у больных, перенесших обострение ишемической болезни сердца.Материалы и методы. В исследование были включены 1145 больных, госпитализированных в кардиологические стационары г.г. Москвы, Санкт-Петербурга, Казани, Челябинска, Перми, Ставрополя и Ростова-на-Дону в связи с обострением ишемической болезни сердца. Максимальный срок наблюдения – 62,5 месяца. Идентификацию аллелей полиморфных маркеров проводили с помощью гибридизационно-флуоресцентного анализа при амплификации в реальном времени. Результаты. В случае полиморфного маркера Thr26Asn гена LTA ассоциации с частотой развития неблагоприятных исходов у больных, перенесших обострение ишемической болезни сердца, обнаружено не было. Однако в случае полиморфного маркера G(-308)A гена TNF была обнаружена выраженная ассоциация. У носителей генотипов GA и AA по сравнению с носителями генотипа GG чаще наблюдался неблагоприятный исход. Время дожития до конечной точки у носителей генотипов GA и AA составило 43,30 месяцев (95% CI = 40,04 - 46,56) против 49,6 месяцев (95% CI = 47,38 - 51,82) у носителей генотипа GG (χ2 = 15,4; р
Обострение ишемической болезни сердца, выживаемость пациентов, полиморфные маркеры g(-308)a гена tnf и thr26asn гена lta, многоцентровое исследование
Короткий адрес: https://sciup.org/14338447
IDR: 14338447
Текст научной статьи Ассоциация генов TNF и LTA с осложнениями атеросклероза у больных, перенесших обострение ишемической болезни сердца
Сердечно-сосудистые заболевания (CCЗ) остаются основной причиной инвалидности и смертности в экономически развитых странах. Одну из актуальнейших проблем современного общества представляет лечение и профилактика этих заболеваний. По данным официальной статистики, в 2006 г. смертность от ССЗ вышла на первое место в России и составила 55,4%. Именно ишемическая болезнь сердца (ИБС) является наиболее частой причиной смерти мужчин старше 45 лет и женщин старше 65 лет во многих странах Европы, в том числе – и в России [1]. Предотвращение этих заболеваний является одной из основных задач, как практической медицины, так и медицинской науки.
НС – нестабильная стенокардия;
ССЗ – сердечно-сосудистые заболевания;
CI – доверительный интервал;
LTA – ген, кодирующий лимфотоксин альфа; OR – отношение шансов;
TNF – ген, кодирующий фактор некроза опухоли.
ИБС – полигенное, многофакторное заболевание [2 - 4]. Больной, перенесший обострение ИБС, попадает в группу высокого риска повторения эпизода обострения. Существует несколько стратификационных шкал, позволяющих выделить группу больных с наиболее высоким риском развития инфаркта миокарда или инсульта. К недостаткам этих шкал относится невозможность регистрации всех критериев у всех больных. Так, например, коронарную ангиографию, нагрузочные тесты и ряд других тестов можно провести лишь некоторым из них. Кроме того, наследственные факторы, роль которых в развитии атеросклероза доказана, очевидно, не прекращают действовать и после формирования ИБС. Однако влияние наследственных факторов на течение
ИБС у таких больных изучено недостаточно.
Генетическую предрасположенность к тому или иному заболеванию чаще всего изучают по принципу «случай-контроль». В тоже время, для больных различными формами атеросклероза крайне сложно подобрать правильную контрольную группу, поскольку нет возможности выявить доклинические формы атеросклероза, с одной стороны, и учесть умерших к моменту обследования, с другой. Этих недостатков лишены, так называемые, проспективные исследования, в которых осуществляется длительное наблюдение за большими группами лиц, входящих в группу риска.
В большом количестве моделей атеросклероза признаки воспаления присутствуют совместно с накоплением липидов в артериальной стенке. Например, лейкоциты, медиаторы иммунной системы и воспаления, обнаруживаются в местах формирования атеросклероза на ранних стадиях не только у экспериментальных животных, но и у человека.
Воспалительный процесс не только обеспечивает инициацию и развитие атеромы, но также принимает непосредственное участие в преципитации тромботических образований к атероме. Большинство артериальных тромбов, которые приводят к фатальному исходу, возникают в результате физического разрушения атеросклеротической бляшки. Активированные макрофаги, широко представленные в атероме, вырабатывают протеолитические ферменты, способные разрушать коллаген, что снижает прочность фибринозной капсулы и приводит к формированию нестабильной бляшки [5].
В исследованиях, проведенных на парах моно- и дизиготных близнецов, было показано, что ряд биомаркеров метаболизма и воспаления достоверно ассоциирован с наследственной отягощенностью ИБС [6, 7]. Проведенный недавно детальный анализ значительного числа работ по ассоциации с ИБС генетических маркеров генов, продукты которых вовлечены в развитие воспалительных процессов, показал достоверную ассоциацию с ИБС таких генов, как CRP (C-реактивный белок), ICAM1 (растворимая межклеточная молекула адгезии типа 1), IL6 (интерлейкин 6) и SELP (P-селектин) [8]. Эти данные соответствуют результатам, полученным в наших предыдущих работах [9 -10]. Нами также была обнаружена ассоциация полиморфных маркеров генов IL6, IL10 и CRP с повышенным риском неблагоприятных исхо- дов у больных русского происхождения, перенесших обострение ИБС.
Исходя из совокупности всех этих данных, в настоящей работе в качестве генов-кандидатов нами были выбраны гены TNF и LTA , которые кодируют фактор некроза опухолей (ФНО) и лимфотоксин альфа (ЛТА), соответственно. Оба эти цитокина также относятся к группе воспалительных цитокинов. Ранее данные медиаторы называли факторами некроза опухолей альфа и бета, они имеют близкие спектры биологических активностей, оба связываются с одними и теми же рецепторами (TNFR1 и TNFR2), но экспрессируются разными типами клеток. ФНО синтезируется в основном в макрофагах, в то время как ЛТА – в лимфоцитах. Гены, их кодирующие, расположены тандемно на хромосоме 6 в области 6p21.3 внутри главного комплекса гистосовместимости (MHC) между генами C4 и HLA-B на расстоянии около 210 т.п.н. от последнего [11].
ФНО является полифункциональным воспалительным цитокином, действующим на метаболизм липидов, процессы коагуляции крови и утилизации глюкозы, а также на функцию эндотелия. ФНО обнаружен в атероматозных бляшках [12], поэтому многие авторы считают, что он может вносить существенный вклад в прогрессию бляшек, усиливая местный воспалительный эффект [13]. Более того, установлено, что фактор некроза опухолей действует на ряд медиаторов атеросклеротического процесса, вследствие чего изменяется гомеостаз липидов, еще более понижается чувствительность клеток к действию инсулина и ускоряется дисфункция эндотелия [14].
Повышенный уровень фактора некроза опухолей ассоциирован с повышенным риском развития ИБС [14] и осложнений ИБС у пожилых пациентов [15, 16]. В промоторной области гена TNF обнаружено несколько полиморфных участков, из них наибольший интерес представляет полиморфизм G/A в положении -308 (rs1800629), так как он расположен в промотор-ной области гена внутри участка связывания транскрипционного фактора AP-2 [17]. Показано, что аллель A ассоциирован с более высокими уровнями как конститутивной, так и индуцируемой фактором AP-2 экспрессии [18].
ЛТА также экспрессируется в атеросклеротических бляшках и, таким образом, может быть прямо вовлечен в патогенез атеросклероза и ИБС. В гене LTA обнаружено несколько однонуклеотидных полиморфизмов, из которых наиболее часто использовались маркеры, расположенные в интроне 1 (A252G), в экзоне 1 (G10A) и в экзоне 3 (C804A). Последнему соответствует аминокислотный полиморфизм Thr26Asn [19].
Цель нашего исследования состояла в определении частоты развития неблагоприятных исходов в группе больных, перенесших обострение ИБС, в зависимости от генотипов полиморфных маркеров G(-308)A гена TNF и Thr26Asn гена LTA .
Материалы и методы
Исследование проводили с декабря 2004 г. по август 2010 г. В исследовании участвовало 16 медицинских центров (Москва, Казань, Пермь, Челябинск, Ставрополь, Ростов-на-Дону, Санкт-Петербург). В исследование включали больных, поступивших в стационар в связи с развитием острого коронарного синдрома. Условие отбора предполагало, что пациенты, у которых не наблюдали инфаркта миокарда с зубцом Q, должны были быть госпитализированы не позднее 72 ч от момента начала заболевания и должны были иметь, по крайней мере, один из следующих дополнительных критериев, выявленных при поступлении в стационар: депрессия сегмента ST, по крайней мере, на 1 мм в двух соседних отведениях; инверсия зубца Т не менее 3 мм; транзиторный подъем сегмента ST; повышение уровня кардиоспецифи-ческих ферментов в крови (фосфокиназа креатинина клеток сердца, тропонины).
Больные, у которых диагностировался инфаркт миокарда с зубцом Q, должны были быть госпитализированы не позднее 10 дней от момента начала заболевания и иметь, по крайней мере, один из следующих дополнительных критериев: стойкий подъем сегмента ST не менее 1 мм в двух смежных отведениях от конечностей или не менее 2 мм в двух соседних грудных отведениях; появление новой блокады левой ножки пучка Гиса; динамика острого инфаркта миокарда (появление патологических зубцов Q, снижение зубца R, изменение конечной части желудочкового комплекса); повышение уровня кардиоспецифических ферментов в крови.
Таким образом, в исследование включены как больные, которые поступили в острой фазе обострения ИБС, так и те, кто перенесли «на ногах» наиболее опасный период заболевания.
Поскольку основной идеей исследования яв- ляется анализ критериев риска развития повторного обострения ИБС, наблюдение за больными начиналось на 10 день от момента обострения ИБС при условии стабилизации состояния, при котором не происходило (в течение предшествующих 10 дней) таких событий, как рецидив инфаркта миокарда; повторные симптомы ишемии (длительностью более 10 минут) у пациента, получающего оптимальную медикаментозную терапию; повторные изменения электрокардиограммы, свидетельствующие об ишемии; повторное повышение уровня карди-оспецифических ферментов. Иначе говоря, в исследование не попадали больные, погибшие в первые 10 дней после обострения ИБС.
В контрольных обследованиях регистрировали неблагоприятные клинические исходы, такие как сердечно-сосудистая смерть, нефатальный инфаркт миокарда, нестабильная стенокардия, нефатальный инсульт, осложненный атеросклероз периферических артерий, потребовавший госпитализации в хирургический стационар. Учитывались также все случаи проведения процедур реваскуляризации. Поскольку в нашей стране хирургическая реваскуляризация миокарда выполняется достаточно редко, состояние больных, подвергшихся вмешательству на коронарных артериях, учитывали только до момента вмешательства; далее больных считали «потерянными» для наблюдения.
Всего обследовано 1145 неродственных больных; мужчин – 717 (62,6%), женщин – 428 (37.4%). Средний возраст составил 61,36 ± 11,70 лет. Национальность больных не учитывалась. Диагноз ИБС в анамнезе был установлен у 768 больных (67,1%), 368 (32,1%) перенесли ИМ. Отмечалось большое число случаев АГ (933 больных – 81,5%); 652 (56,9%) из этих пациентов принимали гипотензивные препараты. Симптоматический периферический атеросклероз отмечался у 147 (12,9%) больных. Указания на недостаточность кровообращения в анамнезе имели 619 (54,1%) пациентов. Инсульт перенесли 107 (9,4%) больных. Число больных с сахарным диабетом в анамнезе составило 167 (14,6%). Курили на момент госпитализации 440 (38,5%) больных, еще 185 (16,2%) курили в прошлом.
С учетом изменений на ЭКГ, стандартным критериям наличия ИМ с формированием Q зубца отвечало 550 (46.4%) больных, инфаркта миокарда без зубца Q или нестабильной стенокардии – 663 (53.6%).
В работе использовали термостабильную ДНК-полимеразу Taq, которая была получена от фирмы "Fermentas" (г. Вильнюс, Литва). Олигонуклеотидные праймеры синтезированы ФГУП «ГосНИИ генетика» (г. Москва) и OOO «ДНК-Синтез» (г. Москва). Геномную ДНК выделяли из цельной крови больных посредством экстракции смесью фенола и хлороформа после инкубации образцов крови с протеиназой К в присутствии 0.1% додецилсульфата натрия [20].
Идентификацию аллелей полиморфных маркеров проводили с помощью гибридизационно-флуоресцентного анализа (TaqMan ® анализ) на амплификаторе в реальном времени ABI 7500 fast (Applied Biosystems, США) в 10 мкл реакционной смеси следующего состава: 70 мМ Трис-HCl pH 8.8, 16.6 мМ сульфат аммония, 0.01%-ный Твин-20, 2 мМ хлорид магния, 0.2 мМ каждого dNTP, по 33 нг праймеров и зондов, 1.5 ед.акт. полимеразы Taq, 50-100 нг геномной ДНК. Условия амплификации фрагмента ДНК: 950C/2 мин – первый цикл; 940C/10 с, 600C/60 с – 40 циклов. Состав праймеров и зондов представлен в таблице 1.
Статистическая обработка полученных данных проводилась с использованием программы SPSS 17.0 for Windows [21]. Для протяженных переменных рассчитывались средние величины и стандартные отклонения (М±m). Для непрерывных числовых показателей был проведен анализ распределения и критериев его соответствия нормальному. Анализ выживаемости больных проводился с помощью метода Каплана-Майера. В качестве основного анализируемого события рассматривали пер- вую конечную точку: госпитализация по поводу нестабильной стенокардии, ИМ, инсульт, смерть от ИМ, смерть от инсульта. В качестве основного статистического критерия используется тест логарифма рангов.
Результаты и обсуждение
Cрок наблюдения за больными составил 62,5 мес. За это время зафиксировано 101 случай фатального ИМ и 71 повторный нефатальный ИМ, 10 фатальных и 16 нефатальных инсультов, 23 больных умерли не от сердечно-сосудистых заболеваний, 62 больных подверглись вмешательству на коронарных артериях, у 163 больных отмечали эпизоды нестабильной стенокардии, потребовавшие повторной госпитализации, 6 больных госпитализировали в связи с осложненным периферическим атеросклерозом.
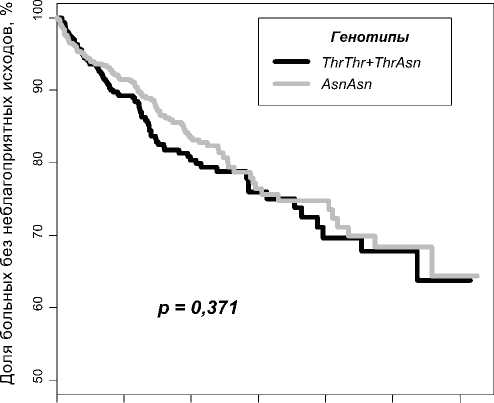
У всех пациентов определяли частоты генотипов полиморфных маркеров Thr26Asn гена LTA и G(-308)A гена TNF . В случае гена LTA проведенный анализ выживаемости больных показал (Рис. 1), что риск развития неблагоприятного исхода после перенесенного острого коронарного синдрома не зависит от генотипов полиморфного маркера Thr26Asn гена LTA (p = 0,371). При разделении исследуемой выборки на мужчин и женщин значимая ассоциация также не была обнаружена.
Наши результаты совпадают с результатами ряда других исследований. Так при изучении ассоциации полиморфных маркеров гена LTA с ИМ в нескольких работах значимой ассоциации получено не было [22, 23]. Также при проведении мета-анализа, учитывающего результаты
Последовательности праймеров и зондов, использованных при проведении гибридизационно-флуоресцентного анализа
Таблица 1
|
Маркер |
Прямой и обратный праймеры (5 ′→ 3 ′ ) |
Аллель |
Зонд |
|
LTA Thr26Asn |
ccgtcagcaccccaagatg gggaggtcaggtggatgtttac |
Thr |
FAM-tgcccacagcaccctcaaaccctg-BHQ-1 |
|
Asn |
VIC- tgcccacagcaacctcaaaccсtg-BHQ-2 |
||
|
TNF G(-308)A |
tggaagttagaaggaaacagac acacaagcatcaaggatacc |
G |
FAM- ccgtccccatgccc -BHQ-1 |
|
A |
VIC- ccgtcctcatgccc -BHQ-2 |
О 10 20 30 40 50 60
Время наблюдения, месяцы
Рис. 1. График Каплана-Майера. Доля неблагоприятных исходов у носителей генотипов ThrThr+ThrAsn и AsnAsn полиморфного маркера Thr26Asn гена LTA в зависимости от времени, прошедшего после ОКС.
нескольких независимых исследований, ассоциации с ССЗ обнаружено также не было [24].
Возможно с развитием неблагоприятных исходов у больных, перенесших ОКС, ассоциированы другие полиморфные маркеры гена LTA , например, такие маркеры, как Cys804Ala или Gly10Ala . Поэтому для окончательных выводов об отсутствии связи гена LTA с частотой неблагоприятных исходов требуется проведение дополнительных исследований.
Однако в случае полиморфного маркера G(-308)A гена TNF нами была обнаружена выраженная ассоциация с частотой неблагоприятных исходов после перенесенного ОКС. У носителей генотипов GA и AA полиморфного маркера G(-308)A чаще наблюдался неблагоприятный исход по сравнению с носителями генотипа GG . Время дожития до конечной точки у носителей генотипов GA и AA составило 43,30 месяцев (95% CI = 40,04-46,56) против 49,6 месяцев (95% CI = 47,38-51,82) у носителей генотипа GG ( χ 2 = 15,4; р < 0,001) (Рис. 2).
Полученные нами данные соответствуют результатам проведенного в 2011 году метаанализа [25], в котором европеоиды – носители аллеля A имели в 1,5 раза больший риск развития ССЗ, по сравнению с носителями генотипа GG (AG+AA против GG , OR = 1,50, 95% CI = 1,23-1,77).
Уровень ФНО в плазме крови повышен у пациентов с ССЗ и может увеличивать риск сердечных патологий через воздействие на эндотелий сосудов [26]. Также следует отметить, что у носителей аллеля A выше уровень транскрипции гена TNF [18, 27].
Молекулярный механизм таких различий до конца не ясен, так как различий в силе взаимодействия факторов транскрипции с двумя аллельными вариантами полиморфного маркера G(-308)A гена TNF обнаружено не было, по крайней мере, для клеточной линии Raji . Возможно, в результате различий в укладке ДНК в полиморфной области, взаимодействие транскрипционных факторов с этим участком различается у носителей разных аллелей, что приводит к усилению трансактивации гена TNF . Несмотря на то, что полиморфный маркер лежит в последовательности связывания транскрипционного фактора AP-2, повышения уровня связывания AP-2 в условиях in vitro с полиморфной областью выявлено не было [18].
В настоящее время представления об атеросклерозе (основной причине ИБС и ОКС), как о процессе накопления липидных частиц в сосудистой стенке в течение всей жизни, претерпели значительные изменения. Современные наблюдения выводят на первый план воспалительный процесс во всех фазах развития атеросклероза: раннем атерогенезе, прогрессировании повреждений и, наконец, формировании тромботических осложнений. Клинические исследования подтверждают корреляцию
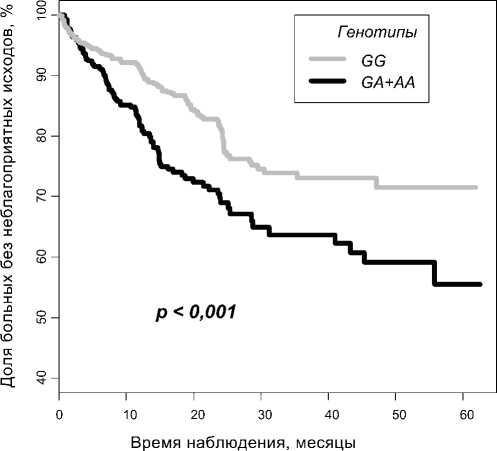
Рис. 2. График Каплана-Майера. Доля неблагоприятных исходов у носителей генотипов GG и GA+AA полиморфного маркера G(-308)A гена TNF в зависимости от времени, прошедшего после ОКС.
циркулирующих маркеров воспаления с предрасположенностью к ишемическим нарушениям и прогнозом течения ОКС.
Работа выполнена при финансовой поддержке Российского фонда фундаментальных исследований (проекты 07-04-01750 и 10-04-01750).
Список литературы Ассоциация генов TNF и LTA с осложнениями атеросклероза у больных, перенесших обострение ишемической болезни сердца
- Оганов Р.Г., Масленникова Г.Я. Вклад сердечно-сосудистых и других неинфекционных заболеваний в здоровье населения России. Сердце. 2003; 2: 58-61.
- Шевченко О.П., Мишнев О.Д. Ишемическая болезнь сердца. М.: Реафарм. 2005. 416 с.
- Goyal A., Blazing M. Should we measure C-reactive protein levels to ascertain the adequacy of statin therapy in patients who are at very high risk for a coronary heart disease event? Am Heart J. 2005; 150: 650-651.
- Аронов Д.А. Первичная и вторичная профилактика сердечно-сосудистых заболеваний -интерполяция на Россию. Сердце. 2002; 3:109-112.
- Berliner J.A., Navab M., Fogelman A.M., et al. Atherosclerosis: Basic Mechanisms: Oxidation, Inflammation, and Genetics. Circulation 1995;91 (9): 2488-96.
- de Craen A.J., Posthuma D., Remarque E.J., van den Biggelaar A.H., Westendorp R.G., Boomsma D.I. Heritability estimates of innate immunity: an extended twin study. Genes Immun. 2005; 6: 167-170.
- Jermendy G., Horváth T., Littvay L., et al. Effect of genetic and environmental influences on cardiometabolic risk factors: a twin study. Cardiovasc Diabetol 2011;10: 96.
- Raman K., Chong M., Akhtar-Danesh G.G., et al. Genetic markers of inflammation and their role in cardiovascular disease. Can J Cardiol. 2012; Sep 19 [Epub ahead of print].
- Благодатских К.А., Агапкина Ю.В., Никитин А.Г. и соавт. Полиморфные маркеры G(-174)C гена IL6 и G(-1082)A гена IL10 и генетическая предрасположенность к неблагоприятному течению ишемической болезни сердца у больных, перенесших острый коронарный синдром. Молекулярная биология. 2010;44(5): 839-846.
- Благодатских К.А., Никитин А.Г., Пушков А.А., и соавт. Полиморфные маркеры G2667C, G3014A, C3872T, A5237G гена CRP и генетическая предрасположенность к неблагоприятному течению ишемической болезни сердца у больных, перенесших обострение ишемической болезни сердца. Медицинская генетика. 2011;4: 3-9.
- Carroll M.C., Katzman P., Alicot E.M. et al. Linkage map of the human major histocompatibility complex including the tumor necrosis factor genes. Proc Natl Acad Sci. 1987;84: 8535-9.
- Barath P., Fishbein M.C., Cao J., et al. Tumor necrosis factor gene expression in human vascular intimal smooth muscle cells detected by in situ hybridization. Am J Pathol. 1990;137(3): 503-9.
- Vaddi K., Nicolini F.A., Mehta P., Mehta J.L. Increased secretion of tumor necrosis factor-alpha and interferon-gamma by mononuclear leukocytes in patients with ischemic heart disease. Relevance in superoxide anion generation. Circulation. 1994; 90 (2): 694-9.
- Fernandez-Real J.M., Ricart W. Insulin resistance and chronic cardiovascular inflammatory syndrome. Endocr Rev. 2003;24(3):278-301.
- Pai J.K., Pischon T., Ma J., Manson J.E., et al. Inflammatory markers and the risk of coronary heart disease in men and women. N Engl J Med. 2004; 351(25): 2599-2610.
- Cesari M., Penninx B.W., Newman A.B., et al. Inflammatory markers and onset of cardiovascular events: results from the Health ABC study. Circulation 2003; 8: 2317-22.
- Wilson A.G., di Giovine F.S., Blakemore A.I., Duff G.W. Single base polymorphism in the human tumour necrosis factor alpha (TNF alpha) gene detectable by NcoI restriction of PCR product. Hum Mol Genet. 1992;1(5): 353.
- Wilson A.G., Symons J.A., McDowell T.L., McDevitt H.O., Duff G.W. Effects of a polymorphism in the human tumor necrosis factor alpha promoter on transcriptional activation. Proc Natl Acad Sci. 1997; 94(7): 3195-9.
- Laxton R., Pearce E., Kyriakou T., Ye S. Association of the lymphotoxin-alpha gene Thr26Asn polymorphism with severity of coronary at herosclerosis. Genes Immun. 2005; 6(6): 539-41.
- Mathew C.G. The isolation of high molecular weight eukaryotic DNA. Methods Mol Biol. 1985; 2: 31-4.
- R Development Core Team. R: A language and environment for statistical computing. R foundation for Statistical Computing. Vienna, Austria, 2010. Available from www.r-project.org.
- Koch W., Tiroch K., von Beckerath N., Schomig A., Kastrati A. Tumor necrosis factor-alpha, lymphotoxin-alpha, and interleukin-10 gene polymorphisms and restenosis after coronary artery stenting. Cytokine. 2003;24(4): 161-171.
- Yamada A., Ichihara S., Murase Y., Kato T., et al. Lack of association of polymorphisms of the lymphotoxin alpha gene with myocardial infarction in Japanese. J Mol Med. 2004;82(7): 477-83.
- Clarke R., Xu P, Bennett D., Lewington S., et al. Lymphotoxin-alpha gene and risk of myocardial infarction in 6,928 cases and 2,712 controls in the ISIS case-control study. PLoS Genet. 2006;2(7): e107.
- Zhang H.F., Xie S.L., Wang J.F., Chen Y.X., Wang Y., Huang T.C.Tumor necrosis factor-alpha G-308A gene polymorphism and coronary heart disease susceptibility: an updated meta-analysis. Thromb Res. 2011;127(5):400-5.
- Plutzky J. Inflammatory pathways in atherosclerosis and acute coronary syndromes. Am J Cardiol. 2001;88(8A):10K-15K.
- Allen RD. Polymorphism of the human TNF-alpha promoter -random variation or functional diversity? Mol Immunol. 1999; 36(15-16): 1017-27.


