Биодеградируемые спейсеры в современных программах лучевой терапии гинекологического рака: возможности и перспективы (краткий обзор литературы)
Автор: Крейнина Ю.М., Шевченко Л.Н., Сотников В.М., Цаллагова З.С., Титова Л.В., Белокопытов Л.Д., Исаева С.Г.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Обзор
Статья в выпуске: 3 т.25, 2025 года.
Бесплатный доступ
Превышение толерантных доз в наиболее иррадиируемых участках органов риска - прямой, сигмовидной, тонкой кишке, мочевом пузыре, мочеточниках - приводящее к развитию геморрагических и фистульных осложнений, традиционно является ведущим фактором, лимитирующим проведение радикальных и паллиативных курсов лучевой терапии у больных с онкогинекологической патологией. Особую значимость это приобретает при использовании внутритканевого и гибридного вариантов контактного облучения. Одним из путей повышения безопасности радиотерапии гинекологических опухолей, в особенности на этапе брахитерапии, является возможность дистанцирования органов риска от мишени с целью максимального выведения их из зоны терапевтического воздействия. Аналогичная проблема у больных раком предстательной железы успешно решается с помощью прокладок-спейсеров, которые вводятся в клетчаточное пространство между прямой кишкой и простатой, увеличивая расстояние между органами. Представлен краткий обзор отечественных и зарубежных клинических исследований, проведенных в период с 2012 по 2025 год. Эти исследования были опубликованы в медицинских журналах и доступны в электронных базах данных (РИНЦ, Pubmed, Scopus, WoS и ResearchGate). В обзоре обобщается мировой опыт применения биодеградируемых спейсеров в онкогинекологии. Особое внимание уделяется развитию технологий лучевой терапии опухолей женской репродуктивной системы и положительным результатам, достигнутым при использовании спейсеров различной природы для лечения опухолей предстательной железы. Резюмировано, что в целом использование биодеградируемых спейсеров является перспективным вариантом повышения эффективности и безопасности лучевого лечения первичных и рецидивных гинекологических опухолей, в особенности при проведении внутритканевой и гибридной брахитерапии.
Злокачественные опухоли, гинекологический рак, опухоли женской репродуктивной системы, химиолучевое лечение, лучевая терапия, брахитерапия, спейсер
Короткий адрес: https://sciup.org/149149281
IDR: 149149281 | DOI: 10.24412/1999-7264-2025-3-51-68
Текст научной статьи Биодеградируемые спейсеры в современных программах лучевой терапии гинекологического рака: возможности и перспективы (краткий обзор литературы)
Рак репродуктивных органов во всем мире является одним из наиболее часто встречающихся видов онкопатологии у женщин. На момент окончания 2023 года в РФ на учете состояло более полумиллиона больных онкогинекологической патологией, в том числе 188767 больных раком шейки, 293665 – раком тела матки, из них более 5 лет – 65-70% от общего числа больных с опухолями данных локализаций. На протяжении десятилетий, с середины прошлого века, базовым и подчас единственно возможным методом эффективного лечения всех основных видов гинекологического рака остается лучевая терапия, в том числе с применением брахитерапии не менее чем у 70% леченых [1].
Превышение максимально допустимых толерантных доз в наиболее иррадиируемых участках прямой кишки и мочевого пузыря, приводящее к развитию геморрагических и фистульных постлучевых осложнений, традиционно является ведущим фактором, лимитирующим проведение радикальных и паллиативных повторных курсов облучения опухолей, локализованных в малом тазу, у больных с онкогинекологической патологией. За прошедшие десятилетия предпринимались неоднократные попытки улучшить общие результаты лучевого лечения и снизить частоту тяжелых осложнений со стороны критических органов таза – мочевого пузыря, прямой кишки, тонкого кишечника – путем использования различных вариантов фракционирования дозы и режимов как дистанционного, так и внутриполостного облучения, а также путем использования веществ самой различной природы в качестве радиомодификаторов и радиопротекторов [2-5].
Техническая и технологическая революция в лучевой терапии, свершившаяся в последние десятилетия, позволила приблизиться к решению данных задач за счет перехода от конвенциальной гамма-терапии к методикам индивидуального конформного облучения на основе прикладного использования данных медицинской визуализации – КТ, МРТ, УЗИ, 18-ФДГ ПЭТ-КТ – для каждого конкретного пациента. Использование технологий конформного лучевого лечения на основе трехмерного планирования, возможность индивидуализации параметров радиационного воздействия и неравномерного облучения различных участков мишени в ходе сеанса в соответствии с клиническими задачами, позволило у больных раком шейки и тела матки, вульвы, влагалища существенно увеличивать суммарные очаговые дозы, подводимые как к зоне первичной опухоли, так и к зонам метастатически измененных лимфатических узлов, без увеличения частоты лучевых повреждений нормальных тканей и пролонгирования общего времени лучевого лечения [6-8].
Еще большие изменения эра визуально-контролируемой лучевой терапии привнесла в практику контактного облучения. С начала 2000-х годов группой европейских и американских радиационных онкологов и медицинских физиков была сформирована концепция адаптивной визуально-контролируемой брахитерапии (Image-Guided Adaptive Brachytherapy, IRABT) с индивидуальным объемным планированием каждой фракции облучения на основе данных КТ, а впоследствии – и МРТ, разработаны принципы формирования клинических терапевтических объемов высокого и промежуточного риска (HR-CTV, IR-CTV), адекватного оконтуривания на основе совмещения изображений КТ и МРТ, обоснованы с позиций прогнозирования фистульных осложнений толерантные и предельные дозы в критических объемах – 0,1 cм3, 1 cм3, 2 cм3 наиболее иррадиируемых зон органов риска [9-12].
Уже на ранних этапах формирования и апробирования этой революционной методологии при раке шейки матки было продемонстрировано ее важное значение для улучшения локального контроля и снижения частоты и степени тяжести осложнений со стороны органов риска. Одним из первых исследований, в котором были показаны преимущества объемного планирования, стало французское исследование STIC. В этом исследовании сравнивали результаты лечения в группе пациенток, которые прошли химиолучевую терапию с последующей брахитерапией, в подгруппах с 2D- и 3D-планированием [13]. Показатели 2-летней выживаемости без локального прогрессирования составили 74% и 79%, а частота осложнений 3-4 степени - 23% и 3% в подгруппах с 2D- и 3D планированием брахитерапии соответственно. Отмечен также рост показателей общей выживаемости с 65% в подгруппе с 2D-планированием до 74% – в подгруппе с 3D-планированием брахитерапии.
Аналогичные результаты были получены в исследовании, проведённом в Вене в 2011 году на группе из 156 пациентов [14]. При анализе 3-летних результатов общий уровень локального контроля составил 95% (98% для опухолей размером 2-5 см, 92% - для опухолей размером более 5 см). Показатели 3-летней опухоль-специфической выживаемости составили
83% для IB, 84% - для IIB, 52% - для IIIB стадии FIGO. Частота осложнений 3-4 степени не превышала 8%. В этом же исследовании была продемонстрирована сильная прямая корреляция «доза-эффект» для уровня локального контроля: показатель в 90% и выше был ассоциирован с эквивалентной дозой D90 на HR-CTV более 86 Гр.
Значение суммарной дозы на HR-CTV D90 было подтверждено и в большом мультицентровом исследовании RETRO-EMBRACE, 2016. Из 731 больных МРРШМ (FIGO IA/IB/IIA 22,8%, IIB 50,4%, IIIA-IVB 26,8%) у 84,8% больных был верифицирован плоскоклеточный рак, у 40,5% имелись клинические признаки метастатического поражения лимфатических узлов. Средняя доза от дистанционного облучения на центр таза составила СОДэкв 46±2,5 Гр, лучевое лечение в сочетании с химиорадиомодификацией препаратами платины проводилось в 77,4% случаев. Медиана наблюдения составила 43 месяца. Подведение в среднем СОДэкв 87±15 Гр на HR-CTV D90 с объемным 3D-планированием брахитерапии по данным МРТ или КТ привело к достижению высокого уровня локального контроля, однако были зарегистрированы поздние лучевые повреждения G2-4 степени у 610 (83,4%) больных. Средние дозы в органах риска (D2cc) составляли в мочевом пузыре 81±22 Гр, в прямой кишке – 64±9 Гр, в сигмовидной кишке – 66±10 Гр, в ректо-сигмоиде – 64±9 Гр. Показатели 3- и 5-летней выживаемости без локального рецидива (ЛК), рецидива в тазу (БРВТ), опухоль-специфической (ОСВ) и общей выживаемости (ОВ) составили 91%/89%, 87%/84%, 79%/73%, 74%/65% соответственно. Для стадий IB, IIB, IIIB показатели ЛК составили 98%/98%, 93%/91%, 79%/75%; БРТ – 96%/96%, 89%/87%, 73%/67% соответственно. Частота развития фистульных осложнений составила 5% для мочевых путей (мочевого пузыря и мочеточников), 7% – для кишечника [15].
Ключевым событием, подтвердившим важность и целесообразность активного внедрения адаптивной визуально-контролируемой брахитерапии в мировую медицинскую практику, стало проспективное наблюдательное многоцентровое когортное исследование EMBRACE-I. В исследовании приняли участие пациенты с раком шейки матки (РШМ) на стадиях IB–IVA из 24 медицинских центров Европы, Азии и Северной Америки. Набор пациенток проводился с июля 2008 по декабрь 2015 года, результаты были опубликованы в 2021-22 гг. В базу данных было включено 1416 больных, в окончательный анализ включены данные по течению заболевания у 1341 больной. Сведения, касающиеся осложнений лечения, были анализированы у 1251 пациентки. Лечение на дистанционном этапе было стандартным, состояло из химиолучевой терапии – наружного облучения таза с РОД 1,8-2 Гр до СОДэкв 45-50 Гр, с еженедельным введением цисплатина 40 мг/м2, с последующей визуально-контролируемой адаптивной брахитерапией на основе МРТ. Из 1341 пациентки МРТ-планирование с оптимизацией распределения дозы было проведено для 1317 (98,2%). Средний объем HR-CTV составил 28 cм3 (IQR 20–40), средняя минимальная изоэффективная доза на 90% клинического терапевтического объема (HR-CTV D90) составила 90 Гр (IQR 85– 94). Медиана наблюдения составила 51 месяц (IQR 20–64). Актуриальная 5-летняя выживаемость без локального прогрессирования ЛК достигла 92% (95% CI 90–93). Актуриальная кумулятивная частота осложнений 3–5 степени со стороны мочевыводящих путей составила 6,8% (95% CI 5,4–8,6), гастроинтестинальных осложнений — 8,5% (6,9– 10,6), осложнений со стороны влагалища — 5,7% (4,3–7,6), частота свищей — 3,2% (2,2–4,5). Авторы резюмировали, что эти результаты обозначили реальный прорыв в лечении МРРШМ, который должен стать основой для рутинной клинической практики и точкой отсчета для оценки результатов будущих исследований [10].
В последнее десятилетие значительное внимание во многих клиниках уделяется развитию технологий гибридной брахитерапии, предусматривающей проведение одномоментно внутриполостной и внутритканевой брахитерапии с внедрением, наряду с эндостатом в полость матки и овоидами или кольцевым аппликатором в своды влагалища, металлических или пластиковых игл в зоны остаточных опухолей в параметриях. Например, в протоколе RETROEMBRACE, который применялся с 1998 по 2012 год, гибридную брахитерапию прошли 23% пациенток. В протоколе EMBRACE-I, который использовался с 2008 по 2015 год, она была выполнена у 43% больных со стадией рака шейки матки IIB-IIIB. Добавление внутритканевого компонента в протокол брахитерапии при МРРШМ в случаях недостаточной резорбции опухоли в ходе дистанционного облучения, по мнению основоположников методики, дает возможность улучшить охват мишени терапевтической изодозой, увеличить локальные дозы до радикальных (СОДэкв 86–90 Гр) без существенного роста частоты осложнений 3–4 степени со стороны органов риска за счет значимого градиента дозы при контактном облучении и использовании технологий визуальноконтролируемой лучевой терапии. Средний объем HR-CTV в исследовании RETROEMBRACE составлял 37± 24 см3, средняя доза на HR-CTVD90 – 87±18 Гр. Актуриальные показатели ЛК и БРВТ за три и пять лет составили 91% и 89%, 87% и 84% соответственно. В исследовании EMBRACE-I, несмотря на то, что объем HR-CTV был меньше, чем в RETROEMBRACE (28 см3 против 37 см3), а средняя суммарная доза на HR-CTV D90 (90 Гр) была сопоставимой, показатели ЛК и БРВТ за пять лет составили 92% и 87% соответственно. Важно отметить, что хотя 25% пациенток, включенных в анализ EMBRACE-I, получили менее 85 Гр на HR-CTV D90, достигнутый уровень локального контроля был выше 95% и превосходил результаты RetroEMBRACE [10-12,15].
В то же время многими исследователями неоднократно подчеркиваются и недостатки такого подхода: трудоемкость, резко снижающаяся пропускная способность брахитерапевтического оборудования, в том числе и вследствие перехода к лечению сдвоенными фракциями на одной имплантации, высочайший уровень требований к квалификации команды специалистов, участвующих в реализации такого варианта брахитерапии, рост материальных затрат и общей лучевой нагрузки на пациентку в связи с необходимостью проведения за короткий промежуток времени нескольких повторных исследований КТ и МРТ, а также — возрастание риска острых и хронических хирургических и радиационных осложнений.
Изложение основного материала
Одним из очевидных способов сделать внутриполостные, внутритканевые и гибридные имплантации более безопасными и снизить риск хирургического и радиационного повреждения органов, которые находятся в зоне риска, является возможность максимально удалить их из зоны воздействия. Подобная проблема успешно решается у пациентов с раком предстательной железы с помощью специальных прокладок-спейсеров. Эти прокладки вводятся в пространство между прямой кишкой и простатой, увеличивая расстояние между ними с 2-3 мм до 13-15 мм. Это значительно снижает риск лучевых повреждений прямой кишки, поскольку объем прямой кишки, попадающий в зону облучения, становится меньше [16].
По данным Hamstra с соавт. (2017), применение гидрогелевых спейсеров у 148 из 222 больных раком предстательной железы, рандомизированных в соотношении 2:1 в основную группу, с введением в периректальное пространство биодеградируемого гидрогелевого спейсера, и контрольную, получавших дистанционную лучевую терапию с СОД 79,2 Гр с РОД 1,8 Гр, привело к снижению на 66% частоты ректитов, на 65% — неудержания мочи, а также способствовало восстановлению в течение 3 лет после лечения эректильной функции у 78% леченых. При оценке 3-летней кумулятивной частоты осложнений, частота ректитов ≥1 степени составляла 9,2% в контрольной группе против 2,0% в основной (P=0,028), ≥2 степени — 5,7% в основной против 0% в контрольной (P=0,012); неудержания мочи ≥1 степени — 15% в контрольной против 4% в основной (P=0,046), с динамическим улучшением показателей качества жизни больных в основной группе по сравнению с контрольной, начиная с 6 мес. наблюдения. Кроме того, введение гидрогеля позволило создать своеобразное «МР-окно» по аналогии с «эхо-окном» при УЗИ и значительно улучшить МР-визуализацию зоны интереса при первичном планировании параметров облучения и динамической визуализации мишени в ходе лучевого лечения. Рассасывание гидрогеля происходило обычно в течение 6 мес. после введения [17].
За прошедшие десятилетия в качестве спейсеров для дистанционной, низко- и высокомощностной и сочетанной лучевой терапии первичного и рецидивного рака предстательной железы было апробировано множество органических и синтетических материалов, от сгустков аутологичной крови [18] до гелей на основе полиэтиленгликоля (ПЭГ) и полиакриламида, коллагена, гиалуроновой кислоты [19]. Спейсеры на основе полиэтиленгликоля (ПЭГ) со временем стали рассматриваться в качестве своего рода «золотого стандарта» в мировой радиотерапевтической практике, в первую очередь за счет создания и апробации специально разработанного для промежностного введения ПЭГ-гидрогелевого препарата SpaceOAR®. В настоящее время именно этот препарат имеет максимальный по длительности и объему выполненных имплантаций опыт применения, подтвержденный целым рядом рандомизированных исследований [20].
В последнее время отмечен существенный интерес к спейсерам на основе гиалуроновой кислоты, что во многом обусловлено разработкой большого числа полностью синтетических аналогов, характеризующихся высокой степенью биосовместимости. С 2020 г. в Европе был разрешен для клинического применения новый спейсер на основе стабилизированной гиалуроновой кислоты неживотного происхождения (Non-Animal Stabilized Hyaluronic Acid, NASHA), – Barrigel® [21]. При сравнении ПЭГ (SpaceOAR®) и гиалуроновой кислоты (Barrigel®) производитель и клинические исследователи указывают на целый ряд критически важных преимуществ последней, позволяя определять препарат на ее основе фактически в качестве спейсера второго поколения, способного значимо снижать раннюю и позднюю токсичность радиотерапии рака простаты при СОД выше 76 Гр, при отсутствии на сегодняшний день данных об осложнениях, связанных с введением или пребыванием Barrigel® в теле человека [16].
Свое развитие получили также технологии дистанцирования органов при радиотерапии в виде надуваемых баллонов. Первоначально они представляли собой силиконовые резервуары, вводимые в эндоскопически или через небольшие разрезы в брюшную полость и наполняемые в дальнейшем физиологическим раствором. Этот вариант использовали для дистанцирования петель тонкой кишки в ходе дистанционного облучения таза и брюшной полости [22]. В дальнейшем были разработаны биодеградирующие баллоны (ProSpace®, BioProtect®), не требующие удаления после окончания облучения, эффективно используемые прежде всего специалистами израильских клиник в фотонной и протонной терапии рака простаты [23].
В то же время, несмотря на огромное число публикаций за последние десятилетия, касающихся применения спейсеров при различных вариантах лучевой терапии рака предстательной железы, метод не нашел широкого применения в радиогинекологии для механического дистанцирования влагалищной трубки, культи влагалища или шейки матки от органов риска. В отечественной литературе, несмотря на очевидные возможности методики в повышении безопасности лучевой терапии при онкогинекологической патологии, подобный опыт не представлен.
Таким образом, целью настоящей работы явилось обобщение имеющегося мирового клинического опыта по применению спейсеров в лучевой терапии опухолей женской 57
репродуктивной системы. Для формирования обзора были проанализированы и обобщены данные, опубликованные с 2012 по 2025 год в отечественных и иностранных медицинских журналах и электронных базах (РИНЦ, PubMED, Scopus, WoS, ResearchGate). Число таких исследований в доступной литературе оказалось весьма ограниченным: в окончательный анализ удалось включить лишь 14 репрезентативных печатных работ по теме обзора, в большинстве из которых представлен опыт отдельных центров США, Японии, Индии, преимущественно в виде описания единичных клинических случаев.
В 2013 году Viswanathan c соавторами опубликовали результаты повторного лучевого лечения 3 больных с локальными рецидивами гинекологического рака с предварительным введением полимерного гидрогелевого спейсера Duraseal® в ректо-вагинальное пространство под УЗ-навигацией. Одна из пациенток была ранее массивно предлечена: в 2005 году проведен курс радикального химио-лучевого лечения по поводу аденокарциномы прямой кишки; в 2010 – оперирована и получила эндовагинальную брахитерапию по поводу карциносаркомы матки, в 2012 году выявлен рецидив опухоли в своде влагалища, с подрастанием к прямой кишке и петлям тонкой кишки, в связи с чем был проведен курс дистанционной лучевой терапии в режиме IMRT на область пахово-подвздошных лимфоузлов и рецидивную опухоль в культе влагалища по резерву толерантности. Для достижения радикальных доз запланирована внутритканевая брахитерапия. У двух других пациенток были диагностированы рецидивные опухоли в культе влагалища после проводившейся ранее сочетанной лучевой терапии, запланирована гибридная брахитерапия с использованием вагинального цилиндра и дополнительных игл. Введение гидрогелевого спейсера позволило увеличить пространство между стенкой влагалища с опухолью и петлями прямой и тонкой кишок более, чем на 10 мм и значимо снизить дозы в прямой, сигмовидной и тонкой кишке у всех леченых: у первой пациентки – на 14%, 60% и 72% соответственно, у двух других – на 11% в прямой кишке, 45% - в сигмовидной кишке при подведении условно -радикальных доз к области первичного очага. Дозовые распределения в мишени и органах риска до и после введения гидрогелевого спейсера у первой пациентки, приводимые авторами, представлены на Рис.1 [24].
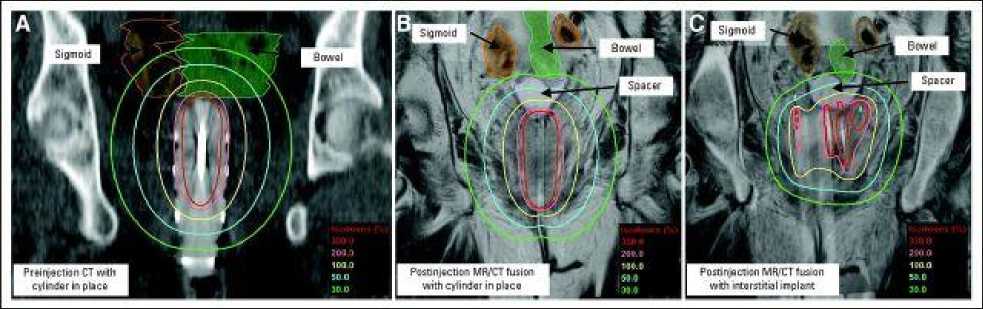
Рис. 1. А – дозовые распределения в области влагалищной трубки с рецидивной опухолью и органах риска от одноканального вагинального цилиндра до введения гидрогелевого спейсера. КТ-томограмма в коронарной проекции. В – дозовые распределения в области влагалищной трубки с рецидивной опухолью и органах риска от одноканального вагинального цилиндра после введения гидрогелевого спейсера. МР/КТ-совмещенное изображение в коронарной проекции. С – дозовые распределения в области влагалищной трубки с рецидивной опухолью и органах риска от одноканального вагинального цилиндра с дополнительным внутритканевым имплантом после введения гидрогелевого спейсера. МР/КТ-совмещенное изображение в коронарной проекции. Sigmoid – сигмовидная кишка. Bowel – тонкая кишка. Spacer – гидрогелевый спейсер. (Цит. по [24]).
Индийские исследователи в 2016 году представили положительные результаты применения спейсера в ходе гибридной брахитерапии рака шейки матки IIb стадии [25]. После введения перед 3 фракцией брахитерапии 50 мл гидроксипропилметилцеллюлозы (Viscomet®) в зону ректо-вагинальной перегородки авторам удалось дистанцировать органы риска на 11 мм вместо 2,3 мм до введения спейсера и на 60–75% увеличить дозы в мишени, с подведением эквивалентной дозы на HR-CTV D90 16,4 Гр вместо 6,7 Гр, на IR-CTV D90 – 11,3 Гр вместо 3,06 Гр, без превышения толерантных доз в наиболее иррадиируемых участках органов риска. При этом дозу D2cc в прямой кишке удалось снизить на 25%, с 4,8 Гр до 3,6 Гр, сигмовидной кишке – на 41%, с 2,2 Гр до 1,3 Гр, в то время как D2cc в мочевом пузыре, не подвергнутого дистанцированию спейсером, возросла на 21%, с 5,7 Гр до 6,9 Гр. В итоге авторам удалось достичь оптимальных кумулятивных эквивалентных доз в мишени и органах риска: HR-CTV D90 98,4 Гр, IR-CTV D90 76,1 Гр, прямая кишка D2cc 67,7 Гр, мочевой пузырь D2cc 73,2 Гр, сигмовидная кишка 59,3 Гр.
В 2012–2024 гг. опубликована целая серия работ из радиологических центров Японии со схожими результатами, в которых введение спейсеров различной природы в ректовагинальное и везиковагинальное пространство обеспечивало безопасную эскалацию дозы в мишени в ходе брахитерапии первичных и рецидивных опухолей женской репродуктивной системы без превышения толерантных доз в наиболее иррадиируемых участках прямой, сигмовидной, тонкой кишок и мочевого пузыря.
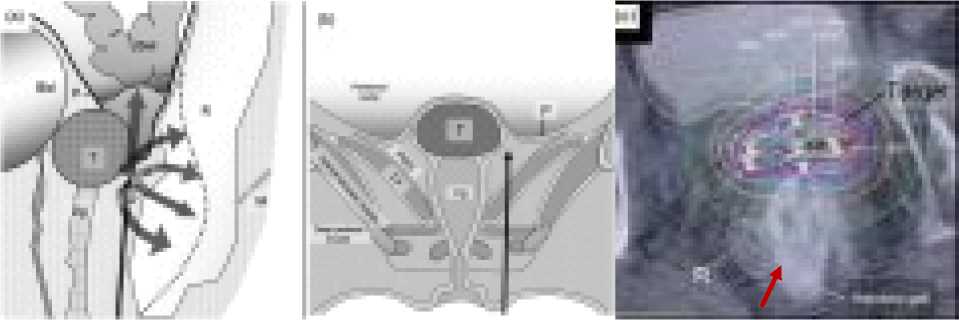
Так, Kishi с соавт. в 2012 году представили клинический случай повторного сочетанного лучевого лечения больной с большой рецидивной опухолью в культе влагалища более 8 см после первичного комбинированного лечения (радикальное хирургическое вмешательство, адъювантная эндовагинальная брахитерапия) рака тела матки. После подведения эквивалентной дозы в 50 Гр на опухоль от дистанционного облучения, авторы выполнили однократную процедуру внутритканевой брахитерапии РОД 14,5 Гр после перкутанного параперинеального введения 30 мл гиалуронового геля в параректальное пространство (Рис. 2). Суммарная эквивалентная доза, полученная опухолью в результате комбинированной лучевой терапии, составила 100,8 Гр. Благодаря введению спейсера, D2cc в ректосигмоиде удалось снизить на 40%, с 96 Гр до 58,5 Гр. При наблюдении в течение 36 месяцев было зафиксировано полное исчезновение опухоли без каких-либо признаков поздних радиационных осложнений [26].
А Б
Рис. 2. Схема введения гиалуронового геля (А) и дозовые распределения в области внутритканевого импланта из 3 игл (Б), прямая кишка R дистанцирована от импланта за счет спейсера (стрелка) (Цит. по [26]).
Аналогичная технология, но уже с введением спейсера на основе геля гиалуроновой кислоты в везико-вагинальное пространство, была применена Murakami с соавт. (2019) для снижения дозы в мочевом пузыре [27]. В период с сентября 2016 года по май 2018 года под наблюдением находилось 15 пациенток с МРРШМ. Все они проходили радикальное химиолучевое лечение. Девять из этих пациенток также получали инъекцию геля гиалуроновой кислоты под ультразвуковой навигацией в ретровезикальное и ректовагинальное пространство. Объём геля составлял от 5 до 10 миллилитров. Препарат, использованный в исследовании, — Sunenyl®, производства Chugai Pharmaceutical Co., Tokyo, Japan. Для инъекции 5 доз геля разводили в 5 миллилитрах физиологического раствора и добавляли 3-5 миллилитров контрастного вещества для улучшения визуализации. Только у трёх пациенток была проведена традиционная внутриполостная брахитерапия с использованием тандема и овоидов. Шести другим пациенткам потребовалась гибридная брахитерапия с дополнительным внутритканевым имплантом. Это было связано с тем, что после дистанционного облучения таза с СОДэкв 50 Гр и химиорадиомодификации цисплатином в дозе 40 мг/м2 не удалось достичь достаточной резорбции опухоли. Средняя суммарная эквивалентная доза от сочетанной лучевой терапии для HR-CTV D90 составила 73,3 Гр, для D2cc в прямой кишке — 52,8 Гр, а в мочевом пузыре — 67,1 Гр. Исследователи обнаружили значительное снижение дозы на D2cc в мочевом пузыре у 9 пациентов, которые использовали спейсер, по сравнению с 6 пациентками без него. Доза составила 449 cГр [диапазон, 416-566, 1SD (стандартное отклонение) = 66.1] против 569 cГр [диапазон, 449647, 1SD = 59.5], p=0.033, без ухудшения покрытия мишени терапевтической изодозой (Рис. 3). Во время установки спейсера не было зафиксировано серьезных побочных эффектов, таких как значительные кровотечения, гематурия или повреждения стенки мочевого пузыря или уретры.
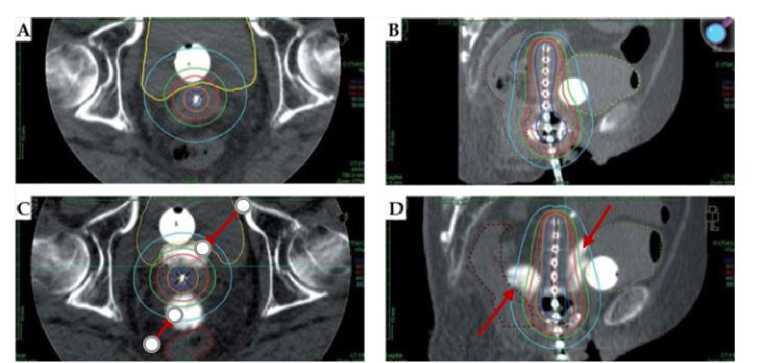
Рис. 3. Распределение дозы при «классической» внутриполостной лучевой терапии (в виде тандема и овоидов) у пациентки без (A-B) и с дополнительным введением геля гиалуроновой кислоты в качестве спейсера в ретровезикальное и ректовагинальное пространство (C-D). Стрелки указывают на места введения геля. Важно отметить, что при использовании геля гиалуроновой кислоты 100% изодоза (6 Гр) значительно отдаляется от стенок мочевого пузыря и прямой кишки, что обеспечивает более безопасную лучевую терапию. (Цит. по [27]).
Еще в одном исследовании, опубликованном Murakami с коллегами в 2020 году, были рассмотрены результаты визуально контролируемой адаптивной брахитерапии с использованием КТ-планирования. В частности, авторы проанализировали распределение дозы в прямой кишке и частоту поздних геморрагических ректитов при различных способах введения аппликаторов: вагинальных цилиндров, тандемов и овоидов, а также внутритканевых и гибридных имплантов. В анализ были включены данные клинических наблюдений за 72 пациентками с гинекологическим раком, которые проходили контактное облучение в Японском Национальном Центре Рака в Токио в период с мая 2008 года по октябрь 2017 года. Среди них было 46 больных раком шейки матки (РШМ), 19 — раком тела матки (РТМ), 5 — раком влагалища, а также по одной пациентке с раком вульвы и раком яичников. 15 пациенток проходили облучение с использованием спейсера на основе геля гиалуроновой кислоты, который устанавливался в ректо-вагинальное пространство. В течение среднего периода наблюдения в 57,7 месяца (диапазон 4,7–123,1) у 30 (41,7%) пациентов были выявлены различные симптомы позднего геморрагического ректита. Однако у женщин, которым был установлен спейсер, частота ректальных кровотечений оказалась значительно ниже, чем у тех, кто не использовал этот метод (13,3% против 49,1%, p=0,01) [28].
Особый интерес представляют данные единственного доступного в литературе одноцентрового псевдорандомизированного исследования, опубликованного Kobayashi с соавт. (2022) [29], касающегося применения спейсеров на основе геля гиалуроновой кислоты в радикальном химиолучевом лечении МРРШМ. В исследование были включены 104 больных МРРШМ, получавших лечение в Японском Национальном Центре Рака, Токио (National Cancer Center Hospital, Tokyo, Japan, с июля 2008 по январь 2020 года. Пациентки были псевдорандомизированы в две группы по 52 больных, в основной из которых под УЗ-навигацией и спинальной анестезией выполнялось введение 5–10,0 геля гиалуроновой кислоты (Sunenyl® (Chugai Pharmaceutical Co., Tokyo, Japan, 5 доз, разведенных в 5 мл физиологического раствора с добавлением 3–5 мл контрастного вещества для улучшения визуализации) в качестве спейсера в ректовагинальное и пузырно-маточное пространство. Гель вводился перед каждой фракцией брахитерапии и рассасывался в течение 2–3 дней. Авторами подчеркнута возможность значимой безопасной эскалации дозы в мишени у больных основной группы, на фоне введения спейсера, без существенных различий между группами в суммарных эквивалентных дозах в мочевом пузыре и прямой кишке: средняя эквивалентная доза на CTVHR D90 в основной группе составляла 79,4 Гр (52,6–97,5 Гр), в контрольной — 76,0 Гр (63,7–99,5 Гр), (p=0.017), D2cc в мочевом пузыре — 56 Гр и 62,9 Гр, D2cc в прямой кишке — 54,8 Гр и 63,7 Гр соответственно.
В продолжение исследований в этой области японские учёные попытались сократить количество фракций брахитерапии, одновременно увеличивая дозу за каждую фракцию, в рамках радикального химиолучевого лечения МРРШМ. Они использовали спейсер, который, как было описано ранее, вводили на этапе брахитерапии [30]. В ретроспективное исследование были включены 20 больных МРРШМ, которые были подобраны парами. У 10 из них в ректовагинальную и пузырно-маточную клетчатку был введен гель гиалуроновой кислоты. На первом этапе всем пациентам была проведена дистанционная лучевая терапия в режиме IMRT/VMAT, с дозой облучения 45 Гр, разделенной на 25 фракций. Брахитерапия осуществлялась у всех пациентов в соответствии с принципами IGABT. Применялись как классические методики внутриполостной лучевой терапии, так и их гибридные варианты. Предельно допустимыми толерантными дозы D2cc считались 80 Гр для мочевого пузыря, 70 Гр — для прямой и сигмовидной кишки соответственно. Ретроспективно были проанализированы дозовые распределения и суммарные эквивалентные дозы в мишени и органах риска для двух, трех и четырех фракций брахитерапии. Была продемонстрирована возможность безопасной эскалации дозы в мишени HR-CTV D90 более 85 Гр и значимо более низкой дозой D2cc в прямой кишке при редукции числа фракций брахитерапии до трех в подгруппе с введенным спейсером (p<0.01).
Kashihara с соавт. (2020) опубликовали результаты комплексного клиникодозиметрического анализа результатов контактного облучения, проведенного с июля 2013 по май 2014 года у 36 больных раком женской половой сферы на фоне введенного спейсера, в том числе у 16 (44,4%) больных контактная лучевая терапия была этапом первичного радикального лечения, у 10 (27,8%) — этапом сочетанной лучевой терапии по поводу рецидива после хирургического лечения, у оставшихся 10 (27,8%) брахитерапия проводилась в монорежиме по поводу рецидива опухоли в тазу после предшествовавшего облучения таза СОДэкв 50,0–81,2 Гр. Во всех случаях интродукции геля переносились хорошо, не было зафиксировано ранних или поздних осложнений после введения при медиане наблюдения 220 дней (18–1046 дней). Отмечено значимое снижение доз D2cc и D0,1cc в прямой кишке на фоне введения спейсера (р<0,001 и р=0,003 соответственно) без существенного влияния на дозиметрические параметры облучения в мочевом пузыре и мишени. Факторами, оказавшими негативное влияние на дозиметрический эффект, явилось увеличение числа игл при внутритканевой имплантации (р=0,003), а также L- cranial 100% (р=0.014) and L-cranial 80% (р=0.001), то есть длина от анального кольца до наиболее краниальной точки, в которой 100% и 80% изодозы соответственно пересекают границы прямой кишки. В целом, авторы сочли концепцию применения спейсеров на основе гиалуроновой кислоты на фоне брахитерапии у больных гинекологическим раком вполне приемлемой и эффективной для снижения дозы в прямой кишке.
Takagawa с соавт. (2022) доложили об успешном использовании ранее описанного биодеградируемого спейсера на основе ПЭГ SpaceOAR® в лечении 59-летней больной с рецидивом РТМ в малом тазу после радикального хирургического лечения и ростом опухоли в правом параметрии с вовлечением параректальной клетчатки на фоне неэффективной ПХТ [31]. Проведен курс сочетанной лучевой терапии, включавший наружное облучение таза с последующим локальным бустом в виде внутритканевой брахитерапии, и введением спейсера под УЗ-навигацией перед имплантацией игл, что позволило эскалировать дозу в мишени до условно-радикальной без превышения толерантных доз в прямой и сигмовидной кишке (Рис. 4).
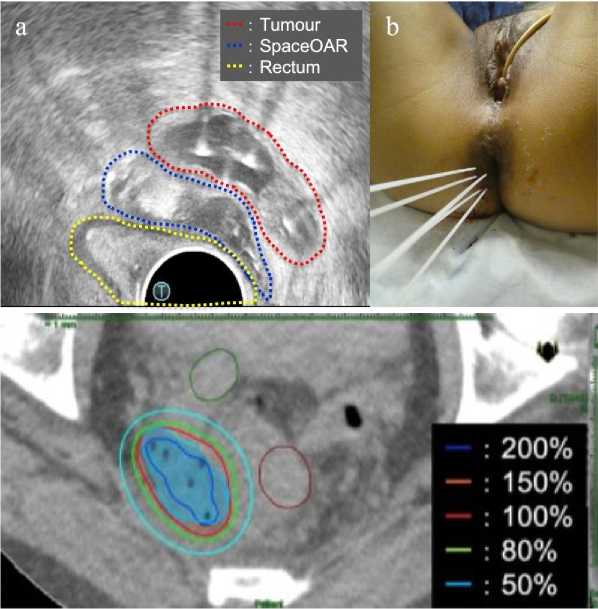
Рис. 4. (а) Трансректальное УЗИ в аксиальной проекции после имплантации гидрогеля SpaceOAR® и игл для внутритканевой лучевой терапии (стрелки). Tumour — рецидивная опухоль; SpaceOAR® — зона введенного геля-спейсера; Rectum — прямая кишка. (b) — имплантированные пластиковые иглы для выполнения внутритканевой брахитерапии. (с) — дозовое распределение от внутритканевого импланта. (Цит. по [32]).
В исследовании, проведённом в 2023 году, Muramoto и его коллеги использовали препарат MucoUp® в качестве спейсера во время стандартной химиолучевой терапии у пяти пациентов с раком шейки матки, имеющим степень распространения IIb-IIIb по FIGO. MucoUp® — это лекарство, содержащее 80 миллиграммов очищенного гиалуроната натрия. Оно зарегистрировано в большинстве стран мира для подслизистых инъекций во время эндоскопических резекций поверхностных опухолей желудочно-кишечного тракта. Авторы вводили по 5–10 миллилитров препарата в везико-вагинальную перегородку и 10–30 миллилитров — в ректо-вагинальную. Это происходило после того, как под контролем ультразвука в указанные структуры была введена игла с мандреном. Перед этим выполнялась предварительная гидродиссекция с использованием аналогичного объема физиологического раствора для подтверждения правильного анатомического расположения проводника. Введение спейсера в обе структуры занимало не более 15 мин. и не удлиняло общего времени выполнения процедуры брахитерапии (120–150 мин.) Средние объемы вводимого препарата составили 8,0 (5,0–10,0) в везикальной части и 15,0 (14,0–30,0) — в ректальной части. Среднее расстояние, на которое удалось дистанцировать стенку мочевого пузыря, составило 7 мм (5–10 мм), прямой кишки — 8 мм (5–19 мм) соответственно. Средние дозы от каждой фракции брахитерапии на HR-CTV D90 составили 11,3 Гр (9,4–18,5 Гр), D2cc в мочевом пузыре 7,9 Гр (6,0–18,9 Гр), прямой кишке — 6,6 Гр (4,6–13,0 Гр), сигмовидной кишке — 3,7 Гр (0,4–5.5 Гр), тонкой кишке — 2,6 Гр (1,5–7,1 Гр). Суммарные эквивалентные дозы от сочетанной лучевой терапии в мишени на HR-CTV D90 составили 80,2 Гр (74,8–82,3 Гр), D2cc в мочевом пузыре 70,9 Гр (64,5–73,1 Гр), прямой кишке — 64,3 Гр (59,4–64,9 Гр), сигмовидной кишке — 54,2 Гр (46,2–57,2 Гр), тонкой кишке — 48,4 Гр (43,2–56,9 Гр). Пределы толерантности в органах риска не были превышены ни у одной из пациенток. Не было зафиксировано осложнений, связанных непосредственно с введением спейсера и его пребыванием в теле человека.
Резюмируя вышеизложенное, можно заключить, что в целом технология механического дистанцирования органов риска от мишени в ходе лучевой терапии опухолей женского полового тракта, с введением биодеградируемых спейсеров, является перспективным вариантом повышения эффективности и безопасности лучевого лечения первичных и рецидивных гинекологических опухолей, в особенности при проведении внутритканевой и гибридной брахитерапии. Введение спейсера, являясь технически несложной для квалифицированного радиогинеколога процедурой, не сопровождающейся, по данным большинства исследователей, ранними и поздними осложнениями, связанными как с самой интродукцией, так и с биодеградацией используемых материалов, позволяет в то же время значимо снизить дозовую нагрузку на критические органы, уменьшить объемы органов, входящие в наиболее иррадиируемые зоны, на границе с мишенью, с возможной эскалацией разовой и суммарной дозы в мишени без роста частоты и степени тяжести лучевых осложнений.
Ограниченный по сравнению с радиоурологией мировой опыт использования спейсеров в лечении гинекологического рака может быть обусловлен целым рядом причин клинического и организационного характера. К клинически значимым, на наш взгляд, причинам можно отнести в первую очередь анатомические особенности строения женской половой системы, позволяющие свободно использовать естественные полости для дистанцирования наиболее иррадиируемых участков полых органов риска от влагалища и шейки матки путем тампонирования или использования специальных ретракторов. То есть необходимость введения спейсера возникает у более ограниченного, чем при раке простаты, числа больных, с выраженным спаечным процессом в малом тазу и брюшной полости после предшествовавших воспалительных процессов или оперативных вмешательств, долихосигмой, с фиксированными к стенке матки или влагалища участками прямой, сигмовидной и тонкой кишок. Значимое вовлечение в этих случаях органов риска в терапевтический изодозный контур с превышением толерантных доз наиболее часто отмечается при выполнении внутритканевых и гибридных брахитерапевтических интродукций, число которых в мировой радиотерапевтической практике прогрессивно падает в течение последних 10 лет в связи с высокими трудозатратами и требованиями к квалификации персонала. Лимитирующим фактором является и резко возрастающая в этом случае стоимость лучевого лечения и отсутствие разрешительных документов на применение спейсеров иностранного производства в РФ. Определенный оптимизм внушают разработки отечественного препарата гиалуроновой кислоты Сферогель®, методика применения которого в виде спейсера при радиологическом лечении рака предстательной железы апробирована и запатентована специалистами ФГБУ НМИЦ онкологии им. Н.Н. Петрова [34], однако, опыт применения субстанции при лечении гинекологического рака авторами на момент написания данного обзора не представлен. Не до конца решенным представляется и вопрос онкологической безопасности применения синтетических препаратов гиалуроновой кислоты при опухолевых процессах в связи с приводимыми рядом исследователей теоретическими предпосылками возможного стимулирующего влияния продуктов биодеградации гиалуроновой кислоты на канцерогенез [35-39]. Тем не менее вопросы клинико-дозиметрического обоснования более широкого и стратифицированного применения биодеградируемых спейсеров в отечественной радиогинекологической практике нуждаются в дальнейшей разработке и могут являться предметом многоцентровых рандомизированных исследований.
Вклад авторов. Крейнина Ю.М.: отбор, перевод и анализ литературных источников, подготовка рукописи, редактирование статьи, утверждение итогового варианта статьи с внесением замечаний; Шевченко Л.Н.: редактирование статьи; Сотников В.М.: автор идеи, редактирование итогового варианта статьи с внесением замечаний; Цаллагова З.С.: редактирование итогового варианта статьи с внесением замечаний; Титова Л.В.: сбор и первичная обработка литературного материала; Белокопытов Л.Д.: сбор, перевод и первичная обработка литературного материала, подготовка итогового варианта статьи для публикации; Исаева С.Г.: сбор, перевод и первичная обработка литературного материала, подготовка итогового варианта статьи для публикации. Все авторы прочитали и согласились с версией рукописи, представленной для публикации.
Финансирование. Это исследование не получило внешнего финансирования.
Соблюдение прав пациентов и правил биоэтики. Данное обзорное исследование было основано на опубликованных работах и поэтому не требовало одобрения этического комитета.


