Биоэлектрокаталитическое восстановление кислорода бактериальными лакказами на электродах, модифицированных многостенными углеродными нанотрубками
Автор: Алферов С. В., Федина В. В., Егоров К. А., Трубицина Л. И.
Журнал: Вестник Воронежского государственного университета инженерных технологий @vestnik-vsuet
Рубрика: Пищевая биотехнология
Статья в выпуске: 2 (100) т.86, 2024 года.
Бесплатный доступ
В данной работе проведено исследование электрохимического поведения биоэлектродов на основе бактериальных лакказ Streptomyces carpinensis VKM Ac-1300, полученных с использованием различных способов иммобилизации. Биоэлектроды формировали путем закрепления фермента на поверхности электрода простой адсорбцией, методом адсорбции на предварительно модифицированном электроде многостенными углеродными нанотрубками и путем ковалентной сшивки фермента по карбоксильным группам с функционализированными многостенными углеродными нанотрубками. Оценка ориентации иммобилизованных ферментов лакказ и их способности к прямому и медиаторному электронному переносу проводилась методом прямой амперометрии при постоянном потенциале. Установлено, что в зависимости от метода иммобилизации правильную ориентацию и, как следствие, возможность прямого переноса электронов имеет от 5 до 10% иммобилизованного фермента. При этом ковалентное пришивание белка на поверхности модифицированных нанотрубками графитовых электродов приводит к более активному прямому переносу электронов, увеличению скорости восстановления кислорода и долговременной стабильности электродов. Таким образом, для бактериальных лакказ Streptomyces carpinensis VKM Ac-1300 показана возможность прямого переноса электронов при их иммобилизации путем ковалентного пришивания по карбоксильным группам многостенных углеродных нанотрубок, разработанные биоэлектроды могут быть использованы в качестве катодов в биотопливных элементах.
Лакказы, иммобилизация, перенос электронов, ковалентное связывание, углеродные нанотрубки
Короткий адрес: https://sciup.org/140306918
IDR: 140306918 | УДК: 640 | DOI: 10.20914/2310-1202-2024-2-126-131
Текст научной статьи Биоэлектрокаталитическое восстановление кислорода бактериальными лакказами на электродах, модифицированных многостенными углеродными нанотрубками
Ферменты лакказы (benzenediol:oxygen oxidoreductase, EC 1.10.3.2) находят практическое применение в различных отраслях промышленности: пищевой, текстильной, целлюлознобумажной, косметической [1, 2]. Благодаря способности быстро восстанавливать кислород лакказы применяются при создании биокатодов в биотопливных элементах [3, 4]. Ключевым моментом при разработке биокатодов топливных элементов является выбор способа иммобилизации фермента, который обеспечивал бы надежность, технологичность, воспроизводимость и стабильность получаемых характеристик. Особенностью строения активного центра лакказ является наличие Т1 центра – первичного акцептора электронов, который передает электроны в медный кластер Т2/Т3, где происходит связывание и разрывание связей кислород-кислород. Для доставки электронов в этот каталитический центр возможны 2 механизма – опосредованный медиаторами и прямой перенос электронов (ППЭ).
Медиаторный перенос электронов предполагает использование редокс-соединений, которые облегчают перенос электронов от электрода к центру Т1. Однако с практической точки зрения, отсутствие медиаторов упрощает процесс изготовления биокатодов. Прямой перенос электрона между электродом и лакказой возможен только в том случае, если фермент правильно ориентирован на поверхности электрода, т. е. активный центр Т1 находится достаточно близко к электроду для осуществления прямого переноса электронов [1, 3, 4]. Для достижения оптимальной ориентации фермента при изготовлении биокатодов в БТЭ используют такие методы иммобилизации как адсорбция и ковалентное связывание. Так как метод адсорбции основан на случайном закреплении молекул белка на поверхности электрода, это может приводить к заметному снижению эффективности прямого транспорта электронов. Именно поэтому перед закреплением фермента проводят модификацию электродов с помощью наноструктурированных материалов. В частности, углеродные нанотрубки (УНТ) могут использоваться для улучшения электрохимического контакта электродов с окислительно-восстановительными центрами ферментов. УНТ могут находиться в непосредственной близости к активному центру и тем самым способствовать прямому переносу электронов между ферментом и электродом [5]. Однако наличие только УНТ бывает недостаточно, поэтому нанотрубки дополнительно модифицируются полициклическими ароматическими соединениями (ПАУ), которые являются аналогами субстрата лакказ (антрацен, антрахинон, нафталин), что способствуют правильной ориентации фермента [6, 7]. Другим подходом для иммобилизации лакказ
Цель работы – выбор метода иммобилизации бактериальных лакказ Streptomyces carpinensis для формирования стабильных биоэлектродов, которые потенциально могут быть использованы как биокатоды в БТЭ.
Материалы и методы
Все реактивы, использованные в работе, были квалификации ХЧ и ЧДА и приобретены в Sigma-Aldrich.
Адсорбция лакказы на графитовом электроде. Грифели («STABILO», HB, 2 мм) очищали мелкодисперсной наждачной бумагой (Р1200). Адсорбцию проводили путем погружения в раствор фермента лакказы Streptomyces carpinensis (3.0 ± 0.2 мг/мл, буфер 20 мМ Tris-HCI, рН 8.0, 0.2 5М NaCl, 0.3 M имидазол) на 24 часа.
Адсорбция лакказы на карбоксилированных нанотрубках. Грифели («STABILO», HB, 2 мм) промывали дистиллированной водой и обрабатывали ультразвуком в ацетоне в течении 5 мин. Обработанные электроды сушили при 90 °С в течение 2 ч для удаления растворителя. Кар-боксилированные многослойные нанотрубки (МУНТ-COOH) серии «Таунит-М» («Нано ТЦ», Томск) диспергировали в диметилсульоксиде ультразвуком в течение 2 мин. Электроды погружали в полученную суспензию нанотрубок на 5 мин, после чего помешали в ток горячего воздуха на 2 ч для удаления избытка растворителя. Процедуру повторяли 4 раза. Адсорбцию проводили путем погружения в раствор фермента лакказы Streptomyces carpinensis (3.0 ± 0.2 мг/мл, буфер 20 мМ Tris-HCI, рН 8.0, 0.25М NaCl, 0.3 M имидазол) на 24 часа.
Ковалентное связывание лакказы. Активацию карбоксильных групп на модифицированных МУНТ-COOH электродах проводили путем погружения в раствор 1-циклогексил-(2-морфолиноэтил) карбодиимид метоп-толу-олсульфоната (3 мг/мл в фосфатном буферном растворе (0.1 М, рН = 7)) на 2 ч. Ковалентную сшивку проводили путем погружения в раствор фермента лакказы Streptomyces carpinensis (3.0 ± 0.2 мг/мл, буфер 20 мМ Tris-HCI, рН 8.0, 0.25М NaCl, 0.3 M имидазол) на 24 часа.
Для удаления избытка несвязанного белка во всех случаях электроды промывали цитратным буферным раствором рН 4.5.
Электрохимические измерения проводили при помощи гальванопотенциостата «IPC-micro» («Kronas», Москва, Россия), интегрированного с ПК. Измерения проводили по двухэлектродной схеме (электрод сравнения Ag/AgCl) в цитратном буфере с рН 4.5, объем ячейки – 4 мл. Перед измерением буферный раствор дегазировали, ячейка продувалась аргоном до содержания кислорода 0 мг/мл, содержание кислорода контролировали с помощью кислородного электрода. Для насыщения буферного раствора кислорода включалась мешалка (скорость перемешивания 200 об/мин). Измеряемым параметром являлась амплитуда сигнала изменения силы тока рабочего электрода, определяемая как разность между начальным и конечным значениями токов в анаэробных и аэробных условиях. Измерения проводились при постоянном потенциале рабочего электрода 200 мВ [1]. Для определения лакказ, способных только к прямому переносу электронов оценку изменения силы тока проводили только в присутствии кислорода. Для определения лакказ, способных только к медиаторному переносу электронов в ячейку добавляли раствор субстрата АБТС (концентрация в ячейке 790 мкмоль).
Результаты
В работе были сформирована три типа электродов. Фермент закрепляли на поверхности электрода простой адсорбцией (электрод A), методом адсорбции на предварительно модифицированном электроде многостенными углеродными нанотрубками (электрод B) и путем ковалентной сшивки фермента по карбоксильным группам МУНТ-СООН, (электрод C). Типичный вид зависимости изменения силы тока от времени представлен на рисунке 1.
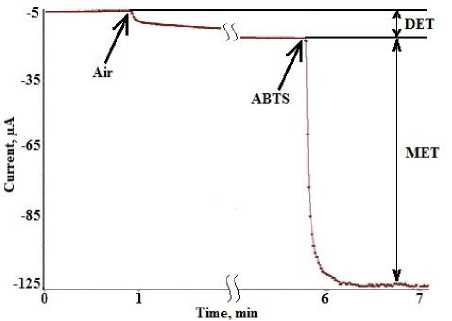
Рисунок 1. Зависимость изменения силы тока от времени для электрода A. DET – прямой перенос электронов, MET – перенос электронов с помощью медиатора
Figure 1. The dependence of the current on time for electrode A. DET - direct electron transfer, MET -mediated electron transfer
Начальное изменение силы тока при насыщении ячейки воздухом соответствует прямому переносу электронов от электрода на активный центр фермента и дальнейшему восстановлению кислорода. Изменение силы тока после добавления АБТС соответствует медиаторному переносу электронов на активный центр фермента и дальнейшему восстановлению кислорода.
Для каждого типа электродов была определена операционная стабильность. Результаты представлены в виде зависимости плотности тока от числа измерений (рисунок 2).
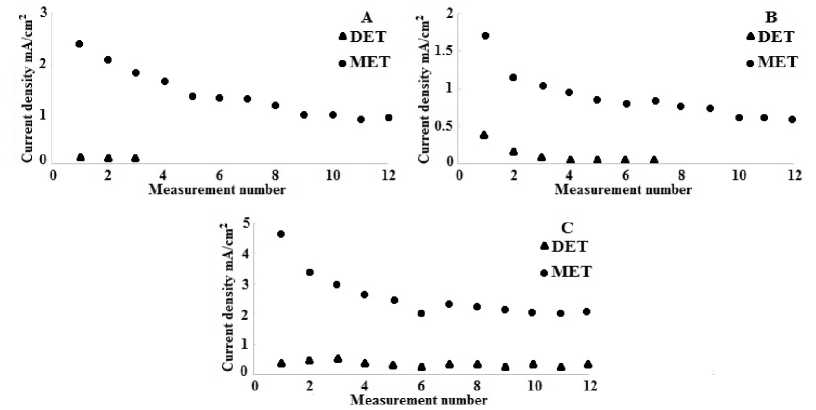
Рисунок 2. Эксплуатационная стабильность электродов с различными типами иммобилизации фермента лакказы. A - адсорбция на графитовом электроде, B - адсорбция на графитовом электроде, модифицированном МУНТ, C - ковалентное связывание с COOH-МУНТ на графитовом электроде
Figure 2. Operational stability of electrodes with different types of laccase enzyme immobilization. A - adsorption on graphite electrode, B - adsorption on graphite electrode modified with MWCNT, C - covalent bounding with MWCNT-COOH on graphite electrode
Для каждого типа электродов выполнена оценка максимальной скорости восстановления кислорода ферментом в режиме ППЭ. Параметр определялся как тангенс наклона прямой падения тока рабочего электрода. Скорости составили: для электрода A – 3,1 ± 0,3 мА • 10-3/мин, для электрода B – 7,7 ± 0,4 мА • 10-3/мин и для электрода C – 66 ± 4 мА • 10-3/мин.
Обсуждение
Применение метода амперометрии для оценки активности иммобилизованных ферментов лакказ ранее рассматривалось в работах [10, 11]. Данный метод позволяет оценить возможности иммобилизованного фермента к прямому переносу электронов, а значит судить о правильности ориентации активного центра фермента относительно поверхности электрода, и кроме того выполнить оценку максимальной скорости восстановления кислорода лакказами в режиме ППЭ. Полученные данные позволяют заключить, что наиболее перспективным методом закрепления является именно ковалентная сшивка фермента по карбоксильным группам с МУНТ-СООН на поверхности электрода. Данный метод позволяет на порядок увеличить скорость прямого ППЭ по сравнению с адсорбцией фермента на предварительно модифицированном электроде.
Оценка операционной стабильности электродов показывает, что для простой адсорбции эффект ППЭ исчезает уже после 3-го измерения, а для адсорбции на МУНТ после 7-го измерения, что свидетельствует о десорбции белка. Подобное поведение лакказ было ранее отмечено в работах [12, 13–20]. При использовании метода ковалентной сшивки сигнал биоэлектрода оставался стабильным, по крайней мере, в течение 12 измерений, что подтверждает правильность выбранного подхода закрепления фермента для его правильной ориентации и соответствует литературным данным [9].
Заключение
Для рекомбинантных бактериальных лакказ Streptomyces carpinensis показана возможность прямого переноса электронов на кислород при иммобилизации на поверхности графитового электрода. Наиболее перспективным методом иммобилизации является ковалентное связывание фермента с модифицированными углеродными нанотрубками. Данный метод способствует правильной ориентации фермента и как следствие, увеличению скорости восстановления кислорода и стабильности биоэлектрода во времени. Разработанные биоэлектроды могут быть использованы в качестве катодов в биотопливных элементах.
Работа выполнена при финансовой поддержке Министерства науки и высшего образования РФ в рамках государственного задания № FEWG-2024-0003 (Биокаталитические системы на основе клеток микроорганизмов, субклеточных структур и ферментов в сочетании с наноматериалами).
Список литературы Биоэлектрокаталитическое восстановление кислорода бактериальными лакказами на электродах, модифицированных многостенными углеродными нанотрубками
- Fernández-Fernández M., Sanromán M.Á., Moldes D. Recent developments and applications of immobilized laccase // Biotechnol. Adv. 2013. №31 (8). P. 1808-1825.
- By S., Arsenault A., Hassani T., Jones J. P., Cabana H. Laccase immobilization and insolubilization: From fundamentals to applications for the elimination of emerging contaminants in wastewater treatment // Crit. Rev. Biotechnol. 2013. №33 (4). P. 404-418.
- Le Goff A., Holzinger M., Cosnier S. Recent progress in oxygen-reducing laccase biocathodes for enzymatic biofuel cells Cell // Mol. Life Sci. 2015. №72. P. 941-952.
- Zhang Y. et al. Application of eukaryotic and prokaryotic laccases in biosensor and biofuel cells: recent advances and electrochemical aspects // Appl. Microbiol. Biotechnol. 2018. №102 (24). P. 10409-10423.
- Holzinger M., Le Goff A., Cosnier S. Carbon nanotube/enzyme biofuel cells // Electrochimica Acta. 2012. №82. P. 179-190.
- Stolarczyk K. et al. Hybrid biobattery based on arylated carbon nanotubes and laccase // Bioelectrochemistry. 2012. №87. P. 154-163.
- Giroud F. et al. Simplifying enzymatic biofuel cells: immobilized naphthoquinone as a biocathodic orientational moiety and bioanodic electron mediator // ACS Catalysis. 2015. №5 (2). P. 1240-1244.
- Bandapati M., Krishnamurthy B., Goel S. Fully assembled membraneless glucose biofuel cell with MWCNT modified pencil graphite leads as novel bioelectrodes // IEEE Transactions on Nanobioscience. 2019. №18 (2). P. 170-175.
- Gáspár S., Brinduse E., Vasilescu A. Electrochemical evaluation of laccase activity in must // Chemosensors. 2020. №8 (4). P. 126.
- Ruff A. et al. A fully protected hydrogenase/polymer-based bioanode for high-performance hydrogen/glucose biofuel cells // Nature communications. 2018. №9 (1). P. 3675.
- Olszewski B., Stolarczyk K. Laccase-catalyzed reduction of oxygen at electrodes modified by carbon nanotubes with adsorbed promazine or acetosyringone // Catalysts. 2018. №8 (10). P. 414.
- Wu F. et al. Role of organic solvents in immobilizing fungus laccase on single-walled carbon nanotubes for improved current response in direct bioelectrocatalysis // Journal of the American Chemical Society. 2017. №139 (4). P. 1565-1574.
- Gutiérrez-Sánchez C. et al. Enhanced direct electron transfer between laccase and hierarchical carbon microfibers/carbon nanotubes composite electrodes. Comparison of three enzyme immobilization methods // Electrochimica acta. 2012. №82. P. 218-223.
- Dey B., Dutta T. Laccases: Thriving the domain of bio-electrocatalysis // Bioelectrochemistry. 2022. V. 146. P. 108144.
- Lopes P., Koschorreck K., Nedergaard Pedersen J., Ferapontov A. et al. Bacillus Licheniformis CotA Laccase mutant: ElectrocatalyticReduction of O2 from 0.6 V (SHE) at pH 8 and in seawater // ChemElectroChem. 2019. V. 6. №. 7. P. 2043-2049.
- Han Z., Zhao L., Yu P., Chen J. et al. Comparative investigation of small laccase immobilized on carbon nanomaterials for direct bioelectrocatalysis of oxygen reduction // Electrochemistry Communications. 2019. V. 101. P. 82-87.
- Zhou Y., Umasankar Y., Ramasamy R.P. Laccase-TiO2 nanoconjugates as catalysts for oxygen reduction reaction in biocathodes // Journal of The Electrochemical Society. 2015. V. 162. №. 14. P. H911.
- Franco A., Cebrián-García S., Rodríguez-Padrón D., Puente-Santiago A.R. et al. Encapsulated laccases as effective electrocatalysts for oxygen reduction reactions // ACS sustainable chemistry & engineering. 2018. V. 6. №. 8. P. 11058-11062.
- Lalaoui N., David R., Jamet H., Holzinger M. et al. Hosting adamantane in the substrate pocket of laccase: direct bioelectrocatalytic reduction of O2 on functionalized carbon nanotubes // Acs Catalysis. 2016. V. 6. №. 7. P. 4259-4264.
- Zhang L., Cui H., Zou Z., Garakani T.M. et al. Directed evolution of a bacterial laccase (CueO) for enzymatic biofuel cells // Angewandte Chemie International Edition. 2019. V. 58. №. 14. P. 4562-4565.


