Биологическая роль селена и сравнительная оценка методов получения его биодоступных форм для биофортификации сельскохозяйственных культур
Автор: Жигайлов А.С., Вечтомова Е.А., Руссаков Д.М., Козлова О.В.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Обзор
Статья в выпуске: 4-2 т.28, 2025 года.
Бесплатный доступ
Селен является жизненно важным микроэлементом для человека и животных, играя ключевую роль в антиоксидантной защите, функционировании иммунной системы, метаболизме гормонов щитовидной железы и др. Дефицит Se, связанный с низким содержанием в почвах многих регионов мира, приводит к серьезным заболеваниям (болезнь Кашина – Бека и болезнь Кешана), а избыток вызывает токсическое отравление (селеноз). Актуальная задача развития сельского хозяйства – разработка эффективных методов биофортификации, направленных на повышение содержания биодоступных форм селена в растениях без негативного влияния на их рост и продуктивность. В ходе исследования проведен сравнительный анализ современных физических, химических и биологических методов получения биодоступных форм селена. Физические методы (механическое измельчение, лазерная абляция и ультразвуковая обработка) позволяют получать наночастицы чистого селена SeNPs, но требуют значительных энергозатрат; наночастицы могут подвергаться агломерации. Химические методы основываются на использовании растворимых соединений селена (селенаты и селениты) и химическом синтезе SeNPs, обеспечивают высокую эффективность усвоения селена растениями, но требуют строгого контроля дозировки из-за риска токсичности и возможного загрязнения окружающей среды. Биологические методы предполагают применение микроорганизмов, способных трансформировать селен в органические формы (селеноцистеин и селенометионин), отличаются экологичностью и способствуют естественному накоплению селена в растениях, но их эффективность зависит от почвенных условий и вида культур. Наиболее рациональной стратегией представляется комбинированный подход, интегрирующий достоинства разных методов.
Селен, биофортификация, биодоступность, наночастицы селена, селенаты, селениты, селенредуцирующие микроорганизмы, сельскохозяйственные культуры, комбинированные методы
Короткий адрес: https://sciup.org/142246589
IDR: 142246589 | УДК: 631.811.98:546.26 | DOI: 10.21443/1560-9278-2025-28-4/2-718-734
Текст научной статьи Биологическая роль селена и сравнительная оценка методов получения его биодоступных форм для биофортификации сельскохозяйственных культур
e-mail: , ORCID:
Жигайлов А. С. и др. Биологическая роль селена и сравнительная оценка методов получения его биодоступных форм для биофортификации сельскохозяйственных культур. Вестник МГТУ. 2025. Т. 28, № 4/2. С. 718–734. DOI:
Zhigailov, A. S. et al. 2025. Biological role of selenium and comparative evaluation of methods for obtaining its bioavailable forms for biofortification of agricultural crops. Vestnik of MSTU, 28(4/2), pp. 718–734. (In Russ.) DOI:
Селен был открыт в 1817 г. шведским химиком Якобом Берцелиусом, который работал на заводе по производству серной и азотной кислот. Одним из видов сырья, которое использовалось в процессе производства, был пирит (сульфид железа), добываемый в шахте в Фалуне. Было замечено, что при использовании руд из Фалуна образуется красноватый осадок. Первоначально считалось, что за этот характерный осадок отвечает соединение мышьяка. Результаты анализа образцов показали вероятное присутствие теллура, однако Берцелиус поставил под сомнение этот результат. В начале 1818 г. Берцелиус повторил эксперименты в лаборатории в Стокгольме и обнаружил, что исследованный осадок содержит новый, ранее не открытый элемент, по свойствам сходный с серой. Это вещество было названо селеном, от греческого слова "селена", что означает "луна".
До 1957 г. селен и его соединения считали исключительно токсичными для живых организмов. Причиной этого мнения являлись массовые отравления скота в некоторых районах Великой равнины США. В 1957 г. открытие К. Шварца и С. Фольца по предотвращению развития некроза печени крыс очень низкими дозами селенита натрия послужило началом использования соединений селена в терапии заболеваний животных ( Миних, 2022 ).
Селен Se является жизненно важным микроэлементом для человека и животных, играя ключевую роль в антиоксидантной защите, иммунной функции, метаболизме гормонов щитовидной железы и других физиологических процессах. Однако его дефицит в рационе, обусловленный низким содержанием в почвах многих регионов мира, приводит к серьезным заболеваниям, таким как болезнь Кашина – Бека и болезнь Кешана. В то же время избыток селена токсичен, что требует точного контроля его поступления в организм ( Mojadadi et al., 2021; Zhang et al., 2020 ).
Основным источником селена для человека являются сельскохозяйственные культуры, содержание микроэлемента в которых напрямую зависит от его доступности в почве и методов агротехнической биофортификации. В связи с этим актуальной задачей становится разработка и оптимизация методов получения биодоступных форм селена, обеспечивающих эффективное накопление элемента в растениях без негативного воздействия на их рост и продуктивность ( Gupta et al., 2000; Trippe et al., 2021 ).
Цель данного исследования – провести сравнительный анализ современных методов получения биодоступных форм селена для биофортификации сельскохозяйственных культур, оценив их эффективность, преимущества и ограничения. В ходе анализа рассмотрены физические, химические и биологические подходы, а также перспективы их комбинированного применения для решения проблемы дефицита селена в питании человека.
Теоретические основы
Селен Se – микроэлемент, представляющий значительный агрономический и пищевой интерес. Селен вместе с кислородом, серой, теллуром и полонием составляют главную подгруппу VI группы1. Эти атомы, называемые халькогенами, по структуре внешней электронной оболочки и, следовательно, по физикохимическим свойствам сходны между собой ( Varlamova et al., 2019 ). По химическим свойствам и условиям нахождения в природе селен сходен с теллуром ( Назаренко и др., 1971 ). Сера и селен значительно различаются по распространенности в земной коре (серы содержится на три порядка больше, чем селена) ( Миних, 2022 ).
С увеличением радиуса атома Se ( r = 1,17 Å) уменьшается сродство к электрону, ослабевают неметаллические свойства и усиливаются металлические свойства. Структура внешней электронной оболочки атома селена подобна структуре атома серы. Этот элемент обладает преимущественно металлоидными свойствами ( Назаренко и др., 1971 ). В химическом отношении они почти полные аналоги, способные образовывать сходные соединения и занимать эквивалентные позиции во многих молекулах ( Миних, 2022 ).
Селен широко распространен по всей Земле и присутствует в различных формах в атмосфере, литосфере, гидросфере и биосфере. В земной коре селен может присутствовать в основном в виде селената Se(VI), селенита Se(IV) и органических форм SeCys и SeMet, хотя элементарный селен Se(0) и селенид Se(-II) также могут присутствовать в зависимости от окислительно-восстановительного потенциала почвы. Элементарный селен встречается в нескольких аллотропных модификациях [металлический (серый) и красный аморфный]. В почвах и водах Se содержится в основном в виде оксианионов: селената (в аэрированных щелочных условиях) и селенита (в нейтральных и кислых условиях). В условиях пониженного увлажнения могут преобладать элементарный селен или селенид ( Okonji et al., 2021 ).
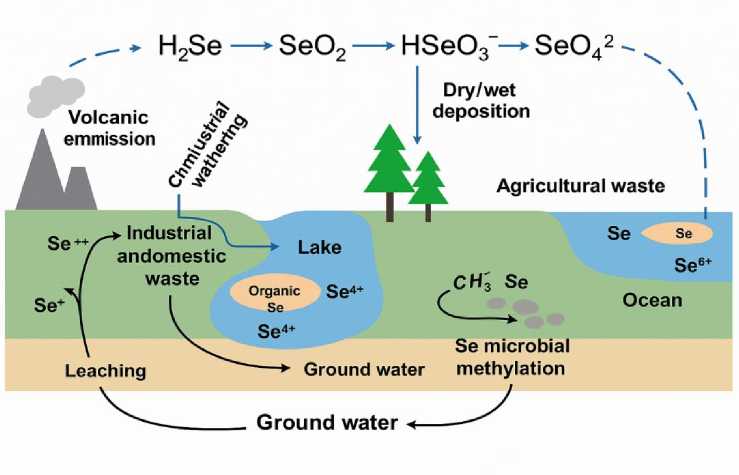
Биогеохимический цикл селена (рис. 1) относится к естественному перемещению и трансформации селена через атмосферу, литосферу, гидросферу, биосферу и включает в себя как органические, так и неорганические формы селена ( Yang et al., 2022 ).
В гидросфере селен присутствует в основном в виде селенатов и селенитов (в следовых количествах). Количество селена в грунтовых водах значительно выше, чем в морской воде, из-за вымывания селена из материнских пород и чрезмерного удобрения почв смесями, богатыми соединениями селена ( Mojadadi et al., 2021 ).
Se4
Ground water andomestic waste
HSeO3 — SeO42
Agricultural waste
Industrial
Se
Lake
Se6+
CH3 Se
Se4+
Organic
Ocean
Leaching
Dry/wet deposition
Volcanic emmission
H2Se
SeO2
Se microbial
Ground water methylation
Рис. 1. Схематическая диаграмма, показывающая биогеохимический цикл Se ( Yang et al., 2022 )
Fig. 1. Schematic diagram showing the biogeochemical cycle of Se ( Yang et al., 2022 )
Селен необходим большинству организмов, включая человека и многих животных. Селен не является биологически активным веществом, однако он выполняет свои биологические функции путем включения в состав селеноцистеина и селенометионина с последующей интеграцией в 25 селенопротеинов млекопитающих (например, глутатионпероксидазу, тиоредоксинредуктазу, йодтирониндейодиназу) ( Ахмеджанова и др., 2020 ).
Эти селенопротеины играют важную роль в антиоксидантной защите, метаболизме гормонов щитовидной железы, синтезе ДНК и работе иммунной системы. Селен входит в состав ряда белков и ферментов, участвует в окислительно-восстановительных реакциях, функционировании механизмов образования и накопления энергии в клетках, обмене белков, жиров, углеводов и нуклеиновых кислот, детоксикации ксенобиотиков, включая тяжелые металлы, необходим для нормального функционирования антиоксидантной, эндокринной, репродуктивной, сердечно-сосудистой систем организма ( Ахмеджанова и др., 2020 ).
Селен – уникальный микроэлемент; это единственный из микроэлементов, который должен быть указан в генетическом коде. Он необходим при очень низком уровне потребления. По данным Роспотребнадзора, физиологическая потребность для взрослых составляет 55 мкг/сут (для женщин), до 70 мкг/сут (для мужчин), физиологическая потребность для детей – от 10 до 50 мкг/сут. При этом селен проявляет токсичные свойства при концентрации выше 800 мкг/сут, также определен безопасный верхний предел – 400 мкг/сут ( Zhang et al., 2020 ). Оптимальное поддержание уровня селена в организме имеет большое значение, поскольку как недостаток, так и избыток этого микроэлемента представляют потенциальную опасность для здоровья человека. Потребление должно быть достаточным для поддержания уровня селенопротеинов, но не настолько высоким, чтобы вызвать селеноз. Клинические проявления токсического воздействия избыточного количества селена у людей и животных могут проявляться комплексом симптомов, включающих нарушения со стороны желудочно-кишечного тракта, патологические изменения волос и ногтей (повышенную ломкость и выпадение), различные дерматологические поражения, неврологические нарушения, а в тяжелых случаях – повреждение внутренних органов ( Zhang et al, 2020 ).
Таким образом, Se является незаменимым элементом (в количестве ~55 мкг в день), но обладающим токсичностью при превышении оптимальных доз.
Физиологическая роль селена велика. Являясь компонентом антиоксидантных ферментов (например, глутатионпероксидазы, тиоредоксинредуктазы), он помогает нейтрализовать свободные радикалы и защищает от окислительного стресса. В щитовидной железе селеносодержащие йодтирониндейодиназы регулируют активацию гормонов щитовидной железы и метаболизм. Селен также поддерживает иммунную систему, подавляя воспаление и усиливая функцию Т-лимфоцитов и лейкоцитов (Ning et al., 2018). Геном человека кодирует ~25 селенопротеинов; среди них глутатионпероксидазы, которые защищают клеточные мембраны от перекисного окисления липидов, а селенопротеин Р транспортирует Se в плазму (Strachan et al., 2009). Исследования показывают, что потребление Se может влиять на риск развития рака, сердечно-сосудистых заболеваний и вирусных инфекций, хотя клинические результаты различаются.
Дефицит селена – широко распространенная проблема, с которой сталкивается около миллиарда человек в мире. Основной причиной служит употребление продуктов питания, содержащих пониженное содержание микроэлемента. Количество селена в организме зависит от его поступления из окружающей среды и обусловлено геохимическими особенностями и в целом биогеохимической организованностью территорий, поскольку миграция селена в природных условиях осуществляется по пищевой цепи из почвы в растения, организм животных и человека ( Естафьева и др., 2021 ). Кроме того, дефицит Se может наблюдаться вследствие нарушения обмена веществ, нарушения адсорбционной функции ЖКТ, кожи и легких ( Пономарева и др., 2023 ).
Длительная нехватка селена в организме человека способна вызвать серьезные системные нарушения включая болезнь Кашина – Бека, болезнь Кешана, расстройства нервной системы и иммунологическую недостаточность. Определить дефицит селена можно с помощью анализа его уровня в сыворотке или плазме крови.
Селен – антиоксидантный микроэлемент – жизненно важен для общего состояния здоровья человека и особенно важен для функционирования головного мозга. Мозговая ткань является одним из органов с самым высоким содержанием селена в организме человека. Селен защищает мозг от окислительного стресса, стресса эндоплазматического ретикулума и воспалений ( Liu et al., 2014 ).
Недостаточное поступление селена с пищей способно вызывать различные патологические состояния, включая снижение экспрессии селенопротеинов в различных органах и развитие церебральных нарушений. При ограниченном поступлении этого микроэлемента организм человека способен поддерживать относительно стабильную концентрацию селена в тканях головного мозга за счет его перераспределения из других тканей. Исследования демонстрируют, что при восполнении дефицита посредством селенсодержащих добавок нормализация уровня селена происходит в первую очередь в мозговой ткани ( Rayman, 2000 ). Это свидетельствует о существовании специальных механизмов селективного накопления селена в мозге, что подчеркивает его критическую роль в регуляторных процессах центральной нервной системы.
Болезнь Кашина – Бека (БКБ) – эндемическое заболевание опорно-двигательной системы, распространенное преимущественно в Сибирском регионе России, Северной Корее и часто встречается в Китае. Клинические проявления БКБ включают боль в суставах, увеличенные и деформированные суставы и двигательные нарушения; в тяжелых случаях они проявляются в виде карликовости и инвалидности. Ведущим патогенетическим очагом является апоптоз и некроз хондроцитов в суставном хряще, эпифизе и эпифизарной пластинчатой хрящевой ткани ( Zhang et al., 2023; Liao et al., 2024 ). Чаще всего он встречается у детей в возрасте от 5 до 13 лет. У пациентов, страдающих болезнью Кашина – Бека необычно низкий уровень селена в волосах и цельной крови, а также заметно снижен уровень глутатионпероксидазы в крови ( Sun et al., 2023 ).
Многочисленные экспериментальные исследования подтвердили, что применение селеновых добавок благотворно влияет на профилактику и лечение БКБ ( Ning et al., 2018; Strachan et al., 2009 ). БКБ преимущественно встречается в регионах с дефицитом селена, но не на всех территориях с низким содержанием селена отмечается повышенная частота заболевания среди населения. Учитывая отсутствие комплексного анализа элементного дисбаланса в окружающей среде и организме людей, страдающих БКБ, исследование биоэлементного профиля БКБ может иметь решающее значение для пересмотра уникальной роли Se в развитии данного заболевания ( Liu et al., 2024а ).
Болезнь Кешана (БК) – эндемическая форма кардиомиопатии, характеризующаяся поражением миокарда, о которой впервые сообщили в 1935 г. в уезде Кешань (провинция Хэйлунцзян, Китай). Заболевание преимущественно поражает женщин детородного возраста и детей школьного возраста ( Liao et al., 2024 ). Основными клиническими проявлениями заболевания являются острые или хронические сердечные приступы, сопровождающиеся истощением, аритмией, учащенным сердцебиением после ограниченной физической нагрузки, отсутствием аппетита, сердечной недостаточностью, гипертрофией сердца и застойной сердечной недостаточностью.
Одной из наиболее известных гипотез развития болезни Кешана является биогеохимическая этиологическая гипотеза о питании, рассматривающая в основном дефицит селена как предпосылку, вызывающую данную болезнь (Hou et al., 2021). Эпидемиологические исследования показали, что БК преимущественно распространена в зоне с низким содержанием селена, протянувшейся с северо-востока на юго-запад Китая, где отмечается сниженное содержание этого микроэлемента в воде, почве и зерновых культурах. При этом у пациентов с БК уровень селена в крови, волосах и органах значительно ниже, чем у здоровых людей (Liu et al., 2021).
Важное доказательство роли селенодефицита было получено в 1974 г. в ходе рандомизированного контролируемого исследования, проведенного в эндемичном регионе. Результаты показали, что в группе, получавшей селеновые добавки, заболеваемость БК была существенно ниже по сравнению с контрольной группой, что подтвердило значительное влияние селена на профилактику заболевания и указало на дефицит этого микроэлемента как одну из ключевых причин развития БК.
Чрезмерное употребление пищевых добавок или диета, богатая продуктами с высоким содержанием селена, могут привести к накоплению селена и селенозу в организме. Острое отравление селеном диагностировать достаточно трудно, поскольку его симптомы довольно специфичны. К ним относятся артериальная гипотензия, тахикардия и неврологические расстройства, такие как тремор и непроизвольные мышечные сокращения. Хронический селеноз характеризуется выпадением волос, деформацией и ломкостью ногтей, кожной сыпью, болью в суставах, разрушением зубов и специфическим запахом чеснока в выдыхаемом воздухе из-за присутствия летучего соединения диметилселенида ( Rayman, 2000 ).
Разница между необходимым и токсичным потреблением невелика. Национальные органы здравоохранения и ВОЗ рекомендуют взрослым принимать около 55–70 мкг Se в день и не превышать 400 мкг/сут во избежание токсического воздействия. Таким образом, селен имеет решающее значение для антиоксидантной функции щитовидной железы и иммунитета; дефицит приводит к серьезным нарушениям здоровья, в то время как хронический переизбыток вызывает селеноз ( Liu et al., 2024б ).
Основными источниками естественного биогеохимического поступления Se в окружающую среду являются выветривание горных пород и извержение вулканов. Кроме того, разложение органических матриц, содержащих селен, путем расщепления сложных органических веществ в результате жизнедеятельности различных групп микроорганизмов поддерживает приток этого элемента в окружающую среду. В глобальном масштабе селен, как правило, в большей степени концентрируется в осадочных породах, чем в магматических, и может циркулировать во всех сферах окружающей среды ( Okonji et al., 2021 ).
Содержание селена в почвах в основном зависит от исходного материала, типа и текстуры почвы, происхождения и геологической истории, содержания органического вещества, степени выветривания и количества осадков, преобладающих геогенных процессов в почве и отложений Se. Почвы с низким содержанием Se происходят из магматических пород и оседают в районах, характеризующихся ограниченным количеством осадков и повышенными темпами эрозии. Почвы с высоким содержанием Se происходят из осадочных пород, как правило, меловых отложений (таких как черные сланцы), содержащих селениты и селениды, связанные с сульфидными минералами ( Сычев и др., 2015 ) .
Климатические условия также играют значительную роль в распределении Se в почвах: в засушливых регионах с хорошо окисленными почвами наблюдается потеря селена вследствие испарения, тогда как во влажном климате происходит его накопление благодаря осаждению. На содержание селена в почве также воздействуют многочисленные факторы, включая уровень pH, количество органических веществ, окислительно-восстановительный потенциал и тип почвы ( Liu et al., 2024б ). Особенно важным параметром является кислотность почвы – максимальные концентрации селена обычно фиксируются в почвах с pH 6,5–7,5, где элемент находится в подвижной форме селената, легко усваиваемой растениями. И наоборот, при выходе за эти оптимальные границы pH (как в кислую, так и в щелочную сторону) селен переходит в труднодоступные формы (селениты и селениды), прочно связывающиеся с почвенными минералами. В кислых почвах высокое содержание железа и алюминия дополнительно способствует образованию малоподвижных соединений селена, что существенно снижает его биодоступность для растений. Наиболее благоприятные условия для усвоения селена растениями создаются при pH 6,5–7,5, достаточном содержании органики и оптимальном окислительно-восстановительном потенциале. При этом разные типы почв демонстрируют заметные различия в содержании селена: минимальные концентрации характерны для песчаных почв, тогда как глинистые почвы обычно богаче селеном. Сравнительный анализ показывает следующую закономерность увеличения содержания селена в основных типах зональных почв: красные почвы > желтые почвы > черноземы > темно-коричневые почвы ( Yang et al., 2022 ).
Содержание Se в разных типах почв изменяется от 10 до 1 000 мкг/кг и выше. Низким содержанием селена в земной коре отличаются такие регионы, как Китай, Новая Зеландия и Океания, Украина, Финляндия, Германия ( Gupta et al., 2000 ). Испания, США, Австралия имеют высокое содержание селена в почве ( Smith et al., 2013 ).
Средняя концентрация селена в почвах России составляет 300 мкг/кг. На основе анализа региональных биогеохимических особенностей распределения селена, а также сопоставления его содержания в растениях и водах, В. В. Ермаков разработал карту селенового статуса страны (рис. 2). На карте указаны следующие обозначения: 1 – дефицит селена четко выражен; 2 – умеренный недостаток селена в среде; 3 – территория с относительно нормальным статусом селена; 4 – территория с повышенным содержанием селена в растениях и среде; 5 – участки селеновых аномалий и потенциальных биогеохимических гиперпровинций; цифры на карте – административные единицы.
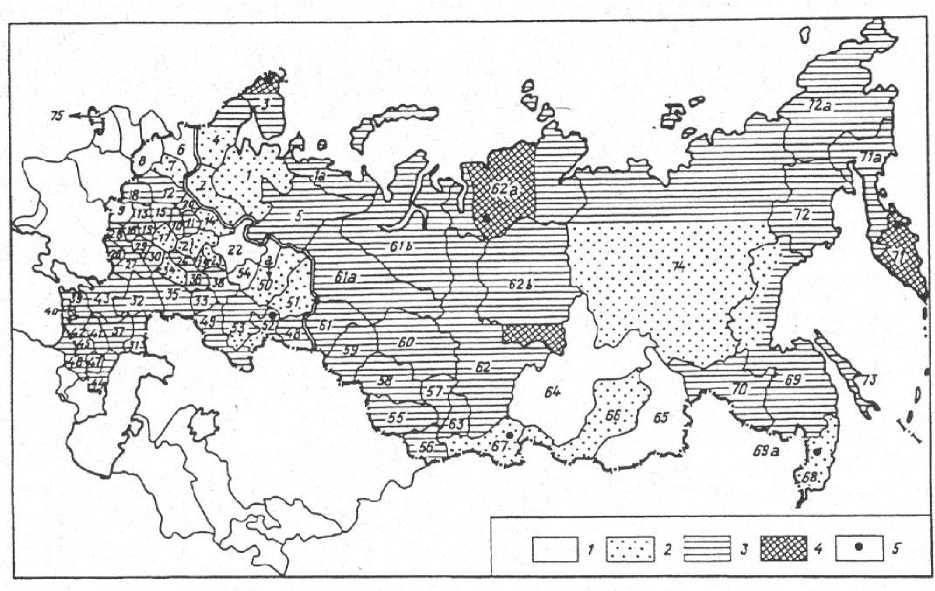
Рис. 2. Селеновый статус России ( Ермаков, 1999 )
Fig. 2. Selenium status of Russia ( Ermakov , 1999 )
Согласно исследованиям наиболее выраженный дефицит селена наблюдается в Центральном Черноземье (Брянская, Ленинградская, Ярославская, Кировская области), отдельных районах Поволжья, Предбайкалья, Забайкалья и Дальнего Востока. При этом территории с повышенным содержанием селена встречаются крайне редко и представлены лишь локальными участками в Красноярском крае, Адыгее, на Камчатке, Курильских островах и в Туве ( Сычев и др., 2015 ).
В современной классификации регионы с содержанием селена ниже 100 мкг/кг считаются селенодефицитными, при концентрации 200–300 мкг/кг – среднеобеспеченными, а при более высоких показателях дефицит элемента отсутствует. К числу селенодефицитных регионов относятся Нечерноземная зона России, Южный Урал, Удмуртия, Карелия, Якутия, Забайкалье и Приморский край. В Западной Сибири содержание селена в почвах варьирует от 0,1 до 0,8 мг/кг, при этом максимальные значения характерны для высокогумусированных тяжелосуглинистых почв Барабинской и Ишимской равнин ( Побилат и др., 2020 ). Территории Кемеровской области и Республики Алтай относятся к биогеохимическим провинциям с селеновой недостаточностью.
Селен является жизненно важным микроэлементом для живых организмов, играющим существенную роль в поддержании здоровья человека. В то же время его необходимость для растительных организмов остается научно не доказанной. Физиологическое значение селена в первую очередь обусловлено его включением в состав селенопротеинов, которые синтезируются посредством метаболической системы, ответственной за усвоение и преобразование этого элемента в организме ( Kang et al., 2020 ).
Селен поступает в организм человека или животного по следующей цепочке: почва – растение – пища. Растения способны поглощать как ионы селената, так и ионы селенита у корней, однако ни один из них не поглощается специфичным для Se транспортером ( Trippe et al., 2021 ). Поглощение Se имеет общий механизм с серой и фосфором через анионные каналы и транспортерами. Селенат SeO2 - имитирует сульфат и поглощается переносчиками сульфатов в корнях (например, SULTR1;1 и SULTR1;2) или некоторыми аквапоринами. Процесс усвоения селенита более сложный: он может поступать как через транспортеры фосфатов, так и по пассивным каналам (например, аквапорин OsNIP2;1 в рисе) ( Raina et al., 2021 ).
Метаболизм селена у высших растений тесно взаимосвязан с обменом серы благодаря их химическому сходству: оба элемента образуют тетраэдрические структуры и имеют близкие значения pKa (1,9 для сульфата против 1,74 для селената). Это сходство подтверждается тем, что селен проникает в растения через те же транспортные системы, что и сера (сульфатные транспортеры SULTR), а его ассимиляция происходит по аналогичным биохимическим путям (Raina et al., 2021).
Попадая в клетку растения через корни, неорганический Se быстро преобразуется в органические формы. Растения восстанавливают селенат до селенита (с помощью АТФ-сульфурилазы), а затем до селенида, который участвует в метаболизме серы. В конечном итоге Se включается в состав аминокислот, главным образом селеноцистеина и селенометионина, а также в состав белков вместо серы. Из-за этих процессов большая часть Se в тканях съедобных растений находится в органической форме (Se-AAs) ( Zhang et al., 2006 ).
В модельном растении Arabidopsis thaliana идентифицировано 14 генов, кодирующих сульфатные транспортеры, которые активно участвуют в этом процессе ( Yuan et al., 2021 ).
В хлоропластах селенат сначала преобразуется АТФ-сульфурилазой в 5'-селенаденозилфосфат, который затем восстанавливается до селенита под действием аденозин-5'-фосфосульфатредуктазы. Далее селенит вступает в реакцию с О-ацетилсерином (OAS) при участии цистеинсинтазы CSase, образуя селеноцистеин SeCys. Этот ключевой метаболит имеет три основных пути превращения: 1) расщепление селеноцистеинлиазой до аланина и элементарного селена; 2) метилирование селеноцистеинметилтрансферазой с образованием метилселеноцистеина MeSeCys, который может далее превращаться в летучий диметилдиселенид DMDSe, способствуя выведению избытка селена; 3) превращение селеноцистеина SeCys в селенометионин SeMet через последовательные реакции с участием цистиононин-γ-синтазы и цистатионин-β-лиазы, с последующим катализом метионинсинтазой ( Li et al., 2020 ).
У некоторых растений SeMet может метилироваться метионинметилтрансферазой MMT с образованием метилселенометионина MeSeMet, предшественника летучего диметилселенида DMSe. Растения способны накапливать селеноаминокислоты SeCys и SeMet как в хлоропластах, так и в цитоплазме. Основными формами накопления селена в растениях являются селеноаминокислоты, селенопротеины и различные селенсодержащие соединения, включая селенополисахариды. Схематическое изображение основных путей поглощения и метаболизма селена в растениях представлено на рис. 3 ( Zhang et al., 2006 ), где указаны обозначения: SULTR – транспортер сульфата; ATPS, АТФ-сульфурилаза; APSe – аденозин-5′-фосфоселенат; APR – аденозин-5′-фосфосульфатредуктаза; SiR – сульфитредуктаза; GSH – глутатион; CSase – цистеинсинтаза; SMT – селеноцистеинметилтрансфераза; SL – селеноцистеинлиазы; CGS – цистатионин-γ-синтаза; CBL – цистатионин β-лиаза; MTR – метионинсинтаза; MMT – метионинметилтрансфераза; SeCys – селеноцистеин; SeMet – селенометионин; SeHCys – Se гомоцистеин; SeMSeMet – метилселенометионин; SeMSeCys – метилселеноцистеин; DMSe – диметилселенид; DMDSe – диметилдиселенид.
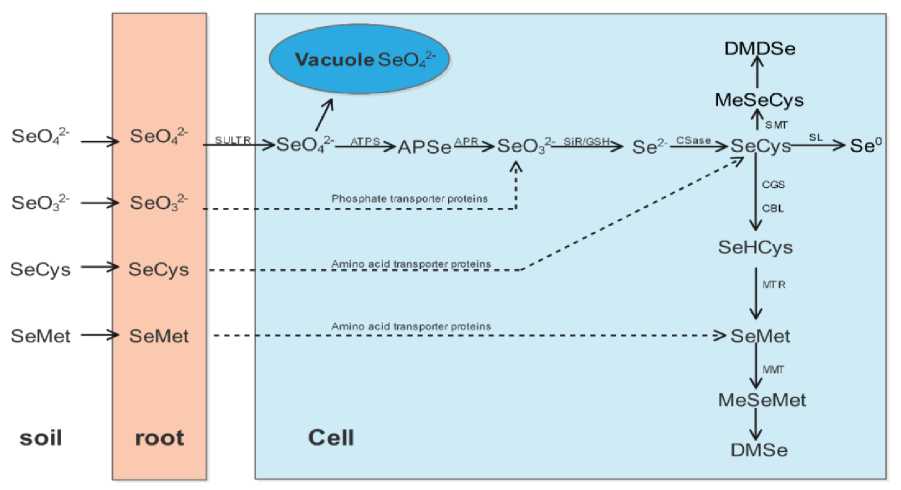
Рис. 3. Основные способы поглощения и усвоения селена растениями ( Zhang et al., 2006 )
Fig. 3. The main ways of selenium absorption and assimilation by plants ( Zhang et al., 2006 )
В последние десятилетия активно разрабатываются методы получения растений, обогащенных селеном, что особенно важно для регионов с его дефицитом в почвах, где население не получает достаточного количества этого микроэлемента с пищей. Наиболее эффективным и проверенным способом повышения содержания селена в растениях является их культивирование на почвах с высоким содержанием Se или применение селенсодержащих удобрений. Все растения по способности накапливать селен можно разделить на три группы:
-
1) неаккумуляторы (содержание Se менее 100 мг/кг), к которым относится большинство покрытосеменных растений;
-
2) аккумуляторы (100–1 000 мг Se/кг при выращивании на богатых селеном почвах), включающие такие виды, как Brassica juncea, Brassica napus, Broccoli, Helianthus, Aster, Camelina, Medicago sativa ;
-
3) гипераккумуляторы (1 000–15 000 мг Se/кг), представленные родами Stanleya, Astragalus, Conopsis, Neptunia и Xylorhiza .
Особенностью растений-аккумуляторов является их способность активно поглощать и концентрировать селен из почвы ( Перфильева, 2022; Tangjaidee et al., 2023 ).
Большинство сельскохозяйственных культур обладают низкой толерантностью к селену (менее 50 мг Se на кг сухого веса), однако представители семейства капустных, а также лук, чеснок и некоторые виды грибов демонстрируют повышенную способность к накоплению этого элемента благодаря высокому содержанию серосодержащих соединений. Химическое сходство селена с серой позволяет ему замещать серу в биохимических процессах, что приводит к образованию селенсодержащих аналогов органических соединений и способствует увеличению концентрации селена в растении. Среди бобовых культур особенно выделяется чечевица как богатый источник селена, однако наибольшее содержание этого микроэлемента обнаружено в орехах, богатых белком (фисташках, грецких и бразильских орехах). Фрукты, характеризующиеся низким содержанием белка и высоким содержанием воды, как правило, содержат минимальные количества селена.
Однако более высокие концентрации Se токсичны для растений: они вызывают окислительный стресс и повреждают белки (из-за неправильного сочетания Se с S). Симптомы токсичности Se для растений включают хлороз, задержку роста, омертвение листьев и снижение урожайности. Эти параллели с токсичностью для животных подчеркивают узкий диапазон полезных свойств ( Germ et al., 2007 ).
Физиологическая роль селена в растениях продолжает активно изучаться. Современные исследования выявили его участие в ключевых метаболических процессах, включая биосинтез хлорофилла, цикл трикарбоновых кислот и метаболизм длинноцепочечных жирных кислот. Особый научный интерес представляет способность селена усиливать антиоксидантную защиту растений посредством активации ферментных систем (супероксиддисмутазы, каталазы и глутатионпероксидазы) и стимуляции синтеза неферментных антиоксидантов (аскорбата, флавоноидов, алкалоидов и каротиноидов). Важнейшую роль играет включение селеноцистеина в активный центр Se-зависимой глутатионпероксидазы – ключевого фермента антиоксидантной системы. По мнению исследователей, именно участие селена в регуляции антиоксидантного статуса растений объясняет его защитное действие при различных стрессовых воздействиях ( Перфильева, 2022 ).
Агрономическая биофортификация направлена на обеспечение растений селеном в формах, которые они могут усваивать; методы делятся на физические, химические и биологические.
Элементарный селен Se(0) встречается в нескольких аллотропных формах: красный аморфный порошок, черная аморфная форма и серая гексагональная (металлическая) форма. В табл. 1–2 представлены физические характеристики элементарного селена.
Таблица 1. Физические свойства металлического селена ( Назаренко и др., 1971 )
Table 1. Physical properties of metallic selenium ( Nazarenko et al., 1971 )
|
Параметр |
Значение |
|
Цвет |
Серый, металлический блеск |
|
Плотность, г/см3 |
4,81 |
|
Температура плавления, °C |
221 |
|
Температура кипения, °C |
684,95 |
|
Удельная теплота плавления, кДж/моль |
5,23 |
|
Удельная теплота испарения, кДж/моль |
59,7 |
|
Молярная теплоемкость, Дж/ (K·моль) |
25,4 |
|
Молярный объем, см3/ моль |
16,5 |
|
Твердость |
Хрупкий |
|
Электропроводимость |
Высокая при комнатной температуре, но снижается при нагревании |
|
Кристаллическая структура |
Гексагональная плотноупакованная решетка |
Таблица 2. Физические свойства красного аморфного селена ( Назаренко и др., 1971 )
Table 2. Physical properties of red amorphous selenium ( Nazarenko et al., 1971 )
|
Параметр |
Значение |
|
Цвет |
От ярко-красного до красновато-черного |
|
Плотность, г/см3 |
4,26 |
|
Температура плавления, °C |
180–200 (зависит от чистоты) |
|
Твердость |
Хрупкий, легко крошится |
|
Электропроводимость |
Низкая при комнатной температуре, увеличивается при нагревании |
|
Структура |
Аморфная, без четкой кристаллической структуры |
В почвах преобладают красные и черные формы (кластеры наночастиц или порошки), но все формы элементарного селена практически нерастворимы и, следовательно, минимально доступны для растений. Красный аморфный селен обычно образуется в виде агрегатов размером от наноразмеров до микроразмеров при осаждении, но при более высоких температурах он медленно превращается в более стабильную серую кристаллическую форму. Серый гексагональный селен (металлический) состоит из более крупных кристаллов (микронного размера) и по свойствам инертен. На практике ни красный, ни серый Se в больших количествах не усваиваются растениями. Напротив, очень мелкие частицы Se (элементарные наночастицы Se), образующиеся в результате физических процессов, могут быть более доступными из-за большой площади их поверхности, при этом они остаются нерастворимыми ( Kessi et al., 1999 ).
Помимо простого диспергирования, физическое получение наночастиц SeNPs селена достигается механическими или энергетическими методами.
Шаровой помол ( механическое измельчение ) . При высокоэнергетическом измельчении порошка элементарного Se можно получить SeNPs размером в десятки нанометров. Например, в одном отчете был получен SeNPs с длиной волны 37–85 нм с помощью высокоскоростного шарового измельчения. Этот метод относительно прост и масштабируем, для него требуется только оборудование для измельчения. Однако он требует больших затрат энергии, а полученные наночастицы имеют тенденцию к агломерации без поверхностно-активных веществ ( Обидина, 2021 ).
Лазерная абляция. При фокусировке высокоэнергетических лазерных импульсов на объемном Se в жидкости образуются чистые коллоидные SeNPs (обычно ~5–200 нм). При лазерной абляции образуются очень чистые SeNPs без использования химических реагентов, но масштабирование ограничено производительностью лазера ( Филиппов и др., 2021; Кузьмин и др., 2012 ).
Обработка ультразвуком. Ультразвуковое излучение может разрушать агрегаты Se или способствовать диспергированию частиц. На практике обработка ультразвуком часто используется после синтеза (например, после измельчения шариков) для деагломерации SeNPs ( Тананаев и др., 2018; Фолманис, 2016 ).
Наночастицы селена, полученные физическими методами, могут применяться для обработки сельскохозяйственных культур в качестве удобрения почвы или опрыскивания листьев. Например, в качестве "наноудобрений" использовались SeNPs физического производства: благодаря их небольшому размеру и большой площади поверхности они легче усваиваются корнями и, таким образом, улучшают всхожесть семян и урожайность. В исследовании ( Фолманис, 2016 ) отмечалось, что SeNPs действуют как удобрение, повышая всхожесть и общую продуктивность, поскольку они "более доступны для корней растений".
Преимущества физических методов заключаются в получении частиц Se высокой чистоты без применения химических реагентов. При наличии оборудования можно получать большие объемы наноразмерного Se, при этом не образуются токсичные побочные продукты или остатки растворителей. Полученный элементарный Se имеет постоянный химический состав (чистый Se).
Физические методы имеют ограничения. Элементарный Se остается нерастворимым; только наноразмерная форма может приблизиться к биодоступности. Физические процессы являются энергоемкими (измельчение, лазеры) и требуют специального оборудования. Коллоиды SeNP могут со временем накапливаться, если их не стабилизировать. Широко распространены крупнозернистые гранулы и низкая стабильность. Несмотря на чистоту произведенного Se, при применении этих методов часто требуется тонкое измельчение или затраты энергии для получения крупности в нанометрах.
Химические подходы используют растворимые соединения селена или химический синтез для получения биодоступных форм селена.
Неорганические добавки селена. Селенаты и селениты щелочных и щелочноземельных металлов широко используются в сельском хозяйстве. Эти соли хорошо растворимы в воде и легко усваиваются растениями с помощью переносчиков питательных веществ ( Блинов и др., 2023 ). Например, внекорневая обработка селенатом натрия успешно повысила уровень селена в растениях. В ходе трехлетних полевых исследований сои внекорневая подкормка селенатом натрия Na2SeO4 в дозе 15-100 г/га увеличила содержание Se в семенах до ~16,2 мг/кг (по сравнению с исходно низким фоновым содержанием в контроле)
без снижения урожайности. Примечательно, что ~73 % добавленного Se было извлечено из семян в основном в виде органического селенометионина ( Mrština et al., 2024 ). Аналогично, обработка селенитом натрия Na2SeOs в дозе 5-10 г/га способствует повышению содержания Se в тканях риса и улучшает размер и качество плодов клубники. Таким образом, эти неорганические формы эффективно обогащают растения ( Lin et al., 2024 ).
Химический синтез наночастиц селена SeNPs. Растворимые соединения Se могут быть химически восстановлены с образованием наночастиц Se. Распространенным методом является восстановление Na2SeO3/H2SeO3 с помощью восстановителя (аскорбиновой кислоты, глюкозы, NaBH4 и т. д.) в присутствии стабилизаторов (например, полисорбатов, крахмала, хитозана) ( Блинов и др., 2023 ). Например, при добавлении аскорбиновой кислоты по каплям в раствор селенистой кислоты (с поверхностно-активным веществом) образуются коллоидные частицы. Обычно размер частиц составляет ~50–100 нм ( Блинов и др., 2024 ). В исследовании первичные SeNPs (до связывания с белком) имели средний диаметр ~71 нм. Без стабилизаторов эти SeNPs имеют тенденцию к агломерации в течение 2 недель; при использовании стабилизирующих веществ (желатин, PEI и т. д.) дисперсии оставались стабильными в течение нескольких месяцев ( Bužková et al., 2025 ).
Химически синтезированные SeNPs использовались при исследовании растений. Например, SeNPs, применяемые к растениям, могут снижать стресс и стимулировать рост. Коллоидная природа наночастиц может улучшить усвоение по сравнению с обычными Se. Однако при химическом подходе используются растворители и реагенты, которые необходимо удалять перед применением, или экологически безопасные восстановители.
Биологические подходы к биофортификации используют микроорганизмы (бактерии или грибы) для доставки селена в растения.
Почвенные микроорганизмы выполняют важнейшую функцию в регуляции биодоступности и миграции селена за счет осуществления окислительно-восстановительных реакций и процессов метилирования/ деметилирования. Микроорганизмы способны преобразовать Se в органические аминокислоты (например, селеноцистеин). Различные группы микроорганизмов (например, Bacillus, Pseudomonas, Rhodococcus и т. д.) способны восстанавливать селениты и селенаты до элементарного селена в ходе анаэробного дыхания ( Li et al., 2024 ). Селеновосстанавливающие бактерии могут трансформировать элементарный селен в селениды, которые, в свою очередь, подвергаются аэробному окислению специализированными микроорганизмами, такими как Thiobacillus и Thiothrix ( Somagattu et al., 2024) . В целом биологические стратегии могут обеспечить обогащение Se при минимальном накоплении токсинов. Ключевым ограничением является вариабельность: эффективность зависит от штамма микроорганизма, почвенных условий и вида растений. Биологическая биофортификация является экологически чистой технологией по сравнению с интенсивным использованием химикатов.
Результаты и обсуждение
Анализ литературных данных позволяет провести сравнительную характеристику (табл. 3) методов получения биодоступных форм селена для биофортификации сельскохозяйственных культур, выделив три основные группы: физические, химические и биологические. Эффективность каждого подхода варьируется в зависимости от целевой культуры, почвенно-климатических условий и требуемой формы селена в конечном продукте.
Физические методы (механическое измельчение, лазерная абляция, ультразвуковая обработка) направлены на получение наночастиц селена SeNPs высокой чистоты. Ключевым преимуществом является отсутствие химических реагентов и потенциальных токсичных примесей. Однако основным ограничением остается низкая биодоступность элементарного селена Se(0) для растений из-за его нерастворимости. Преодолеть это ограничение позволяют только наноразмерные частицы, обладающие большой удельной поверхностью. Например, предпосевная обработка семян пшеницы наночастицами SeNPs, полученными лазерной абляцией, в концентрации 10 мг/л способствовала увеличению длины проростков на 15–20 % по сравнению с контролем и повышала устойчивость к окислительному стрессу ( Razaghi et al., 2021 ). Несмотря на это, энергоемкость процессов и склонность частиц к агломерации без применения стабилизаторов затрудняют широкое практическое применение физических методов в сельском хозяйстве.
Химические методы, в частности использование растворимых неорганических солей (селената Na2SeO4 и селенита натрия Na2SeO3), являются наиболее изученными и технологичными. Их главное преимущество – высокая биодоступность и предсказуемость накопления селена в растениях. Многочисленные полевые испытания подтверждают эффективность этого подхода. Так, внекорневая подкормка селенатом натрия в дозе 10–20 г Se/га для яровой пшеницы позволила увеличить содержание селена в зерне с фоновых 0,02–0,05 мг/кг до 0,3–0,5 мг/кг, при этом до 85 % селена трансформировалось в органическую форму – селенометионин. Аналогично, обработка селенитом натрия листьев салата в концентрации 5 мкМ привела к увеличению содержания Se в 8–10 раз без признаков фитотоксичности. Химический синтез SeNPs (например, восстановление селенита натрия аскорбиновой кислотой) предлагает компромиссный вариант, сочетая контролируемый размер частиц и более высокую безопасность по сравнению с солями (Vahdati et al., 2020). Ограничения метода связаны с риском токсичности при передозировке, возможным загрязнением окружающей среды анионами селена и необходимостью тщательного контроля дозировки.
Биологические методы основаны на способности почвенных микроорганизмов (бактерии родов Bacillus, Pseudomonas, Rhizobium и др.) трансформировать неорганические формы селена в биодоступные органические соединения (селеноцистеин, селенометионин) или элементарный селен в биогенной форме. Этот подход является наиболее экологичным, так как имитирует естественные почвенные процессы. Практическое применение демонстрирует, например, инокуляция семян гороха штаммом Pseudomonas putida , способным восстанавливать селенит ( Liu et al., 2014 ). Это привело к увеличению содержания селена в побегах на 30 % по сравнению с контролем, где вносился только селенит. Однако эффективность биологических методов сильно зависит от типа почвы, ее pH, влажности, исходной микробиоты и вида растения, что делает результаты менее стабильными и предсказуемыми по сравнению с химическими методами.
Таблица 3. Сравнительный анализ методов ( Bužková et al., 2025; Vahdati et al., 2020;
Филиппов и др., 2021; Mrština et al., 2024 )
Table 3. Comparative analysis of the methods ( Bužkova et al., 2025; Vahdati et al., 2020;
Filippov et al., 2021; Mrština et al., 2024 )
|
Критерий |
Методы |
||
|
физические |
химические |
биологические |
|
|
Основные подходы |
Механическое измельчение, лазерная абляция, ультразвуковая обработка |
Использование растворимых солей (селенаты, селениты), химический синтез SeNPs |
Использование микроорганизмов (бактерии, грибы) для трансформации селена |
|
Формы селена |
Элементарный Se (наночастицы, аморфные/кристаллические формы) |
Селенаты SeO2 - , селениты SeO2 - , химически синтезированные SeNPs |
Органические формы (селеноцистеин, селенометионин), Se(0), летучие соединения (DMSe, DMDSe) |
|
Биодоступность |
Низкая (кроме наночастиц) |
Высокая (растворимые соли), умеренная (SeNPs) |
Высокая (органические формы, микробные метаболиты) |
|
Преимущества |
Чистота продукта, отсутствие химических реагентов, масштабируемость (шаровый помол) |
Высокая эффективность, контроль размера частиц (SeNPs), простота применения |
Экологичность, естественная интеграция в почвенные процессы, образование органических форм |
|
Недостатки |
Энергоемкость, агломерация частиц, низкая растворимость |
Токсичность некоторых реагентов, необходимость очистки, потенциальное загрязнение |
Зависимость от условий среды (pH, температуры), колебания стабильности |
Перспективным направлением является комбинирование методов. Например, совместное применение низких, нетоксичных доз селенита натрия (5–10 г/га) с инокуляцией селентрансформирующими бактериями показало синергетический эффект на томатах: содержание селена в плодах было на 40 % выше, чем при использовании только химического или только биологического метода, при этом полностью исключался риск фитотоксичности. Такой интегрированный подход позволяет нивелировать недостатки отдельных методов и максимизировать эффективность биофортификации ( Kessi et al., 1999 ) .
Таким образом, каждый подход имеет свои преимущества. Неорганические соли (химические соединения) обеспечивают максимальную эффективность усвоения растениями и предсказуемое обогащение, но создают риск переизбытка и экологической мобильности. Физические методы дают очень низкое мгновенное усвоение (элементарный Se в значительной степени инертен), хотя наночастицы Se могут повысить устойчивость к стрессам и урожайность при правильном применении. Биологические методы обеспечивают баланс: обработанный микробами Se легко усваивается, а симбиозы могут существенно повысить уровень Se и качество антиоксидантов при низких затратах на охрану окружающей среды. Тщательная интеграция этих методов (например, сочетание низких доз селеновых удобрений совместно с внесением микроорганизмов) предлагает многообещающую стратегию безопасной и эффективной биофортификации сельскохозяйственных культур.
Заключение
В ходе проведенного сравнительного анализа методов получения биодоступных форм селена доказана целесообразность применения интегрированного подхода к биофортификации, позволяющего нивелировать недостатки отдельных методов. Выбор оптимального метода определяется конкретными агротехническими, экономическими и экологическими условиями.
Химические методы на основе селенатов и селенитов остаются наиболее эффективным и управляемым инструментом для быстрого и значительного повышения содержания селена в сельскохозяйственной продукции, что подтверждается успешным опытом их применения в полевых условиях для таких культур, как пшеница и салат.
Биологические методы представляют собой устойчивую и экологичную альтернативу; они перспективны прежде всего для органического земледелия и регионов с высокими экологическими стандартами, однако требуют дальнейшей стандартизации и адаптации к локальным условиям.
Физические методы получения SeNPs, несмотря на ограниченное практическое применение, обладают потенциалом в создании новых видов удобрений пролонгированного действия и повышенной безопасности.
Наиболее рациональной стратегией представляется комбинированный подход, интегрирующий достоинства разных методов. Сочетание низких доз химических препаратов с микробиологическими инокулянтами позволяет достичь высокой эффективности обогащения при минимальных рисках для окружающей среды и фитосанитарного состояния растений. Дальнейшие исследования должны быть направлены на разработку и оптимизацию гибридных технологий, а также на селекцию сельскохозяйственных культур с повышенной способностью к накоплению и трансформации селена.


