Чрескожная видеоэндоскопическая задняя цервикальная фораминотомия и дискэктомия при латеральных грыжах межпозвонковых дисков (обзор литературы и результаты собственных исследований)
Автор: Кравцов Максим Николаевич, Люлин Сергей Владимирович, Кузнецов Михаил Владимирович, Гайдар Борис Всеволодович, Свистов Дмитрий Владимирович
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Обзор литературы
Статья в выпуске: 2, 2018 года.
Бесплатный доступ
Представлен обзор литературы по сравнительной оценке эффективности различных методик задней цервикальной фораминотомии. Показано, что перкутанная видеоэндоскопическая задняя фораминотомия является хорошей альтернативой стандартным методикам шейной дискэктомии при латеральных «мягких» грыжах межпозвонковых дисков c монорадикулярным синдромом. При равной клинической эффективности методика имеет преимущества, общие для миниинвазивных вмешательств. В статье сделан акцент на технических аспектах выполнения чрескожной видеоэндоскопической задней цервикальной фораминотомии. Дано подробное описание оперативной техники с иллюстрациями. Продемонстрирован собственный клинический случай.
Задняя цервикальная фораминотомия, перкутанная видеоэндоскопическая дискэктомия, грыжа межпозвонкового диска, шейный отдел, цервикальная радикулопатия
Короткий адрес: https://sciup.org/142213649
IDR: 142213649 | УДК: 616.711.1-007.43-089.877-072.1 | DOI: 10.18019/1028-4427-2018-24-2-240-251
Текст научной статьи Чрескожная видеоэндоскопическая задняя цервикальная фораминотомия и дискэктомия при латеральных грыжах межпозвонковых дисков (обзор литературы и результаты собственных исследований)
Дискогенная цервикальная радикулопатия остаётся распространённым заболеванием среди людей трудоспособного возраста, оказывающим значительное влияние на качество их жизни [1]. Несмотря на эффективность консервативного лечения, существенная доля больных, в конечном итоге, нуждается в хирургических вмешательствах. Наиболее распространенными вариантами оперативных пособий при этой патологии являются переднея шейная дискэктомия и спондилодез, задняя фораминотомия и эндопротезирование межпозвонкового диска [1, 2]. Важно отметить, что именно задняя цервикальная фораминотомия (ЗЦФ) является эффективной методикой, не ограничивающей диапазон движений в шейном отделе позвоночника и минимизирующей влияние на дегенеративные изменения в смежных двигательных сегментах [3]. ЗЦФ представляет собой хирургическое пособие, заключающееся в частичной резекции ламинарных частей дуг и суставных отростков смежных позвонков. Одно из первых сообщений, описывающих данную методику, датировано 1947 годом и принадлежит Frykholm R. [4]. В последующем техника была усовершенствована и популяризирована Scoville W. и Whitcomb B. [5]. ЗЦФ позволяет добиться адекватной декомпрессии и визуализации выходящего нервного корешка в области бокового кармана и межпозвонкового отверстия. В отличие от передней дискэктомии ЗЦФ не требует стабилизации. [6, 7, 8]. В последнее время возникло возрождение интереса к этому виду операций, что во многом обусловлено развитием минимально-инвазивных технологий лечения, в том числе, перкутанной видеоэндоскопии.
Эффективность открытой ЗЦФ
Основным показанием для ЗЦФ является изолированная односторонняя цервикальная радикулопатия, обусловленная «мягкой» латеральной грыжей межпозвонкового диска. Кроме того, ЗЦФ может быть использована при стенозе бокового кармана и межпозвонкового отвер-
стия, причиной которого является артроз с гипертрофией фасеточных суставов и унковертебральных сочленений [9]. Правильный отбор пациентов для выполнения ЗЦФ позволяет добиться клинического улучшения в 93–97 % случаев [6, 7]. Открытый задний доступ к шейному отделу позвоночника предполагает субпериостальную диссекцию и временную компрессию параспинальной мускулатуры ретрактором. По данным ряда исследований, у 20 % пациентов после открытой ЗЦФ возникают локальные боли в шее, спазм мышц и дисфункция шейного отдела позвоночника [10–14]. Избежать вышеуказанных последствий открытой ЗЦФ стало возможным благодаря использованию альтернативной передней дискэктомии, а также путём минимизации заднего доступа к шейным межпозвонковым дискам.
С момента первого описания Cloward R.B. в 1958 году [15] переднего доступа к шейному отделу позвоночника и последующих работ, усовершенствовавших методику дискэктомии и спондилодеза [16, 17], данная хирургическая техника, ввиду простоты и универсальности, постепенно закрепила за собой статус «золотого стандарта» лечения компрессионной цервикальной миело- и радикулопатии, остающегося актуальным и по сей день [13, 18]. Незначительная травма кожного и мышечного покровов при переднем доступе к шейному отделу позвоночника обусловливает хорошую переносимость пациентами данной операции. Отмечено небольшое число случаев неудовлетворённости оперативным вмешательством по поводу наличия болей в шее в сравнении с открытым задним доступом. В проспективном сравнительном исследовании доступов к межпозвонковому диску шейного отдела позвоночника Herkowitz H.N. и его коллегами [19] сообщено о хороших и отличных результатах у 90 % пациентов, оперированных передним доступом, и только у 75 % оперированных задним доступом. Однако почти у 90 % пациентов, оперированных задним доступом, отметился регресс симптомов радикулопатии [19]. Более поздние исследования показали, что в правильно сопоставленных когортах клинические исходы передней шейной дискэктомии со спондилодезом (ПШДС) и ЗЦФ аналогичны [20]. По количеству ревизий и повторных оперативных вмешательств в сравниваемых группах ПШДС и ЗЦФ существенных различий выявлено не было [21]. Несмотря на свою простоту и универсальность, передний хирургический доступ к шейному отделу позвоночника также не лишён недостатков, основными из которых являются риск травмы пищевода, трахеи, сонной артерии, яремной вены, возвратного гортанного нерва, симпатического ганглия и лимфатического грудного протока. Кроме того, отсутствие движений между шейными позвонками после переднего спондилодеза создаёт предрасположенность к ускоренной дегенерации смежных сегментов [11, 13, 22, 23, 24].
С целью сохранения движения в оперированном сегменте позвоночника и уменьшения нагрузки на смежные межпозвонковые суставы и диски были изобретены и внедрены в клиническую практику искусственные межпозвонковые диски для шейного отдела [25]. Однако биомеханические исследования искусственных дисков показали, что динамические имплантаты не являются истинным заменителем межпозвонковых дисков. Диапазон движения на имплантированном сегменте часто оказывался большим, чем нормальное физиологическое движение, а диапазон движения смежного сегмента уменьшался [26, 27]. Позже было сообщено и о других проблемах, связанных с тотальным протезированием шейных межпозвонковых дисков, таких как гетеротопическая оссификация, блокирование имплантата и спонтанный спондилодез [28, 29, 30]. Ещё одним из существенных недостатков искусственных дисков является их высокая стоимость, при этом риски осложнений, связанных с передним доступом, аналогичны технике ПШДС [26]. ЗЦФ, в этом аспекте, имеет некоторые преимущества перед передней дискэктомией, обусловленные сохранением собственного межпозвонкового диска, поддержанием естественной биомеханики позвоночника и снижением рисков, обусловленных имплантацией инородных тел в межтеловой промежуток, таких как синдром ускоренной дегенерации смежного позвоночно-двигательного сегмента [18]. M.J. Clarke с соавторами проследили отсроченные рентгенологические исходы у 303 пациентов после одноуровневой ЗЦФ и определили 5 и 10-летние уровни риска дегенерации оперированного сегмента, составившие 3,2 и 5,0 % соответственно. Авторами была определена десятилетняя заболеваемость синдромом смежного уровня, составившая 6,7 %. Результаты данного исследования свидетельствуют о медленном прогрессировании дегенеративно-дистрофических изменений в оперированном и смежных позвоночно-двигательных сегментах шейного отдела позвоночника после открытой ЗЦФ [3].
Предположение о последствиях ЗЦФ, влияющих на прогрессирующее нарастание шейного кифоза, не было убедительно подтверждено в работе J. Jagannathan с соавт., обобщивших опыт 162 открытых фораминотомий. Наблюдение в течение продолжительного периода пациентов этой выборки не выявило существенной тенденции к кифозу. Авторами определена группа повышенного риска, требующая динамического рентгенологического наблюдения и включающая пациентов старше 60 лет, перенесших хирургическое вмешательство на шейном отделе позвоночника из открытого заднего доступа, а также пациентов с дооперационным углом шейного лордоза, не превышающим 10° [31]. Отмечено, что количество выполненных ЗЦФ за одну операцию пропорционально числу случаев отсроченного кифоза и нестабильности шейного отдела позвоночника. Но далеко не все исследователи разделяют такую позицию. Получено множество доказательств, подтверждающих низкий риск последствий ЗЦФ в виде отсроченного кифоза и сегментарной нестабильности, при условии выполнения резекции менее 50 % межпозвонкового сустава [32–35].
В продолжение сравнения методик шейной дискэктомии посредством переднего и заднего доступов следует подчеркнуть, что ЗЦФ является менее затратной в финансовом отношении и более экономичной по результатам анализа прямых и косвенных расходов, связанных непосредственно с операцией и длительностью периода трудопотерь [36]. Необходимо отметить, что стабилиация после передней дискэктомии или цервикальная артропластика влияет на категорию годности больных, относящихся к специфическому контингенту лиц (военнослужащих и т.д.), ввиду чего, ЗЦФ может быть методом выбора при «мягких» латеральных гры- жах шейного отдела позвоночника у данной категории пациентов [37, 38].
Эволюция минимально-инвазивных методик ЗЦФ
Минимально-инвазивная ЗЦФ используется в клинической практике с начала 2000-х годов. Первоначально на трупных моделях была отработана оперативная техника задней тубусной ЗЦФ. В исследованиях продемонстрирована возможность создания аналогичного по размерам и форме костного дефекта в области дуги и суставных отростков шейных позвонков в сравнении с открытой техникой операции. Кроме того, полноценность костной декомпрессии выходящего корешкового нерва превалировала в группе тубусной микроэндоскопии [33, 39].
Последующие работы, оценивающие эффективность тубусной ЗЦФ, свидетельствовали о её высокой эффективности, сравнимой с открытым вариантом хирургического пособия [11, 12, 32, 40, 41]. При этом продолжительность операции, кровопотеря, а также длительность госпитализации и потребность в послеоперационных обезболивающих препаратах в целом были ниже в случае, когда операция выполнялась по минимально-инвазивной методике [40, 42, 43, 44, 45]. Тубусная ЗЦФ выполнялась как посредством виде-оэндоскопической визуализации, так и при помощи оптического увеличения и освещения операционного микроскопа [46, 47]. Описаны варианты выполнения этого оперативного пособия в положении пациента лёжа на животе и сидя с фиксированной головой [13]. Технические нюансы тубусной ЗЦФ в целом не влияли на эффективность метода. Частотота осложнений, ве-ключающих повреждение твёрдой мозговой оболочки и нерва, раневые инфекции, послеоперационные гематомы, находились в диапазоне от 1 до 9 % [14, 45, 48, 49, 50]. Около 4 % пациентов нуждались в повторном оперативном вмешательстве, что сравнимо с открытой техникой операций [41].
Стремление специалистов к минимизации хирургической агрессии повлияло на эволюцию эндоскопического оборудования, инструментария для эффективной резекции костной ткани и декомпрессии, что предопределило развитие новой технологии – чрескожной (перкутанной) видеоэндоскопии или полностью эндоскопической (full-endoscopic) хирургии позвоночника. Чрескожная эндоскопия сегодня является наименее инвазивным хирургическим пособием на позвоночнике, являясь стандартной процедурой при поясничных межпозвонковых грыжах [51, 52, 53], подтверждая свою высокую эффективность [54].
В 2007 г. S. Ruetten с соавторами впервые сообщили об опыте лечения 87 пациентов с латеральными грыжами межпозвонковых дисков шейного отдела позвоночника методом чрескожной видеоэндоскопической ЗЦФ 6,9-миллиметровым эндоскопом через рабочую канюлю, наружный диаметр которой составлял 7,9 мм. Таким образом, оперативное вмешательство осуществлялось посредством пункционного доступа к задним структурам шейного отдеа позвоночника через кожный разрез, не превышающий 1 см в длину. Авторами представлены следующие результаты: у 87,4 % пациентов с дискогенной радикулопатией отметился полный регресс корешковой симптоматики; не было отмечено серьёзных периоперационных осложнений; продол- жительность болей в проекции шейного отдела позвоночника, связанных с операцией, не превышала 5 дней; за двухлетний период наблюдения частота рецидивов грыж не превысила 3,4 %; в повторном оперативном лечении нуждались 5,7 % пациентов [55]. В 2008 году тем же авторским коллективом опубликованы результаты проспективного рандомизированного сравнительного исследования клинической эффективности чрескожной видеоэндоскопической ЗЦФ и стандартной ПШДС. При этом диаметр рабочей канюли для осуществления эндоскопического доступа и диаметр эндоскопа были ещё на 1 мм меньше, чем в исследовании 2007 года. Клинические результаты в сравниваемых группах за двухлетний период статистически не различались. Среднее время продолжительности операции в группе ПШДС составило 68 минут и было на 28 минут меньшим (p < 0,001), чем в группе чрескожной эндоскопической ЗЦФ. По частоте ревизионных вмешательств в группах не имелось статистически значимой разницы: 4,7 % – в группе ПШДС и 6,7 % – в группе перкутанной эндоскопической ЗЦФ. По показателю количества дней трудопотерь метод ПШДС значительно превалировал (p < 0,01): 34 дня против 19 дней после чрескожной эндоскопической ЗЦФ. Проанализировав результаты, авторы пришли к выводу, что чрескожная видеоэндо-скопическая ЗЦФ является хорошей альтернативой стандартным методикам шейной дискэктомии при латеральных «мягких» грыжах межпозвонковых дисков c монорадикулярным синдромом. При равной клинической эффективности метод имеет преимущества, общие для миниинвазивных процедур [56].
За последнее время проведено несколько исследований, оценивающих эффективность перкутанной эндоскопической ЗЦФ в сравнении с передней перкутанной чрездисковой эндоскопической техникой и задней тубусной микроэндоскопией. Клинические результаты сравниваемых методик оказались сопоставимыми [44, 57]. Авторы отмечают преимущества оперативной техники перкутанной эндоскопической ЗЦФ, заключа-ющиейся в прецизионности доступа, яркой освещённости операционной полости, отличной визуализации анатомических структур в условиях жидкой среды физиологического раствора хлорида натрия, возможностях выполнения адекватной декомпрессии [37, 57]. При правильно выбранных показаниях перкутанная эндоскопическая ЗЦФ имеет преимущества перед вышеуказанными методиками по продолжительности пребывания пациентов в стационаре и послеоперационным рентгенологическим изменениям шейного отдела позвоночника в динамике [57]. В исследовании Kim C.H. с соавторами (2015) доказано отсутствие влияния перкутанной эндоскопической ЗЦФ на сагиттальный баланс шейного отдела позвоночника [18].
Чрескожная видеоэндоскопическая хирургия как поясничного, так и шейного отделов позвоночника за последнее время имеет тендецию к широкому рас-пространию среди зарубежных и отечественных специалистов. Это во многом обусловлено общими тенденциями современной хирургии позвоночника и в целом, системы здравоохранения, заключающимися в минимизации оперативных вмешательств, сокращении койко-дня, экономии медикаментов и быстром восстановлении трудоспособности больных. Однако, несмо- тря на очевидные преимущества чрескожной видеоэн-доскопической хирургии позвоночника, существуют нюансы обучения специалистов данной технике, существенно отличающейся от привычной классической микрохирургии и даже тубусной микроэндоскопии. Хирург при выполнении подобных вмешательств должен уметь интерпретировать интраоперационную рентгенологическую и видеоэндоскопическую картину в условиях отсутствия ориентиров, привычных для открытого доступа. Кроме того, подобные операции требуют использования более длинных хирургических инструментов, работать которыми приходится в полостях малого объёма в условиях постоянной ирригации физиологическим раствором хлорида натрия, ориентируясь на видеоизображение под изменённым углом в 25–30º, обусловленным формой дистального конца эндоскопа. Описываемые выше особенности метода предопределяют длительный период обучения, необходимость дополнительной подготовки хирургов в ка-даверных лабораториях.
С целью привлечения интереса большего круга специалистов к этой методике мы считаем необходимым предоставление возможности ознакомления отечественных нейрохирургов и вертебрологов с основами хирургической техники чрескожной видеоэндоскопии позвоночника в медицинских периодических изданиях. Если методика микроэндоскопической тубусной ЗЦФ подробно изложена в современных работах не только зарубежных, но и отечественнымх авторов [1, 13, 39], то основы хирургической техники «full-endoscopic» ЗЦФ в русскоязычной литературе по настоящее время не представлены. В данной статье сделан акцент на технических аспектах выполнения чрескожной видеоэндоскопической ЗЦФ.
Чрескожная видеоэндоскопическая ЗЦФ и дискэктомия
Показания [55]: односторонний монорадикуляр-ный цервикальный болевой синдром, обусловленный:
-
1) боковой или фораминальной ипсилатеральной одноуровневой «мягкой» грыжей межпозвонкового диска от С2–С3 до С7–Th1 сегментов (в т.ч. с кранио-каудальным смещением секвестра при условии его латеральной локализации);
-
2) вторичным ипсилатеральным одноуровневым фораминальным стенозом с гипертрофией межпозвонкового сустава.
Противопоказазания [47, 55]:
-
1) грыжа и остеофиты центральной и парацентральной локализации;
-
2) вторичная компрессионная миелопатия на фоне центрального стеноза позвоночного канала;
-
3) шейный кифоз;
-
4) нестабильность.
Предоперационное обследование
Помимо оценки неврологического статуса обязательным условием является выполнение МРТ и КТ шейного отдела позвоночника как взаимодополняющих методов. Цель предоперационного инструментального обследования больного современными методами нейровизуализации заключается в установлении чёткой взаимосвязи между невологическими проявлениями и обнаруженным патологическим субстратом. В дополнение к радиологическим методам диагностики электронейромиография также может помочь в уточнении основного диагноза. Совокупность полученных данных позволяет определить положение грыжи межпозвонкового диска, её плотность, провести дифференциальную диагностику с опухолями позвоночного канала, травмами, воспалительными заболеваниями, демиелинизирующими процессами, кровоизлияниями, пороками развития, невропатиями, карпальным синдромом, плечелопаточным периартритом и т.д. Посредством рентгенографии шейного отдела позвоночника в прямой и боковой проекциях объективно оценивается степень имеющейся деформации. Информативной также является спондилография с функциональными пробами – с наклонами головы впрерёд и назад – для исключения сегментарной нестабильности. В некоторых случаях психологический скрининг пациентов при помощи анкет, рекомендованных в общеврачебной практике, оправдан для исключения психосоматических или психологических расстройств, которые могут отразиться на результате хирургического лечения [58].
Положение пациента и операционной бригады, выбор анестезии
Операция проводится под общей анестезией в положении пациента на животе с несколько приподнятым головным концом операционного стола для уменьшения давления в эпидуральном венозном сплетении. Достигается незначительное выпрямление шейного лордоза с целью увеличения междугового промежутка. Голова укладывается лицом на подголовник и дополнительно фиксируется к нему пластырем. Необходимость в фиксации головы скобой Мейнфилда отсутствует. Руки располагаются вдоль туловища, плечи смещаются в каудальном направлении путём умеренного их натяжения и фиксации при помощи пластыря. Таким положением достигается улучшенная рентгенологическая визуализация нижних шейных сегментов (рис. 1).
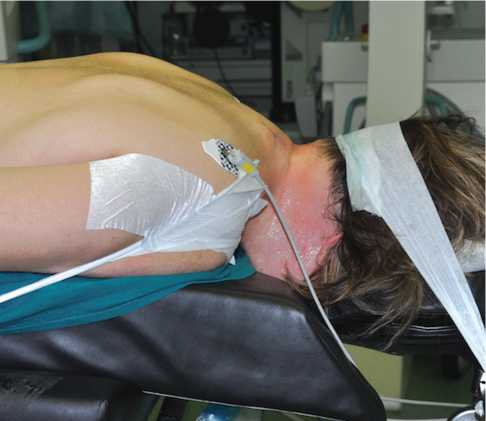
Рис. 1. Положение пациента на операционном столе (пояснение в тексте)
Мочевой катетер, как правило, не устанавливается. Однократное внутривенное введение антибиотиков осуществляют непосредственно перед кожным разрезом. Стероиды нами не применяются. На этапе освоения методики не исключается интраоперационный нейрофизи- ологический мониторинг для оценки соматосенсорных вызванных потенциалов и электромиограмм. Анестезиологическое пособие в таком случае предусматривает минимальные дозы миорелаксантов [13]. Сидячее и по-лусидячее положение пациента, используемое для профилактики интраоперационного венозного кровотечения при открытой и тубусной задней фораминотомии, не используется. В отличие от микрохирургической и микроэндоскопической методик ЗЦФ гемостаз во время операции достигается регуляцией давления подаваемого физиологического раствора в операционную полость по специальному каналу эндоскопа. Безопасный диапазон значений давления ирригации составляет 50–80 см вод. ст. Хирург и операционная сестра находятся со стороны доступа. Напротив них устанавливаются экраны монитора рентгеновской С-дуги и эндоскопической стойки.
Оперативная техника
На коже пациента в области операционного поля стерильным маркером отмечают линию остистых отростков. По рентгеновскому снимку в боковой проекции определяют уровень оперативного вмешательства и проводят перпендикуляр к срединной линии. Точка доступа смещена по перпендикуляру на 1,5–2 см от линии остистых отростков (рис. 2, а) в «больную» сторону.
В прямой рентгеновской проекции определяют костные ориентиры пластинок дуг смежных позвонков и межпозвонковый сустав целевого уровня. Под контролем флюороскопии в прямой проекции через точ- ку доступа вводят пункционную иглу диаметром 18G (рис. 2, а), дистальный конец которой устанавливают на нижний край дуги вышележащего позвонка в зоне её перехода на нижний суставной отросток в «V-точке» [18], что определяют по ощущению сопротивления.
Прямая рентгеновская флюороскопия позволяет точно определить направление и позиционирование пункционной иглы, избежать её отлонения от запланированной траектории в сторону позвоночного канала либо латеральнее межпозвонкового сустава (рис. 2, в). Боковой рентгеновской проекцией дополнительно контролируют положение дистального конца иглы относительно глубины ее введения и соотношения с уровнем целевого межпозвонкового диска (рис. 2, г). Из иглы извлекают стилет и вводят струнный проводник. Иглу извлекают. Выполняют кожный разрез длиной около 8 мм. По струнному проводнику вводят трубчатые расширители увеличивающегося диаметра, по которым устанавливают рабочую канюлю со скошенным срезом, наружным диаметром 7,5 мм (рис. 2, б).
При необходимости, по завершении данного этапа операции, могут быть выполнены дополнительные рентгеновские снимки, подтверждающие положение дистального конца рабочей канюли. В канюлю вводят эндоскоп. Дальнейшие манипуляции осуществляют через рабочий канал эндоскопа под видеоэндоскопиче-ским контролем при непрерывном орошении операционной полости 0,9 % раствором хлорида натрия (рис. 3).
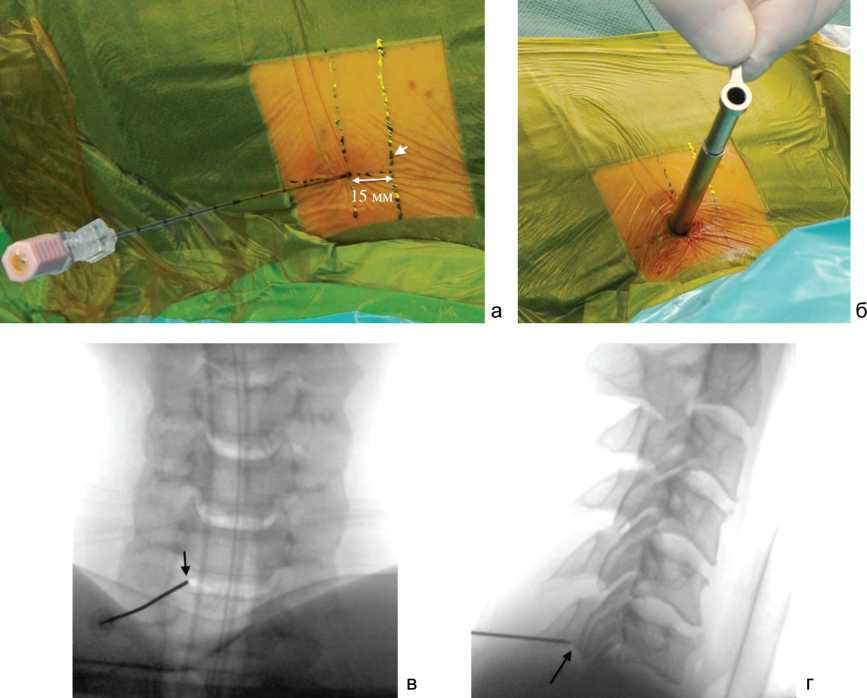
Рис. 2. Этапы заднего пункционного эндоскопического доступа к шейному отделу позвоночника: а – этап введения пункционой иглы через точку, смещённую на 15 мм вправо от линии остистых отростков (указана короткой стрелкой); б – положение рабочей канюли перед введением в неё эндоскопа; в – положение пункционной иглы на прямой спондилограмме; г - положение пункционной иглы на боковой спондилограмме (чёрными стрелками указан дистальный конец иглы, расположенный справа на нижнем крае латеральной части пластинки дуги СVI позвонка)
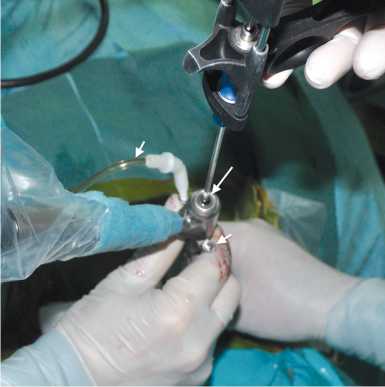
Рис. 3. Видеоэндоскопический этап операции: инструменты вводят через рабочий канал эндоскопа диаметром 3,6–3,7 мм (длинная стрелка) в условиях непрерывной ирригации физиологическим раствором хлорида натрия (короткими стрелками указаны система подачи жидкости и отверстие для её оттока)
Как было указано выше, перкутанная видеоэндоско-пическая техника предполагает работу в полостях малого объёма. В этих условиях самыми надёжными анатомическими ориентирами являются костные структуры позвоночника, изображение которых явно угадывается при видеоэндоскопии и может быть подтверждено контрольной рентгенографией. Мы рекомендуем начинать со скелетирования нижнего края пластинки дуги вышележащего позвонка и постепенно смещать рабочую канюлю в сторону межпозвонкового сустава, переходя на медиальный край нижнего суставного отростка, с последующим переходом на дугу нижележащего позвонка. Данный этап выполняется при помощи биполярного электрода и щипцов. После «обнажения» указанных костных ориентиров достигается чёткая визуализация так называемой «V-точки» в медиальном отделе межпозвонкового сустава, определяемой по схождению смежных краёв дуг выше- и нижележащего позвонков (рис. 4).
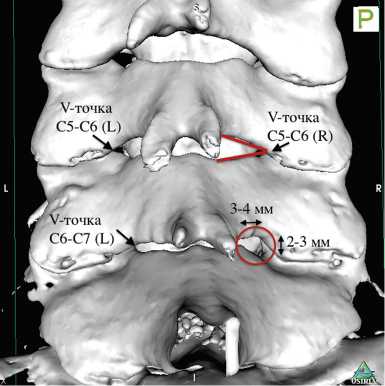
Рис. 4. КТ-реконструкция задней поверхности шейных позвонков в режиме SSD с указанием ориентиров «V-точки» и костного дефекта после черескожной видеоэндоскопи-ческой фораминотомии: «V-точка» определяется по схождению смежных краёв пластинок дуг позвонков (красные отрезки) в медиальном отделе межпозвонкового сустава (стрелки); окружностью выделена зона выполненной эндоскопической перкутанной фораминотомии (размеры костного дефекта не превышают 4 мм)
Границы операционной полости при перкутанной видеоэндоскопии не позволяют одномоментно обеспечить визуализацию всего межпозвонкового сустава, что легко обеспечивается при тубусной микроэндоскопии и открытой микрохирургии. Поэтому «V-точка» является главным видеоэндоско-пическим ориентиром и центром костной резекции при чрескожной эндоскопической ЗЦФ. Ламиното-мия и фасетотомия выполняются алмазным бором из «V-точки» к периферии (рис. 5, а, б).
Этап костной резекции необходимо осуществлять при сохранённой целостности жёлтой связки, что является мерой профилактики повреждения твёрдой мозговой оболочки и невральных структур (рис. 5, в, г). Размеры и форма образованного костного окна могут быть заранее рассчитаны по КТ.
Сформированное костное окно обычно имеет округлую форму диаметром 4–8 мм (рис. 4). В целях сохранения сегментарной стабильности, как указывалось выше, рекомендуется ограничиться резекцией менее 50 % межпозвонкового сустава. Размеры фора-минотомического костного окна оценивают визуально путём сопоставления области выполненной резекции с размерами инструментов, например, с внутренним диаметром рабочей канюли (6,5 мм) или головкой бора (3,5 мм). В зависимости от расположения грыжи межпозвонкового диска по данным МРТ смещение резецируемой зоны в кранио-каудальном направлении от целевого межпозвонкового диска контролируют этапной рентгенографией в боковой проекции.
В последующем выполняют удаление жёлтой связки специальными конхотомами или кусачками Керри-сона, идентифицируют латеральный край дурального мешка и спинномозговой корешок, лоцирующийся более краниально в зоне образовавшегося костного окна (рис. 6, а, б).
При помощи биполярного радиочастотного электрода коагулируются вены эпидурального сплетения. Изогнутым пуговчатым крючком и микролопаткой мобилизируют нервный корешок и материал грыжи межпозвонкового диска (рис. 6, б, в), расположенный, как правило, в аксилярной зоне [18]. Технические возможности осуществления этапа задней шейной дискэктомии методом перкутанной видеоэндоскопи-ческой методики несколько уступают возможностям микрохирургии и тубусной видеоэндоскопии. Это обусловлено тем, что рабочий канал эндоскопа позволяет работать только одним инструментом, то есть – одной рукой. Таким образом, невозможно одновременно осуществить тракционный манёвр неврального корешка и экстракцию материала межпозвонкового диска. В методике поясничной перкутанной эндоскопической дискэктомии функцию «второй руки» берёт на себя «губа» рабочей канюли при осуществлении ротационного манёвра. В шейном же отделе подобное смещение дурального мешка может повлечь за собой повреждение корешка и спинного мозга. К тому же, размеры костного окна при задней цервикальной фораминотомии не позволяют ввести рабочую канюлю в полость позвоночного канала. В этой связи мы рекомендуем использовать канюли с удлинённой «губой» (рис. 7), способной незначительно сместить и удержать под временной защитой корешковый нерв.
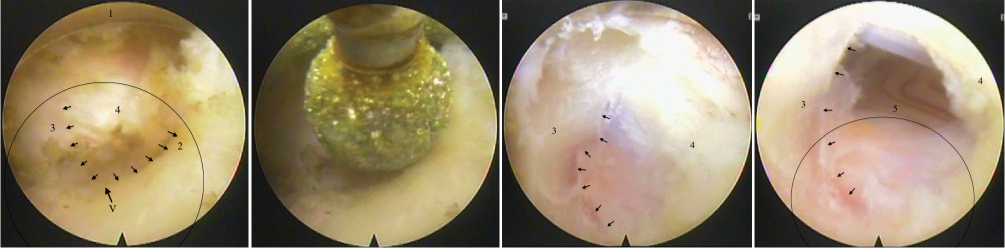
Рис. 5. Этап скелетирования, костной резекции и флавотомии: а – «обнажены» костные ориентиры позвоночника области планируемой фораминотомии; б – начало костной резекции алмазным бором; в – результат частичной ламинотомии CVII позвонка с послойной флавотомией алмазным бором; г – вид эпидурального пространства через дефект в жёлтой связке (1 – край рабочей канюли, 2 – дуга CVI позвонка, 3 - дуга CVII позвонка, 4 – желтая связка в междуговом промежутке, 5 – латеральный край твёрдой мозговой оболочки; маленькими стрелками обозначены смежные края дуг позвонков, большой стрелкой обозначена «V-точка», окружностью выделена зона планируемой фораминотомии)
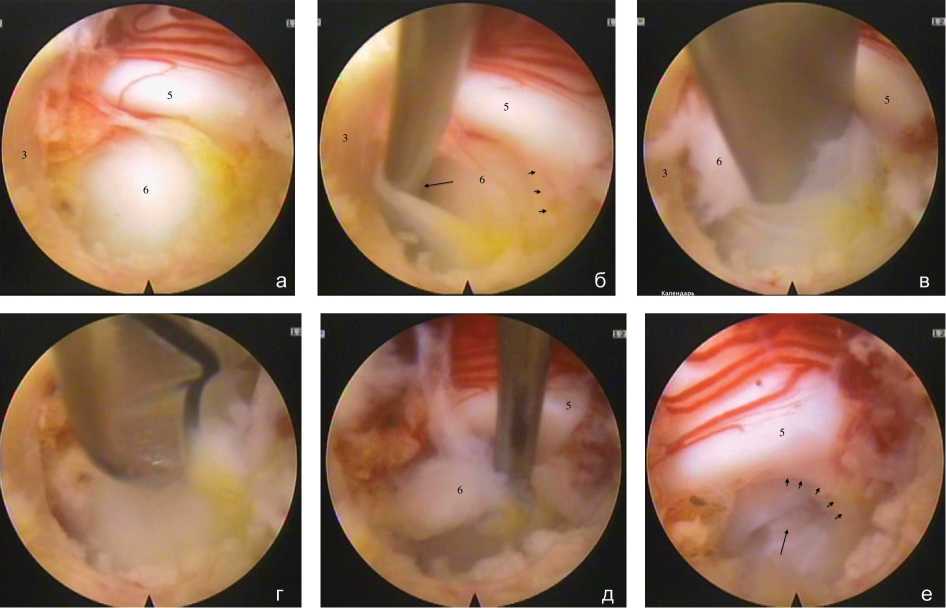
Рис. 6. Этап удаления грыжи и декомпрессии невральных структур: а – видеоэндоскопическая картина области латерального кармана и межпозвонкового отверстия после фораминотомии; б – вскрытие вентральной мемебраны микролопаткой (стрелка); в – мобилизация грыжи межпозвонкового диска микролопаткой через дефект вентральной мембраны; г – удаление фрагментов грыжи кусачками; д – мобилизация фрагментов грыжи межпозвонкового диска из-под корешкового нерва изогнутым пуговчатым крючком; е – видеоэн-доскопические признаки декомпрессии невральных структур, стрелкой указан дефект вентральной мембраны (3 – резецированный верхний край дуги CVII позвонка, 5 – латеральный край дурального мешка, 6 – грыжа межпозвонкового диска, мелкими стрелками указана аксилярная область корешкового нерва)

Рис. 7. Дистальные концы рабочих канюль (1 – с косым срезом 45º; 2 – стандартная; 3 – с удлинённой «губой» (стрелка)
После удаления грыжи кусачками (рис. 6, г, д) оценивают степень декомпрессии корешкового нерва по его передаточной пульсации (рис. 6, е). Дополнительно оценивается его податливость при тракции изогнутым пуговчатым зондом. Эффективность гемостаза устанавливается визуально после временной остановки ирригации физиологического раствора. Рабочая канюля и эндоскоп извлекаются. Накладывается один узловой шов на кожу. Дренирования раны не требуется.
В послеоперационном периоде рекомендуется ношение мягкого шейного ортеза в течение 7 дней.
Эндоскопическое оборудование
Для операции нами используются жёсткие эндоскопы со стержнелинзовой оптической системой:
-
1. Эндоскоп «Joimax ® » (Германия) с внешним диаметром 6,3 мм, содержащий помимо оптической системы и световолоконных проводников эксцентрично расположенный рабочий канал для введения инструментов диаметром 3,7 мм; два канала диаметром по 1,5 мм для ирригации и аспирации. Угол обзора эндоскопа составляет 30º. Наружный диаметр рабочей канюли равен 7,5 мм.
-
2. Эндоскоп «SpineTip - KarlStorz» (Германия) – устройство аналогичного типа диаметром 6,6 мм с рабочим каналом 3,6 мм, углом обзора 25º. Внешний диаметр рабочей канюли – 7,9 мм.
Возможные осложнения
В немногочисленных научных публикациях, посвященных чрескожной эндоскопической задней шейной фораминотомии, сообщается об отсутствии осложнений, повлиявших на жизнь и здоровье пациентов, таких как кровотечение, гематома, повреждение твёрдой мозговой оболочки и невральных структур с устойчивым неврологическим дефицитом. Частота осложнений, по данным литературы, варьирует от 0 до 5 % и включает транзиторную гипестезию и монопарез, неполное удаление грыжи [44, 56, 57]. Доля повторных вмешательств не превышает 5 % [59].
Клинический пример. Пациент М., 33 лет, спортсмен, заболел остро. Началу заболевания предшествовало переохлаждение. Боль возникла в проекции шейного отдела позвоночника с иррадиацией в правую руку. Через неделю появилось онемение по задней поверхности правой руки. Интенсивность боли достигала 8 из 10 баллов по визуально-аналоговой шкале. Лечение в неврологическом стационаре в течение 3-х недель не оказало положительного эффекта. При неврологическом осмотре выявлены гипестезия в дерматоме С7 справа, незначительная гипотрофия трицепса и большой грудной мышцы, парез разгибателей предплечья до 4 баллов. МРТ шейного отдела позвоночника выявила правостороннюю боковую грыжу межпозвонкового диска CVI–CVII. При рентгенографии деформации и нестабильности шейного отдела позвоночника не обнаружено. КТ подтвердила низкую плотность грыжевого выпячивания. 15.06.2017 года пациенту выполнена чрескожная видеоэндоскопическая задняя фораминотомия и дискэктомия по методике, описанной выше. Продолжительность операции составила 60 мин. Объём кровопотери был минимальным, и с учётом постоянной ирригации физиологическим раствором не высчитывался. Пациент выписан на 2-е сутки после операции. Трудоспособность восстановлена через 2 недели. Катамнез составляет 6 месяцев. Болевой синдром полностью регрессировал, чувствительность восстановилась. При объективной оценке – сила в правой руке наросла до 5 баллов, однако сохраняется незначительная гипотрофия большой грудной мышцы. До- и послеоперационные МРТ и КТ представлены на рисунке 8.
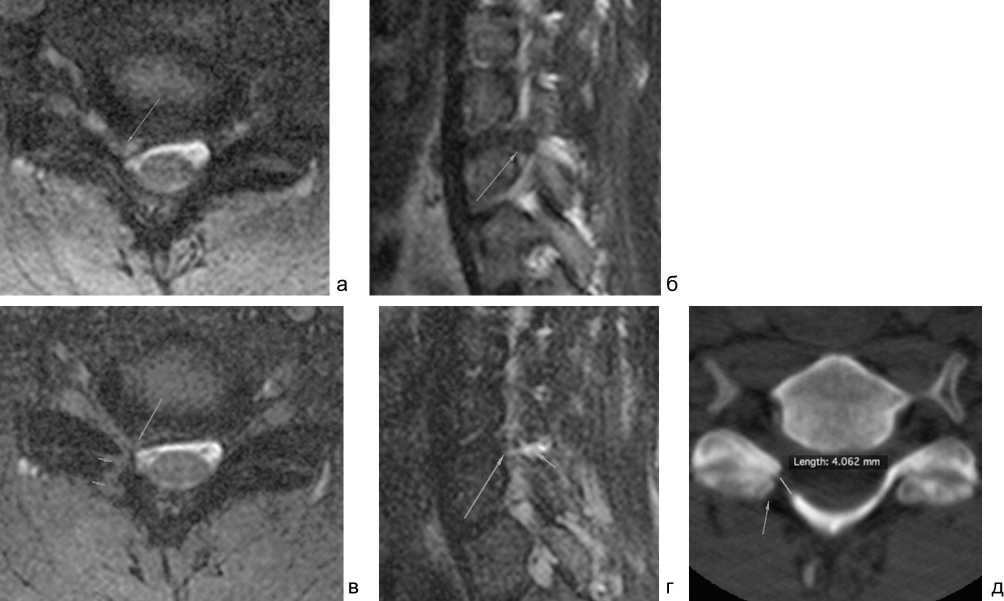
Рис. 8. МРТ и КТ пациента до и после операции: аксиальная (а) и сагиттальная (б) проекции МРТ до операции (стрелкой указана боковая грыжа межпозвонкового диска с признаками компрессии корешкового нерва); аксиальная (в) и сагиттальная (г) МР-томограммы в 1-е сутки после операции (длинной стрелкой указана область удалённой грыжи, короткими стрелками показаны послеоперационные изменения по ходу доступа); д – КТ после операции: область выполненной задней фораминотомии CVI-CVII справа (стрелкой указана резецированная часть нижнего суставного отростка СVI; линией отмечен размер костного дефекта в дуге CVII – 4 мм)
ЗАКЛЮЧЕНИЕ
Чрескожная видеоэндоскопическая ЗЦФ является безопасным и эффективным хирургическим пособием при «мягких» боковых грыжах межпозвонковых дисков CII–ThI, сопровождающихся монорадикулярным синдромом. При правильно выбранных показаниях клинические результаты этого вида оперативного пособия соответствуют ранее описанным открытым и минимально-инвазивным методам лечения. В то же время, особенности хирургической техники обеспечивают значительно меньшую травматизацию тканей по ходу доступа, что отражается на сокращении времени операций и сроков пребывания пациентов в стационаре, быстром восстановлении их трудоспособности, снижении слу- чаев послеоперационной локальной боли и мышечного спазма, уменьшении потребности в обезболивающих препаратах в послеоперационном периоде. Перкутанный эндоскопический метод ЗЦФ является достойной альтернативой открытым оперативным пособиям и вписывается в общую концепцию развития современной спинальной хирургии. Тем не менее, хирург, желающий освоить метод перкутанной видеоэндоскопической ЗЦФ, первоначально должен овладеть хирургической техникой стандартных открытых операций на шейном отделе позвоночника, чтобы без особого труда осуществить конверсию в случае развития интраоперационных осложнений при эндоскопическом вмешательстве.
Список литературы Чрескожная видеоэндоскопическая задняя цервикальная фораминотомия и дискэктомия при латеральных грыжах межпозвонковых дисков (обзор литературы и результаты собственных исследований)
- Гуща А.О., Арестов С.О., Вершинин А.В. Первый опыт применения новой техники портальной эндоскопической дискэктомии при грыжах межпозвонковых дисков шейного отдела позвоночника//Вопросы нейрохирургии им. Н.Н. Бурденко. 2016. Т.80, №. 6. С. 15-23.
- Fehlings M.G., Gray R.J. Posterior cervical foraminotomy for the treatment of cervical radiculopathy//J. Neurosurg. Spine. 2009. Vol. 10, No 4. P. 343-344 DOI: 10.3171/2009.1.SPINE08899
- Same-segment and adjacent-segment disease following posterior cervical foraminotomy/M.J. Clarke, R.D. Ecker, W.E. Krauss, R.L. McClelland, M.B. Dekutoski//J. Neurosurg. Spine. 2007. Vol. 6, No 1. P. 5-9 DOI: 10.3171/spi.2007.6.1.2
- Frykholm R. Deformities of dural pouches and strictures of dural sheaths in the cervical region producing nerve-root compression; a contribution to the etiology and operative treatment of brachial neuralgia//J. Neurosurg. 1947. Vol. 4, No 5. P. 403-413 DOI: 10.3171/jns.1947.4.5.0403
- Scoville W.B., Whitcomb B.B. Lateral rupture of cervical intervertebral disks//Postgrad. Med. 1966. Vol. 39, No 2. P. 174-180.
- Posterior-lateral foraminotomy as an exclusive operative technique for cervical radiculopathy: a review of 846 consecutively operated cases/C.M. Henderson, R.G. Hennessy, H.M. Shuey Jr., E.G. Shackelford//Neurosurgery. 1983. Vol. 13, No 5. P. 504-512.
- Krupp W., Schattke H., Müke R. Clinical results of the foraminotomy as described by Frykholm for the treatment of lateral cervical disc herniation//Acta Neurochir. (Wien). 1990. Vol. 107, No 1-2. P. 22-29.
- Zeidman S.M., Ducker T.B. Posterior cervical laminoforaminotomy for radiculopathy: review of 172 cases//Neurosurgery. 1993. Vol. 33, No 3. P. 356-362.
- Eck J.C., Vaccaro A.R. Surgical Atlas of Spinal Operations. 1st edition. JP Medical Ltd. 2013. 537 p.
- Results of posterior cervical foraminotomy for treatment of cervical spondylitic radiculopathy/J.P. Grieve, N.D. Kitchen, A.J. Moore, H.T. Marsh//Br. J. Neurosurg. 2000. Vol. 14, No 1. P. 40-43.
- Fessler R.G., Khoo L.T. Minimally invasive cervical microendoscopic foraminotomy: an initial clinical experience//Neurosurgery. 2002. Vol. 51, No 5 Suppl. P. S37-S45.
- Siddiqui A., Yonemura K.S. Posterior cervical microendoscopic diskectomy and laminoforaminotomy. In: Kim D.H., Fessler R.G., Regan J.J. Endoscopic Spine Surgery and Instrumentation: Percutaneous Procedures. New York: Thieme, 2005. 404 p. P. 66-73.
- Endoscopic posterior cervical foraminotomy and discectomy/J.E. O’Toole, H. Sheikh, K.M. Eichholz, R.G. Fessler, M.J. Perez-Cruet//Neurosurg. Clin. N. Am. 2006. Vol. 17, No 4. P. 411-422.
- Clinical outcomes of microendoscopic foraminotomy and decompression in the cervical spine/C.D. Lawton, Z.A. Smith, S.K. Lam, A. Habib, R.H. Wong, R.G. Fessler//World Neurosurgery. 2014. Vol. 81, No 2. P. 422-427 DOI: 10.1016/j.wneu.2012.12.008
- Cloward R.B. The anterior approach for removal of ruptured cervical disks//J. Neurosurg. 1958. Vol. 15, No 6. P. 602-617.
- Bailey R.W., Badgley C.E. Stabilization of the cervical spine by anterior fusion//J. Bone Joint Surg. Am. 1960. Vol. 42-A. P. 565-594.
- Smith G.W., Robinson R.A. The treatment of certain cervical-spine disorders by anterior removal of the intervertebral disc and interbody fusion//J. Bone Joint Surg. Am. 1958. Vol. 40-A, No 3. P. 607-624.
- Changes in cervical sagittal alignment after single-level posterior percutaneous endoscopic cervical diskectomy/C.H. Kim, K.H. Shin, C.K. Chung, S.B. Park, J.H. Kim//Global Spine J. 2015. Vol. 5, No 1. P. 31-38 DOI: 10.1055/s-0034-1395423
- Herkowitz H.N., Kurz L.T., Overholt D.P. Surgical management of cervical soft disc herniation. A comparison between the anterior and posterior approach//Spine. 1990. Vol. 15, No 10. P. 1026-1030.
- Cervical discectomy. A prospective analysis of three operative techniques/F.P. Wirth, G.C. Dowd, H.F. Sanders, C. Wirth//Surg. Neurol. 2000. Vol. 53, No 4. P. 340-348.
- Reoperation rates after anterior cervical discectomy and fusion versus posterior cervical foraminotomy: a propensity-matched analysis/D. Lubelski, A.T. Healy, M.P. Silverstein, K.G. Abdullah, N.R. Thompson, K.D. Riew, M.P. Steinmetz, E.C. Benzel, T.E. Mroz//Spine J. 2015. Vol. 15, No 6. P. 1277-1283 DOI: 10.1016/j.spinee.2015.02.026
- Late radiographic findings after anterior cervical fusion for spondylotic myeloradiculopathy/H. Baba, N. Furusawa, S. Imura, N. Kawahara, H. Tsuchiya, K. Tomita//Spine. 1993. Vol. 18, No 15. P. 2167-2173.
- Hilibrand A.S., Robbins M. Adjacent segment degeneration and adjacent segment disease: the consequences of spinal fusion?//Spine J. 2004. Vol. 4, No 6 Suppl. P. 190S-194S DOI: 10.1016/j.spinee.2004.07.007
- Adjacent segment disease after anterior cervical interbody fusion/H. Ishihara, M. Kanamori, Y. Kawaguchi, H. Nakamura, T. Kimura//Spine J. 2004. Vol. 4, No 6. P. 624-628.
- Анализ результатов применения тотальной артропластики межпозвонкового диска пояснично-крестцового отдела позвоночника протезом M6-L: мультицентровое исследование/В.А. Бывальцев, А.А. Калинин, Ю.Я. Пестряков, В.В. Шепелев, И.А.Степанов//Вестник РАМН. 2017. Т. 72, №. 5. С. 393-402.
- Range of motion change after cervical arthroplasty with ProDisc-C and prestige artificial discs compared with anterior cervical discectomy and fusion/U.K. Chang, D.H. Kim, M.C. Lee, R. Willenberg, S.H. Kim, J. Lim//J. Neurosurg. Spine. 2007. Vol. 7, No 1. P. 40-46 DOI: 10.3171/SPI-07/07/040
- X-Ray-based kinematic analysis of cervical spine according to prosthesis designs: analysis of the Mobi C, Bryan, PCM, and Prestige LP/S.B. Park, K.J. Kim, Y.J. Jin, H.J. Kim, T.A. Jahng, C.K. Chung//J. Spinal Disord. Tech. 2015. Vol. 28, No 5. P. E291-E297 DOI: 10.1097/BSD.0b013e318288a923
- Cho S.K., Riew K.D. Adjacent segment disease following cervical spine surgery//J. Am. Acad. Orthop. Surg. 2013. Vol. 21, No 1. P. 3-11 DOI: 10.5435/JAAOS-21-01-3
- Lee S.E., Chung C.K., Jahng T.A. Early development and progression of heterotopic ossification in cervical total disc replacement//J. Neurosurg. Spine. 2012. Vol. 16, No 1. P. 31-36 DOI: 10.3171/2011.8.SPINE11303
- Richards O., Choi D., Timothy J. Cervical arthroplasty: the beginning, the middle, the end?//Br. J. Neurosurg. 2012. Vol. 26, No 1. P. 2-6 DOI: 10.3109/02688697.2011.595846
- The posterior cervical foraminotomy in the treatment of cervical disc/osteophyte disease: a single-surgeon experience with a minimum of 5 years' clinical and radiographic follow-up/J. Jagannathan, J.H. Sherman, T. Szabo, C.I. Shaffrey, J.A. Jane//J. Neurosurg. Spine. 2009. Vol. 10, No 4. P. 347-356 DOI: 10.3171/2008.12.SPINE08576
- Adamson T.E. Microendoscopic posterior cervical laminoforaminotomy for unilateral radiculopathy: results of a new technique in 100 cases//J. Neurosurg. 2001. Vol. 95, No 1 Suppl. P. 51-57.
- Endoscopic foraminotomy using MED system in cadaveric specimens/S.W. Roh, D.H. Kim, A.C. Cardoso, R.G. Fessler//Spine. 2000. Vol. 25, No 2. P. 260-264.
- Cervical stability after foraminotomy. A biomechanical in vitro analysis/T.A. Zdeblick, D. Zou, K.E. Warden, R. McCabe, D. Kunz, R. Vanderby//J. Bone Joint Surg. Am. 1992. Vol. 74, No 1. P. 22-27.
- Posterior cervical foraminotomy: anatomic study in cadavers/L.A.A. Júnior, F.A. de A. Júnior, J.A. Malheiros, S.N.S. Gusmão, A.A. Nicolato, G. Gouveia//Coluna/Columna. 2014. Vol. 13, No 1. P. 49-52. Available at: http://dx.doi.o DOI: rg/10.1590/S1808-185120141301RCC68
- Cost-utility analysis of anterior cervical discectomy and fusion with plating (ACDFP) versus posterior cervical foraminotomy (PCF) for patients with single-level cervical radiculopathy at 1-year follow-up/M.D. Alvin, D. Lubelski, K.G. Abdullah, R.G. Whitmore, E.C. Benzel, T.E. Mroz//Clin. Spine Surg. 2016. Vol. 29, No 2. P. E67-E72 DOI: 10.1097/BSD.0000000000000099
- Early outcome of posterior cervical endoscopic discectomy: an alternative treatment choice for physically/socially active patients/C.H. Kim, C.K. Chung, H.J. Kim, T.A. Jahng, D.G. Kim//J. Korean Med. Sci. 2009. Vol. 24, No 2. P. 302-306 DOI: 10.3346/jkms.2009.24.2.302
- Tumialán L.M., Ponton R.P., Gluf W.M. Management of unilateral cervical radiculopathy in the military: the cost effectiveness of posterior cervical foraminotomy compared with anterior cervical discectomy and fusion//Neurosurg. Focus. 2010. Vol. 28, No 5. P. E17 DOI: 10.3171/2010.1.FOCUS09305
- Burke T.G., Caputy A. Microendoscopic posterior cervical foraminotomy: a cadaveric model and clinical application for cervical radiculopathy//J. Neurosurg. 2000. Vol. 93, No 1 Suppl. P. 126-129.
- Winder M.J., Thomas K.C. Minimally invasive versus open approach for cervical laminoforaminotomy//Can. J. Neurol. Sci. 2011. Vol. 38, No 2. P. 262-267.
- Ross D.A., Bridges K.J. Technique of Minimally Invasive Cervical Foraminotomy//Oper. Neurosurgery (Hagerstown). 2017. Vol. 13, No 6. P. 693-701 DOI: 10.1093/ons/opx053
- Khoo L.T., Perez-Cruet M.J., Laieh D.T. et al. Posterior cervical microendoscopic foraminotomy. In: Perez-Cruet M.J., Fessler R.G., eds. Outpatient Spinal Surgery. St. Louis: Quality Medical Publishing Inc. 2002. P. 71-93.
- Kim K.T., Kim Y.B. Comparison between open procedure and tubular retractor assisted procedure for cervical radiculopathy: results of a randomized controlled study//J. Korean Med. Sci. 2009. Vol. 24, No 4. P. 649-653 DOI: 10.3346/jkms.2009.24.4.649
- Minimally invasive cervical foraminotomy and diskectomy for laterally located soft disk herniation/C.H. Kim, K.T. Kim, C.K. Chung, S.B. Park, S.H. Yang, S.M. Kim, J.K. Sung//Eur. Spine J. 2015. Vol. 24, No 12. P. 3005-3012 DOI: 10.1007/s00586-015-4198-1
- Complications, outcomes, and need for fusion after minimally invasive posterior cervical foraminotomy and microdiscectomy/B. Skovrlj, Y. Gologorsky, R. Haque, R.G. Fessler, S.A. Qureshi//Spine J. 2014. Vol. 14, No 10. P. 2405-2411 DOI: 10.1016/j.spinee.2014.01.048
- Ольхов В. М., Горбатюк К. I., Столяренко О. О. Шейная микродискэктомия: выбор метода и хирургической тактики//Український нейрохiрургiчний журнал. 2016. №. 4. С. 33-38.
- Minimally invasive posterior cervical foraminotomy/J. Ahn, E. Tabaraee, D.D. Bohl, K. Singh//J. Spinal Disord. Tech. 2015. Vol. 28, No 8. P. 295-297 DOI: 10.1097/BSD.0000000000000318
- Minimally invasive disc preserving surgery in cervical radiculopathies: the posterior microscopic and endoscopic approach/A. Franzini, G. Messina, P. Ferroli, G. Broggi//Acta Neurochir. Suppl. 2011. Vol. 108. P. 197-201 DOI: 10.1007/978-3-211-99370-5_30
- Posterior minimally invasive approaches for the cervical spine/V.C. Gala, J.E. O’Toole, J.M. Voyadzis, R.G. Fessler//Orthop. Clin. North Am. 2007. Vol. 38, No 3. P. 339-349 DOI: 10.1016/j.ocl.2007.02.009
- Clinical outcomes of microendoscopic decompression surgery for cervical myelopathy/A. Minamide, M. Yoshida, H. Yamada, Y. Nakagawa, K. Maio, M. Kawai, H. Iwasaki//Eur. Spine J. 2010. Vol. 19, No 3. P. 487-493 DOI: 10.1007/s00586-009-1233-0
- Transforaminal arthroscopic decompression of lateral recess stenosis/P. Kambin, K. Casey, E. O’Brien, L. Zhou//J. Neurosurg. 1996. Vol. 84, No 3. P. 462-467 DOI: 10.3171/jns.1996.84.3.0462
- Yeung A.T., Tsou P.M. Posterolateral endoscopic excision for lumbar disc herniation: surgical technique, outcome, and complications in 307 consecutive cases//Spine. 2002. Vol. 27, No 7. P. 722-731.
- Ruetten S., Komp M., Godolias G. A new full-endoscopic technique for the interlaminar operation of lumbar disc herniations using 6-mm endoscopes: prospective 2-year results of 331 patients//Minim. Invasive Neurosurg. 2006. Vol. 49, No 2. P. 80-87 DOI: 10.1055/s-2006-932172
- Use of newly developed instruments and endoscopes: full-endoscopic resection of lumbar disc herniations via the interlaminar and lateral transforaminal approach/S. Ruetten, M. Komp, H. Merk, G. Godolias//J. Neurosurg. Spine. 2007. Vol. 6, No 6. P. 521-530 DOI: 10.3171/spi.2007.6.6.2
- A new full-endoscopic technique for cervical posterior foraminotomy in the treatment of lateral disc herniations using 6.9-mm endoscopes: prospective 2-year results of 87 patients/S. Ruetten, M. Komp, H. Merk, G. Godolias//Minim. Invasive Neurosurg. 2007. Vol. 50, No 4. P. 219-226 DOI: 10.1055/s-2007-985860
- Full-endoscopic cervical posterior foraminotomy for the operation of lateral disc herniations using 5.9-mm endoscopes: a prospective, randomized, controlled study/S. Ruetten, M. Komp, H. Merk, G. Godolias//Spine. 2008. Vol. 33, No 9. P. 940-948 DOI: 10.1097/BRS.0b013e31816c8b67
- Anterior or posterior approach of full-endoscopic cervical discectomy for cervical intervertebral disc herniation? A comparative cohort study/J.S. Yang, L. Chu, L. Chen, F. Chen, Z.Y. Ke, Z.L. Deng//Spine. 2014. Vol. 39, No 21. P. 1743-1750 DOI: 10.1097/BRS.0000000000000508
- Особенности психологического статуса пациентов, оперированных по поводу вертеброгенного болевого синдрома/В.И. Леонов, И.О. Крицкая, Ю.А. Щербук, Е.В. Ливиненко, Т.В. Сергеева//Рос. нейрохирург. журнал им. А.Л. Поленова. 2017. Спец. вып.: «Поленовские чтения: сб. материалов XVI Всероссийской научно-практической конференции». С. 145-146.
- Rates of anterior cervical discectomy and fusion after initial posterior cervical foraminotomy/T.Y. Wang, D. Lubelski, K.G. Abdullah, M.P. Steinmetz, E.C. Benzel, T.E. Mroz//Spine J. 2015. Vol. 15, No 5. P. 971-976 DOI: 10.1016/j.spinee.2013.05.042


