Чрезкожная трансторакальная биопсия прикорневых образований легких с использованием коаксиальной системы и КТ навигации
Автор: Лазаренко В.А., Перепелевский А.Н., Станоевич У.С., Гребенкин Е.Н., Сумина О.Е.
Журнал: Вестник Российского научного центра рентгенорадиологии Минздрава России @vestnik-rncrr
Рубрика: Лучевая диагностика
Статья в выпуске: 3 т.22, 2022 года.
Бесплатный доступ
Введение. Задача гистологической верификации патологического процесса в центральной части корня легкого, на периферии и в прикорневой зоне легкого крайне сложна. В современном мире предпочтения отдаются малоинвазивным методикам получения морфологического материала. Трансторакальная биопсия образований легкого под контролем компьютерной томография - метод выбора для верификации периферических новообразований с относительно низким процентом постманипуляционных осложнений (6- 9%). Однако при биопсии прикорневых новообразований легкого, в связи с увеличением толщины паренхимы до биопсируемого очага, процент постманипуляционных осложнений существенно возрастает до 15-22%. Цель исследования: оценить эффективность применения трансторакальной биопсии прикорневых образований легкого с использованием в качестве навигации компьютерной томографии в комбинации с коаксиальной системой; проанализировать характер, частоту постманипуляционных осложнений и определить диагностическую ценность предложенной методики. Материал и методы. С декабря 2018 года по декабрь 2021 в отделении торакальной хирургии ОБУЗ КОНКЦ им. Г.Е. Островерхова 316 первичным пациентам выполнена чрезкожная трансторакальная биопсия прикорневых образований легкого под контролем КТ и использованием коаксиальной системы с целью гистологической верификации. Результаты. Продолжительность выполнения манипуляции варьировала от 9 до 23 минут и в среднем составила 16±2,3 минуты. У 22 пациентов (6,9%) развились постманипуляционные осложнения, такие как кровохарканье и пневмоторакс. У 97,2% пациентов удалось получить информативный гистологический материал и верифицировать диагноз морфологически. Чувствительность, специфичность и точность предложенной методики составили 97%, 100% и 97% соответственно. Заключение. Учитывая низкую частоту постманипуляционных осложнений (6,9%), использование коаксиальной системы с перманентной анестезией в трансторакальных биопсиях прикорневых образований легкого под контролем компьютерной томографии является безопасным малоинвазивным методом морфологической верификации. Применение данной методики верификации позволяет получить качественный высокоинформативный морфологический материал, достаточный для иммуногистохимического исследования без использования инвазивных операционных методов верификации.
Чрезкожная трансторакальная трепанобиопсия, трансторакальная биопсия, коаксиальная трансторакальная система, перманентная инфильтрационная анестезия, трепанобиопсия легких, компьютерная томография, биопсия под кт навигацией
Короткий адрес: https://sciup.org/149142247
IDR: 149142247 | УДК: 616.24-076:616.24-006-07
Текст научной статьи Чрезкожная трансторакальная биопсия прикорневых образований легких с использованием коаксиальной системы и КТ навигации
Рак легкого по-прежнему остается лидером по смертности в структуре злокачественных новообразований во всем мире, несмотря на достижения комплексного лечения [4, 17]. Наиболее часто выявляются опухоли III и IV стадий, однако за последние годы отмечается увеличение выявляемости на ранних стадиях за счет увеличения количества случаев выполнения компьютерной томографии органов грудной клетки при COVID-19 [4]. Легкие также занимают первое место в структуре локализаций отдаленного метастазирования других первичных опухолей [4, 8, 9, 18]. Как известно, помимо опухолевой патологии легкого, существуют также и другие специфические заболевания легочной паренхимы, такие как туберкулез. Также стоит помнить о саркоидном воспалительном системном поражении легких и лимфатических узлов средостения. В последнее время, в связи с новой короновирусной инфекцией COVID-19, увеличилось количество постпневмонических изменений в виде очагового фиброза [4]. С учетом разнообразия нозологий, диагностируемых в легочной паренхиме, важно получить морфологическое подтверждение диагноза для определения правильной тактики лечения пациента [1, 17, 18].
Задача гистологической верификации патологического процесса в центральной части корня легкого, на периферии и в прикорневой зоне легкого крайне сложна [3, 13]. За последнюю сотню лет появилось большое количество инвазивных и малоинвазивных методов, от диагностической торакотомии до трансбронхиальной пункции под навигацией [6]. Но применение диагностической операции с использованием торакотомического или торакоскопического доступа под комбинированным наркозом часто не целесообразно, особенно учитывая, что большинство пациентов имеют неверифицированный опухолевый процесс, сопутствующую патологию и возраст 50+ [2, 11, 14].
Именно поэтому предпочтения отдаются малоинвазивным методикам получения морфологического материала. Видеобронхоскопия (ВБС) – исследование, позволяющее осуществить качественную биопсию из экзофитно растущих опухолей трахеобронхиального дерева до бронхов 4 порядка, с низким процентом постманипуляционных осложнений -0,05-6%, но данная процедура не эффективна при перибронхиальном периферическом расположении очага [3]. В последние годы в клиническую практику внедрен новый способ получения морфологического материала из перибронхиальных образований с удалением от бронха до 3 см (граница ультразвукового окна) - эндобронхиальная ультрасонография с кор-биопсией (ЭБУС). ВБС и ЭБУС - методики полностью эндобронхиальные и применимы с использованием эндоскопа и анестезиологической поддержки [6, 10].
Но даже при использовании этих методик невозможно получить биопсию из периферических и прикорневых образований легочной паренхимы с удалением от стенки бронха 1-4 порядка более 3 см [5, 13]. По статистике, в большинстве случаев, именно это расположение образования встречается чаще, и методика получения биопсии в данном случае таже должна быть эффективной, безопасной и надежной [17, 18]. Следующая малоинвазивная методика трансторакальной биопсии появилась ещё в 1902 году и с тех пор прошла путь от слепых пункций наугад до современного высокоточного метода биопсии под контролем методов трехмерной визуальной навигации. Методы навигации в трансторакальных биопсиях являются одним из важнейших компонентов точности и безопасности выполнения. Трансторакальная биопсия под ультразвуковым контролем является идеальным методом получения биопсийного материала из субплеврально расположенных очагов легкого и средостения, когда между УЗ-датчиком и образованием отсутствует воздушная прослойка [10]. Рентген навигация эффективна при динамических биопсиях в движении, например, позволяет в режиме реального времени выполнить биопсию образований, расположенных в паренхиме на диафрагме [6]. Трансторакальная биопсия образований легкого под контролем компьютерной томография - метод выбора для верификации периферических новообразований, с высокими показателями диагностической ценности - чувствительность 80-98%, специфичность 85-100%, точность 67-98%, а также с относительно низким процентом постманипуляционных осложнений от 6% до 9% [2, 11, 14, 16, 19]. Однако, при биопсии прикорневых новообразований легкого, когда происходит увеличение толщины паренхимы до биопсируемого очага, процент постманипуляционных осложнений возрастает до 15–22%, поэтому необходимо использование дополнительных транспортных систем, снижающих постманипуляционные осложнения и позволяющих получить несколько фрагментов биопсируемой ткани через 1 прокол легочной паренхимы [1, 12, 15]. В данной статье именно эта методика выбрана для оценки результатов биопсии прикорневых образований легкого с использованием коаксиальной системы в условиях стационара ОБУЗ КОНКЦ им. Г.Е. Островерхова.
Цель исследования: оценить эффективность применения трансторакальной биопсии прикорневых образований легкого с использованием в качестве навигации компьютерную томографию в комбинации с коаксиальной системой, проанализировать характер, частоту постманипуляционных осложнений и определить диагностическую ценность предложенной методики.
Материал и методы
С декабря 2018 года по декабрь 2021 в отделении торакальной хирургии ОБУЗ КОНКЦ им. Г.Е. Островерхова 316 первичным пациентам выполнена чрезкожная трансторакальная биопсия прикорневых образований легкого под контролем КТ и использованием коаксиальной системы с целью гистологической верификации.
Дизайн исследования: нерандомизированное исследование с ретроспективным анализом, включающим:
-
1. Анализ информативности полученного гистологического материала.
-
2. Анализ характера и частоты развития постманипуляционных осложнений.
-
3. Анализ временного промежутка затраченного на выполнения исследования.
-
4. Анализ чувствительности, специфичности и точности предложенной методики.
Критерии включения в исследование:
-
1. Наличие у первичного пациента не верифицированного образования легочной
-
2. Пациенты с наличием не верифицированного образования легочной паренхимы,
паренхимы, размером не менее 5 мм, располагающегося в прикорневом отделе с удалением более 3-х сантиметров от трахеи и бронхов 1–3 порядка.
размером не менее 5 мм, располагающееся в прикорневом отделе с удалением менее 3-х сантиметров от трахеи и бронхов 1-3 порядка, которым было проведено ЭБУС с неинформативной биопсией.
Критерии исключения:
-
1. Субплевральное расположение и удаленное менее 2-х сантиметров от висцеральной
-
2. Образование размером менее 5 мм в диаметре.
-
3. Локализация процесса в единственном легком.
-
4. Буллезная болезнь, а именно, наличие булл в зоне прохождения биопсийного
-
5. Заболевания крови с нарушением функции гемостаза.
-
6. Сердечно-легочная недостаточность 3 степени и выше.
-
7. Невозможность пациента находиться в положении лежа менее 15 минут.
плевры образование.
коридора.
Все пациенты были обследованы в амбулаторных условиях согласно действующим клиническим рекомендациям Минздрава России, проведены лабораторно-инструментальные методы диагностики, ультразвуковое исследование органов брюшной полости и компьютерная томография органов грудной клетки. Также пациенты консультированы врачом терапевтом и кардиологом по необходимости – с целью выявления сопутствующей патологии и её коррекции. После дообследования на амбулаторном этапе пациенты были госпитализированы в отделение торакальной хирургии для выполнения забора морфологического материала с использованием предложенной методики.
Оборудование: трансторакальная биопсия выполнялась в манипуляционной КТ с использованием в качестве навигационной установки аппарата спиральной компьютерной томографии GE Discovery HD750 CT. В качестве транспортного коридора использовали коаксиальную систему с функцией перманентной анестезией диаметром 14G и длинной 10 см (патент на изобретение №2734721) (Рис. 1) [7]. Биопсию выполняли полуавтоматической одноразовой биопсийной иглой гильотинного типа диаметром 14G и длинной 15 см фирмы MDL.
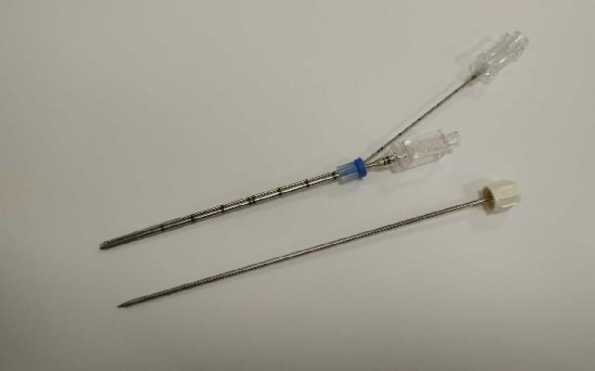
Рис. 1. Коаксиальная система для трансторакальной доставки биопсийных игл.
Методика исследования
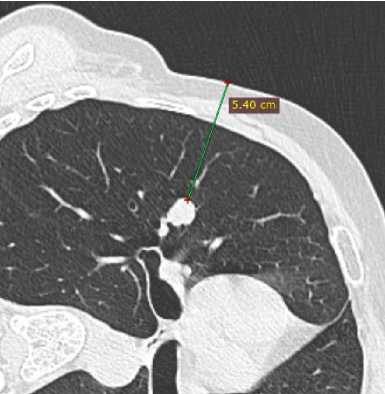
Пациента укладывали на стол компьютерного томографа таким образом, чтобы обеспечить минимальное расстояние от висцеральной плевры до очага минуя опасные анатомические зоны (Рис. 2А).
А
Б
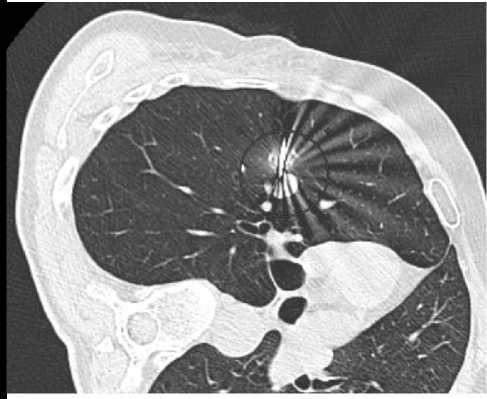
Рис. 2. Срез компьютерной томографии органов грудной клетки. (А) расстояние от края кожи до края образования, (Б) коаксиальная система у края опухоли.
В месте предполагаемого прокола на кожу клеилась рентгенконтрастная метка. Далее осуществлялось сканирование зоны манипуляции. При нужной локализации место прокола кожи обрабатывалось раствором антисептика и выполнялась инфильтрационная анестезия кожи раствором Новокаина 0,25–5,0%. Далее под контролем КТ через кожу к краю образования в легочной паренхиме подводилась коаксиальная система с функцией перманентной анестезии (Рис. 3). В качестве анестезии использовался раствор Лидокаина 2– 5,0%. При локализации коаксиальной системы у края опухоли (Рис. 2Б) центральный стелет системы извлекался, и в канал вводилась полуавтоматическая биопсийная игла, после чего выполнялось одномоментное двукратное взятие гистологического биоптата. Длинна выстрела биопсийной иглы была 10 мм. После манипуляции КС с биопсийной иглой извлекались. Далее морфологический материал помещался в 10% раствор нейтрального формалина и передавался на гистологическое и иммуногистохимическое исследование. Через 10 минут после манипуляции выполнялось контрольное КТ исследование органов грудной клетки с целью выявления постманипуляционных осложнений (Рис. 4).
Рис. 3. Заведение коаксиальной системы с функцией перманентной анестезии.
При выявлении клинически значимого пневмоторакса с ателектазом легкого более 15% выполнялось дренирование плевральной полости, при возникновении кровохарканья сразу назначалась однокомпонентная гемостатическая терапия. В среднем кровохарканье прекращалось через 5–6 минут после манипуляции. При отсутствии осложнений пациенты оставлялись под наблюдением на 4 часа. В случае недостаточного количества гистологического материала для уточняющей морфологической диагностики проводилась повторная трансторакальная биопсия.
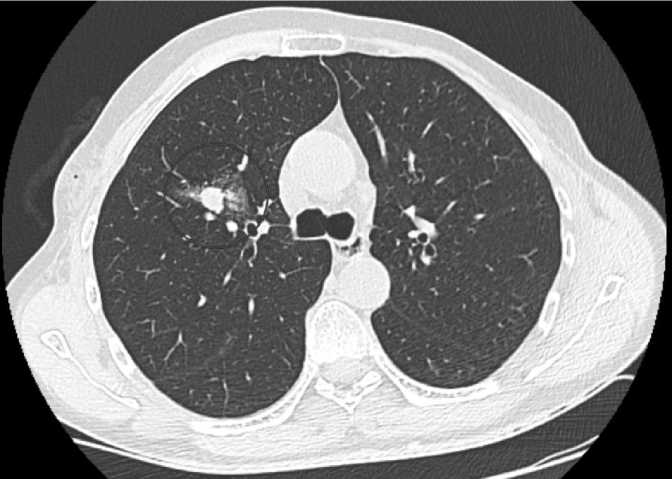
Рис. 4. Срез компьютерной томографии органов грудной клетки после манипуляции, опухолевый узел после биопсии помечен красным кругом.
Методы статистического анализа
Статистическую обработку данных проводили с использованием программного обеспечения SPSS Statistics 23.0. Для количественных данных рассчитывали стандартные описательные статистики в группах – стандартное отклонение и среднее значение, для качественных – частотные характеристики. Для анализа развития осложнений и эффективности метода выполнялось вычисление критерия ꭓ2 Пирсона и ꭓ2 с соотношением правдоподобия.
Результаты исследования
Всего было проведено 329 трансторакальных биопсий у 316 пациентов, 205 мужчин и 111 женщин (64,8% и 35,2%, соответственно). Возраст варьировал от 24 лет до 87 лет, в основном преобладала возрастная категория 50 лет и выше – 67,9%. У больных была выявлена следующая сопутствующая патология: сахарный диабет у 48 пациентов (15,1%), гипертоническая болезнь у 71 пациента (22,4%), ишемическая болезнь сердца выявлена у 85 пациентов (26,8%), ХОБЛ – у 132 пациентов (41,7%), ожирение – у 57 пациентов (18,0%).
Продолжительность выполнения манипуляции варьировала от 9 до 23 минут и в среднем составила 16±2,3 минуты, время, затраченное на дренирование, не учитывалось, так как это влияло на достоверность полученных данных. В основном удлинение времени на манипуляцию было связано с корректировкой коаксиальной системы в паренхиме при расположении образования вблизи крупных сосудов. Всего у 16 пациентов длительность исследования составила более 20 минут.
У 22 пациентов (6,9%) развились постманипуляционные осложнения, такие как кровохарканье и пневмоторакс. По классификации Clavien осложнения распределились следующим образом: 1 степень (нет осложнений) - 294 (93,1%), 2 степень (активное медикаментозное вмешательство) - 13 (4,1%), 3а степень (осложнение, требующее дополнительного вмешательства без наркоза) - 9 (2,8%), 3б степень (вмешательства под наркозом) - 0 (0,0%), и 5 степень (смерть больного) - 0 (0,0%) пациента. Напряженный пневмоторакс, требующий экстренного дренирования, развился у 2 пациентов сразу после прокола легочной паренхимы. Отсроченный пневмоторакс с колабированием более 15% легкого диагностирован в первые 4 часа у 7 пациентов, при этом у 6-ти из них длительность манипуляции составила более 20 минут - это 37,5% от 16 пациентов. Наличие при этом хронической обструктивной болезни легкого (ХОБЛ) значимо (р =0,008) повышало риск развития осложнения. Всем больным своевременно было выполнено дренирование плевральной полости. При появлении аэростаза устанавливались дренажи из плевральной полости. У 8 пациентов дренажи были удалены на 2-е сутки, и только у одного пациента фаза неполного аэростаза продолжалась до конца 4-х суток. В других 13 случаях (4,1%) сразу после манипуляции появилось кровохарканье, которое было купировано в течении 10 минут внутримышечным введением 500 мг (4 мл) раствора Этамзилата. Гемоторакса выявлено не было.
Неинформативный биопсийный материал был получен у 9 пациентов, что составило 2,8%. В 4 (1,2%) случаях полученного материала было недостаточно, поэтому исследование в этих 13-ти случаях было повторено. Отделением патоморфологии ОБУЗ КОНКЦ им Г.Е. Островерхова был проведен анализ полученного гистологического материала. Оценка проводилась по нескольким критериям: длина, количество фрагментов, качество биоптата. Срез биопсии осуществлялся с края образования для исключения забора некротизированной ткани, длина столбика ткани в основном была от 6,2 до 9,9 мм. Опухолевый материала был передан для иммуногистохимического исследования. В таблице 1 представлены критерии оценки гистологического материала в средних значениях.
Таблица 1. Критерии оценки гистологического материала
|
Количество исследований, ( n= 316), шт. |
Количество столбиков, шт. |
Длина, мм |
Качество биоптата, % |
Информативность, % |
Повторное исследование, абс; % |
|
329 |
2,3 |
8,7 |
94 |
97,2 |
4; 1,2 |
Морфология полученного гистологического материала представлена на рисунке 5. Злокачественные опухоли были диагностированы у 271 пациента, что составило 85,7%, доброкачественные новообразования выявлены у 8 больных (2,5%), неопухолевые процессы обнаружены у 37 пациентов и (11,7%).
Железисто
Злокачественная
плоскоклеточный мезотелиома; 4; 1% Лимфома; 3; 1% рак; 8; 2%
Крупноклеточный;
12; 4%
Мелкоклеточный рак; 19; 6%
Метастатические опухоли; 67; 21%
Саркоидоз; 8 2,5%
Фиброз 4; 1,2%
Плоскоклеточный
рак; 54; 17%
Туберкулез; 7; 2%
Воспалительные изминения; 18; 6%
Аденокарцинома 104; 33%
Рис. 5 . Морфология гистологического материала ( n =316).
Пациенты, у которых был выявлен туберкулез (2,2%), были направлены на лечение в областной противотуберкулезный диспансер. Группа пациентов с воспалительными и фиброзными изменениями записаны на контрольное исследование КТ ОГК через 1 месяц.
Таким образом, при выполнении трансторакальной биопсии прикорневых образований легкого под контролем КТ и с использованием коаксиальной системы, у 97,2% пациентов удалось получить информативный гистологический материал и верифицировать диагноз морфологически.
При статистической обработке нами было установлено достоверное (р <0,05)
увеличение количества осложнений при увеличении времени манипуляции. Чувствительность, специфичность и точность предложенной методики составили 97%, 100% и 97% соответственно.
Клинический пример
Больная Т., 74 лет, история болезни №74** в декабре 2019 года обратилась в онкологический центр по направлению из районной больницы с диагнозом: D38.1 Новообразование верхней доли левого легкого.
Обследование
Спирометрия: умеренная рестрикция; ВБС: эндоскопическая картина нормы; КТ ОГК: периферическое образование верхней доли левого легкого размером 21x18 мм, больше данных за неопластический процесс; ПЭТ-КТ: метаболически активное образование верхней доли левого легкого SUV MAX 14,7; МРТ головного мозга: без метастатического поражения. УЗИ л/у шейно-надключичной группы: неспецифическая лимфоаденопатия.
Сопутствующая патология: сахарный диабет 2 типа, целевой уровень HbA1c <7,5%; артериальная гипертензия 3 степени, риск 4, гипертрофия миокарда левого желудочка, хронический бронхит в стадии ремиссии, ожирение II степени, ДН I-II, эмфизема легких.
Больная госпитализирован в ООТХ ОБУЗ КО НКЦ им. Г.Е. Островерхова.
Пациентке проведена трансторакальная биопсия опухоли верхней доли левого легкого под контролем КТ с использованием коаксиальной системы диаметром 14G (Патент РФ на изобретение № 2734721 от 22.10.2020) и одноразовой полуавтоматической биопсийной иглы для мягких тканей размером 16G (Рис. 6).
А
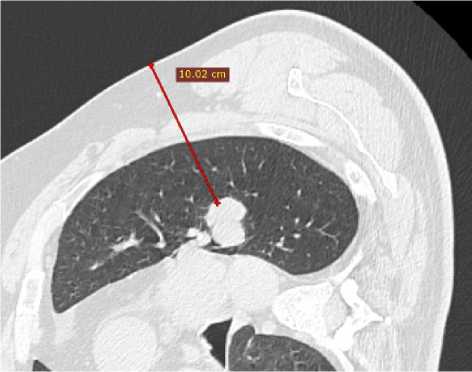
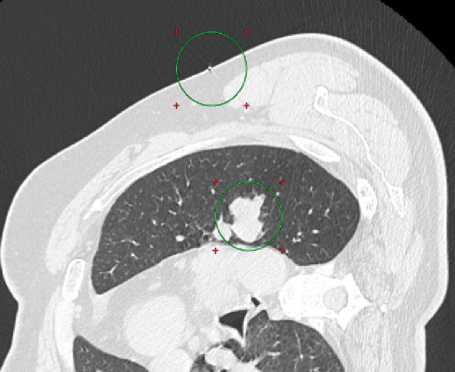
Рис. 6. Трансторакальная биопсия новообразования верхней доли левого легкого. (А) расстояние от кожи до края опухоли, (Б) рентгенконтрастная метка на коже, (В) кончик коаксиальной системы у края опухоли.
Предварительно измерено расстояние от кожи до опухоли, в предполагаемом месте трепанобиопсии, учитывая ожирение, этот показатель был равен 100 мм., причем 55 мм – это толщина грудной стенки (Рис. 6А). Манипуляция длилась 14 минут, морфологический материал получен удовлетворительного качества, объемом 3 столбика ткани опухоли.
На контрольной КТ ОГК, выполненной через 15 минут, постманипуляционного пневмоторакса нет, на контрольной рентгенографии ОГК, выполненной через 2 часа постманипуляционного пневмоторакса нет (Рис. 7).
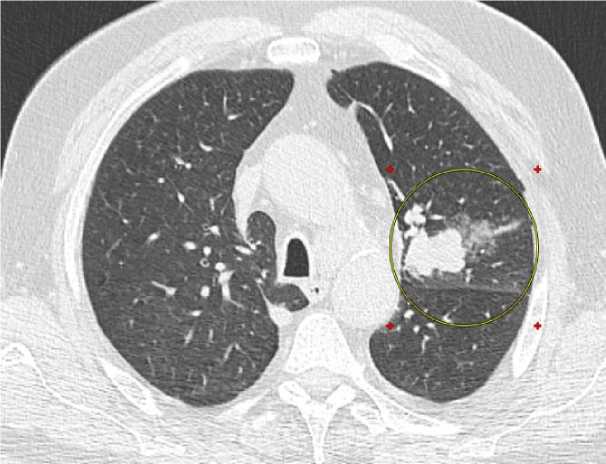
Рис. 7. Компьютерная томография органов грудной клетки, выполненная через 15 минут после манипуляции.
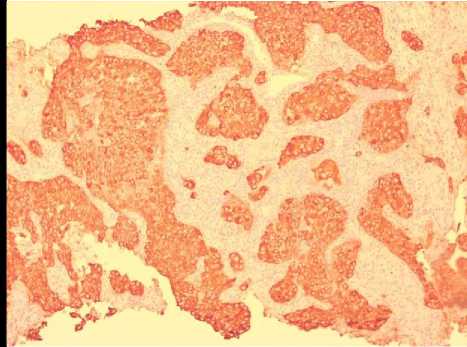
По результатам гистологического и иммуногистохимического исследований была верифицирована аденокарцинома легкого (Рис. 8).
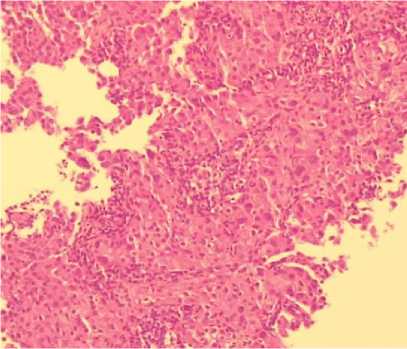
Рис. 8. Гистосканы аденокарциномы легкого. (А) окраска гематоксилином и эозином, (Б) ИГХ: яркая диффузная мембранная экспрессия клетками опухоли СК7.
Поставлен диагноз: С34.1 Рак верхней доли левого легкого ст. IA3 с T1сN0M0 кг II. Пациентка направлена на радикальное оперативное лечение.
Выводы
-
1. Учитывая низкую частоту постманипуляционных осложнений (6,9%), использование коаксиальной системы с перманентной анестезией в трансторакальных биопсиях прикорневых образований легкого под контролем компьютерной томографии является безопасным малоинвазивным методом морфологической верификации. Частота развития серьезных осложнений (3б – 5 степень по Clavien) равна 0%.
-
2. Длительность манипуляции более 20 минут у пациентов с ХОБЛ в анамнезе достоверно увеличивает риск развития постманипуляционного пневмоторакса на 37,5% ( p ˂0,05).
-
3. Применение данной методики верификации позволяет получить качественный высокоинформативный морфологический материал, достаточный для иммуногистохимического исследования без использования инвазивных операционных методов верификации.
Список литературы Чрезкожная трансторакальная биопсия прикорневых образований легких с использованием коаксиальной системы и КТ навигации
- Арсеньев А.И., Барчук А.А., Костицин К.А. и др. Когортное исследование эффективности низкодозной компьютерной томографии и трансторакальной трепан-биопсии в ранней диагностике рака лёгкого. Вестник хирургии. 2018. Т. 177. № 1. С. 60-64. DOI: 10.24884/0042-4625-2018-177-1-60-64.
- Дробязгин Е.А., Кудрявцев А.С., Чикинев Ю.В. и др. Трансторакальная пункционная биопсия в диагностике очаговых образований лёгких. Вестник хирургии. 2016. Т. 3. С. 32-35.
- Василашко В.И., Аблицов Ю.А., Аблицов А.Ю. и др. Современные возможности дифференциальной диагностики периферического рака легкого. Вестник Национального медико-хирургического Центра им. Н.И. Пирогова. 2013. Т. 8. № 2. С. 10-14.
- Каприн А.Д., Старинский В.В., Шахзадова О.А (ред.). Состояние онкологической помощи населению России в 2020 году. Ежегодный отчет главного внештатного онколога минздрава РФ. М.: МНИОИ им. П.А. Герцена - филиал ФГБУ «НМИЦ радиологии» Минздрава России, 2021. 239 с.
- Маринов Д.Т., Полоцкий Б.Е., Лактионов К.К. и др. Трансторакальная пункция как метод выбора для морфологической верификации новообразований средостения в амбулаторных условиях. Вестник ФГБУ" РОНЦ им. Н.Н. Блохина". 2015. Т. 1. С. 55-58.
- Муравьев В.Ю., Иванов А.И., Максимов А.П. и др. Опыт применения сочетанного метода рентген-ассистированной бронхоскопии для морфологической верификации периферического рака легких. Поволжский онкологический вестник. 2017. Т. 32. С. 5156.
- Перепелевский А.Н., Киселев И.Л., Лазаренко В.А., Перепелевская Ю.Е. Коаксиальная система для трансторакальной трепанобиопсии новообразований грудной полости под контролем компьютерной томографии и способ её применения. Российская Федерация, патент RU 2734972 2020.
- Сушко А.А., Прокопчик Н.И., Можейко М.А. и др. Диагностика и лечение опухолей и опухолевидных образований средостения. Журнал Гродненского государственного медицинского университета. 2015. Т. 3. С. 51-55.
- Российский статистический ежегодник. 2019. Статистический сборник М., Росстат. 2019. 795 с.
- Яицкий Н.А., Русанов А.А., Агишев А.С. и др. Трансторакальная игловая биопсия под ультразвуковым наведением при новообразованиях переднего средостения. Вестник хирургии. 2013. Т. 172. № 3. С. 24-27.
- Choi J. W., Park C.M., Goo J.M., et al. C-arm cone-beam CT-guided percutaneous transthoracic needle biopsy of small (<20 mm) lung nodules: diagnostic accuracy and complications in 161 patients. AJR Am J Roentgenol. 2012. V. 199. P. 322-330. DOI: 10.2214/AJR.11.7576.
- Kuriyama T., Masago K., Okada Y., Katakami N. Computed tomography-guided lung biopsy: Association between biopsy needle angle and pneumothorax development. Mol Clin Oncol. 2018. V. 8. No. 2. P. 336-341. DOI: 10.3892/mco.2017.1512.
- Han J., Feng X.L, Xu T.Y., et al. Clinical value of contrast-enhanced ultrasound in transthoracic biopsy of malignant anterior mediastinal masses. J Thorac Dis. 2019. V. 11. No. 12. P. 5290-5299. DOI: 10.21037/jtd.2019.11.51.
- Jaconi M., Pagni F., Vacirca F., et al. C-arm cone-beam CT-guided transthoracic lung core needle biopsy as a standard diagnostic tool: an observational study. Medicine (Baltimore). 2015. V. 94. No. 12. Article ID e698. DOI: 10.1097/MD.0000000000000698.
- Choo J.Y., Park C.M., Lee N.K., et al. Percutaneous transthoracic needle biopsy of small (< 1 cm) lung nodules under C arm cone beam CT virtual navigation guidance. Eur Radiol. 2013. V. 23. No. 3. P. 712-719. DOI: 10.1007/s00330-012-2644-6.
- Nour- Eldin N.E., Alsubhi M., Emam A., et al. Pneumothorax complicating coaxial and non-coaxial CT- guided lung biopsy: Comparative analysis of determining risk factors and management of pneumothorax in a retrospective review of 650 patients. Cardiovasc Intervent Radiol. 2016. V. 39. No. 2. P. 261-270. DOI: 10.1007/s00270-015-1167-3.
- Hwang E.J., Park C.M., Yoon S.H., et al. Risk factors for haemoptysis after percutaneous transthoracic needle biopsies in 4,172 cases: Focusing on the effects of enlarged main pulmonary artery diameter. Eur Radiol. 2018. V. 28. No. 4. P. 1410-1419. DOI: 10.1007/s00330-017-5101-8.
- Bray F., Ferlay J., Soerjomataram I., et al. Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA Cancer J Clin. 2018. V. 68. No. 6. P. 1-31. DOI: 10.3322/caac.21492.
- Kuriyama T., Masago K., Okada Y., Katakami N. Computed tomography-guided lung biopsy: Association between biopsy needle angle and pneumothorax development. Mol Clin Oncol. 2018. V. 8. No. 2. P. 336-341. DOI: 10.3892/mco.2017.1512.


